2. 山西农业大学实验动物管理中心, 太谷 030801
2. Laboratory Animal Center, Shanxi Agricultural University, Taigu 030801, China
卵巢颗粒细胞是雌性哺乳动物卵泡中紧靠着卵泡壁的一层细胞,对卵泡形成和发育过程起支持作用,直接影响卵巢排卵和黄体形成等功能[1-3]。霉菌毒素往往以卵巢颗粒细胞为靶细胞影响雌性动物生殖能力。其中,玉米赤霉烯酮(ZEA)又称为F-2毒素,是一种由禾谷镰刀菌为主的镰刀菌产生的次级代谢产物[4],具有生殖毒性、免疫毒性、细胞毒性、肝毒性、肾毒性、肠毒性、遗传毒性和致癌性[5]。大量研究表明,ZEA主要通过细胞凋亡损害卵巢颗粒细胞发育,进而造成雌性动物生殖障碍,给畜禽养殖业造成巨大经济损失,甚至危害人类健康[6-9]。在生产实践中,主要通过吸附法清除ZEA[10],但却无法有效修复ZEA进入机体后造成的损伤。近年来,中药在畜禽疾病的预防和治疗中发挥着重要作用。咖啡酸(caffeic acid,CA)又名3, 4-二羟基肉桂酸,属于酚酸类化合物,在植物种子、蔬菜、水果和咖啡中广泛分布,也存在于多种中药材中,如当归、川茸、薄荷、蒲公英、金银花、茶叶、杜仲和茵陈等[11-12]。已有的药理学研究表明,咖啡酸具有抗凋亡、抗氧化、抗肿瘤、镇咳、祛痰等作用,但目前未见其抗雌性动物生殖细胞凋亡作用的报道[13-14]。因此,本研究主要探讨咖啡酸对ZEA诱导小鼠卵巢颗粒细胞凋亡的影响,寻找ZEA天然有效的解毒剂,为咖啡酸的临床开发研究提供参考。
1 材料与方法 1.1 实验动物与药物3周龄SPF级雌性昆明小鼠,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。咖啡酸购自中国食品药品检定研究院,批号:110885-201703,含量99.7%。ZEA购自Sigma(美国),货号:Z2125。
1.2 主要试剂与仪器孕马血清促性腺激素购自中国宁波舒生药业有限公司,DMEM/F-12(HAM)1:1培养基购自以色列Biological Industries,DMSO和MTT购自中国北京索莱宝科技有限公司,2×SYBR Green Low ROX qPCR Master Mix购自中国上海Selleck-Bimake公司,TRIzol和PrimerScriptTM RT reagent Kit with gDNA Eraser购自中国大连宝生物工程有限公司,SDS-PAGE凝胶制备试剂盒购自中国武汉博士德生物工程有限公司,DAPI染色液、Western及IP细胞裂解液和增强型蛋白浓度测定试剂盒购自中国碧云天生物技术有限公司,蛋白酶抑制剂、磷酸酶抑制剂购自中国上海Sselleck Bimake公司,FSHR抗体、β-actin抗体购自中国武汉Proteintech公司,cleaved-caspase-3抗体购自美国Abcam公司,cleaved-PARP抗体购自美国CST公司。
主要仪器:体视显微镜(上海光学仪器一厂,中国),Leica DM 3000荧光显微镜(Leica Microsystems,德国),7500定量PCR仪(Applied Biosystems,美国),酶标仪(MD,美国),ND-1000核酸蛋白浓度测定仪(NanoDrop,美国),离心机(Eppendorf,德国),CO2培养箱(Heal force,中国),电泳仪、转膜仪(Bio-Rad,美国),倒置显微镜(Olympus,日本)。
1.3 小鼠卵巢颗粒细胞分离及培养通过观察小鼠阴门状态,挑选处于发情前期的3周龄雌性昆明小鼠(阴门皱襞较为肿胀,黏膜浅红,阴道口微张且有清亮分泌物),腹腔注射5 IU孕马血清促性腺激素(PMSG),48 h后断颈处死。在无菌超净操作台内,用酒精棉球擦拭小鼠腹部消毒;用外科手术剪沿腹中线剪开小鼠腹部皮肤,上翻肠组织,充分暴露两侧输卵管及卵巢;用眼科镊夹起卵巢并撕掉包裹卵巢的膜,取出卵巢迅速放入35 mm细胞培养皿(含有PBS)中;在细胞房内用经过灭菌的眼科镊将卵巢分别夹入含有操作液的35 mm细胞培养皿中,放置于细胞培养箱内;分别在体视显微镜下,用1 mL注射器刺破小鼠卵巢上的卵泡,分离小鼠卵巢颗粒细胞到操作液中;在无菌超净台内用200目滤网过滤含有小鼠卵巢颗粒细胞的操作液到10 mL EP管中,PBS清洗35 mm细胞培养皿,转入上述10 mL EP管中,1 200 r·min-1离心6 min,弃掉上清液;PBS清洗细胞沉淀3次,1 200 r·min-1离心6 min,加入细胞生长培养基重悬;用血球计数板计活细胞数,调整细胞浓度到1×106个·mL-1,将细胞接种到6孔细胞培养板中,混匀后,放置在5% CO2培养箱中37 ℃环境下培养;培养24 h后,在倒置显微镜下观察细胞贴壁及生长情况,待细胞贴壁后换液。
1.4 间接免疫荧光法鉴定小鼠卵巢颗粒细胞以1×105个·mL-1的密度将传代小鼠卵巢颗粒细胞接种于20 mm细胞培养皿中培养24 h,经PBS清洗后,加入提前在-20 ℃预冷的无水乙醇,4 ℃下固定细胞,再经PBS清洗、0.2% TritonX-100通透、3% BSA封闭,弃掉封闭液加入用PBS按1:50比例稀释的FSHR抗体,同时设PBS对照组,37 ℃恒温孵育2 h,滴加用PBS按1:100比例稀释的FITC标记的荧光二抗,恒温避光孵育1 h后,经DAPI染色在荧光显微镜下观察并拍照。
1.5 MTT法检测咖啡酸对小鼠卵巢颗粒细胞活性的影响调整传代小鼠卵巢颗粒细胞浓度为1×105个·mL-1,接种于96孔细胞培养板中,培养24 h后,以咖啡酸最大溶解度(200 μg·mL-1)为起始浓度,连续2倍倍比稀释成7个浓度梯度(200、100、50、25、12.5、6.25、3.125 μg·mL-1),分别加入96孔细胞培养板中,每孔100 μL,每个浓度设置4个重复孔,同时设置细胞对照组(control),置于5% CO2、37 ℃培养箱培养48 h后使用MTT法检测细胞活性。试验重复3次。
1.6 MTT法检测咖啡酸对ZEA诱导小鼠卵巢颗粒细胞损伤模型中细胞活性的影响将传代小鼠卵巢颗粒细胞按1×105个·mL-1接种于96孔板中,培养24 h后,选取200、100和50 μg·mL-1咖啡酸分别与60 μmol·L-1 ZEA共处理细胞,同时设置细胞对照组和ZEA模型组,24 h后使用MTT法测定细胞活性。试验重复3次。
1.7 qRT-PCR技术检测caspase-3 mRNA的相对表达量将提取出的小鼠卵巢颗粒细胞浓度调整到1×106个·mL-1,接种到6孔细胞培养板中,在5% CO2、37 ℃培养箱中培养4 d后,设置细胞对照组和ZEA模型组,同时用不同浓度咖啡酸(200、100和50 μg·mL-1)和60 μmol·L-1 ZEA共同处理细胞24 h,收集细胞,使用Trizol法提取颗粒细胞总RNA,两步法反转录为cDNA。以cDNA为模板,使用ABI 7500 Real-Time PCR系统进行反应。β-actin作内参,按照2-ΔΔCt法计算caspase-3 mRNA相对表达量,引物由北京擎科生物技术有限公司合成,序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences |
以1×106个·mL-1的浓度将提取出的小鼠卵巢颗粒细胞接种到6孔细胞培养板中,在5% CO2、37 ℃培养箱中培养4 d后,设置细胞对照组和ZEA模型组,同时用不同浓度的咖啡酸(200、100和50 μg·mL-1)分别和ZEA(60 μmol·L-1)共同处理细胞24 h,收集细胞,提取细胞总蛋白,用SDS-PAGE凝胶电泳法分离出目的蛋白。将目的蛋白转移到PVDF膜上,用5%脱脂奶粉在室温条件下封闭2 h。加入用TBST按1:1 000比例稀释的cleaved-caspase-3和cleaved-PARP抗体,4 ℃孵育过夜,TBST洗膜后,用TBST按1:20 000比例加入辣根过氧化酶标记的特异性二抗,室温孵育1 h。再用TBST洗膜,滴加适量ECL化学发光液,用X-ray胶片在暗室内曝光,胶片晾干后扫描保存。扫描的图像通过Image J软件进行灰度值分析。
1.9 数据分析运用GraphPad PrismTM5软件对试验数据进行分析,数据均采用“平均数±标准误”表示,单因素方差分析(One-way ANOVA)法分析多组间差异性,P < 0.05表示差异显著,P>0.05表示差异不显著(*P < 0.05、**P < 0.01、***P < 0.001)。
2 结果 2.1 小鼠卵巢颗粒细胞的鉴定卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)是特异表达于卵巢颗粒细胞胞浆中的蛋白,常用于鉴定卵巢颗粒细胞。如图 1所示,在荧光显微镜下,细胞核经DAPI染色后呈蓝色荧光;空白对照组细胞未观察到绿色荧光,而FSHR阳性染色大量出现在试验组细胞的胞浆中,呈绿色荧光。结果表明,提取到的细胞是小鼠卵巢颗粒细胞,可在体外培养用于后续试验。
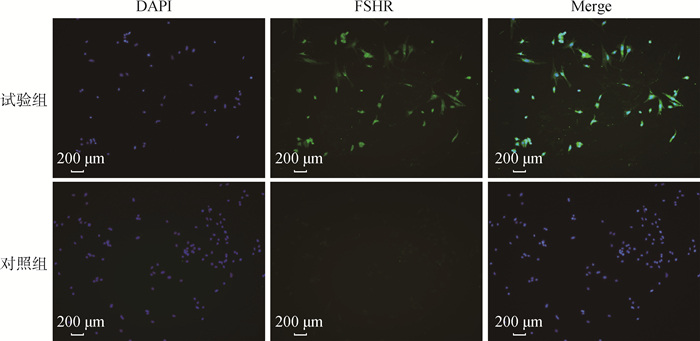
|
图 1 小鼠卵巢颗粒细胞的鉴定 Fig. 1 Identification of mouse ovarian granulosa cells |
用不同浓度咖啡酸处理颗粒细胞48 h后,MTT法检测细胞活性。如图 2所示,与空白对照组相比,不同浓度咖啡酸处理组细胞活性无显著变化(P>0.05),并且细胞活力均在90%以上。结果表明,咖啡酸对颗粒细胞没有毒性作用。
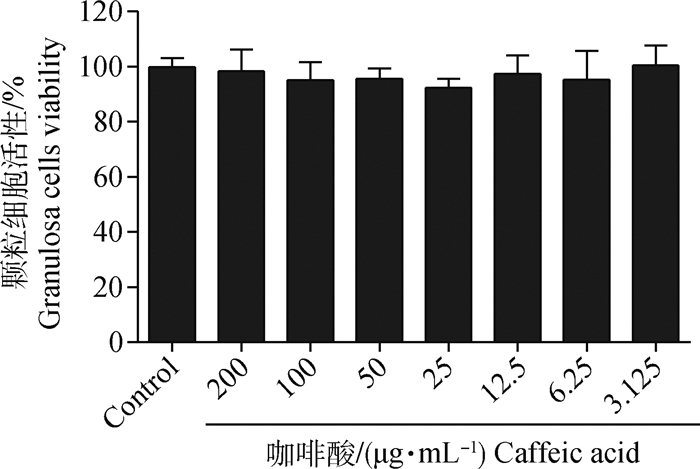
|
图 2 咖啡酸对小鼠卵巢颗粒细胞活性的影响 Fig. 2 Effect of caffeic acid on the viability of mouse ovarian granulosa cells |
根据上述试验结果,选取200、100和50 μg·mL-1咖啡酸分别与60 μmol·L-1 ZEA共处理细胞,24 h后倒置显微镜下观察细胞形态与贴壁情况。如图 3A所示,空白对照组细胞形态呈梭形或多角形,贴壁紧密,体积较大,轮廓清晰,而ZEA模型组细胞体积较小,贴壁较差,细胞间隙增大,咖啡酸处理组的细胞比ZEA组细胞贴壁紧密,细胞间隙减小。使用MTT法测定细胞活性,如图 3B所示,与空白对照组相比,ZEA组细胞活力显著降低(P<0.001);与ZEA组相比,咖啡酸处理组细胞活力均显著升高(P < 0.001)。结果表明,ZEA可降低颗粒细胞活力,而咖啡酸对ZEA诱导的小鼠卵巢颗粒细胞损伤具有保护作用。

|
A.小鼠卵巢颗粒细胞形态学观察;B.咖啡酸对ZEA诱导的颗粒细胞损伤细胞活性的影响。***表示与ZEA组相比,差异极显著(P < 0.001),下同 A. Morphology of mouse ovarian granulosa cells; B. The effect of caffeic acid on ZEA-induced granulosa cell injury cell viability. ***indicated extremely significantly difference when compared with ZEA group (P < 0.001), the same as below 图 3 咖啡酸对ZEA诱导颗粒细胞损伤的保护作用 Fig. 3 The protective effect of caffeic acid on ZEA-induced granulosa cell damage |
qRT-PCR检测给药24 h后卵巢颗粒细胞凋亡基因caspase-3 mRNA相对表达量。如图 4所示,与空白对照组相比,ZEA处理组凋亡基因caspase-3相对表达量显著升高(P < 0.001);与ZEA组相比,咖啡酸处理组细胞凋亡基因caspase-3相对表达量显著降低(P < 0.001)。结果表明,ZEA可诱导小鼠颗粒细胞凋亡,而咖啡酸可能通过抑制凋亡基因caspase-3在颗粒细胞中的表达发挥保护作用。

|
图 4 咖啡酸对小鼠卵巢颗粒细胞凋亡基因caspase-3表达的影响 Fig. 4 Effect of caffeic acid on the expression of caspase-3 in mouse ovarian granulosa cells |
Western blot检测给药24 h后各试验组卵巢颗粒细胞凋亡蛋白cleaved-caspase-3和cleaved-PARP的表达水平。如图 5所示,与空白对照组相比,ZEA处理组凋亡蛋白cleaved-caspase-3和cleaved-PARP表达水平显著升高(P < 0.001);与ZEA组相比,咖啡酸处理组细胞凋亡蛋白cleaved-caspase-3和cleaved-PARP表达水平显著降低(P < 0.001)。结果表明,咖啡酸可能通过降低凋亡相关蛋白cleaved-caspase-3和cleaved-PARP表达抵抗ZEA诱导的细胞凋亡。
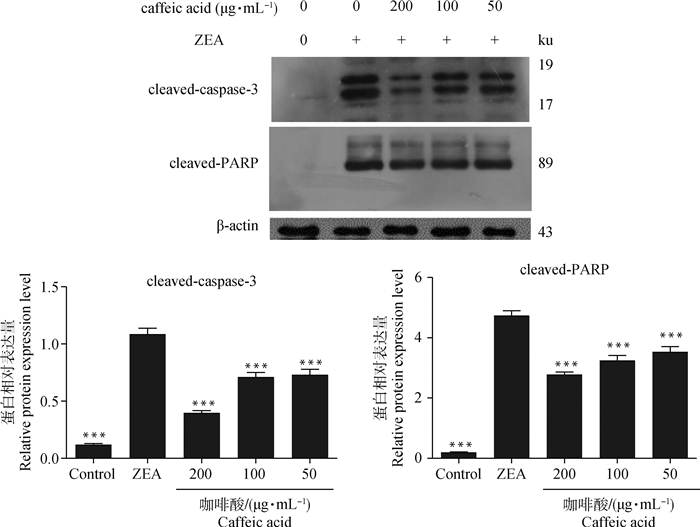
|
图 5 咖啡酸对ZEA诱导的颗粒细胞凋亡蛋白的影响 Fig. 5 The effect of caffeic acid on the protein expression levels of ZEA-induced apoptosis in granulosa cells |
作为卵泡中重要的功能细胞,卵巢颗粒细胞具有启动卵母细胞生长和调节卵泡按照一定的顺序进行排列发育的作用。颗粒细胞上有多种激素受体,并且通过卵母细胞的缝隙连接提供营养和代谢产物,以自分泌和旁分泌的方式分泌性激素、抑制素等物质为优势卵泡发育及成熟提供有利的微环境[15-16]。研究发现,环境污染物[17]、霉菌毒素[18]、缺氧[19]、化疗药物[20]和重金属[21]等多种外界刺激均可引发颗粒细胞凋亡。在动物养殖业中,ZEA是较为常见的诱发颗粒细胞凋亡的霉菌毒素之一[8, 22-23]。咖啡酸作为一种安全、无毒害且来源广泛的天然酚酸类化合物,具有很高的医学价值,广泛应用于抗氧化[24]、抗菌[25]、抗病毒[26]和抗肿瘤[27]等方面。然而,未有关于其抗雌性生殖细胞损伤的报道。本实验室前期已成功建立了ZEA致小鼠卵巢颗粒细胞损伤模型[28-29],本试验在此模型基础上探究了咖啡酸是否可以发挥生殖保护作用。研究结果表明,咖啡酸可以显著恢复ZEA破坏的细胞形态和降低的细胞活力。
本试验进一步探究了咖啡酸发挥抗损伤作用的可能机制。细胞凋亡是动物机体为维持内环境稳定,细胞自主有序死亡的过程,此过程受促凋亡基因和抑凋亡基因的双重调控,两者通过死亡受体途径或线粒体途径激活caspase蛋白酶,启动一系列的级联反应,切割多聚腺苷酸二磷酸核糖基聚合酶(poly ADP-ribose polymerase, PARP)等底物,最终导致细胞凋亡[30]。在caspase级联反应中,caspase-3是下游一个重要的公共凋亡效应因子,在各种因素引发的凋亡程序中起最后的枢纽作用[31]。PARP是真核细胞内具有多聚腺苷酸二磷酸核糖基催化活性的蛋白酶。它通过识别损伤的DNA片段而被激活,被认为是DNA损伤的感受器。它还能对许多蛋白进行修饰从而修复结构损伤的DNA[32]。同时,PARP作为细胞凋亡调控的核心成员caspases蛋白酶的主要切割底物[33]。因此,它在DNA损伤修复、基因转录、基因组的完整和稳定以及细胞凋亡等方面发挥重要作用。在凋亡过程中,活化的caspase-3可以剪切PARP成片段,使其失去酶活力,不能发挥正常功能,加速了细胞的不稳定[33]。因此,在本试验中,与空白对照组相比,60 μmol·L-1 ZEA处理组中凋亡基因caspase-3 mRNA相对表达量显著增加,同时,凋亡蛋白cleaved-caspase-3、cleaved-PARP的蛋白表达量显著增加,以上试验结果表明,ZEA诱导小鼠卵巢颗粒细胞凋亡模型成功建立。
给予咖啡酸治疗后,凋亡基因caspase-3 mRNA相对表达量显著减少,同时,凋亡蛋白cleaved-caspase-3、cleaved-PARP的蛋白表达量显著降低。此试验结果表明,咖啡酸能抑制caspase-3酶活性,减少对PARP的剪切,从而抵抗ZEA诱导的细胞凋亡,促进DNA修复,维持基因组稳定。
4 结论咖啡酸可以抑制ZEA诱导的细胞凋亡,显著恢复颗粒细胞活性,主要是通过抑制凋亡相关蛋白caspase-3和PARP的表达来发挥保护作用。
| [1] | EDSON M A, NAGARAJA A K, MATZUK M M. The mammalian ovary from genesis to revelation[J]. Endocr Rev, 2009, 30(6): 624–712. |
| [2] | HUNZICKER-DUNN M, MAIZELS E T. FSH signaling pathways in immature granulosa cells that regulate target gene expression:branching out from protein kinase A[J]. Cell Signal, 2006, 18(9): 1351–1359. |
| [3] | MATZUK M M, BURNS K H, VIVEIROS M M, et al. Intercellular communication in the mammalian ovary:oocytes carry the conversation[J]. Science, 2002, 296(5576): 2178–2180. |
| [4] | GRENIER B, APPLEGATE T J. Modulation of intestinal functions following mycotoxin ingestion:meta-analysis of published experiments in animals[J]. Toxins, 2013, 5(2): 396–430. |
| [5] |
杨美璐, 吴峰洋, 刘静慧, 等. 玉米赤霉烯酮毒性的研究进展[J]. 饲料研究, 2019, 42(1): 74–77.
YANG M L, WU F Y, LIU J H, et al. Advances on research of zearalenonel toxicity[J]. Feed Research, 2019, 42(1): 74–77. (in Chinese) |
| [6] | WANG Y J, ZHENG W L, BIAN X J, et al. Zearalenone induces apoptosis and cytoprotective autophagy in primary leydig cells[J]. Toxicol Lett, 2014, 226(2): 182–191. |
| [7] | ZHU L, YUAN H, GUO C Z, et al. Zearalenone induces apoptosis and necrosis in porcine granulosa cells via a caspase-3- and caspase-9-dependent mitochondrial signaling pathway[J]. J Cell Physiol, 2012, 227(5): 1814–1820. |
| [8] | XU M L, HU J, GUO B P, et al. Exploration of intrinsic and extrinsic apoptotic pathways in zearalenone-treated rat sertoli cells[J]. Environ Toxicol, 2016, 31(12): 1731–1739. |
| [9] | KOWALSKA K, HABROWSKA-GÓRCZYŃSKA D E, PIASTOWSKA-CIESIELSKA A W. Zearalenone as an endocrine disruptor in humans[J]. Environ Toxicol Pharmacol, 2016, 48: 141–149. |
| [10] | ROGOWSKA A, POMASTOWSKI P, SAGANDY-KOVA G, et al. Zearalenone and its metabolites:effect on human health, metabolism and neutralisation methods[J]. Toxicon, 2019, 162: 46–56. |
| [11] | SAMRA Y A, SAID H S, ELSHERBINY N M, et al. Cepharanthine and Piperine ameliorate diabetic nephropathy in rats:role of NF-κB and NLRP3 inflammasome[J]. Life Sci, 2016, 157: 187–199. |
| [12] |
曹敏, 归萌, 同婉莹, 等. 咖啡酸酯类和酰胺类衍生物的合成和应用研究进展[J]. 化学工程师, 2019, 33(7): 64–68.
CAO M, GUI M, TONG W Y, et al. Progress in the synthesis and application of caffeic acid esters and caffeic acid amide derivatives[J]. Chemical Engineer, 2019, 33(7): 64–68. (in Chinese) |
| [13] | LIN C L, CHEN R F, CHEN J Y F, et al. Protective effect of caffeic acid on paclitaxel induced anti-proliferation and apoptosis of lung cancer cells involves NF-κB pathway[J]. Int J Mol Sci, 2012, 13(5): 6236–6245. |
| [14] | GENARO-MATTOS T C, MAURÍCIO Â Q, RETTORI D, et al. Antioxidant activity of caffeic acid against iron-induced free radical generation:a chemical approach[J]. PLoS One, 2015, 10(6): e0129963. |
| [15] | ALAM M H, MIYANO T. Interaction between growing oocytes and granulosa cells in vitro[J]. Reprod Med Biol, 2020, 19(1): 13–23. |
| [16] | ALAM M H, LEE J, MIYANO T. GDF9 and BMP15 induce development of antrum-like structures by bovine granulosa cells without oocytes[J]. J Reprod Dev, 2018, 64(5): 423–431. |
| [17] | SIROTKIN A V, KADASI A, BALÁŽI A, et al. Mechanisms of the direct effects of oil-related contaminants on ovarian cells[J]. Environ Sci Pollut Res Int, 2020, 27(5): 5314–5322. |
| [18] | GUO Y W, WANG W X, CHEN Y Q, et al. Continuous gibberellin A3 exposure from weaning to sexual maturity induces ovarian granulosa cell apoptosis by activating Fas-mediated death receptor signaling pathways and changing methylation patterns on caspase-3 gene promoters[J]. Toxicol Lett, 2020, 319: 175–186. |
| [19] | YADAV A K, YADAV P K, CHAUDHARY G R, et al. Autophagy in hypoxic ovary[J]. Cell Mol Life Sci, 2019, 76(17): 3311–3322. |
| [20] | WU Y P, MA C S, ZHAO H H, et al. Alleviation of endoplasmic reticulum stress protects against cisplatin-induced ovarian damage[J]. Reprod Biol Endocrinol, 2018, 16(1): 85–97. |
| [21] | LIU J, LUO L F, WANG D L, et al. Cadmium induces ovarian granulosa cell damage by activating PERK-eIF2α-ATF4 through endoplasmic reticulum stress[J]. Biol Reprod, 2019, 100(1): 292–299. |
| [22] | RAI A, DAS M, TRIPATHI A. Occurrence and toxicity of a fusarium mycotoxin, zearalenone[J]. Crit Rev Food Sci Nutr, 2020, 60(16): 2710–2729. |
| [23] | YANG F X, LI L, CHEN K L, et al. Melatonin alleviates β-zearalenol and HT-2 toxin-induced apoptosis and oxidative stress in bovine ovarian granulosa cells[J]. Environ Toxicol Pharmacol, 2019, 68: 52–60. |
| [24] | LOS M, MOZOLUK M, FERRARI D, et al. Activation and caspase-mediated inhibition of PARP:a molecular switch between fibroblast necrosis and apoptosis in death receptor signaling[J]. Mol Biol Cell, 2002, 13(3): 978–988. |
| [25] | ARCAMBAL A, TAILÉ J, COURET D, et al. Protective effects of antioxidant polyphenols against hyperglycemia-mediated alterations in cerebral endothelial cells and a mouse stroke model[J]. Mol Nutr Food Res, 2020, 64(13): 1900779. |
| [26] | ZHANG F Y, ZHAI T H, HAIDER S, et al. Synergistic effect of chlorogenic acid and caffeic acid with fosfomycin on growth inhibition of a resistant Listeria monocytogenes strain[J]. ACS Omega, 2020, 5(13): 7537–7544. |
| [27] | REN X B, LIU J, HU L, et al. Caffeic acid phenethyl ester inhibits the proliferation of HEp2 cells by regulating Stat3/Plk1 pathway and inducing S phase arrest[J]. Biol Pharm Bull, 2019, 42(10): 1689–1693. |
| [28] | YI Y Y, WAN S X, HOU Y X, et al. Chlorogenic acid rescues zearalenone induced injury to mouse ovarian granulosa cells[J]. Ecotoxicol Environ Saf, 2020, 194: 110401. |
| [29] |
扆妍妍, 侯雅鑫, 张宇瞳, 等. 小鼠、鸡卵巢颗粒细胞分离培养方法的比较与优化[J]. 中国兽医杂志, 2019, 55(1): 23–27.
YI Y Y, HOU Y X, ZHANG Y T, et al. The Comparison and Optimization of isolation and culture methods of mouse and chicken ovary Granulosa cells[J]. Chinese Journal of Veterinary Medicine, 2019, 55(1): 23–27. (in Chinese) |
| [30] | CHEN J W, MEHTA J L, HAIDER N, et al. Role of caspases in Ox-LDL-induced apoptotic cascade in human coronary artery endothelial cells[J]. Circ Res, 2004, 94(3): 370–376. |
| [31] | EISEMANN T, PASCAL J M. Poly(ADP-ribose) polymerase enzymes and the maintenance of genome integrity[J]. Cell Mol Life Sci, 2020, 77(1): 19–33. |
| [32] | LINDAHL T, SATOH M S, POIRIER G G, KLUNGLAND A. Post translational modification of poly (ADP-ribose) polymerase induced by DNA strand breaks[J]. Trends Biochem Sci, 1995, 20(10): 405–411. |
| [33] | NICHOLSON D W, ALI A, THORNBERRY N A, et al. Identification and inhibition of the ICE/CED-3 protease necessary for mammalian apoptosis[J]. Nature, 1995, 376(6535): 37–43. |



