2. 广西壮族自治区兽医研究所 广西兽医生物技术重点实验室, 南宁 530001
2. Guangxi Key Laboratory of Veterinary Biotechnology, Guangxi Veterinary Research Institute, Nanning 530001, China
铜作为动植物机体必需的微量元素之一,对维持生物机体正常生理机能有重要作用。有研究表明,在饲料中添加一定的铜元素能够提高母猪的繁殖能力,因此,铜制剂通常会用做动物饲料的添加剂[1]。随着经济的快速发展,土壤重金属污染的范围也越来越广。环境中难以提纯的重金属元素,如铜,可通过转移富集在农作物或其他植物中,再通过食物链进入人体,对人体健康构成潜在威胁[2]。高铜日粮不仅影响动物的正常发育,引发贫血、营养不良、生产繁殖障碍等疾病,随着铜的不断蓄积,还会引起明显的铜中毒,不但降低了畜牧业产能,人食用了这些动物制品,更容易导致铜在人体肝、脑、肾等部位积累,进而导致动脉粥样硬化,加速细胞老化死亡,最终危害人体健康[3]。肾是铜中毒的主要靶器官之一,铜中毒会造成肾功能受损,临床表现为食欲废绝、精神沉郁、体重减轻。病理剖检器官病变不明显,死亡病例可观察到肾轻度肿大[4]。观察大鼠组织切片可见肾小管上皮细胞颗粒变性和空泡变性,间质充血,肾小管上皮细胞脱落[5]。此外,还有研究表明,铜暴露能够抑制肾组织的抗氧化系统,降低谷胱甘肽和超氧化物歧化酶的活性,同时,使生化参数中肌酐和尿素氮的值升高,破坏线粒体修复机制,诱导细胞凋亡,加速细胞自噬[6]。
重金属暴露会引起机体免疫失调,对机体伤害程度与重金属摄入的剂量有关[7-8]。增殖细胞核抗原PCNA与细胞的增殖和凋亡有关,PCNA的表达对细胞增殖有促进作用[9-10]。Ki-67是一种与细胞增殖特异相关的核蛋白,若通过免疫荧光试验,测得Ki-67的阳性率高, 则说明处于增殖期的细胞比例高[11-12]。有研究表明,铜蓄积在肝组织会引起炎症相关基因表达,激活NF-κB信号通路,使其mRNA明显上调,IL-1β, IL-6, IL-10 mRNA相对表达量也会上调[13]。炎性因子如IL-1β、IL-2、IL-6、IL-18、NF-κB、TNF-α在炎症的发生、发展过程中有重要作用[13-15]。对于铜中毒引起器官损伤的解剖学、血液学变化目前已有大量临床研究,而铜中毒是否影响肾组织免疫反应以及细胞增殖,目前没有确切结论。因此,本研究用不同浓度的铜刺激大鼠,检测各组大鼠肾组织Ki-67、PCNA、IL-1β、IL-2、IL-6、IL-18、NF-κB、TNF-α mRNA和蛋白的变化,旨在探讨高铜刺激对动物机体炎症反应和细胞增殖的影响。
1 材料与方法 1.1 试验动物及处理随机选取20日龄SD大鼠32只,所有大鼠在试验开始前适应环境14 d并保持在受控环境中(14 h光照和10 h黑暗循环),然后随机分成4组,每组8只,各组大鼠每天自由采食含有碱式CuCl2的日粮,根据实验动物饲料营养标准CB14924—2010,对照组的正常基础日粮中的铜含量是15 mg·kg-1。在此基础上,试验选择了基础日粮中铜含量的2、4、8倍作为高铜处理组。各组日粮CuCl2的含量分别为:对照组15 mg·kg-1、高铜Ⅰ组30 mg·kg-1、高铜Ⅱ组60 mg·kg-1、高铜Ⅲ组120 mg·kg-1,连续饲喂6个月。试验结束后,用0.4%戊巴比妥按30 mg·kg-1剂量安乐死大鼠,剖开腹腔取出肾,生理盐水冲洗后,一部分经液氮速冻及时放入-80 ℃冰箱待检, 另一部分在4%多聚甲醛溶液中固定以备进一步形态学的检查。
1.2 试验试剂和仪器Trizol、PrimeScript RTMaster Mix购自TaKaRa公司;ChamQ SYBR Color qPCR MasterMix购自Vazyme公司;RIPA裂解液购自Beyotime公司;其它试剂均为国产分析纯。
TDZ5-WS型冷冻离心机,购自湖南湘仪实验室仪器开发有限公司;MyCyclerTMThermal型基因扩增仪,购自美国Bio-Rad公司;LightCycler480型荧光定量PCR仪,购自美国Bio-Rad公司;Unique-R10型超纯水仪,购自厦门锐思捷科学仪器有限公司;H-5700型显微镜购自日本日立公司。激光共聚焦显微镜购自德国莱卡。
1.3 免疫荧光检测细胞增殖水平将肾组织用40 mL·L-1多聚甲醛固定24 h后,流水冲洗过夜,然后脱水、透明、浸蜡、包埋,将组织切片(5 μm)固定在载玻片上,37 ℃展片台过夜,然后将切片脱蜡、水化。在10 mmol·L-1柠檬酸盐抗原修复液(pH = 6.0)中微波介导抗原修复15 min后,将切片透化30 min,并在37 ℃下用50 g·L-1BSA封闭1 h,然后将其与Ki-67一抗(1:500; Bioss,China)4 ℃孵育过夜。随后,将FITC标记的二抗(Beyotime,中国,1:500)在37 ℃的黑暗环境中孵育60 min。最后将切片用DAPI(4’,6-diamidino-2-phenylindole,Keygen,中国)复染5 min。用共聚焦荧光显微镜(TCS SP8;Leica,德国)观察切片,并通过Image J软件分析数据。
1.4 肾组织病理学分析将肾组织用40 mL·L-1多聚甲醛固定24 h后,流水冲洗过夜,然后脱水、透明、浸蜡、包埋,将组织切片(5 μm)固定在载玻片上,37 ℃展片台过夜,并用苏木精和尹红(HE)染色、中性树脂封片,用光学显微镜观察组织病理学变化。
1.5 实时荧光定量PCR总RNA的提取按照TaKaRa试剂盒说明书进行。RNA浓度用NanaDrop-2000微量核算测定仪检测。内参基因为管家基因GAPDH。引物序列见表 1,用软件Primer Express 5.0设计,委托生工生物工程(上海)股份有限公司合成。RNA反转录操作按试剂盒说明书进行。将反转后的cDNA进行RT-qPCR反应,反应体系为10 μL:cDNA 2 μL,2× ChamQ SYBR qPCRMasterMix 5 μL,引物F/R为0.4 μL,DEPC水2.2 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s;共进行40个循环,检测Ki-67、PCNA、IL-1β、IL-2、IL-6、IL-18、NF-κB、TNF-α mRNA的相对表达量。
|
|
表 1 引物序列 Table 1 Primer sequences |
免疫印迹法检测大鼠肾组织PCNA、IL-1β、IL-6、IL-18的蛋白表达量,以GAPDH作为内参。分析天平称取20 mg左右组织样品,加入500 μL的RIPA裂解液,匀浆后12 000 g 4 ℃离心15 min取上清,测定蛋白浓度后稀释至同一浓度,煮沸后于-80 ℃保存。将提取的蛋白样在垂直电泳仪上经13% SDS-PAGE分离后,转移到PVDF膜上。50 g·L-1的脱脂奶粉室温封闭1.5 h。一抗4 ℃摇床过夜后TBST洗涤3次,二抗室温孵育1 h后用PBST充分洗涤,使用ECL发光液显影,拍照,分析。
1.7 数据处理试验数据先用Excel 2016初步处理,所得结果显示为至少三个独立试验的“平均值±标准差”,应用SPSS统计分析软件进行差异显著性检验,使用GraphPad Prism 7.0进行分析并作图,P < 0.05被认为具有统计学意义。
2 结果 2.1 大鼠肾组织病理学观察肾组织病理学变化如图 1所示。对照组大鼠的肾组织和肾小管结构清晰,形态良好。而高铜组HE染色结果显示,肾淤血、水肿,有中性粒细胞为主的炎性细胞浸润,并且伴有肾小管萎缩。其中,高铜Ⅲ组肾淤血、肾小管萎缩最为明显。
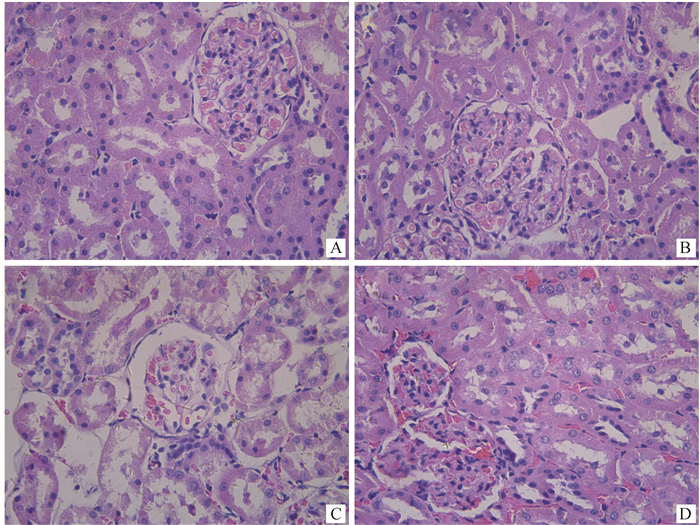
|
A~D分别为对照组、高铜Ⅰ组、高铜Ⅱ组和高铜Ⅲ组 A-D are control group, high-copper Ⅰ group, high-copper Ⅱ group and high-copper Ⅲ group, respectively 图 1 肾组织病理切片图(HE染色,400×) Fig. 1 Pathological section of kidney tissues (HE staining, 400×) |
高铜对大鼠肾细胞增殖水平的影响如图 2、3所示,与对照组相比,3个高铜处理组的Ki-67、PCNA mRNA及蛋白表达量均明显下降,其中,Ki-67 mRNA的表达量在高铜Ⅱ组和高铜Ⅲ组显著降低(P < 0.05)。免疫荧光结果显示,Ki-67蛋白表达量呈剂量依赖性下降,与对照组相比,3个铜处理组均显著降低(P < 0.05)。且增殖细胞核抗原PCNA的荧光定量PCR结果显示,PCNA mRNA表达量随着铜含量的上升呈梯度下降趋势,在高铜Ⅱ组和高铜Ⅲ组时差异显著(P < 0.05),此外,与对照组相比,铜处理组的PCNA蛋白表达均下降,且差异显著(P < 0.05)。
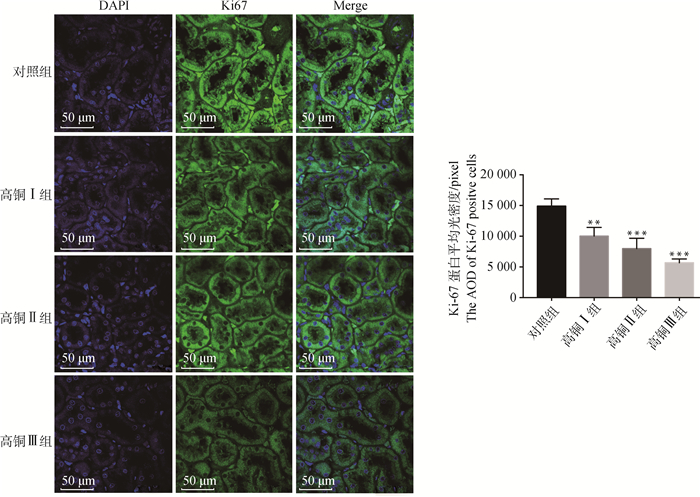
|
与对照组相比,*表示P < 0.05,**表示P < 0.01,***表示P < 0.001,n=8。下同 Compared with control group, * indicates P < 0.05, ** indicates P < 0.01, *** indicates P < 0.001, n = 8. The same as below 图 2 Ki-67在肾的表达及平均光密度(AOD)检测(400×) Fig. 2 The expression and average optical density (AOD) detection of Ki-67 in kidney (400×) |
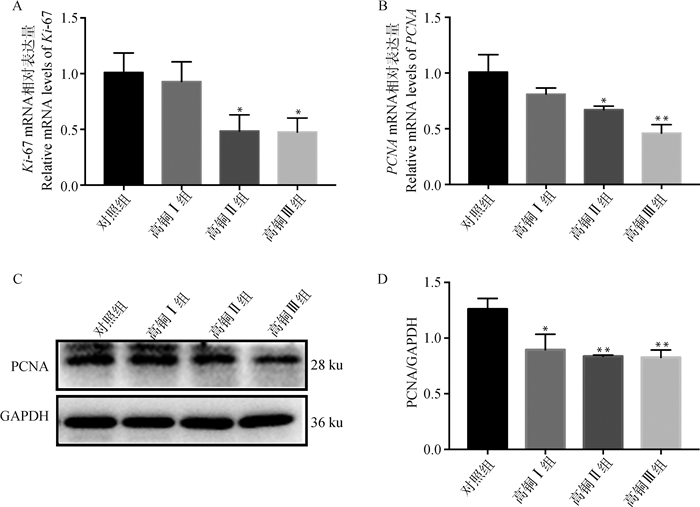
|
A.Ki-67 mRNA相对表达量; B. PCNA mRNA相对表达量; C. PCNA蛋白相对表达量; D. PCNA蛋白相对表达量 A. Ki-67 mRNA relative expression; B. PCNA mRNA relative expression; C. PCNA protein relative expression; D. PCNA protein relative expression 图 3 高铜对大鼠肾增殖相关基因Ki-67和PCNA相对表达量的影响 Fig. 3 Effect of high copper content on relative expression levels of proliferation-related genes Ki-67 and PCNA in rat kidneys |
高铜对炎性因子IL-1β、IL-2、IL-6、IL-18、NF-κB、TNF-α mRNA的影响如图 4所示。其中,IL-1β、IL-6、IL-18 mRNA的相对表达量呈剂量依赖性上升;IL-2 mRNA相对表达量在高铜Ⅱ组显著上调(P < 0.05),其他组别差异不显著(P>0.05)。NF-κB、TNF-α mRNA在高铜组的相对表达量与对照组相比显著上调(P < 0.05)。
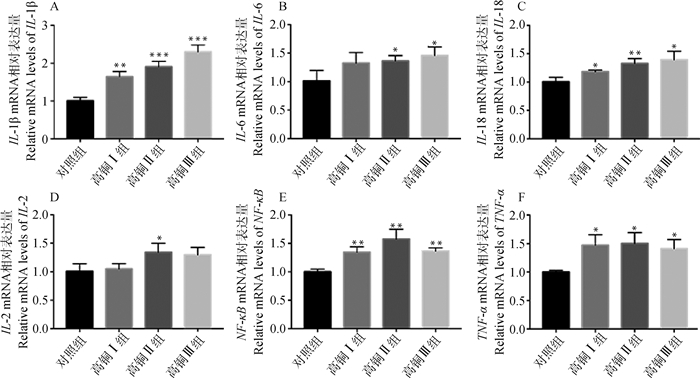
|
A. IL-1β mRNA相对表达量; B. IL-6 mRNA相对表达量; C. IL-18 mRNA相对表达量; D. IL-2 mRNA相对表达量; E. NF-κB mRNA相对表达量; F. TNF-α mRNA相对表达量 A. IL-1β mRNA relative expression; B. IL-6 mRNA relative expression; C. IL-18 mRNA relative expression. D. IL-2 mRNA relative expression; E. NF-κB mRNA relative expression; F. TNF-α mRNA relative expression 图 4 高铜作用下大鼠肾细胞IL-1β、IL-6、IL-18、IL-2、NF-κB、TNF-α mRNA的表达 Fig. 4 Expression of IL-1β, IL-6, IL-18, IL-2, NF-κB and TNF-α mRNA in rat kidney cells under high copper content |
Western blot结果显示(图 5),饲喂高铜日粮后,IL-1β蛋白表达呈剂量依赖性上调,差异显著(P < 0.05)。随着饲料铜含量上升,IL-6和IL-18蛋白表达有先升高后降低的趋势。高铜Ⅱ组IL-6蛋白的表达量较对照组显著上调(P < 0.05),但其他组别变化不显著(P>0.05)。高铜Ⅰ组IL-18蛋白表达显著上调(P < 0.01), 但高铜Ⅱ、Ⅲ组IL-18蛋白表达量相较对照组显著下降(P < 0.01)。
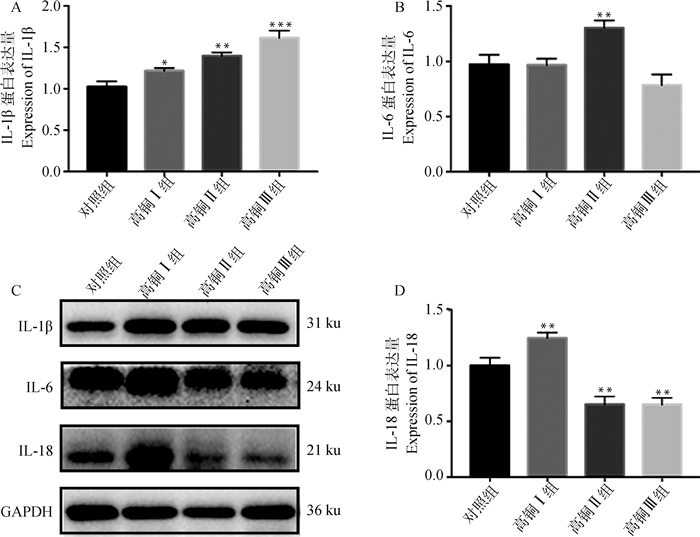
|
A. IL-1β蛋白相对表达量; B. IL-6蛋白相对表达量; C.IL-1β、IL-6、IL-18蛋白相对表达量; D. IL-18蛋白相对表达量 A. IL-1β protein relative expression; B. IL-6 protein relative expression; C. IL-1β, IL-6 and IL-18 proteins relative expression; D. IL-18 protein relative expression 图 5 高铜作用下大鼠肾细胞IL-1β、IL-6、IL-18蛋白的表达 Fig. 5 Expression of IL-1β, IL-6 and IL-18 proteins in rat kidney cells under high copper content |
研究表明,铜会参与很多生物学功能,如细胞呼吸、增强动物免疫力、促进动物生长等。在畜牧业生产过程中,饲料中添加一定量的硫酸铜可以促进畜禽生长,如果饲料中铜的浓度过高或比例不平衡,容易引起铜中毒,会给动物机体、食品安全、人类健康及自然环境带来较大的危害[16-17]。铜中毒对动物心、肺、肝等器官均有影响,会产生明显病理变化,且与铜的浓度呈正相关,剂量越大,损害越大。同时,高铜刺激也会导致细胞活性下降[18-20]。有研究表明,长期在低铜环境下暴露会引起小鼠大脑线粒体蛋白的异常表达,这些异常表达的蛋白参与细胞凋亡,造成线粒体损伤、内质网应激等[11, 21]。已有研究表明,铜会与细胞膜受体结合,经一系列反应,激活NF-κB通路,诱导IL-1β、IL-2、IL-6、IL-18、TNF-α转录, 促使炎性因子释放,造成免疫功能失调。另外,低剂量的铜可以促进细胞增殖,但高剂量则会抑制增殖活性[22-25]。
本试验分4个浓度梯度建立大鼠铜暴露模型,并采用多种方法评价不同浓度的铜对大鼠肾病理组织学损伤以及对细胞炎性因子表达和细胞增殖的影响。HE染色的结果显示,高铜的刺激导致肾淤血、肾小管萎缩和以中性粒细胞为主的炎性细胞浸润。病理组织学检查结果显示,高铜暴露对肾细胞和组织学层面产生了不可逆的损伤。另外,Ki-67、PCNA mRNA相对表达量及其蛋白表达量可评价细胞增殖功能。Ki-67是细胞增殖蛋白,常作为正常细胞和肿瘤细胞的标志物,PCNA仅在细胞分裂阶段表达,是DNA合成的必需条件,二者对细胞周期有调控作用[26-27]。本试验中,Ki-67和PCNA两种蛋白表达量的降低,反映了肾细胞的分裂状态受到高铜抑制。高铜暴露对大鼠肾细胞造成了损伤,这种损伤直接抑制了肾细胞分裂过程中DNA的合成,阻碍了细胞增殖分裂进程,最终表现为高铜的暴露抑制了肾细胞的增殖。
NF-κB是重要的核转录因子,在控制免疫、炎症方面起重要作用,同时也是应激反应的靶分子,通过促进下游炎性分子的表达,最终导致肾组织充血肿胀,肾小管萎缩,组织炎性细胞浸润[28]。受NF-κB调控的基因有IL-1β、IL-2、IL-6、IL-18、TNF-α等。IL-1β能够通过刺激细胞因子、金属蛋白酶等途径介导炎症反应和免疫应答[29];IL-6可通过中枢神经系统,调节机体免疫应答[18];IL-2则能够激活T细胞,介导体液免疫[30];IL-18是重要的单核细胞趋化因子,促进巨噬细胞分化,诱导多种细胞因子分泌[31-32]。TNF-α是细胞反应中最初且最重要的炎症细胞因子,能够在细胞核亚细胞水平上激发瀑布效应,诱导多种炎性因子表达[33-34]。本试验结果证实,高铜能够激活NF-κB信号通路,从而使肾细胞中炎症细胞因子mRNA的表达上调,随着日粮中铜含量的提高,NF-κB mRNA转录水平显著上调,在高铜Ⅱ组达到最高。由此可见,高铜可诱导肾细胞NF-κB的活化,进而引起一系列基因的表达,主要包括IL-1β、IL-2、IL-6、TNF-α,从而激活机体免疫应答,促进免疫炎症反应的发生。但IL-6、IL-18的蛋白表达量在高铜Ⅲ组低于高铜Ⅱ组,推测是过高浓度的铜导致肾细胞损伤,从而激活了机体的保护机制, 如自噬和受损伤肾细胞的凋亡。本试验结果表明,日粮铜含量达到30、60和120 mg·kg-1时,将会对肾组织造成不可逆的损伤,而这一损伤主要通过NF-κB途径进行介导,NF-κB的激活使其下游的IL-1β、IL-2、IL-6、IL-18、TNF-α等细胞炎性因子表达上调,从而介导白细胞趋化反应,同时,高铜的浸润在细胞层面也对肾组织造成不可逆的损伤,抑制肾细胞增殖,最终表现为病理组织学上的肾充血水肿、炎性细胞浸润和肾小管的萎缩,而这一结论与文丹等[28]的研究结果也基本相符。
4 结论高铜日粮可抑制大鼠肾细胞增殖,并通过NF-κB信号通路造成炎性损伤。
| [1] |
张倚剑, 梁天柱, 冯栋梁, 等. 微量元素铜在养殖业中的应用研究[J]. 广西农学报, 2019, 34(3): 57–62.
ZHANG Y J, LIANG T Z, FENG D L, et al. Research on trace element copper application in aquaculture[J]. Journal of Guangxi Agriculture, 2019, 34(3): 57–62. (in Chinese) |
| [2] | WANG Z H, LIU X Y, QIN H Y. Bioconcentration and translocation of heavy metals in the soil-plants system in Machangqing copper mine, Yunnan Province, China[J]. J Geochem Explor, 2019, 200: 159–166. DOI: 10.1016/j.gexplo.2019.02.005 |
| [3] |
柏云江. 铜锌砷等过量对饲料安全的影响及对策[J]. 现代畜牧兽医, 2010(3): 55–57.
BAI Y J. Effect on feed safety of superfluous addition for Cu, Zn, As and countermeasure[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2010(3): 55–57. (in Chinese) |
| [4] |
杨光, 崔恒敏, 邓俊良, 等. 实验性雏鸡铜中毒的病理学研究[J]. 中国兽医科技, 2005, 35(10): 801–806.
YANG G, CUI H M, DENG J L, et al. Pathological study of experimental copper toxicity in chickens[J]. Chinese Journal of Veterinary Science and Technology, 2005, 35(10): 801–806. (in Chinese) |
| [5] | WAN F, ZHONG G L, NING Z J, et al. Long-term exposure to copper induces autophagy and apoptosis through oxidative stress in rat kidneys[J]. Ecotoxicol Environ Saf, 2020, 190: 110158. DOI: 10.1016/j.ecoenv.2019.110158 |
| [6] | ZHAO H J, WANG Y, FEI D X, et al. Destruction of redox and mitochondrial dynamics co-contributes to programmed cell death in chicken kidney under arsenite or/and copper (Ⅱ) exposure[J]. Ecotoxicol Environ Saf, 2019, 179: 167–174. DOI: 10.1016/j.ecoenv.2019.04.062 |
| [7] |
于燕波, 张淑静, 臧鹏, 等. 低剂量有机磷农药和重金属联合暴露对大鼠白细胞介素、肿瘤坏死因子及免疫球蛋白的影响[J]. 卫生研究, 2014, 43(2): 317–319.
YU Y B, ZHANG S J, ZANG P, et al. Effects of low doses of organophosphorus pesticides combined with heavy metals on interleukin, tumor necrosis factor and immunoglobulin in rats[J]. Journal of Hygiene Research, 2014, 43(2): 317–319. (in Chinese) |
| [8] | JIAO T, CHU X H, GAO Z Q, et al. New insight into the molecular basis of Fe (Ⅲ) stress responses of Procambarus clarkii by transcriptome analysis[J]. Ecotoxicol Environ Saf, 2019, 182: 109388. DOI: 10.1016/j.ecoenv.2019.109388 |
| [9] |
任洁, 程春来, 芦兰, 等. 肺癌血清标志物PCNA及Bax的表达及与预后的关系[J]. 重庆医学, 2017, 46(10): 1399–1401.
REN J, CHENG C L, LU L, et al. Expression of lung cancer serum markers PCNA and Bax and their relationship with prognosis[J]. Chongqing Medical Journal, 2017, 46(10): 1399–1401. (in Chinese) |
| [10] | CHI J R, YU Z H, LIU B W, et al. SNHG5 promotes breast cancer proliferation by sponging the miR-154-5p/PCNA axis[J]. Mol Ther Nucleic Acids, 2019, 17: 138–149. DOI: 10.1016/j.omtn.2019.05.013 |
| [11] |
郑皓, 景嘉楠, 董慧, 等. 细胞周期蛋白依赖性激酶16(CDK16)与细胞增殖指标Ki67在食管鳞癌中的表达及意义[J]. 西安交通大学学报:医学版, 2019, 40(3): 425–431.
ZHENG H, JING J N, DONG H, et al. Expression and significance of cyclin-dependent kinase 16 and cell proliferation index Ki67 in esophageal squamous cell carcinoma[J]. Journal of Xi'an Jiaotong University:Medical Sciences, 2019, 40(3): 425–431. (in Chinese) |
| [12] | LI L T, JIANG G, CHEN Q, et al. Ki67 is a promising molecular target in the diagnosis of cancer (review)[J]. Mol Med Rep, 2015, 11(3): 1566–1572. DOI: 10.3892/mmr.2014.2914 |
| [13] |
刘云才.低剂量铜暴露对大鼠肝功能和炎性因子表达的影响及乳酸菌干预作用[D].青岛: 青岛大学, 2017.
LIU Y C.Effects of low dose copper exposure on liver function and expression of inflammatory cytokines in rats and intervention of Lactic acid bacteria[D]. Qingdao: Qingdao University, 2017.(in Chinses |
| [14] | CHEN J W, STEFANOVSKI D, HAUGHAN J, et al. Inflammatory mediators are potential biomarkers for extracorporeal shockwave therapy in horses[J]. Equine Vet J, 2020, 52(3): 449–454. DOI: 10.1111/evj.13183 |
| [15] | LIU X Y, CHEN G N, DU G M, et al. Berbamine ameliorates ethanol-induced liver injury by inhibition of hepatic inflammation in mice[J]. Chin J Nat Med, 2020, 18(3): 186–195. |
| [16] | HILL G M, SHANNON M C. Copper and zinc nutritional issues for agricultural animal production[J]. Biol Trace Elem Res, 2019, 188(1): 148–159. DOI: 10.1007/s12011-018-1578-5 |
| [17] |
刘伟. 猪五种常见潜在有毒物质中毒症的诊疗[J]. 现代畜牧科技, 2019(2): 103–104.
LIU W. Diagnosis and treatment of five common potential toxic substance poisoning diseases in pigs[J]. Modern Animal Husbandry Science & Technology, 2019(2): 103–104. (in Chinese) |
| [18] |
郭剑英, 余文兰, 曹华斌, 等. 铜对大鼠肝细胞活性、自由基代谢及细胞膜电位的影响[J]. 中国兽医学报, 2016, 36(11): 1939–1943, 1948.
GUO J Y, YU W L, CAO H B, et al. The effects of copper on rat hepatocytes proliferation activity and its free radical metabolism and the membrane potential[J]. Chinese Journal of Veterinary Science, 2016, 36(11): 1939–1943, 1948. (in Chinese) |
| [19] |
邱文才, 蔡跃佳, 李伟豪, 等. 铜中毒对小鼠心肺及肝功能的影响[J]. 动物医学进展, 2019, 40(11): 55–58.
QIU W C, CAI Y J, LI W H, et al. Effects of copper poisoning on cardiac, pulmonary and hepatic functions in mice[J]. Progress in Veterinary Medicine, 2019, 40(11): 55–58. (in Chinese) |
| [20] | GIERGIEL M, DURKALEC M M, NAWROCKA A, et al. Ingestion of bedding material as a cause of acute copper sulfate poisoning in turkey poults[J]. Poult Sci, 2019, 98(2): 707–711. DOI: 10.3382/ps/pey430 |
| [21] | LIN X M, WEI G, HUANG Z J, et al. Mitochondrial proteomic alterations caused by long-term low-dose copper exposure in mouse cortex[J]. Toxicol Lett, 2016, 263: 16–25. DOI: 10.1016/j.toxlet.2016.10.009 |
| [22] |
付世新, 罗春海, 刘海瑞. 铜对猪传代肾细胞(PK15)增殖的影响[J]. 黑龙江八一农垦大学学报, 2008, 20(2): 47–50.
FU S X, LUO C M, LIU H R. Effect of copper on proliferation of PK15[J]. Journal of Heilongjiang August First Land Reclamation University, 2008, 20(2): 47–50. (in Chinese) |
| [23] |
张静, 曲小姝, 刘树萍, 等. 过渡金属铜修饰的仲钨酸盐抑制人卵巢癌细胞增殖的研究[J]. 东北师大学报:自然科学版, 2017, 49(3): 92–96.
ZHANG J, QU X S, LIU S P, et al. Inhibitory effect of a paradodecatungstate-B compound decorated by transition metal copper on the growth of human ovarian carcinoma SKOV-3 cells[J]. Journal of Northeast Normal University:Natural Science Edition, 2017, 49(3): 92–96. (in Chinese) |
| [24] | PEREIRA T C P, CAMPOS M M, BOGO M R. Copper toxicology, oxidative stress and inflammation using zebrafish as experimental model[J]. J Appl Toxicol, 2016, 36(7): 876–885. DOI: 10.1002/jat.3303 |
| [25] | KENNETH N, HUCKS G, KOCAB A, et al. Copper is a potent inhibitor of both the canonical and non-canonical NFκB pathways[J]. Cell Cycle, 2014, 13(6): 1006–1014. DOI: 10.4161/cc.27922 |
| [26] |
李敏.增殖细胞核抗原和肿瘤增殖标记分子在胃癌中的表达及临床意义[D].泸州: 西南医科大学, 2019.
LI M.Expression and clinical significance of proliferating cell nuclear antigen and tumor proliferation marker molecule in gastric cancer[D]. Luzhou: Southwest Medical University, 2019.(in Chinese) |
| [27] | QIU X M, WANG H, WANG Z, et al. Expression of PCNA, Ki-67 and COX-2 in breast cancer based on DCE-MRI image information[J]. J Infect Public Health, 2019. DOI: 10.1016/j.jiph.2019.06.024 |
| [28] |
文丹, 廖媛, 李健春, 等. 异甘草素通过Smad3/Arid2-IR/NF-κB轴改善顺铂诱导的急性肾损伤小鼠炎症反应[J]. 中国比较医学杂志, 2020, 30(6): 25–30, 46.
WEN D, LIAO Y, LI J C, et al. Effect of isoliquiritigenin on cisplatin-induced acute kidney injury in mice with inflammation through the Smad3/Arid2-IR/NF-κB axis[J]. Chinese Journal of Comparative Medicine, 2020, 30(6): 25–30, 46. (in Chinese) |
| [29] | TURNLUND J R, KEYES W R, KIM S K, et al. Long-term high copper intake:effects on copper absorption, retention, and homeostasis in men[J]. Am J Clin Nutr, 2005, 81(4): 822–828. DOI: 10.1093/ajcn/81.4.822 |
| [30] | FUNSTEN J R, BRIZUELA K O M, SWATZEL H E, et al. PKC signaling contributes to chromatin decondensation and is required for competence to respond to IL-2 during T cell activation[J]. Cell Immunol, 2020, 347: 104027. DOI: 10.1016/j.cellimm.2019.104027 |
| [31] |
聂兆超, 石星, 毛海婷. IL-18诱导的单核细胞THP-1对肺癌细胞增殖、迁移和侵袭的影响[J]. 南京医科大学学报:自然科学版, 2019, 39(10): 1430–1436.
NIE Z C, SHI X, MAO H T. Effects of IL-18-induced mononuclear cell THP-1 on proliferation, migration and invasion of lung cancer cells[J]. Journal of Nanjing Medical University:Natural Sciences, 2019, 39(10): 1430–1436. (in Chinese) |
| [32] | OKAMURA H, TSUTSUI H, KASHIWAMURA S I, et al. Interleukin-18:a novel cytokine that augments both innate and acquired immunity[J]. Adv Immunol, 1998, 70: 281–312. DOI: 10.1016/S0065-2776(08)60389-2 |
| [33] |
赵洪礼, 吴战军. 细胞因子与重症急性胰腺炎关系研究进展[J]. 临床消化病杂志, 2010, 22(1): 61–63.
ZHAO H L, WU Z J. Research progress on the relationship between cytokines and severe acute pancreatitis[J]. Chinese Journal of Clinical Gastroenterology, 2010, 22(1): 61–63. (in Chinese) |
| [34] | LUZARDO-OCAMPO I, CAMPOS-VEGA R, DE MEJIA E G, et al. Consumption of a baked corn and bean snack reduced chronic colitis inflammation in CD-1 mice via downregulation of IL-1 receptor, TLR, and TNF-α associated pathways[J]. Food Res Int, 2020, 132: 109097. DOI: 10.1016/j.foodres.2020.109097 |



