小反刍兽疫(peste des petits ruminants,PPR)是由小反刍兽疫病毒(peste des petits ruminants virus,PPRV)引起山羊、绵羊及野生小反刍兽的一种急性、烈性、接触性动物传染病。该病至今依然是世界范围内严重威胁动物健康养殖的重大疫病之一。PPRV对淋巴细胞和上皮细胞具有较强噬性,其感染宿主后造成机体免疫抑制是其致病的主要特征[1-3]。淋巴细胞信号活化分子(signaling lymphocyte activation molecule, SLAM)是PPRV等麻疹病毒在淋巴细胞的主要受体,其在多种哺乳动物淋巴细胞、树突细胞和巨噬细胞等表达[4-8]。在山羊的研究表明,SLAM表达水平与PPRV对宿主细胞的感染性和复制水平密切相关[9-13]。然而,有关PPRV对宿主细胞SLAM表达的调控作用尚未完全阐明。本实验室前期研究表明, miR-218在调节山羊外周血单核细胞(PBMCs)中SLAM的表达中发挥关键作用[14]。流式细胞术检测结果表明PPRV感染能够分别导致病毒侵染呈阳性和阴性的细胞中SLAM表达水平均较未感染对照组显著升高,提示了外泌体对SLAM表达水平的调控作用。
外泌体(exosomes)是由包括外周血单核细胞在内的多种细胞分泌的、直径80~100 nm的双层脂质膜囊泡[15],其作为转运各种生物分子的重要载体,内含多种蛋白质、mRNA和miRNA,参与细胞间通讯和病原体转移等过程[14]。2003年,Gould[16]等提出了逆转录病毒的"特洛伊木马外泌体假说":即逆转录病毒“挟持”外泌体的形成和分泌途径,产生更多感染性病毒颗粒,与外泌体一起分泌至细胞外,从而将病毒致病相关蛋白、基因组等病毒组分转运到全身各处,导致免疫功能的失调,造成病毒扩散及产生免疫抑制[17-19],但有关外泌体在PPRV感染中的研究鲜有报道。本实验室前期的研究表明,PPRV感染能够显著提高山羊PBMCs中外泌体分泌水平[20],提示外泌体可能在PPRV感染中发挥作用。
本研究旨在通过检测PPRV感染山羊PBMCs源外泌体对接纳细胞(正常山羊PBMCs)中SLAM表达水平的调控作用,分析外泌体介导PPRV对山羊细胞中SLAM表达的网络调控作用及其作用机制,为探寻PPRV防控提供了新靶点。
1 材料与方法 1.1 病毒及细胞本试验中所用PPRV标准疫苗毒株N75-1为本实验室保存,病毒在Vero细胞上增殖,滴度是105.65TCID50·mL-1;山羊PBMCs从西北农林科技大学实验动物中心18月龄健康莎能奶山羊颈静脉处无菌采血,随后用外周血单核细胞分离液分离获得,将PBMCs置于RPMI 1640培养基,于37 ℃、5%CO2培养箱中培养。
1.2 主要试剂DMEM/F-12为Gibco产品;胎牛血清为Hy-clone产品;胰蛋白酶为Amresco产品;Lipofectamine 2000转染试剂、RNA酶抑制剂和TRIzolRNA试剂盒均为Invitrogen公司产品;外周血单核细胞分离试剂盒购自天津灏洋生物制品科技有限公司;逆转录试剂盒和miRNA定量试剂盒均购自广州锐博生物科技有限公司;鼠抗SLAM单克隆抗体、兔抗GAPDH抗体、HRP-羊抗兔IgG、HRP-羊抗鼠IgG和pcDNA3.1均购自Invitrogen公司;鼠抗PPRV N蛋白、鼠抗PPRV H蛋白抗体由中国兽医药品监察所提供。
1.3 病毒感染山羊PBMCs分离后于含10%胎牛血清的RPMI 1640培养基、5% CO2、37 ℃培养16 h。将PPRV N57-1株接种至山羊PBMCs(MOI=1),同时设置未感染对照组(Mock),于感染后24 h收取培养上清。感染组和未感染对照均设置3个独立重复。
1.4 PBMCs源外泌体的提取与纯度鉴定收集山羊外周血单核细胞培养上清液,外泌体提取参考文献[20],主要过程:于4 ℃ 30 000×g离心10 min以去除细胞碎片;吸取上清经0.22 μm滤膜过滤;按比例加入外泌体提取试剂,上下颠倒混匀,4 ℃静止过夜后1 500×g离心30 min, 弃掉上清,1 500×g再次离心5 min, 弃上清;离心管管底的沉淀即为外泌体,用适量含2%胎牛血清的RPMI1640培养基重悬后置于-80 ℃保存备用,避免反复冻融。外泌体纯度鉴定采用纳米粒子追踪术(NTA)及电子显微镜分析(EM)。
1.5 PBMCs源外泌体对接纳细胞SLAM表达及细胞因子分泌的影响分别从PPRV未感染组(Exo-Mock)和感染组(Exo-PPRV)取10 mL培养上清液提取相应的外泌体,用含2%胎牛血清的RPMI1640培养基调整浓度后,分别与接纳细胞(正常山羊PBMCs)共培养48 h后收取细胞样本,同时设置外泌体未共育对照组(Control);各组均设置3个独立的生物学重复;分别采用qRT-PCR及Western blot检测上述细胞中SLAM及TNF-α、IFN-α、IL-10和IFN-γ的表达水平。
1.6 RNA的提取和荧光定量PCR用Trizol reagent处理各组PBMCs后提取总RNA,Nanodrop2000超微量分光光度计定量,用cDNA逆转录试剂盒将RNA逆转录为cDNA,采用SYBR Green Ⅰ进行qRT-PCR,每组设3个重复,分别检测各组细胞样本中SLAM mRNA、novel-miR218、TNF-α mRNA、IFN-α mRNA、IL-10 mRNA、IFN-γ mRNA转录水平。novel-miR218检测以5S为内参基因,其余以GAPDH为内参基因,2-△△Ct进行相对定量计算,每个样品重复3次求平均值。TNF-α、IFN-α、IL-10、IFN-γ和GAPDH基因扩增引物序列参考文献[21],SLAM和novel-miR218扩增引物序列参考文献[22]。
1.7 Western blot检测将各组细胞样本用RIPA裂解后进行SDS-PAGE检测,然后将蛋白质电转至PVDF膜上,5%脱脂奶粉室温封闭2 h, 分别用GAPDH抗体、PPRV N蛋白抗体、PPRV H蛋白抗体在4 ℃孵育过夜,TBST洗膜4次,二抗孵育1 h, TBST洗膜6次,加入化学发光剂ECL,曝光获得相应条带,采用ImageJ2x软件分析灰度值。
1.8 流式细胞术检测将外泌体共育组(Exo-Mock和Exo-PPRV)和外泌体未共育对照组(Control)的细胞(1×106)分别与FITC标记的抗SLAM抗体室温下避光孵育15 min;加入分支聚乙烯亚胺(PEI),37 ℃孵育15 min后超速离心去除PEI。加入金纳米颗粒后轻柔重悬混匀,37 ℃孵育60 min,加APC DNA染料室温下反应15 min后用流式细胞仪检测。
1.9 质粒与转染质粒pcDNA3.1-H及pcDNA3.1-N等均由本实验室构建并保存。按照Invitrogen公司提供的Lipofectamine 2000转染试剂说明书将pcDNA3.1-H转染至山羊PBMCs中,利用Western blot检测转染细胞中PPRV-H蛋白表达情况,利用qRT-PCR检测SLAM mRNA和miR-218转录水平,流式细胞术检测转染细胞SLAM受体在细胞表面表达水平。
1.10 数据处理与统计每个试验重复3次,所有数据均采用t检验进行统计分析,数据用“x±s”表示,“*”表示差异显著(P < 0.05), “**”表示差异极显著(P < 0.01), “ns”表示差异不显著。
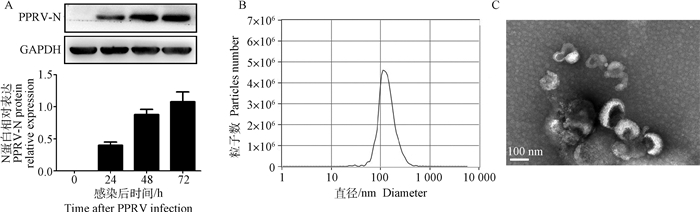
2 结果 2.1 PPRV在山羊PBMCs中的增殖规律及其诱导外泌体纯度鉴定为检测PPRV感染山羊PBMCs后的增殖规律,通过Western blot检测PPRV N蛋白在山羊PBMCs的表达水平。结果表明,PPRV N蛋白在感染后24 h时明显增加且随着感染时间延长而持续升高(图 1A)。对PPRV感染山羊PBMCs源外泌体的纯度进行了鉴定分析,纳米颗粒示踪分析结果表明,提取的外泌体粒径在100 nm处出现峰值(图 1B)。透射电镜下观察到外泌体呈现典型的茶托样结构,直径约为100 nm(图 1C)。
|
A. Western blot检测PPRV感染山羊PBMCs中PPRV N蛋白的表达;B.纳米粒子追踪术检测外泌体的粒径大小分布;C.透射电镜鉴定外泌体形态 A. Western blot analysis of PPRV N protein expression in PPRV infected goat PBMCs; B. NTA analysis of size distribution of exosomes; C. TEM identification of exosomes 图 1 PPRV在山羊PBMCs中的增殖规律及其诱导外泌体纯度鉴定 Fig. 1 The proliferation of PPRV in goats PBMCs and the purity identification of its induced exosomes |
不同处理组提取Exosomes与正常山羊PBMCs共培养后,对细胞SLAM mRNA转录和表达水平进行检测,结果表明:Exo-PPRV组SLAM mRNA转录水平较Exo-Mock组、未处理对照组(Control)显著上调(P < 0.05);Exo-Mock组SLAM mRNA转录水平与未处理对照组(Control)相比差异不显著(图 2A )。流式细胞术检测结果表明:Exo-PPRV组SLAM细胞表面表达水平较Exo-Mock组、未处理对照组(Control)显著上调(P < 0.05);Exo-Mock组SLAM细胞表面表达水平与未感染对照组(Control)相比差异不显著(图 2B)。以上结果表明,PPRV感染PBMCs源外泌体能够显著上调接纳细胞中SLAM mRNA转录和表达水平。
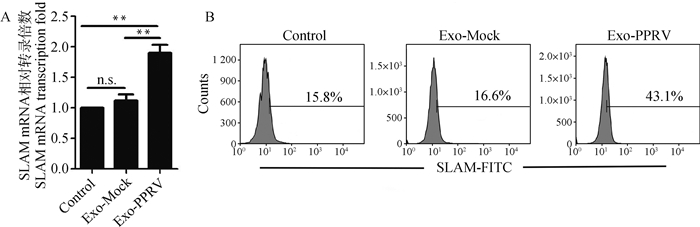
|
A. qRT-PCR检测SLAM mRNA转录水平(与对照组比较,**. P < 0.01; n.s.无显著差异);B.流式细胞术检测SLAM受体表面表达水平 A. qRT-PCR analysis of SLAM mRNA transcription level (compared with control, **. P < 0.01; ns. No significant difference); B. Flow cytometric analysis of SLAM expression level 图 2 PPRV感染山羊PBMCs源外泌体对接纳细胞中SLAM表达的影响 Fig. 2 Effect of exosomes derived from PPRV-infected goat PBMCs on the expression of SLAM receptor in recipient cells |
不同处理组提取外泌体与正常山羊PBMCs共培养后,分别对细胞中TNF-α、IFN-α、IL-10、IFN-γ mRNA转录水平进行检测。qRT-PCR检测结果表明,Exo-PPRV组TNF-α、IL-10、IFN-γ mRNA转录水平较Exo-Mock组、外泌体未共育对照组(Control)均显著上调(P < 0.05)(图 3 A、C、D), IFN-α mRNA转录水平较Exo-Mock组、外泌体未共育对照组(Control)均显著下调(P < 0.05)(图 3B);Exo-Mock组TNF-α、IFN-α、IL-10、IFN-γ mRNA转录水平与外泌体未共育对照组(Control)相比差异不显著(图 3A~D )。该研究结果表明PPRV感染山羊PBMCs源外泌体对接纳细胞中多种细胞因子转录水平具有一定的调节作用。

|
A. qRT-PCR技术检测TNF-α mRNA转录水平; B. qRT-PCR技术检测IFN-α mRNA转录水平; C. qRT-PCR技术检测IL-10 mRNA转录水平; D. qRT-PCR技术检测IFN-γ mRNA转录水平。与对照组比较,*.P < 0.05; **. P < 0.01; ns.无显著差异 A. qRT-PCR analysis of TNF-α mRNA transcription level; B. qRT-PCR analysis of IFN-α mRNA transcription level; C. qRT-PCR analysis of IL-10 mRNA transcription level; D. qRT-PCR analysis of IFN-γ mRNA transcription level. Compared with control, *.P < 0.05; **. P < 0.01; ns. No significant difference 图 3 PPRV感染山羊PBMCs源外泌体对接纳细胞中细胞因子转录水平的影响 Fig. 3 Effects of PPRV-infected goat PBMCs exosomes on the transcription level of cytokines |
本实验室前期研究表明,细胞miR-218靶向负调控SLAM表达水平,而PPRV结构蛋白H蛋白及N蛋白通过调控miR-218进而调节SLAM表达[14]。为深入探究PPRV感染细胞源外泌体对接纳细胞中SLAM表达水平的调控机制,本研究首先对PPRV感染细胞源外泌体中PPRV H及N蛋白荷载量进行了检测。Western blot检测结果表明,在PPRV感染源外泌体(PPRV-exosome)及PPRV感染对照细胞(PPRV-infected cells)中均检测到PPRV-H蛋白及PPRV-N蛋白表达,且外泌体中PPRV-H蛋白表达水平与PPRV感染细胞中均较高,而外泌体中PPRV-N蛋白表达量较PPRV感染组低;在未感染细胞外泌体(Mock-exosome)中则未检测到PPRV N蛋白和PPRV H蛋白表达(图 4A)。将不同处理组提取外泌体与正常山羊PBMCs共培养后, Exo-PPRV共培养组细胞检测到高表达水平的PPRV-H蛋白和少量PPRV-N蛋白表达,Exo-Mock组、外泌体未处理对照组(Control)未检测到PPRV N蛋白和PPRV H蛋白表达(图 4B)。对PPRV感染细胞源外泌体共孵育山羊PBMCs中miR-218的qRT-PCR检测结果表明,Exo-PPRV组miR-218表达水平较Exo-Mock组、未处理对照组(Control)显著下调(P < 0.05);Exo-Mock组miR-218表达水平与未处理对照组(Control)相比差异不显著(图 4C)。该结果表明PPRV感染源外泌体中荷载高水平的PPRV H蛋白且可将其传递至接纳细胞中,而传递至接纳细胞中的H蛋白对miR-218表达水平具有显著的负调控作用。

|
A. Western blot技术检测外泌体中PPRV蛋白表达;B. Western blot技术检测外泌体共孵育细胞中PPRV蛋白表达;C. qRT-PCR技术检测外泌体共孵育细胞中miR-218表达水平。与对照组比较,*.P < 0.05; **. P < 0.01; n.s.无显著差异 A. Western blot analysis of PPRV relative protein expression in exosomes; B. Western blot analysis of PPRV relative protein expression in exosomes incubated cells; C. qRT-PCR analysis of miR-218 expression level in exosomes incubated cells. Compared with control, *.P < 0.05; **. P < 0.01; ns. No significant difference 图 4 PPRV感染山羊PBMCs源外泌体及接纳细胞中病毒蛋白及miR-218表达水平 Fig. 4 Expression levels of viral proteins and miR-218 in PBMCs-derived exosomes and receptor cells of PPRV-infected goats |
为进一步验证PPRV H蛋白对SLAM表达的作用,将pcDNA3.1-H转染山羊PBMCs后48 h后,Western blot检测结果表明,在pcDNA3.1-H转染组检测到PPRV-H蛋白表达,在pcDNA3.1转染组和未转染对照组(Control)未检测到PPRV-H蛋白表达(图 5A)。对pcDNA3.1-H转染细胞中miR-218的qRT-PCR检测结果显示,pcDNA3.1-H转染组miR-218表达水平较pcDNA3.1转染组、未转染对照组(Control)显著下调(P < 0.05);pcDNA3.1转染组miR-218表达水平与未转染对照组(Control)相比差异不显著(图 5B)。对pcDNA3.1-H转染细胞中SLAM mRNA的qRT-PCR结果显示,pcDNA3.1-H转染组SLAM mRNA表达水平较pcDNA3.1转染组、未转染对照组(Control)显著上调(P < 0.05);pcDNA3.1转染组SLAM mRNA表达水平与未转染对照组(Control)相比差异不显著(图 5C)。流式细胞术检测结果说明,pcDNA3.1-H转染组SLAM细胞表面表达水平较pcDNA3.1转染组、未转染对照组(Control)显著上调(P < 0.05);pcDNA3.1组SLAM细胞表面表达水平与未感染对照组(Control)相比差异不明显(图 5D)。该研究结果进一步表明PPRV H蛋白通过调控miR-218进而调节SLAM mRNA转录和表达水平。

|
A. Western blot技术检测pcDNA3.1-H转染细胞中PPRV H蛋白表达;B. qRT-PCR技术检测pcDNA3.1-H转染细胞中miR-218表达水平;C. qRT-PCR技术检测pcDNA3.1-H转染细胞中SLAM mRNA转录水平;D.流式细胞术检测pcDNA3.1-H转染细胞中SLAM细胞表面表达水平。与对照组比较,*.P < 0.05; **. P < 0.01; ns.无显著差异 A. Western blot analysis of PPRV-H expression in PBMCs transfected with pcDNA3.1-H. B. qRT-PCR analysis of miR-218 expression in PBMCs transfected with pcDNA3.1-H. C. qRT-PCR analysis of SLAM mRNA transcription in PBMCs transfected with pcDNA3.1-H. D. Flow cytometric analysis of SLAM expression in PBMCs transfected with pcDNA3.1-H.Compared with control, *.P < 0.05; **. P < 0.01; ns. No significant difference 图 5 pcDNA3.1-H转染山羊PBMCs中miR-218及SLAM的表达 Fig. 5 Expression of miR-218 and SLAM receptors in PBMCs transfected with pcDNA3.1-H |
小反刍兽疫是由副黏病毒科麻疹病毒属小反刍兽疫病毒(PPRV)引起的一种急、热性、高度接触性一类传染病,主要感染包括野生动物在内的小反刍动物,其中山羊高度易感,绵羊易感。该病危害严重,其发病率可高达90%~100%,病死率可达50%~ 100%[23-25]。PPRV主要是通过与特定受体结合来感染宿主细胞,但目前其感染宿主细胞的致病机制尚未完全明确。研究表明,SLAM受体是PPRV感染宿主淋巴细胞的唯一受体[9-13]。本实验室前期研究表明,miR-218在调节山羊PBMC的SLAM受体表达中发挥关键作用[14]。值得注意的是,基于免疫荧光和流式细胞术检测的分析表明:PPRV感染组中,PPRV阴性细胞SLAM表达水平较正常对照组细胞显著升高,提示外泌体对SLAM受体表达水平的调控作用。
外泌体是由细胞主动分泌的80~100 nm的囊泡结构[17-18],越来越多的研究表明,外泌体在病毒感染中发挥着重要作用,一方面被感染的细胞分泌的外泌体可以携带病毒RNA、蛋白质,从而影响邻近细胞[15, 26-27];另一方面病毒可以“挟持”外泌体,实现免疫逃逸[28]。但有关外泌体在PPRV感染中的作用的研究鲜有报道,本实验室前期研究表明PPRV感染能够显著提高山羊PBMC中外泌体分泌水平[20],这提示外泌体可能在PPRV感染中发挥作用。本研究表明,PPRV感染源细胞外泌体能显著提高未感染细胞中SLAM表达水平。这与前期相关研究结果一致[14, 29-30]。同时,本研究还表明PPRV感染源外泌体可显著改变接纳细胞中TNF-α、IFN-α、IL-10和IFN-γ的表达水平。大量体外及动物试验研究表明,PPRV感染能够导致宿主细胞免疫相关细胞因子分泌表达水平发生改变[21, 23, 30]。PPRV感染源外泌体中是否荷载了感染性病毒核酸或者病毒蛋白以及荷载分子是否改变了接纳细胞中细胞因子的表达水平等尚待进一步研究。此外,越来越多的研究表明,SLAM受体相关信号通路在调节受体免疫水平中发挥关键作用[14, 31-33]。本研究中PPRV感染细胞源外泌体对接纳细胞中SLAM表达水平的上调作用,是否与SLAM相关信号通路激活而导致细胞因子表达水平发生变化也有待进一步研究。
外泌体中载荷内容物在调节接纳细胞生物学功能中发挥关键作用,特别是在不同的生理周期及病原体等外界不同应激因素作用下,外泌体中载荷物及其含量也不同。本实验室前期研究表明,PPRV结构蛋白H在负向调节山羊PBMC中miR-218中发挥重要作用[14],结合miR-218对SLAM受体表达的负调控作用,作者推测PPRV感染细胞源外泌体中可能荷载了部分PPRV蛋白并在诱导接纳细胞SLAM受体表达中发挥关键作用。基于Western blot的研究表明,PPRV感染源外泌体中荷载了高水平的PPRV的H蛋白且能够将其传递至接纳细胞内,而接纳细胞内低表达miR-218与高表达SLAM则提示miR-218在介导H蛋白对SLAM表达中的关键作用。为了进一步明确PPRV-H在调节接纳细胞中SLAM受体表达水平的调控作用,作者将构建的PPRV-H表达质粒转染至山羊PBMCs中,并检测其对转染细胞中SLAM表达的调节作用,研究表明转染PPRV-H表达载体可以显著提高转染细胞中SLAM表达水平。以上结果明确了PPRV感染细胞源外泌体对接纳细胞中SLAM表达的调控作用,而外泌体中荷载的高水平PPRV H蛋白是介导该调控作用的关键分子。
4 结论PPRV感染细胞源外泌体对山羊PBMCs中SLAM表达水平、TNF-α、IL-10和IFN-γ表达水平具有正调控作用,而外泌体中荷载的高水平PPRV H蛋白在外泌体介导的SLAM表达及细胞因子表达水平调控中发挥关键作用。
| [1] | KUMAR P, TRIPATHI B N, SHARMA A K, et al. Pathological and immunohistochemical study of experimental peste des petits ruminants virus infection in goats[J]. J Vet Med B, 2004, 51(4): 153–159. DOI: 10.1111/j.1439-0450.2004.00747.x |
| [2] | KAMEL M, EL-SAYED A. Toward peste des petits virus (PPRV) eradication:Diagnostic approaches, novel vaccines, and control strategies[J]. Virus Res, 2019, 274: 197774. DOI: 10.1016/j.virusres.2019.197774 |
| [3] | ZHU Z X, LI P F, YANG F, et al. Peste des petits ruminants virus nucleocapsid protein inhibits beta interferon production by interacting with IRF3 to block its activation[J]. J Virol, 2019, 93(16): e00362-19. DOI: 10.1128/JVI.00362-19 |
| [4] | PRAJAPATI M, ALFRED N, DOU Y X, et al. Host cellular receptors for the peste des petits ruminant virus[J]. Viruses, 2019, 11(8): 729. DOI: 10.3390/v11080729 |
| [5] | SEKI F, ONO N, YAMAGUCHI R, et al. Efficient isolation of wild strains of canine distemper virus in Vero cells expressing canine SLAM (CD150) and their adaptability to marmoset B95a cells[J]. J Virol, 2003, 77(18): 9943–9950. DOI: 10.1128/JVI.77.18.9943-9950.2003 |
| [6] | PAWAR R M, RAJ G D, KUMAR T M A S, et al. Effect of siRNA mediated suppression of signaling lymphocyte activation molecule on replication of peste des petits ruminants virus in vitro[J]. Virus Res, 2008, 136(1-2): 118–123. DOI: 10.1016/j.virusres.2008.04.026 |
| [7] | ONO N, TATSUO H, TANAKA K, et al. V domain of human SLAM (CDw150) is essential for its function as a measles virus receptor[J]. J Virol, 2001, 75(4): 1594–1600. DOI: 10.1128/JVI.75.4.1594-1600.2001 |
| [8] | VON MESSLING V, SVITEK N, CATTANEO R. Receptor (SLAM[CD150]) recognition and the V protein sustain swift lymphocyte-based invasion of mucosal tissue and lymphatic organs by a Morbillivirus[J]. J Virol, 2006, 80(12): 6084–6092. DOI: 10.1128/JVI.00357-06 |
| [9] | FUJITA K, MIURA R, YONEDA M, et al. Host range and receptor utilization of canine distemper virus analyzed by recombinant viruses:Involvement of heparin-like molecule in CDV infection[J]. Virology, 2007, 359(2): 324–335. DOI: 10.1016/j.virol.2006.09.018 |
| [10] | ALBINA E, KWIATEK O, MINET C, et al. Peste des petits ruminants, the next eradicated animal disease[J]. Vet Microbiol, 2013, 165(1-2): 38–44. DOI: 10.1016/j.vetmic.2012.12.013 |
| [11] | CAPOBIANCHI M R, GIOMBINI E, ROZERA G. Next-generation sequencing technology in clinical virology[J]. Clin Microbiol Infect, 2013, 19(1): 15–22. DOI: 10.1111/1469-0691.12056 |
| [12] | KWIATEK O, ALI Y H, SAEED I K, et al. Asian lineage of peste des petits ruminants Virus, Africa[J]. Emerg Infect Dis, 2011, 17(7): 1223–1231. DOI: 10.3201/eid1707.101216 |
| [13] | OHISHI K, ANDO A, SUZUKI R, et al. Host-virus specificity of morbilliviruses predicted by structural modeling of the marine mammal SLAM, a receptor[J]. Comp Immunol Microbiol Infect Dis, 2010, 33(3): 227–241. |
| [14] | QI X F, WANG T, LI Z, et al. MicroRNA-218 regulates signaling lymphocyte activation molecular (SLAM) mediated peste des petits ruminants virus infectivity in goat peripheral blood mononuclear cells[J]. Front Immunol, 2019, 10: 2201. DOI: 10.3389/fimmu.2019.02201 |
| [15] | DENZER K, KLEIJMEER M J, HEIJNEN H F, et al. Exosome:from internal vesicle of the multivesicular body to intercellular signaling device[J]. J Cell Sci, 2000, 113: 3365–3374. |
| [16] | GOULD S J, BOOTH A M, HILDRETH J E K. The Trojan exosome hypothesis[J]. Proc Natl Acad Sci U S A, 2003, 100(19): 10592–10597. DOI: 10.1073/pnas.1831413100 |
| [17] | CHAPUT N, THÉRY C. Exosomes:immune properties and potential clinical implementations[J]. Semin Immunopthol, 2011, 33(5): 419–440. DOI: 10.1007/s00281-010-0233-9 |
| [18] | PETRIK J. Immunomodulatory effects of exosomes produced by virus-infected cells[J]. Transfus Apher Sci, 2016, 55(1): 84–91. DOI: 10.1016/j.transci.2016.07.014 |
| [19] | ZHANG K S, XU S X, SHI X J, et al. Exosomes-mediated transmission of foot-and-mouth disease virus in vivo and in vitro[J]. Vet Microbiol, 2019, 233: 164–173. DOI: 10.1016/j.vetmic.2019.04.030 |
| [20] |
曾巍, 万阳丽, 关照, 等. 小反刍兽疫病毒感染对山羊外周血单核细胞源外泌体分泌水平的影响[J]. 中国兽医学报, 2019, 39(9): 1715–1720.
ZENG W, WAN Y L, GUAN Z, et al. Effect of peste des petits ruminants virus on the exosome secretion in goat peripheral blood mononuclear cells[J]. Chinese Journal of Veterinary Science, 2019, 39(9): 1715–1720. (in Chinese) |
| [21] | BARON J, BIN-TARIF A, HERBERT R, et al. Early changes in cytokine expression in peste des petits ruminants disease[J]. Vet Res, 2014, 45(1): 22. DOI: 10.1186/1297-9716-45-22 |
| [22] |
宋华杰, 王婷, 李珍, 等. Novel_miR218对山羊外周血单核细胞中SLAM受体表达的影响[J]. 畜牧兽医学报, 2018, 49(11): 2435–2441.
SONG H J, WANG T, LI Z, et al. The effects of Novel_miR218 on the expression of SLAM in goat peripheral blood mononuclear cells[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(11): 2435–2441. (in Chinese) |
| [23] | KUMAR N, MAHERCHANDANI S, KASHYAP S K, et al. Peste des petits ruminants virus infection of small ruminants:a comprehensive review[J]. Viruses, 2014, 6(6): 2287–2327. DOI: 10.3390/v6062287 |
| [24] | STAAL S J, POOLE E J, BALTENWECK I, et al. Targeting strategic investment in livestock development as a vehicle for rural livelihoods[R]. Nairobi, Kenya: ILRI, 2009. |
| [25] | BAILE D, BANYARD A, DASH P, et al. Full genome sequence of peste des petits ruminants virus, a member of the Morbillivirus genus[J]. Virus Res, 2005, 110(1-2): 119–124. DOI: 10.1016/j.virusres.2005.01.013 |
| [26] | WANG J Y, WU F, LIU C T, et al. Exosomes released from rabies virus-infected cells may be involved in the infection process[J]. Virol Sin, 2019, 34(1): 59–65. |
| [27] | LI S, WU S L, CHEN L B, et al. Exosomes modulate the viral replication and host immune responses in HBV infection[J]. Biomed Res Int, 2019, 2019: 2103943. |
| [28] | CARN V, TIMMS C, CHAND P, et al. Protection of goats against capripox using a subunit vaccine[J]. Vet Rec, 1994, 135(18): 434–436. DOI: 10.1136/vr.135.18.434 |
| [29] | PAWAR R M, DHINAKAR RAJ G, BALACHANDRAN C. Relationship between the level of signaling lymphocyte activation molecule mRNA and replication of Peste-des-petits-ruminants virus in peripheral blood mononuclear cells of host animals[J]. Acta Virol, 2008, 52(4): 231–236. |
| [30] | MANJUNATH S, MISHRA B P, MISHRA B, et al. Comparative and temporal transcriptome analysis of peste des petits ruminants virus infected goat peripheral blood mononuclear cells[J]. Virus Res, 2017, 229: 28–40. DOI: 10.1016/j.virusres.2016.12.014 |
| [31] | AVOTA E, GULBINS E, SCHNEIDER- SCHAULIES S. DC-SIGN mediated sphingomyelinase-activation and ceramide generation is essential for enhancement of viral uptake in dendritic cells[J]. PLoS Pathog, 2011, 7(2): e1001290. DOI: 10.1371/journal.ppat.1001290 |
| [32] | VAN DRIEL B J, LIAO G X, ENGEL P, et al. Responses to microbial challenges by SLAMF receptors[J]. Front Immunol, 2016, 7: 4. |
| [33] | YAN F, BANADYGA L, ZHAO Y, et al. Peste des petits ruminants virus-like particles induce a potent humoral and cellular immune response in goats[J]. Viruses, 2019, 11(10): 918. DOI: 10.3390/v11100918 |



