2. 江西农业大学动物群发性疾病监测与防控研究所, 南昌 330045
2. Institute of Animal Population Disease Surveillance and Prevention & Control, Jiangxi Agricultural University, Nanchang 330045, China
铜(copper,Cu)是动物机体必需的微量元素之一,参与机体细胞色素C氧化酶以及超氧化物歧化酶等多种酶的构成,在机体造血机能、增强抵抗力、酶的催化反应以及促进生长等方面具有重要作用,但过量铜可诱导机体产生氧化损伤[1]。而超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、谷胱甘肽还原酶(glutathione reductase,GR)是机体重要的抗氧化酶,常被用以评价机体的抗氧化水平,丙二醛(MDA)常被用于评价机体的氧化损伤[2]。且肾作为铜的主要靶器官之一,过量的铜蓄积会造成肾形态结构变化和正常生理功能降低[3]。正常生理状态下,机体存在的抗氧化防御系统可有效防止脂质过氧化[4]。机体在发生氧化应激时产生大量的活性氧,发生氧化损伤的同时也影响着机体的抗氧化功能[5]。研究表明抗氧化功能可由多种机制进行调控,而在近年来研究发现,核转录相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是机体氧化应激反应中的关键因子,在氧化应激状态下可快速表达继而对抗氧化反应[6]。铜可对机体肾产生氧化损伤,但其是否能影响Nrf2信号通路相关基因的表达尚不清楚。氧化应激效应会导致许多疾病的发生,因此本研究以白羽肉鸡为试验动物,通过饲喂高铜日粮并于49日龄采集肾组织,制作组织切片并检测相关的氧化指标和抗氧化指标以及Nrf2通路上相关基因的表达,从分子和病理变化两个层面上研究铜暴露诱发氧化损伤的机制,进而探讨高铜是否可通过Nrf2信号通路相关基因的表达诱导肉鸡肾的氧化损伤。
1 材料与方法 1.1 试验动物及处理从某种鸡场购入1日龄白羽肉鸡48只,常规免疫,人工控温,24 h光照,自由采食及饮水。将48只肉鸡随机分为4组,每组12只。选用无水硫酸铜作为铜源,肉鸡基础日粮根据NRC(1994)家禽营养需要配制,其中日粮组成与营养水平见表 1。基础日粮对照组含铜量为前期试验[7]推荐的11 mg·kg-1,试验高铜组日粮含铜量为此标准的10、20和30倍,即110(高铜Ⅰ组)、220(高铜Ⅱ组)、330 mg·kg-1(高铜Ⅲ组)。在相同条件下饲喂49 d,静脉注射戊巴比妥(50 mg·kg-1)麻醉后立即采集肾组织,生理盐水洗去表面血液,一部分经液氮速冻后及时放入-80 ℃冰箱保存待检,一部分切成5 mm×5 mm的方块浸泡于4%多聚甲醛溶液中固定。
|
|
表 1 肉鸡基础日粮组成和营养水平 Table 1 Diet composition and nutrients levels for broilers |
无水硫酸铜(分析纯)购自天津大茂化学试剂厂;多聚甲醛(paraformaldehyde)购自美国Sigma公司;切片石蜡、中性树胶购自国药集团公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽还原酶(GR)和总抗氧化能力(T-AOC)检测试剂盒均购自南京建成生物工程研究所;Trizol、PrimeScriptTMRT reagent kit with gDNA Eraser购自日本TaKaRa公司;SYBR GREEN购自美国Vazyme公司;其他试剂均为国产分析纯。
WFJ-2000型可见分光光度计,购自上海洪福仪器仪表有限公司;TDZ5-WS型冷冻离心机,购自湖南湘仪实验室仪器开发有限公司;MyCyclerTMThermal型基因扩增仪,购自美国Bio-Rad公司;LightCycler480型荧光定量PCR仪,购自美国Bio-Rad公司;ELx808型酶标仪,购自美国BIOTECK公司;Unique-R10型超纯水仪,购自厦门锐思捷科学仪器有限公司;H-5700型显微镜购自日本日立公司;Nanodrop-2000型微量紫外分光光度计,购自美国Thermo Fisher科技公司。
1.3 制备石蜡切片将至少固定3 d的肾组织放入包埋盒中,流动自来水冲洗过夜,然后脱水、透明、透蜡、包埋、切片、苏木精-伊红染色、中性树脂封片,用光学显微镜观察肾组织的病理学变化。
1.4 检测肾的氧化指标与抗氧化指标从-80 ℃冰箱中取质量约100 mg的冻肾样,用生理盐水按照1:9比例在匀浆器中匀浆,在4 ℃离心机中590 g离心10 min,取上清液检测SOD活力、GR活力、MDA含量和T-AOC。测定过程严格按照说明书进行。
1.5 检测Nrf2通路相关基因的转录采用实时荧光定量PCR方法。总RNA的提取按照Trizol试剂盒说明书进行操作。利用NanoDrop-2000微量核酸测定仪检测RNA的总浓度和纯度。从GenBank中获得所测基因的序列,并选用管家基因GAPDH基因作为内参基因。最终由上海生工生物有限公司合成。引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
RNA反转录严格按照试剂盒说明书进行。将反转后的cDNA采用染料法进行RT-qPCR反应,反应体系为10 μL:cDNA 1 μL,SYBR premix Ex TaqTM 5 μL,ddH2O 3.2 μL,引物F/R均为0.4 μL。反应条件:预变性95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s;共进行40个循环,检测Nrf2、HO-1、NQO1、GCLC和GCLM mRNA转录水平。
1.6 统计分析所测基因的Ct值用2-ΔΔCt法进行初步处理,应用统计学软件SPSS 17.0进行统计分析,用t检验比较其差异显著性。并用Graphpad Prism 6.0软件作图,结果以x±s表示。
2 结果 2.1 肉鸡肾组织病理学观察由图 1A可看出,在对照组的肾组织中,肾小管的间隙较为致密,细胞形态正常,无变性坏死、脱落现象。而在图 1B可看出,高铜Ⅰ组中的肾小管之间的间隙相比对照组略微变宽,并且有少量的肾小管上皮细胞出现空泡变性、脱落现象。在图 1C中可观察到高铜Ⅱ组的肾小管间的间隙更为稀疏;而在图 1D中可明显观察到,高铜Ⅲ组中的肾小管上皮细胞呈现大面积的脱落,且有空泡变性、坏死现象。
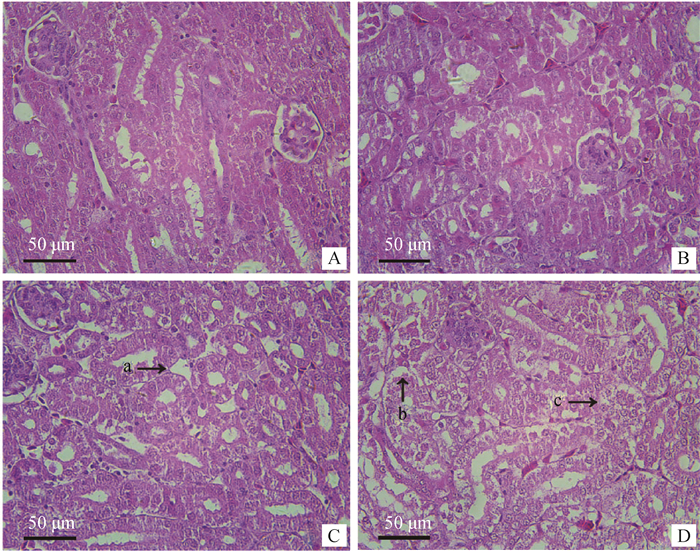
|
A.对照组;B.高铜Ⅰ组;C.高铜Ⅱ组;D.高铜Ⅲ组;a.肾小管间隙变大;b.肾小管上皮脱落;c.肾小管上皮空泡变性 A. Control group; B. High-copper group Ⅰ; C. High-copper group Ⅱ; D. High-copper group Ⅲ; a. Enlargement of renal tubular space; b. Renal tubular epithelial exfoliation; c. Vacuolar degeneration of renal tubular epithelium 图 1 肾组织病理学观察 Fig. 1 Pathological observation of kidney tissue in broiler |
由图 2A可看出,肉鸡肾高铜Ⅱ组和高铜Ⅲ组的T-AOC与对照组相比显著下降(P < 0.05)。由图 2B可看出,高铜组与对照组相比MDA含量无显著变化(P>0.05)。由图 2C和D可看出,高铜Ⅲ组与对照组相比SOD和GR活性下调,且差异显著(P < 0.05)。

|
A. T-AOC;B. MDA含量;C. SOD活力;D. GR活力。相同字母表示不同组别间差异不显著(P>0.05),不同字母表示不同组别间较差异显著(P < 0.05) A. T-AOC; B. MDA content; C. SOD activity; D. GR activity. The same letter indicates that there is no significant difference among different groups (P>0.05), the different letters indicate significant differences among different groups (P < 0.05) 图 2 高铜对肉鸡肾氧化与抗氧化指标的影响 Fig. 2 Effect of high-copper on kidney oxidant and antioxidant indices in broilers |
由图 3A可看出,随着日粮中铜含量的升高,高铜Ⅱ、Ⅲ组Nrf2 mRNA相对表达量与对照组相比显著上调(P < 0.05),而高铜Ⅲ组与高铜Ⅱ组相比Nrf2 mRNA相对表达量下降显著(P < 0.05);由图 3B可看出,高铜Ⅱ组和高铜Ⅲ组GCLC mRNA相对表达量与对照组相比显著上升(P < 0.05);由图 3C可看出,高铜组GCLM mRNA相对表达量与对照组相比升高,差异显著(P < 0.05);由图 3D可看出,高铜组与对照组相比HO-1 mRNA相对表达量显著上调(P < 0.05),而高铜Ⅲ组与高铜Ⅱ组相比下降显著(P < 0.05);由图 3E可看出,随着日粮中铜含量的升高,NQO1 mRNA相对表达量无显著差异(P>0.05)。
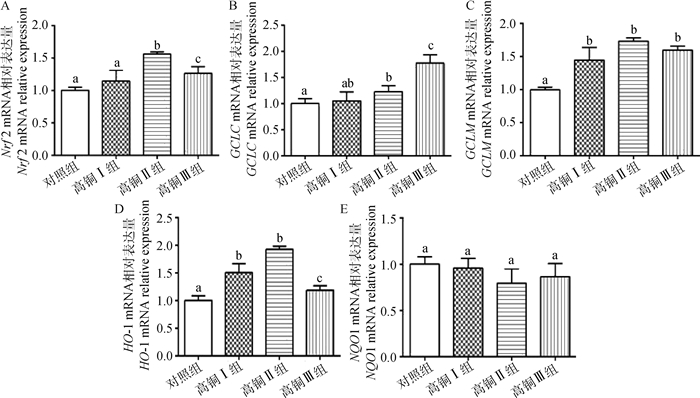
|
A. Nrf2;B. GCLC;C. GCLM;D. HO-1;E. NQO1。相同字母表示不同组别间差异不显著(P>0.05),不同字母表示不同组别间较差异显著(P < 0.05) A. Nrf2; B. GCLC; C. GCLM; D. HO-1; E. NQO1. The same letter indicates that there is no significant difference between different groups (P>0.05), the different letters indicate significant differences between different groups (P < 0.05) 图 3 高铜对肉鸡肾Nrf2通路相关基因相对转录量的影响 Fig. 3 Effect of high-copper on the mRNA expression of Nrf2 pathway related genes |
动物摄入过量的铜会造成机体铜中毒,而肾作为肉鸡铜中毒的主要靶器官之一,会产生一系列的病理组织学变化,如肾小管上皮细胞发生空泡变性、脱落,肾小管间间隙稀疏等[8]。铜分布于体内各种组织器官,构成细胞色素氧化酶和铜蓝蛋白等多种酶,且参与机体清除自由基、氧化磷酸化等作用。铜对多种酶活力以及抗氧化功能都有影响,高水平的铜会引起组织产生氧化应激,抗氧化酶活性降低,从而影响机体的抗氧化功能[9-10]。作为衡量机体抗氧化系统功能的综合性指标,T-AOC可通过分解自由基和减少脂质过氧化来维持机体氧化还原的平衡状态[11]。SOD为自由基清除剂,它广泛存在于生物体的各种组织中,能清除超氧阴离子自由基(O2-)。O2-具有细胞毒性,可导致脂质过氧化[12-13]。SOD将有害的O2-在酶的作用下转化成无害的水,从而保护机体免受氧化损伤[14]。MDA是氧化应激的终产物,其含量可反映机体脂质过氧化的程度[15],因此也是常用的过氧化指标。GR是机体抗氧化体系的重要组成部分,可将氧化型谷胱甘肽还原成还原型谷胱甘肽,后者可以清除自由基以及一些过氧化物,防御机体氧化损伤[16]。刘好朋等[17]用高铜饲喂商品代科宝肉鸡50 d,发现当日粮中铜含量为330和550 mg·kg-1时,肉鸡血清SOD、GR和T-AOC显著下降,MDA含量显著上升,提示过量的铜导致抗氧化酶活性的下降,脂质过氧化程度加剧,继而MDA含量增多。本试验中,随着日粮中铜含量的增加,肾的肾小管之间间隙变宽,肾小管上皮细胞出现空泡变性、脱落现象,并且饲喂了高铜日粮的肉鸡肾T-AOC水平下降,GR以及SOD活性显著降低,MDA含量升高,表明饲喂了高铜日粮的肉鸡肾中氧化应激产物增多,与刘好朋等的研究成果相符合。由此可知,高铜日粮诱导了肉鸡肾氧化损伤。
顺式转录调控元件(antioxidant response element,ARE)可与Nrf2结合而激活该序列的基因转录。启动子区域具有顺式作用元件的基因包括:HO-1、GCLC、GCLM和NQO1[18]。
Nrf2介导氧化还原途径调节抗氧化酶及基因的表达,从而增加细胞对氧化应激的抗性。正常生理条件下,Nrf2和细胞骨架相关蛋白Keap 1以二聚体形式存在于细胞质中,使抗氧化物处于基础表达水平[19-20]。血红素氧合酶-1(HO-1)是一种由Nrf2调节的内源性抗氧化酶,可催化生成胆红素,胆红素有清除多种自由基的能力,避免其堆积造成细胞损伤[21-22]。HO-1正常状态下低水平表达,在各种应激刺激下被诱导表达而发挥内源性保护作用,从而减轻组织的氧化应激[23]。NADPH:苯醌氧化还原酶-1(NADPH: quinine oxidoreductase-1, NQO1),降解醌及其衍生物,从而保护细胞对抗氧化还原,NQO1激活可引起氧化应激[24]。谷氨酸-半胱氨酸连接酶(glutamate-cysteine ligase,GCL)是谷胱甘肽(GSH)合成过程中的限速酶,GCL由催化亚基(GCL catalytic subunit,GCLC)和修饰亚基(GCL modifier subunit,GCLM)组成,前者有催化活性,后者有重要调节功能[25]。吕航等[26]用亚砷酸钠对雄性野生型C57BL/6小鼠进行腹腔注射,发现用5 mg·kg-1亚砷酸钠染毒6 h的小鼠主动脉Nrf2、GCLC、GCLM和NQO1 mRNA相对表达水平呈上升趋势,提示砷可引起小鼠主动脉氧化应激。本试验结果表明,当日粮中铜含量为220和330 mg·kg-1时,Nrf2 mRNA相对表达量与对照组相比显著升高,GCLC、GLCM和HO-1 mRNA相对表达量显著上调,说明肉鸡随着日粮中铜含量增加,机体处于对抗氧化应激的状态,与吕航等的研究成果基本相符。
4 结论高铜日粮可引起肉鸡肾发生氧化损伤,并诱导肾Nrf2信号通路相关基因的表达。
| [1] | GAETKE L M, CHOW C K. Copper toxicity, oxidative stress, and antioxidant nutrients[J]. Toxicology, 2003, 189(1-2): 147–163. DOI: 10.1016/S0300-483X(03)00159-8 |
| [2] | VÉLEZ-ALAVEZ M, LABRADA-MARTAGÍN V, MÉNDEZ-RODRIGUEZ L C, et al. Oxidative stress indicators and trace element concentrations in tissues of mako shark (Isurus oxyrinchus)[J]. Comp Biochem Physiol A Mol Integr Physiol, 2013, 165(4): 508–514. DOI: 10.1016/j.cbpa.2013.03.006 |
| [3] |
崔伟, 李敏, 彭西, 等. 高铜对雏鸡肾脏组织结构及生化指标影响的研究[J]. 畜牧兽医学报, 2010, 41(1): 86–91.
CUI W, LI M, PENG X, et al. Effect of dietary high copper on tissue structure and biochemical parameters of kidney in chickens[J]. Acta Veterinaria et Zootechnica Sinica, 2010, 41(1): 86–91. (in Chinese) |
| [4] |
张爱君. 砷中毒对抗氧化酶系统的影响[J]. 中国地方病防治杂志, 2014, 29(1): 21–24.
ZHANG A J. Effects of arsenic poisoning on antioxidant enzyme system[J]. Chinese Journal of Control of Endemic Diseases, 2014, 29(1): 21–24. (in Chinese) |
| [5] | RADAK Z, ZHAO Z F, KOLTAI E, et al. Oxygen consumption and usage during physical exercise:the balance between oxidative stress and ROS-dependent adaptive signaling[J]. Antioxid Redox Signal, 2013, 18(10): 1208–1246. DOI: 10.1089/ars.2011.4498 |
| [6] | LI W G, KONG A N. Molecular mechanisms of Nrf2-mediated antioxidant response[J]. Mol Carcinog, 2009, 48(2): 91–104. DOI: 10.1002/mc.20465 |
| [7] |
曹华斌, 苏荣胜, 郭剑英, 等. 不同来源日粮铜水平对肉鸡肝线粒体H2O2生成变化的研究[J]. 畜牧兽医学报, 2009, 40(12): 1805–1811.
CAO H B, SU R S, GUO J Y, et al. Effects of dietary copper of different sources and dosages on hydrogen peroxide generation of mitochondria from broiler hepatocyte[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(12): 1805–1811. (in Chinese) |
| [8] |
杨光, 崔恒敏, 邓俊良, 等. 实验性雏鸡铜中毒的病理学研究[J]. 中国兽医科技, 2005, 35(10): 801–806.
YANG G, CUI H M, DENG J L, et al. Pathological study of experimental copper toxicity in chickens[J]. Chinese Journal of Veterinary Science and Technology, 2005, 35(10): 801–806. (in Chinese) |
| [9] |
崔伟, 彭西, 赵丽, 等. 高铜对雏鸭肾脏抗氧化功能的影响[J]. 畜牧兽医学报, 2009, 40(4): 572–576.
CUI W, PENG X, ZHAO L, et al. Effect of high copper on the antioxydic function of kidney in ducklings[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(4): 572–576. (in Chinese) |
| [10] |
刘好朋, 唐兆新, 苏荣胜, 等. 高铜日粮对肉鸡肝脏TrxR2基因mRNA表达和还原活性的影响[J]. 畜牧兽医学报, 2011, 42(3): 423–428.
LIU H P, TANG Z X, SU R S, et al. Effect of high-level copper diet on expression of TrxR2 mRNA and reduction activity of TrxR2 of liver in broiler[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(3): 423–428. (in Chinese) |
| [11] | DING H, ZHAO B. Change characteristics of women boxers' Na+, K+- ATPase, ROS and T-AOC before the match[J]. Energy Procedia, 2012, 17: 671–677. DOI: 10.1016/j.egypro.2012.02.153 |
| [12] |
魏彦明, 李文广. 四君子汤体外抗脂质过氧化合活性氧自由基的作用[J]. 畜牧兽医学报, 2002, 33(2): 197–199.
WEI Y M, LI W G. The effect of sijunzi decoction on lipid peroxidation and active oxygen free radicals in vitro[J]. Acta Veterinaria et Zootechnica Sinica, 2002, 33(2): 197–199. (in Chinese) |
| [13] | OLSON K R, GAO Y, ARIF F, et al. Metabolism of hydrogen sulfide (H2S) and production of reactive sulfur species (RSS) by superoxide dismutase[J]. Redox Biol, 2018, 15: 74–85. DOI: 10.1016/j.redox.2017.11.009 |
| [14] |
生宝亮, 徐刚, 陈德伟, 等. 大鼠实验性高原肺水肿中T-AOC、MDA、SOD、CAT和IL-6的表达[J]. 第三军医大学学报, 2012, 34(23): 2364–2367.
SHENG B L, XU G, CHEN D W, et al. T-AOC, MDA, SOD, CAT and IL-6 levels in rat pulmonary edema induced by hypobaric hypoxia[J]. Journal of Third Military Medical University, 2012, 34(23): 2364–2367. (in Chinese) |
| [15] | ZHOU Y H, YU J P, LIU Y F, et al. Effects of Ginkgo biloba extract on inflammatory mediators (SOD, MDA, TNF-α, NF-κBp65, IL-6) in TNBS-induced colitis in rats[J]. Mediators Inflamm, 2006, 2006: 92642. |
| [16] |
李素娟, 邢艳刚, 薛星晨, 等. 氟对小鼠睾丸谷胱甘肽抗氧化系统的影响[J]. 畜牧兽医学报, 2017, 48(5): 954–962.
LI S J, XING Y G, XUE X C, et al. Effect of fluoride on glutathione antioxidant system in mice testis[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5): 954–962. (in Chinese) |
| [17] |
刘好朋, 贾雪霞, 潘家强, 等. 高铜日粮对肉鸡血清抗氧化功能的影响[J]. 黑龙江畜牧兽医, 2011(11): 1–4.
LIU H P, JIA X X, PAN J Q, et al. Effect of different levels of copper sulfate in diet on serum antioxidant index in broilers[J]. Heilongjiang Animal Science and Veterinary Medicine, 2011(11): 1–4. (in Chinese) |
| [18] | ZHANG C, LIN J, GE J, et al. Selenium triggers Nrf2-mediated protection against cadmium-induced chicken hepatocyte autophagy and apoptosis[J]. Toxicol Vitro, 2017, 44: 349–356. DOI: 10.1016/j.tiv.2017.07.027 |
| [19] | LINKER R A, LEE D H, RYAN S, et al. Fumaric acid esters exert neuroprotective effects in neuroinflammation via activation of the Nrf2 antioxidant pathway[J]. Brain, 2011, 134(3): 678–692. |
| [20] | YANG S H, LONG M, YU L H, et al. Sulforaphane prevents testicular damage in kunming mice exposed to cadmium via activation of Nrf2/ARE signaling pathways[J]. Int J Mol Sci, 2016, 17(10): 1703. DOI: 10.3390/ijms17101703 |
| [21] |
梁小明, 邵天伟. 胆红素对机体的病理损伤和生理保护作用[J]. 实用医院临床杂志, 2012, 9(3): 172–175.
LIANG X M, SHAO T W. Pathological damage and physiological protection of bilirubin in human body[J]. Practical Journal of Clinical Medicine, 2012, 9(3): 172–175. (in Chinese) |
| [22] | LIU J, WANG L, TIAN X Y, et al. Unconjugated bilirubin mediates heme oxygenase-1-induced vascular benefits in diabetic mice[J]. Diabetes, 2015, 64(5): 1564–1575. DOI: 10.2337/db14-1391 |
| [23] | REN J W, FAN C C, CHEN N, et al. Resveratrol pretreatment attenuates cerebral ischemic injury by upregulating expression of transcription factor Nrf2 and HO-1 in rats[J]. Neurochem Res, 2011, 36(12): 2352–2362. DOI: 10.1007/s11064-011-0561-8 |
| [24] | KEUM Y S, HAN Y H, LIEW C, et al. Induction of heme oxygenase-1 (HO-1) and NAD[P]H: quinone oxidoreductase 1 (NQO1) by a phenolic antioxidant, butylated hydroxyanisole (BHA) and its metabolite, tert-butylhydroquinone (tBHQ) in primary-cultured human and rat hepatocytes[J]. Pharm Res, 2006, 23(11): 2586–2594. DOI: 10.1007/s11095-006-9094-2 |
| [25] | WIŚNIEWSKI M, LAPIŚSKI M, ZDZIARSKA A, et al. Molecular cloning and analysis of Ancylostoma ceylanicum glutamate-cysteine ligase[J]. Mol Biochem Parasitol, 2014, 196(1): 12–20. DOI: 10.1016/j.molbiopara.2014.07.003 |
| [26] |
吕航, 朱佳玉, 陈承杰, 等. 急性亚砷酸钠暴露对小鼠主动脉Nrf2通路的影响[J]. 环境与健康杂志, 2017, 34(1): 1–4.
LÜ H, ZHU J Y, CHEN C J, et al. Effects of acute sodium arsenite exposure on Nrf2 pathway in arota of mice[J]. Journal of Environment and Health, 2017, 34(1): 1–4. (in Chinese) |



