2. 重庆市高校兽医科学工程研究中心中兽药创新研发实验室, 重庆 402460
2. Chinese Veterinary Herbal Drugs Innovation Research Lab, University Veterinary Science Engineering Research Center, Chongqing 402460, China
在我国西南地区以及长江流域地区,夏、秋季节气候独特,常处于高热高湿环境,使得仔猪易发湿热泄泻。仔猪湿热泄泻主要是由于湿邪热毒蕴结脾,导致脾之运化功能失调,谷气料毒积于肠道之中,属里热湿证,治疗原则应以清热燥湿、利水止泻为宜[1]。肠道是机体消化、吸收营养物质的主要场所,对机体的消化吸收起着十分重要的作用;同时肠道也是机体最大的免疫器官,肠道黏膜层是肠道发挥其免疫功能的主要部位所在,肠道黏膜层主要包括黏膜上皮、固有层、黏膜肌肉层[2-3]。
仔猪湿热泄泻易导致肠道出现损伤,肠黏膜遭到破坏,仔猪生长发育受到严重的影响。肠上皮细胞为单层柱状细胞并弯曲褶皱形成绒毛-隐窝结构,肠黏膜上皮细胞主要由吸收细胞、杯状细胞(goblet cell,GC)和内分泌细胞3部分组成,杯状细胞作为机体肠道内重要的分泌细胞,可分泌黏蛋白(mucoprotein, MUC)、肠三叶因子(intestinal trilobular factor, ITF)、抵抗素样分子(resistin-like molecule β, RELMβ)等物质,这些分泌物是小肠黏液的主要成分,可在肠道表面形成一层保护性凝胶层,保护肠黏膜免受侵袭[4]。其中,MUC对上皮细胞起重要保护和润滑作用;而ITF是一类生长因子类多肽物质,特异分布于肠黏膜表面,不仅可促进细胞增殖与移行,还具有稳定肠道黏液层、增强肠道黏膜屏障的功能;两者相互作用,形成保护性黏液凝胶层,阻止肠黏膜的损伤,从而在肠黏膜屏障功能中均发挥重要作用[5-8]。复方术苦芩是由西南大学动物科学学院中药创新研究室研发,具有清热燥湿、健脾和胃、利水止泻等主要功效。前期研究发现复方术苦芩主要是通过改善胃肠功能、提高免疫、增强抗病能力、促进肠黏膜修复等来发挥主要作用的[9]。为此,笔者用复方术苦芩总多糖(polysaccharides from ZhuKuQin, ZKQPs)探究其对湿热泄泻仔猪小肠GC数量以及MUC-2和ITF-3 mRNA转录量和含量的影响,进一步阐明复方术苦芩对湿热泄泻仔猪小肠损伤修复作用的机制。
1 材料与方法 1.1 试验材料60只30~35日龄三元断奶仔猪(长×大×荣昌),体重(10.0±0.3)kg,雌雄各半,由西南大学荣昌校区动物科统一购买。复方术苦芩,由白术(5.5份)、苦参(2份)、黄芪(6.5份)、金银花(6.5份)、白头翁(5.5份)、栀子(2.5份)、黄芩(6.5份)、广藿香(4.5份)组成,购自四川千金中药饮片有限公司,批号:160201;番泻叶:购于安徽省毫州市德昌药业有限公司,制备成每毫升含1 g生药的番泻叶提取液;白头翁散:重庆天龙牧业科技有限公司;批号:20170425。中性树胶购自重庆川东化工(集团)有限公司,批号:20170109;PAS染色液购自Secoma-Bio公司,批号:051117G1001;猪肠三叶因子(ITF-3)、猪黏蛋白-2(MUC-2)试剂盒购自厦门惠嘉生物技术有限公司,批号:201707;Trizol总RNA抽提试剂盒购自生工生物工程(上海)股份有限公司,批号:B511321;反转录试剂盒购自GoScriptTM Reverse Transcription System,批号:A5000;荧光定量试剂盒购自TaKaRa SYBR® Premix Ex-TaqTM Ⅱ,批号:RR820A。
1.2 主要仪器设备切片机(浙江省金华市科迪仪器设备有限公司);显微镜(日本IX51 Olympus);-86 ℃超低温冷冻冰箱(中科美菱低温科技股份有限公司DW-HL678);酶标仪(Bio-Rad公司iMark);荧光定量PCR仪(TU-1950 Roche公司)等仪器。
1.3 试验方法 1.3.1 药物的制备 1.3.1.1 ZKQPs提取制备[10]按比例称取所需药材共100 g,粉粹后加入8倍石油醚,置于多功能提取浓缩机组中,60 ℃回流提取3次;将药渣加入6倍75%乙醇,回流提取2次,合并滤液,回收乙醇至无乙醇味,得滤液A;将醇提后药物加入8倍蒸馏水水提,提取3次,得滤液B,合并滤液A、B,浓缩至生药量为1 g·mL-1,加入无水乙醇至含醇量达80%进行醇沉,4 ℃过夜,过滤,加水溶解滤渣,反复醇沉3次;将粗提的多糖加水溶解后,加入sevag试剂除蛋白(5次以上,至几乎无蛋白);进行二次醇沉,最后分别依次加入无水乙醇、丙酮、乙醚进行洗涤、纯化(3次以上),30 ℃干燥,得多糖。参照文献[11]采用苯酚硫酸法测定ZKQPs的糖含量。
1.3.1.2 番泻叶提取液将番泻叶水提三次,浓缩为生药量为1 g·mL-1的溶液。
1.3.2 动物分组与处理参考文献方法[12],将适应性饲养一周的断奶仔猪60头随机分为A、B两组,A组为空白对照组(10头),饲养于湿度65%~75%,25~27 ℃的圈舍中,给予正常饲料、自由饮水;B组为造模组(50头),用保温灯和喷雾器使造模圈舍环境控制在35~38 ℃,相对湿度90%~95%,将造模仔猪饲喂于圈舍中,并饲喂高脂配合饲料(猪油18%+蔗糖1%+酒糟5%,连续10 d,隔天加入1%番泻叶提取液)、自由饮水。将B组造模成功后的50头仔猪随机分为模型组、阳性药物组、ZKQPs高、中、低剂量组,各组分圈饲养,饲喂正常仔猪配合饲料,自由饮水。ZKQPs高、中、低剂量组仔猪分别按体重给予75、50和25 mg·kg-1 ZKQPs,2次·d-1,阳性药物组仔猪按体重给予白头翁散1.0 g·kg-1,于每天9:00、15:00拌料给药2次,连续给药7 d。模型组与空白对照组仔猪,拌以等量生理盐水,正常饲喂饲料、自由饮水。
模型成功判定标准[13]:当仔猪出现精神沉郁(喜卧,不愿走动)、采食下降、口渴喜饮、排便次数增加、排稀粪或水样便、肛门红肿、肛周污秽、尿黄短赤、身体消瘦、被毛粗乱等症状时可判定模型建立成功。
1.3.3 仔猪小肠组织的采集与制备试验结束后仔猪禁食12 h,每组随机抽取3头仔猪,进行放血屠宰,采取小肠组织(十二指肠、空肠、回肠),在每段小肠起始端2 cm处采集各段小肠组织两段,每段5 cm,第一段用灭菌生理盐水冲洗干净,放入4%甲醛溶液中固定,用于检测GC,第二段-86 ℃冷冻用于检测仔猪小肠表面分泌物中MUC-2和ITF-3含量,并检测MUC-2和ITF-3的转录情况。
1.3.4 仔猪小肠组织GC的检测(PAS染色法)将固定好的仔猪各段小肠组织进行修块、脱水、透明、包埋、切片;PAS染色,封片,镜检。每组随机选取1头仔猪,每头仔猪各段小肠组织(十二指肠、空肠、回肠)各制作一张切片,每段小肠组织切片在显微镜(400×)下选取5根完整的小肠绒毛计数GC。
1.3.5 ELISA法检测仔猪小肠表面分泌物中MUC-2和ITF-3的含量用猪MUC-2和ITF-3 ELISA试剂盒检测各段小肠表面分泌物中MUC-2和ITF-3的含量。操作步骤严格按照试剂盒说明书进行,以空白孔调零,在450 nm波长检测各孔的OD值,计算各样本的含量。
1.3.6 荧光定量PCR检测仔猪小肠组织中MUC-2和ITF-3的mRNA转录水平登录GenBank,根据已有的猪MUC-2和ITF-3和内参基因β-actin mRNA核苷酸序列,利用Primer Premier 5.0软件设计相对应的引物,由生工生物工程(上海)股份有限公司合成相对应的MUC-2和ITF-3引物,引物信息见表 1。仔猪小肠组织总RNA提取严格参照UNIQ-10柱式Trizol总RNA抽提试剂盒说明书进行操作。使用promega反转录试剂盒(GoScriptTM Reverse Transcription System)将提取的总RNA反转录成cDNA,在Roche Light Cycler 96荧光定量PCR仪上扩增,共40个循环,每个样品3个重复。
|
|
表 1 引物信息表 Table 1 The table of primer information |
用SPSS 20.0统计软件,对所得数据进行显著性检验,并进行分析比较,数据以平均值±标准差表示;RT-PCR mRNA相对转录量分析数据处理采用2-△△Ct法,结果通过Bio-Rad CFX Manager软件进行分析。
2 结果 2.1 ZKQPs的糖含量ZKQPs糖含量为91.42%。
2.2 ZKQPs对湿热泄泻仔猪的作用及对各段小肠GC数量的影响结果显示,造模第3天开始,造模组仔猪陆续开始出现食欲减退,饮水次数增加,精神沉郁,粪便开始不成形,在造模第5天仔猪出现粪便溏稀、泄泻如水样且腥臭,采食量大幅下降,饮水量增加,仔猪逐渐消瘦,被毛粗乱逆立,肛周有污物、肛门红肿,可判定成功建立湿热泄泻模型。用药后仔猪临床症状出现好转;在给药第5天时,仔猪粪便基本成形,采食、饮水基本恢复正常,提示ZKQPs对仔猪湿热泄泻有较好的治疗效果。与空白对照组比较,模型组仔猪十二指肠、空肠、回肠中GC数量均减少,差异显著(P<0.05);与模型组比较,阳性药物组仔猪十二指肠、空肠、回肠中GC数量增加,差异显著(P<0.05)。与阳性药物组比较,除ZKQPs低剂量组仔猪十二指肠、空肠、回肠外,各ZKQPs剂量组仔猪十二指肠、空肠、回肠中GC数量差异不显著(P > 0.05)。与模型组比较,除ZKQPs低剂量组仔猪十二指肠外,各ZKQPs剂量组仔猪十二指肠、空肠、回肠中GC数量均有所增加,其中ZKQPs高、中剂量组仔猪十二指肠、回肠和ZKQPs高剂量组仔猪空肠GC数量差异显著(P<0.05)。结果详见图 1、2。
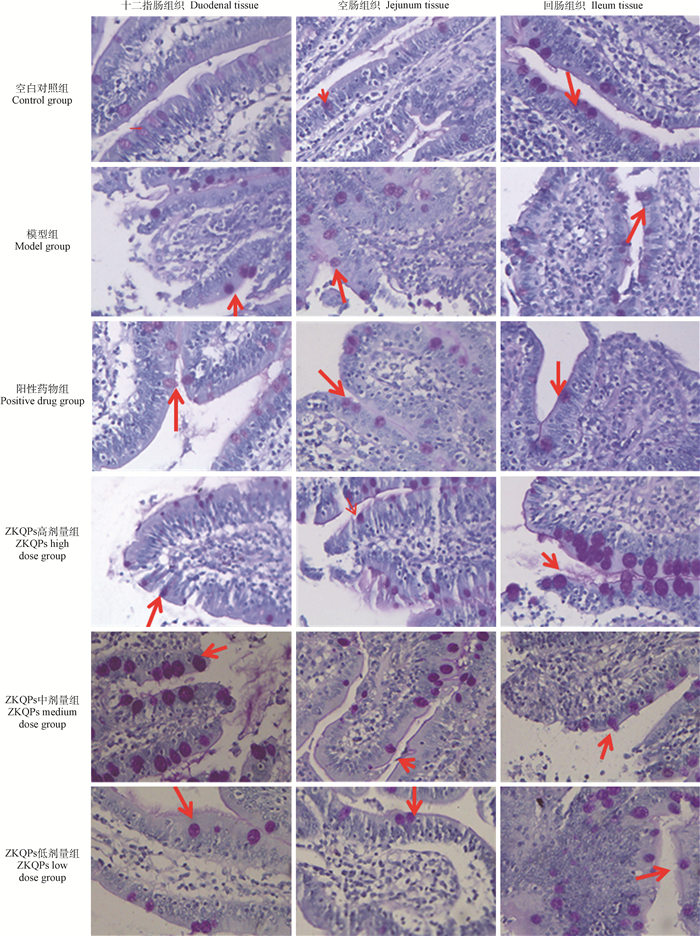
|
图 1 仔猪各段小肠GC分布(PAS染色,400×) Fig. 1 GC distribution in the small intestine tissue of piglets (PAS staining, 400×) |
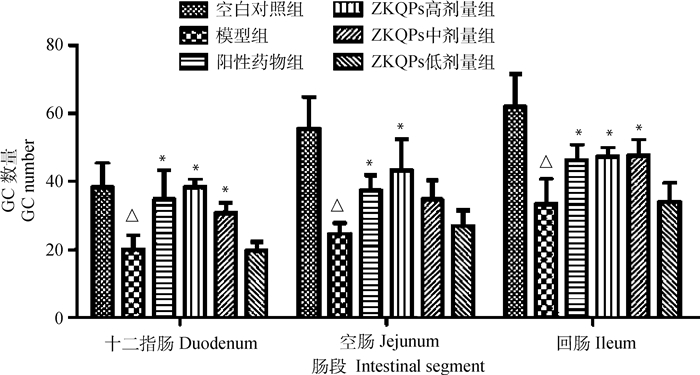
|
模型组vs空白对照组,△. P<0.05,△△. P<0.01;各药物组(阳性药物及不同剂量ZKQPs)vs模型组,*. P<0.05,**. P<0.01。下同 The model group vs the blank control group, △. P < 0.05, △△. P < 0.01; the drug groups (positive drug and different doses of ZKQPs) vs the model group, *. P < 0.05, **. P < 0.01. The same as below 图 2 仔猪不同小肠段GC数量 Fig. 2 The number of GC in different intestinal segments of piglets |
结果显示,与空白对照组比较,模型组仔猪十二指肠和空肠表面分泌物中MUC-2含量降低,差异极显著(P<0.01),仔猪回肠表面分泌物中MUC-2含量降低,差异显著(P<0.05)。与模型组比较,阳性药物组仔猪十二指肠、空肠表面分泌物中MUC-2含量增加,差异极显著(P<0.01)。与阳性药物组比较,ZKQPs高剂量组仔猪十二指肠、空肠和回肠表面分泌物中MUC-2含量差异不显著(P > 0.05)。与模型组比较,除ZKQPs低剂量组外,各ZKQPs剂量组仔猪十二指肠、空肠和回肠表面分泌物中MUC-2含量均升高,其中ZKQPs高剂量组仔猪十二指肠、空肠表面分泌物中MUC-2含量差异极显著(P<0.01),ZKQPs高剂量组仔猪回肠表面分泌物中MUC-2含量差异显著(P<0.05)。结果详见图 3。

|
图 3 仔猪小肠表面分泌物中MUC-2含量 Fig. 3 The content of MUC-2 in secretion of small intestine in piglets |
结果显示,与空白对照组比较,模型组仔猪十二指肠、空肠、回肠表面分泌物中ITF-3含量降低,差异极显著(P<0.01),与模型组比较,阳性药物组仔猪空肠、回肠表面分泌物中ITF-3含量增加,差异极显著(P<0.01)。与阳性药物组比较,除ZKQPs低剂量组仔猪十二指肠、空肠、回肠外,各ZKQPs剂量组仔猪十二指肠、空肠、回肠表面分泌物中ITF-3含量差异不显著(P > 0.05)。除十二指肠、空肠ZKQPs低剂量组外,各ZKQPs剂量组仔猪十二指肠、空肠、回肠表面分泌物中ITF-3含量均升高,其中ZKQPs高剂量组仔猪十二指肠表面分泌物中ITF-3含量与模型组比较,差异极显著(P<0.01);ZKQPs高、中剂量组仔猪空肠分泌物中ITF-3含量与模型组比较,差异极显著(P<0.01);各ZKQPs剂量组仔猪回肠表面分泌物中的ITF-3含量均升高,与模型组比较,差异极显著(P<0.01)。结果详见图 4。

|
图 4 仔猪小肠表面分泌物中ITF-3含量 Fig. 4 The content of ITF-3 in secretion of small intestine in piglets |
结果显示,与空白对照组比较,模型组仔猪十二指肠中MUC-2 mRNA的转录量降低差异显著(P<0.05);与阳性药物组比较,各ZKQPs剂量组仔猪十二指肠MUC-2 mRNA的转录量差异不显著(P>0.05)。与模型组比较,ZKQPs各剂量组仔猪十二指肠中MUC-2 mRNA的转录量均升高,ZKQPs高剂量组仔猪十二指肠中MUC-2 mRNA转录量差异显著(P<0.05)。结果见图 5A。
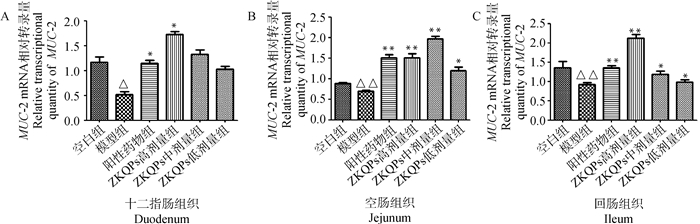
|
图 5 仔猪小肠各段MUC-2 mRNA相对转录量 Fig. 5 Relative transcriptional quantity of MUC-2 mRNA in different intestinal segment of piglets |
与空白对照组比较,模型组仔猪空肠中MUC-2 mRNA的转录量降低差异极显著(P<0.01);与阳性药物组比较,各ZKQPs剂量组仔猪空肠中MUC-2 mRNA的转录量差异不显著(P > 0.05)。与模型组比较,ZKQPs各剂量组仔猪空肠中MUC-2 mRNA的转录量均升高,ZKQPs高、中剂量组仔猪空肠中MUC-2 mRNA转录量差异极显著(P<0.01),低剂量组差异显著(P<0.05)。结果见图 5B。
与空白对照组比较,模型组仔猪回肠中MUC-2 mRNA的转录量降低,差异极显著(P<0.01);与阳性药物组比较,各ZKQPs剂量组仔猪回肠中MUC-2 mRNA的转录量差异不显著(P > 0.05)。与模型组比较,ZKQPs各剂量组仔猪回肠中MUC-2 mRNA的转录量均升高,ZKQPs高剂量组仔猪回肠中MUC-2 mRNA转录量差异极显著(P<0.01),ZKQPs中、低剂量组仔猪回肠中MUC-2 mRNA转录量差异显著(P<0.05)。结果见图 5C。
2.5.2 仔猪小肠组织中ITF-3 mRNA的转录情况结果显示,与空白对照组比较,模型组仔猪十二指肠中ITF-3 mRNA的转录量降低,差异极显著(P<0.01);与阳性药物组比较,ZKQPs高剂量组仔猪十二指肠中ITF-3 mRNA的转录量差异不显著(P > 0.05)。与模型组比较,ZKQPs高、中剂量组仔猪十二指肠中ITF-3 mRNA的转录量均升高,差异极显著(P<0.01)。结果见图 6A。

|
图 6 仔猪小肠各段ITF-3 mRNA相对转录量 Fig. 6 Relative transcriptional quantity of ITF-3 mRNA in different intestinal segment of piglets |
与空白对照组比较,模型组仔猪空肠中ITF-3 mRNA的转录量降低,差异极显著(P<0.01);与阳性药物组比较,ZKQPs高剂量组仔猪空肠中ITF-3 mRNA的转录量差异不显著(P > 0.05)。与模型组比较,ZKQPs各剂量组仔猪空肠中ITF-3 mRNA的转录量均升高,ZKQPs高、中剂量组仔猪空肠中ITF-3 mRNA转录量差异极显著(P<0.01)。结果见图 6B。
与空白对照组比较,模型组仔猪回肠中ITF-3 mRNA的转录量降低,差异极显著(P<0.01);与阳性药物组比较,ZKQPs高剂量组仔猪回肠中ITF-3 mRNA的转录量差异不显著(P > 0.05)。与模型组比较,除ZKQPs低剂量组外,各ZKQPs剂量组仔猪回肠中ITF-3 mRNA的转录量均升高,ZKQPs高剂量组仔猪回肠中ITF-3 mRNA转录量差异极显著(P<0.01),ZKQPs中剂量组仔猪回肠中ITF-3 mRNA转录量差异显著(P<0.05)。结果见图 6C。
3 讨论多糖是一类由许多单糖分子通过糖苷键聚合形成的碳水化合物,广泛存在于植物、微生物(细菌及真菌)和海藻中。研究表明,多糖具有改善小肠黏膜结构和改善小肠营养物质吸收的功能,可从很多方面对肠道屏障进行修复[14];在肠上皮细胞表面形成类似于肠道屏障黏液层的亲水凝胶层,维护肠道屏障结构的完整性[15];也能降低肠黏膜通透性使肠道屏障得到保护。仔猪断奶后其胃肠尚未发育完全,处于“稚阴稚阳”状态,高热、高湿的环境会使湿邪、热毒集聚仔猪体内,使得饲料在胃肠内异常发酵,有害微生物大量繁殖,产生毒素刺激肠壁细胞分泌体液,破坏黏液屏障,出现泄泻。小肠GC是肠黏膜上皮中分泌黏液的细胞,GC在肠黏膜损伤后的修复重建起着重要作用[16],当肠黏膜遭到严重损伤后,肠黏膜表面几乎由GC来代替脱落的肠绒毛,在肠黏膜损伤的后期,GC数量会出现下降[17]。石玉祥等[18]研究发现,枸杞多糖能增加小鼠小肠GC的数量。本试验利用人工复制仔猪湿热泄泻模型,结果显示,模型组仔猪十二指肠、空肠、回肠中GC数量均减少,与文献[12]结果一致。除ZKQPs低剂量组仔猪十二指肠外,其余各治疗组仔猪小肠内GC数量均有所增加,可见ZKQPs能提高湿热泄泻仔猪小肠GC的数量,在肠道内形成亲水性凝胶,有效的阻止病原微生物直接侵袭肠黏膜上皮,减少肠黏膜的损伤,促进肠黏膜的自我修复。
MUC-2属于分泌型黏蛋白,在肠道表面形成一层黏液层,具有保护肠黏膜的作用。肠道的黏液屏障主要是由GC分泌的黏蛋白与水、无机盐等结合共同形成的凝胶型网状结构黏液层,可分为两层,即可供共生菌寄生的疏松黏液层和以“过滤”形式阻止病原微生物进入的紧密附着黏液层[19]。研究表明[20-21],当MUC-2的结构和功能发生改变后,致病微生物可自由穿过黏液层,直接攻击肠黏膜上皮细胞,使得肠黏膜受到损伤发生病变。黏液层是抑制肠道内细菌与肠上皮细胞直接接触的重要因素,黏液层变薄或消失后,细菌就能直接侵袭上皮细胞导致肠道炎性反应或免疫反应,这是肠道发生病变的重要因素[22]。邓桦等[23]研究显示,玉屏风多糖可从多方面调控小鼠肠黏膜的免疫应答,可有效增强肠黏膜免疫功能,缓解和改善免疫抑制小鼠肠黏膜免疫屏障的损伤。本研究结果显示,模型组仔猪小肠组织MUC-2含量和MUC-2 mRNA的转录量均显著降低,除个别肠段ZKQPs低剂量组仔猪小肠组织MUC-2 mRNA的转录量和MUC-2含量没有改变外,其余各组中仔猪小肠组织MUC-2含量和MUC-2 mRNA的转录量均增加,这可能与ZKQPs可使损伤后的肠黏膜的GC数量增多有关。受损肠黏膜在修复过程中,黏液屏障的恢复十分重要,其关系到生物屏障的恢复,一旦黏液层形成后,肠道内的共生菌就可在肠道寄生,形成菌群隔离带,阻止致病微生物对肠粘膜上皮细胞的侵袭。
ITF-3是属于三叶肽蛋白家族的成员,为GC分泌的小分子多肽,研究证明其在维持肠上皮细胞的完整性、恢复肠黏膜的正常通透性、加速肠黏膜的修复等方面起到重要作用[23],大量研究发现ITF-3与MUC-2相互作用,进而增强肠道黏液屏障,是由于其特殊的空间结构可与MUC-2中糖苷链结合[24]。ITF-3具有维护内质网结构的功能,对蛋白质的折叠和分泌具有一定的调控作用[25]。研究发现,ITF-3能通过促进细胞移行、促进黏液分泌等机制减轻烧伤后肠道损伤,促进受损黏膜修复[26]。ITF-3主要在肠道内转录,由具有分泌功能的杯状细胞,黏膜细胞和腺细胞等合成并分泌进入肠道,与MUC-2共同发生作用,以一种旁分泌的方式作用于邻近的肠细胞[27]。ITF-3可使得紧密链接蛋白转录,肠黏膜通透性恢复正常,起到保护肠黏膜的作用[28-29]。本研究结果显示,模型组仔猪小肠中的ITF-3含量和ITF-3 mRNA的转录量均降低;除个别肠段ZKQPs低剂量组仔猪小肠组织ITF-3含量和ITF-3 mRNA的转录量没有改变外,其余各组仔猪各段小肠内的ITF-3含量和ITF-3 mRNA的转录量均有所增加,推测ZKQPs可通过改善小肠内的ITF-3含量和ITF-3 mRNA的转录量达到加速修复肠黏膜的作用。
4 结论ZKQPs可提高湿热泄泻仔猪小肠GC的数量以及MUC-2和ITF-3含量和其mRNA转录量,以发挥ZKQPs对湿热泄泻仔猪小肠肠黏膜的修复作用,形成较好的肠道内环境。
| [1] |
罗成宇, 李点, 姚欣艳, 等. 熊继柏教授辨治泄泻经验[J]. 中华中医药杂志, 2014, 29(9): 2850–2853.
LUO C Y, LI D, YAO X Y, et al. Experience of professor Xiong Ji-bo in differentiation and treatment of diarrhea[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2014, 29(9): 2850–2853. (in Chinese) |
| [2] | KRAEHENBUHL J P, NEUTRA M R. Molecular and cellular basis of immune protection of mucosal surfaces[J]. Physiol Rev, 1992, 72(4): 853–879. DOI: 10.1152/physrev.1992.72.4.853 |
| [3] |
黄蓉, 欧希龙. 肠道黏膜屏障功能损伤机制及其防治的研究进展[J]. 现代医学, 2015, 43(5): 659–662.
HUANG R, OU X L. Research progress in the mechanism of intestinal mucosal barrier function and its prevention and treatment[J]. Modern Medical Journal, 2015, 43(5): 659–662. (in Chinese) |
| [4] | KESIMER M, KIRKHAM S, PICKLES R J, et al. Tracheobronchial air-liquid interface cell culture:a model for innate mucosal defense of the upper airways[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 296(1): L92–L100. DOI: 10.1152/ajplung.90388.2008 |
| [5] |
李娟, 吴丽华, 石岩, 等. MUC1, MUC2和MUC3在胃增生性息肉中的转录模式[J]. 世界华人消化杂志, 2011, 19(35): 3591–3596.
LI J, WU L H, SHI Y, et al. Expression patterns of MUC1, MUC2 and MUC3 in gastric hyperplastic polyps[J]. World Chinese Journal of Digestology, 2011, 19(35): 3591–3596. (in Chinese) |
| [6] | JOHANSSON M E V, PHILLIPSON M, PETERSSON J, et al. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria[J]. Proc Natl Acad Sci U S A, 2008, 105(39): 15064–15069. DOI: 10.1073/pnas.0803124105 |
| [7] |
董文逍, 曹海龙, 王邦茂. 杯状细胞在肠道疾病发病中作用的研究进展[J]. 国际消化病杂志, 2015, 35(4): 244–246, 269.
DONG W X, CAO H L, WANG B M. Progress in the role of goblet cells in the pathogenesis of intestinal diseases[J]. International Journal of Digestive Diseases, 2015, 35(4): 244–246, 269. DOI: 10.3969/j.issn.1673-534X.2015.04.005 (in Chinese) |
| [8] | SUEMORI S, LYNCH-DEVANEY K, PODOLSKY D K. Identification and characterization of rat intestinal trefoil factor:tissue- and cell-specific member of the trefoil protein family[J]. Proc Natl Acad Sci U S A, 1991, 88(24): 11017–11021. DOI: 10.1073/pnas.88.24.11017 |
| [9] |
曾宇君, 赖建彬, 朱兆荣, 等. 术苦芩颗粒对湿热泻痢仔猪血清D-木糖、淀粉酶及脂肪酶的影响[J]. 中国兽医杂志, 2015, 51(1): 57–59.
ZENG Y J, LAI J B, ZHU Z R, et al. The effect of Zhukuqin ganules on serum D-xylose, amylase and lipase in piglets of damp-heat and diarrhea syndrome[J]. Chinese Journal of Veterinary Medicine, 2015, 51(1): 57–59. DOI: 10.3969/j.issn.0529-6005.2015.01.021 (in Chinese) |
| [10] |
庞敏, 朱兆荣, 乔芊芊, 等. 术芩总多糖对免疫低下小鼠脾淋巴细胞增殖与自噬的影响[J]. 畜牧兽医学报, 2018, 49(12): 2762–2770.
PANG M, ZHU Z R, QIAO Q Q, et al. Effect of polysaccharides from Zhuqin formula on the proliferation and autophagy of spleen lymphocyte in Immunocompromised Mice[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2762–2770. (in Chinese) |
| [11] |
赵祥升, 董娜, 冯锦东, 等. 益智多糖含量测定[J]. 中国现代应用药学, 2013, 30(10): 1070–1074.
ZHAO X S, DONG N, FENG J D, et al. Determination of polysaccharides content in Alpinia oxyphylla[J]. Chinese Journal of Modern Applied Pharmacy, 2013, 30(10): 1070–1074. (in Chinese) |
| [12] |
陈凌锋, 蔡旭滨, 檀新珠, 等. 太子参茎叶多糖对断奶仔猪肠道免疫功能、肠黏膜形态结构及盲肠内容物菌群的影响[J]. 动物营养学报, 2017, 29(3): 1012–1020.
CHEN L F, CAI X B, TAN X Z, et al. Effects of Radix pseudostellariae stem and leaf polysaccharide on intestinal immune function, intestinal mucosal morphology and cecum contents flora of weaned piglets[J]. Chinese Journal of Animal Nutrition, 2017, 29(3): 1012–1020. DOI: 10.3969/j.issn.1006-267x.2017.03.035 (in Chinese) |
| [13] |
刘钟杰, 许剑琴.
中兽医学[M]. 4版. 北京: 中国农业出版社, 2011: 459.
LIU Z J, XU J Q. Chinese herbal medicine[M]. 4th ed. Beijing: China Agriculture Press, 2011: 459. (in Chinese) |
| [14] |
陈清华.牛膝多糖对猪的营养效应和免疫调控机理研究[D].长沙: 湖南农业大学, 2008.
CHEN Q H. Study on the mechanism of nutrition and immunomodultion of Achyranthes bidentata polysaccharide in pigs[D]. Changsha: Hunan Agricultural University, 2008. (in Chinese) http://cdmd.cnki.com.cn/article/cdmd-10537-2009090841.htm |
| [15] |
左涛.鱿鱼墨多糖改善化疗小鼠肠道黏膜免疫的作用及机理探讨[D].青岛: 中国海洋大学, 2015.
ZUO T. Protective effects of squid ink polysaccharides on intestinal mucosal immunity in chemotherapeutic mice and the underlying mechanisms[D]. Qingdao: Ocean University of China, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10423-1015716156.htm |
| [16] |
翟双双. 肠道黏膜屏障机能及其调控研究进展[J]. 现代畜牧兽医, 2014(7): 54–58.
ZHAI S S. Progress on function and regulation of the intestinal mucosal barrier[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2014(7): 54–58. DOI: 10.3969/j.issn.1672-9692.2014.07.016 (in Chinese) |
| [17] |
常建星, 陈双, 蒋龙元, 等. 小肠杯状细胞在大鼠休克后肠黏膜重建中的作用[J]. 中华胃肠外科杂志, 2005, 8(6): 510–512.
CHANG J X, CHEN S, JIANG L Y, et al. Effect of goblet cell in rat intestine on the restitution process of the gut barrier after hemorrhagic shock[J]. Chinese Journal of Gastrointestinal Surgery, 2005, 8(6): 510–512. DOI: 10.3760/cma.j.issn.1671-0274.2005.06.012 (in Chinese) |
| [18] |
石玉祥, 闫金坤, 王雪敏. 枸杞多糖对小鼠肠道上皮内淋巴细胞和杯状细胞数量、分布及对IL-2水平影响[J]. 食品科学, 2011, 32(13): 318–320.
SHI Y X, YAN J K, WANG X M. Effect of Chinese wolfberry (Lycium barbarum) polysaccharides on number and distribution of intraepithelial lymphocytes and goblet cells and IL-2 expression in mice[J]. Food Science, 2011, 32(13): 318–320. (in Chinese) |
| [19] | LINDEN S K, SUTTON P, KARLSSON N G, et al. Mucins in the mucosal barrier to infection[J]. Mucosal Immunol, 2008, 1(3): 183–197. DOI: 10.1038/mi.2008.5 |
| [20] |
王娜, 唐雪婵. 黏蛋白-2与肠黏膜屏障损伤的研究进展[J]. 基础医学与临床, 2015, 35(7): 985–988.
WANG N, TANG X C. Research progress of mucin-2 and intestinal mucosal barrier damage[J]. Basic & Clinical Medicine, 2015, 35(7): 985–988. (in Chinese) |
| [21] | ADLER K B, TUVIM M J, DICKEY B F. Regulated mucin secretion from airway epithelial cells[J]. Front Endocrinol, 2013, 4: 129. |
| [22] | LANG T, HANSSON G C, SAMUELSSON T. Gel-forming mucins appeared early in metazoan evolution[J]. Proc Natl Acad Sci U S A, 2007, 104(41): 16209–16214. DOI: 10.1073/pnas.0705984104 |
| [23] |
邓桦, 杨鸿, 蒋焱平, 等. 玉屏风多糖对小鼠肠黏膜免疫应答和免疫损伤的调控作用[J]. 中国兽药杂志, 2018, 52(12): 43–48.
DENG H, YANG H, JIANG Y P, et al. Regulatory effects of Yupingfeng polysaccharides on intestinal mucosal immune response and immune injury in mice[J]. Chinese Journal of Veterinary Drug, 2018, 52(12): 43–48. (in Chinese) |
| [24] | HANSSON G C, JOHANSSON M E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria[J]. Gut Microbes, 2010, 1(1): 51–54. DOI: 10.4161/gmic.1.1.10470 |
| [25] | SCHUSTER A T, HOMER C R, KEMP J R, et al. Chromosome-associated protein D3 promotes bacterial clearance in human intestinal epithelial cells by repressing expression of amino Acid transporters[J]. Gastroenterology, 2015, 148(7): 1405–1416. DOI: 10.1053/j.gastro.2015.02.013 |
| [26] | MIMOUNA S, BAZIN M, MOGRABI B, et al. HIF1A regulates xenophagic degradation of adherent and invasive Escherichia coli (AIEC)[J]. Autophagy, 2014, 10(12): 2333–2345. DOI: 10.4161/15548627.2014.984275 |
| [27] |
吴炜.肠三叶因子与谷氨酰胺对烧伤后肠道谷氨酰胺转运能力影响的实验研究[D].蚌埠: 蚌埠医学院, 2014.
WU W. Effects of intestinal trefoil factor and glutamine on intestinal glutamine transport after burn injury[D]. Bengbu: Bengbu Medical College, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10367-1014190286.htm |
| [28] | HINZ M, SCHWEGLER H, CHWIERALSKI C E, et al. Trefoil factor family (TFF) expression in the mouse brain and pituitary:changes in the developing cerebellum[J]. Peptides, 2004, 25(5): 827–832. |
| [29] |
许玲芬, 董亚珞, 孙梅, 等. PAF对肠上皮细胞紧密连接的影响及ITF的保护作用[J]. 世界华人消化杂志, 2008, 16(4): 372–378.
XU L F, DONG Y L, SUN M, et al. Effect of platelet-activating factor on tight junction in intestinal epithelial cells and protective effect of intestinal trefoil factor[J]. World Chinese Journal of Digestology, 2008, 16(4): 372–378. DOI: 10.3969/j.issn.1009-3079.2008.04.006 (in Chinese) |



