2. 黑龙江省实验动物与比较医学重点实验室, 哈尔滨 150030
2. Heilongjiang Key Laboratory for Laboratory Animals and Comparative Medicine, Harbin 150030, China
Toll样受体(toll-like receptors, TLRs)是机体天然免疫系统模式识别受体家族成员,主要识别病原微生物的“共性”成分即病原相关分子模式,并进一步触发下游信号级联反应而参与病原体感染过程。目前已发现有十余种TLRs,在组织细胞内广泛分布,其中,TLR3能够特异性地识别病毒的双链RNA,介导激活树突状细胞、巨噬细胞和B细胞,诱导干扰素产生,发挥抗病毒作用;但也有研究表明,TLR3表达增强可诱导促炎症因子过表达,引起组织损伤、病毒扩散,加重病情[1-3]。鸡的TLR系统和哺乳动物的TLR系统具有相似性。chTLR3存在于4号染色体,核酸基因全长为2 691 bp,编码897个氨基酸[4]。有研究显示,属于双链RNA病毒科的传染性法氏囊病病毒(infectious bursa diseases,IBDV)可引起感染雏鸡体内chTLR3基因表达变化[5];本课题组前期研究也显示,IBDV感染的鸡胚成纤维细胞系DF-1细胞内chTLR3基因表达水平较对照组明显升高,且IBDV的毒力影响chTLR3的表达[6]。另有研究发现,TLR3参与机体的凋亡过程[7-8],而重金属镉可导致中毒动物发生细胞凋亡,笔者实验室前期的研究也发现,鸡TLR4参与了镉致雏鸡损伤过程[9],因此推测chTLR3也与镉致鸡损伤机制密切相关。
上述研究结果提示,chTLR3可参与鸡体内多种疾病的损伤与抗损伤反应,深入研究chTLR3的生物学功能具有重要意义。而示踪chTLR3蛋白分布、表达及其生物学功能研究的必需物质前提是效价高、特异性强的抗体,但目前尚无商品化的抗chTLR3抗体。因此,本研究拟采用DNA免疫与杂交瘤细胞技术相结合来制备抗chTLR3单克隆抗体,为进一步研究chTLR3在鸡疾病发病机制中的作用提供重要的物质基础。
1 材料与方法 1.1 实验材料6~8周龄的雌性BALB/c小鼠,5只,每只体重20 g左右,购自辽宁本溪动物保健中心;7日龄海兰白雏鸡,10只,购自哈尔滨成高子区种鸡孵化场;小鼠骨髓瘤细胞系SP2/0细胞由本实验室保存;重组质粒pVAX1-Igk-chTLR3、pET30a-chTLR3及chTLR3胞外区原核表达蛋白、雏鸡外周血淋巴细胞蛋白均由本实验室制备并保存;HRP(horseradish peroxidase)标记山羊抗鼠IgG、FITC(fluoresceine isothiocyanate)标记山羊抗鼠IgG、DAB(diaminobenzidine)显色底物购自北京中杉金桥生物技术有限公司;HAT(50×)和HT(100×)培养基、小鼠单抗亚类鉴定试剂盒、秋水仙素、DMSO(dimethyl sulfoxide)购自Simga公司;RPMI(roswell park memorial institute)1640培养液、DMEM(dulbecco′s modified eagle media)培养液、胎牛血清购自四季清公司;淋巴细胞分离液购自天津灏洋生物制品科技有限公司;β-actin单克隆抗体、ECL(enhanced chemiluminescence)超敏发光液购自碧云天生物技术有限公司。
1.2 动物免疫将纯化的pVAX1-Igk-chTLR3质粒,以100 μg·只-1免疫6~8周龄健康雌性BALB/c小鼠,每2周免疫一次,共免疫7次,每次免疫剂量相同。七免之后,小鼠断尾采血,检测血清效价,达到融合标准,加强免疫一次后准备细胞融合[10]。
1.3 间接ELISA方法的建立以纯化的chTLR3胞外区原核表达蛋白为抗原,采用棋盘法确定ELISA检测方法中的各项条件。各孔包被抗原量分别为0.2、0.4、0.8、1.0、1.2、1.4 μg,每孔100 μL。血清的稀释倍数为1:400、1:800、1:1 600、1:3 200、1:6 400。ELISA步骤如下:抗原包被过夜,PBST(phosphate buffered saline with Tween)洗3次,5 min·次-1;分别加入3% BSA、10%牛血清和5% BSA作为封闭液,封闭2 h,PBST洗3次,5 min·次-1;一抗的孵育时间分别为1.5、2与3 h,PBST洗3次;加入1:5 000稀释的HRP标记山羊抗鼠IgG,分别孵育1、1.5与2 h,PBST洗3次;加入先配好的OPD-H2O2底物显色液,显色10 min,并用2 mol·L-1浓硫酸终止反应;在酶标仪读取OD450 nm值。根据阳性与阴性OD比值大于2.1,判定为阳性[11]。
1.4 阳性杂交瘤细胞的筛选和克隆免疫小鼠血清效价达到1:6 400后,制备小鼠脾细胞并将其与SP2/0细胞融合,用适量37 ℃预热的HAT 1640将细胞悬起,融合细胞悬液按100 μL·孔-1接种于已铺有饲养层细胞的96孔细胞培养板内,37 ℃、5% CO2培养箱培养。待细胞增长至细胞孔约1/3时,取细胞上清,采用“1.3”建立的间接ELISA方法进行检测,选取OD值较高的融合细胞进行克隆。克隆过程中,逐渐将培养基中的HAT浓度缩小,添加HT用来补偿,最后完全用HT代替HAT,至细胞状态稳定,即可得到稳定分泌单克隆抗体的杂交瘤细胞株。
1.5 单克隆抗体生物学特性检测 1.5.1 单克隆抗体效价检测参照“1.3”建立的间接ELISA方法检测所获杂交瘤细胞上清抗体效价。chTLR3胞外区原核蛋白包被酶标板,SP2/0细胞上清作为阴性对照,小鼠血清作为阳性对照。
1.5.2 Western blot检测单克隆抗体与chTLR3蛋白的反应取适量雏鸡外周血淋巴细胞蛋白、chTLR3胞外区原核表达蛋白、pET30a-chTLR3及pET30a空载体,分别与等量的2×样品缓冲液煮沸后,进行SDS-PAGE;转印;将NC(nitrocellulose)膜置于5%脱脂乳中37 ℃孵育1 h;PBST缓冲液振荡洗涤NC膜3次,每次5 min;加入杂交瘤细胞上清液,室温孵育2 h;PBST缓冲液洗涤3次,每次5 min;HRP标记山羊抗鼠IgG(1:1 000稀释)室温孵育1.5 h;PBST缓冲液洗涤3次,DAB显色2 min,蒸馏水终止显色。
1.5.3 杂交瘤细胞分泌抗体稳定性试验将获得的杂交瘤细胞进行扩大培养,调整细胞状态至对数生长期进行冻存。一段时间后复苏,并进行传代培养,每隔5代通过ELISA方法检测杂交瘤细胞上清抗体效价。
1.5.4 杂交瘤细胞染色体计数将杂交瘤细胞与SP2/0分别进行扩大培养,传代后36 h左右,加入终浓度0.2 μL·mL-1的秋水仙素,继续培养5 h,离心收集细胞沉淀,加入37 ℃预热的0.075 mol·L-1 KCl 5 mL,37 ℃水浴15 min后,室温固定2 min后,离心弃上清,重复固定一次,保留少量的固定液,混匀细胞沉淀,吸取细胞悬液1滴放在载玻片上,Giemsa染色10 min,水洗后显微镜下观察染色体的形态,并记下数目。
1.5.5 单克隆抗体亚类鉴定采用小鼠单抗Ig类/亚类鉴定试剂盒鉴定本试验所获阳性杂交瘤细胞分泌抗体的亚类,具体试验操作参照说明书进行,其中6种HRP标记物(IgG1、IgG2a、IgG2b、IgG3、IgM和IgA)用含有10%胎牛血清的PBST稀释,阳性杂交瘤细胞上清不稀释。
1.6 应用单克隆抗体检测镉中毒鸡脾与外周血淋巴细胞内chTLR3的表达变化 1.6.1 动物分组及样品采集、处理7日龄海兰白雏鸡10只,常规饲养,随机分为染镉组和正常对照组,每组5只。对照组雏鸡每天给予全价饲料,染镉组雏鸡每日给予添加140 mg·kg-1氯化镉的全价饲料[12],于饲喂镉后40 d,对雏鸡心脏采血并处死,快速采取脾,放入液氮速冻后转入-80 ℃保存。将新鲜雏鸡抗凝血2 mL与Hank’s液1:1混合,小心加入等体积的淋巴细胞分离液,参照操作说明制备鸡外周血液细胞,在细胞沉淀中加入细胞裂解液,4 ℃、12 000 r·min-1离心5 min,取上清,与SDS上样buffer混匀,煮沸后得到的蛋白样品-40 ℃保存备用。将雏鸡脾剪成细小的碎块,按照每20 mg组织加入200 μL的比例加入裂解液,并按与裂解液1:100的比例加入PMSF(phenylmethanesulfonyl fluoride),充分研磨后将样品12 000 r·min-1离心5 min,取上清,与SDS上样buffer混匀,煮沸后得到的蛋白样品-40 ℃保存备用。
1.6.2 Western blot检测雏鸡外周血淋巴细胞与脾中chTLR3的变化方法基本同“1.5.2”,采用ECL超敏发光液进行化学曝光,利用Image软件分析Western blot结果。
1.6.3 间接免疫荧光法检测chTLR3在雏鸡脾的分布制备7 μm厚的冰冻切片,切片置于-20 ℃丙酮20 min;PBS(phosphate buffered saline)洗3次,每次10 min;一抗chTLR3单克隆抗体(细胞上清),4 ℃孵育过夜;PBS洗3次,每次10 min;FITC标记的羊抗鼠IgG(1:200稀释)37 ℃避光孵育1.5 h,PBS洗3次;PI染色液(1:20稀释),避光瞬染1 s后甩去,PBS洗3次;荧光显微镜下观察chTLR3在雏鸡脾的分布。
1.6.4 流式细胞术检测雏鸡外周血淋巴细胞中chTLR3的表达变化分离的雏鸡外周血淋巴细胞中加入500 μL 4%的多聚甲醛,室温固定30 min;加入1 mL PBS,1 000 r·min-1,离心5 min;加入1 mL 1%的triton-100,室温孵育10 min;PBS洗一次,离心弃上清;加入杂交瘤细胞上清室温孵育1 h,离心弃上清;用PBS洗一次,离心、弃上清;加入1:200倍稀释的FITC标记的羊抗鼠IgG,室温避光孵育1 h,离心、弃上清;PBS洗后离心、弃上清;500 μL的PBS悬浮细胞,放置流式管中,4 ℃避光,流式细胞仪检测雏鸡外周血淋巴细胞中chTLR3的表达变化。
1.7 数据处理采用SPSS 17.0软件对数据进行分析,单向方差分析法对组间差异显著性进行统计比较,P < 0.05被认为具有统计意义。组间变化关系用Graph Pad Software Prism 6绘制柱状图表示,所有结果均表示为“x±s”。
2 结果 2.1 间接ELISA方法的建立以纯化后的chTLR3胞外区原核蛋白为抗原,小鼠血清作为抗体,利用矩阵滴定方法确定间接ELISA最佳反应条件抗原为1 μg·孔-1、抗体浓度为1:1 600稀释,5% BSA封闭2 h,一抗作用时间为2 h,二抗作用时间为1.5 h。
2.2 阳性杂交瘤细胞的筛选、稳定性及染色体计数用建立的间接ELISA法筛选获得一株阳性杂交瘤细胞,该株杂交瘤细胞在连续传代培养和冻存后仍保持稳定分泌特异性单克隆抗体的能力。经计算该株杂交瘤细胞染色体数为(94±2)条,SP2/0细胞的染色体平均数为67条,而BALB/c小鼠脾细胞染色体数为40条。所以,本试验获得的细胞株为杂交瘤细胞(图 1)。

|
图 1 杂交瘤细胞和SP2/0细胞的染色体计数(×1 000) Fig. 1 The number of chromosomas of the hybridoma cell line and SP2/0 cell line(×1 000) |
间接ELISA法检测结果显示,细胞上清效价为1:25。对单克隆抗体的亚类进行分析,得到的单克隆抗体亚型为IgG3类(图 2)。

|
图 2 chTLR3单克隆抗体亚类鉴定 Fig. 2 The subclass identification of monoclonal antibody against chTLR3 |
图 3结果显示,杂交瘤细胞株上清能与chTLR3胞外区原核表达蛋白、pET30-chTLR3表达菌发生反应,特异性条带大小位于预期大小的55 ku处,表明该单克隆抗体能与chTIR3原核表达蛋白有良好的反应性。

|
M.预染蛋白质相对分子质量标准;1. chTLR3胞外区纯化蛋白;2. pET30a-chTLR3表达菌;3. pET30a空载体对照 M. Prestained protein marker; 1. Purified protein of chTLR3 extracellular area; 2. Expressing bacteria of pET30a-chTLR3;3. pET30a empty vector 图 3 单克隆抗体与chTLR3胞外区原核蛋白的反应 Fig. 3 The reaction of monoclonal antibody and chTLR3 extracellular domain prokaryotic protein |
图 4结果显示,杂交瘤细胞上清能与雏鸡外周血淋巴细胞中的chTLR3蛋白特异性结合,在110~130 ku处出现一条特异性条带,这与文献报道的鼠TLR3蛋白全长大小约为116 ku[13]一致,表明该单克隆抗体能够与雏鸡外周血淋巴细胞中表达的天然chTLR3蛋白反应。

|
M.预染蛋白质相对分子质量标准;1.雏鸡外周血淋巴细胞;2. PBS对照 M. Prestained protein marker; 1. Peripheral blood lymphocytes of chicken; 2. Control of PBS 图 4 单克隆抗体与雏鸡外周血淋巴细胞中chTLR3蛋白的反应 Fig. 4 The reaction of monoclonal antibody and chTLR3 protein in chicken peripheral blood lymphocytes |
以制备的抗chTLR3单克隆抗体作为一抗,采用Western blot方法检测正常对照组雏鸡和染镉组雏鸡外周血淋巴细胞及脾内chTLR3的表达情况,结果在预期大小处有明显的特异性条带,且染镉组雏鸡外周血淋巴细胞及脾内chTLR3表达量较对照组雏鸡均有明显增加,表明该抗体可用于Western blot检测雏鸡体内chTLR3的表达变化(图 5)。

|
***表示chTLR3/β-actin相对表达量组间比较差异显著(P < 0.001),无标记表示差异不显著(P > 0.05)。下同 *** means the values significantly different at 0.001 level and differ quietly (with unlabeled, P > 0.05). The same as below 图 5 Western blot检测雏鸡外周血淋巴细胞与脾chTLR3的表达变化 Fig. 5 The expression changes of chTLR3 in peripheral blood and spleen of chickens by Western blot |
间接免疫荧光检测结果显示,在对照组雏鸡与染镉组雏鸡脾内均显示有特异性绿色荧光信号,表明利用该抗体检测到了两组雏鸡脾内chTLR3蛋白的表达。与对照组雏鸡相比,染镉组雏鸡脾chTLR3表达量明显增加,chTLR3阳性细胞散布于红髓中,强阳性细胞主要集中在红髓与白髓的交界处,在脾窦的网状上皮细胞处、小梁静脉内皮细胞处的阳性细胞也明显增多,表明该抗体可用于间接免疫荧光方法示踪雏鸡体内chTLR3的分布及表达变化(图 6)。
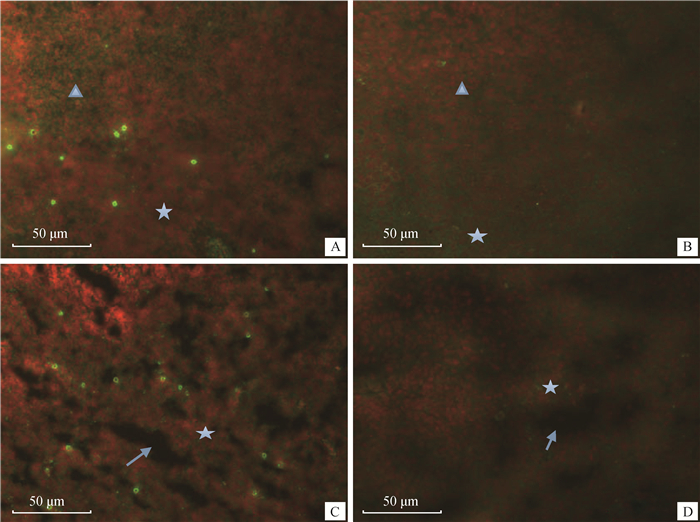
|
A、C为染镉组,B、D为对照组。在图A、B中,“★”示红髓,“▲”示白髓;在图C、D中,“★”示髓索,“箭头”示髓窦 A and C are the cadmium poisoning group, and B and D are the control group. In Fig.A and B, "★" shows red pulp, "▲" shows white pulp; In Fig.C and D, "★" shows medullary cord, and "arrow" shows medullary sinus 图 6 免疫荧光法检测雏鸡脾chTLR3的表达变化 Fig. 6 The expression changes of chTLR3 in spleen of chickens by immunofluorescence assay |
利用该抗体采用流式细胞术在正常雏鸡和染镉雏鸡外周血淋巴细胞内均捕捉到提示有chTLR3表达的荧光信号,图 7展示了总荧光强度、单个淋巴细胞荧光强度以及荧光强度大于102阳性细胞比例的变化,结果提示两组雏鸡外周血淋巴细胞内均有chTLR3表达, 镉中毒能够导致chTLR3表达增强,表明该抗体可用于流式细胞术检测雏鸡细胞内chTLR3的表达变化。
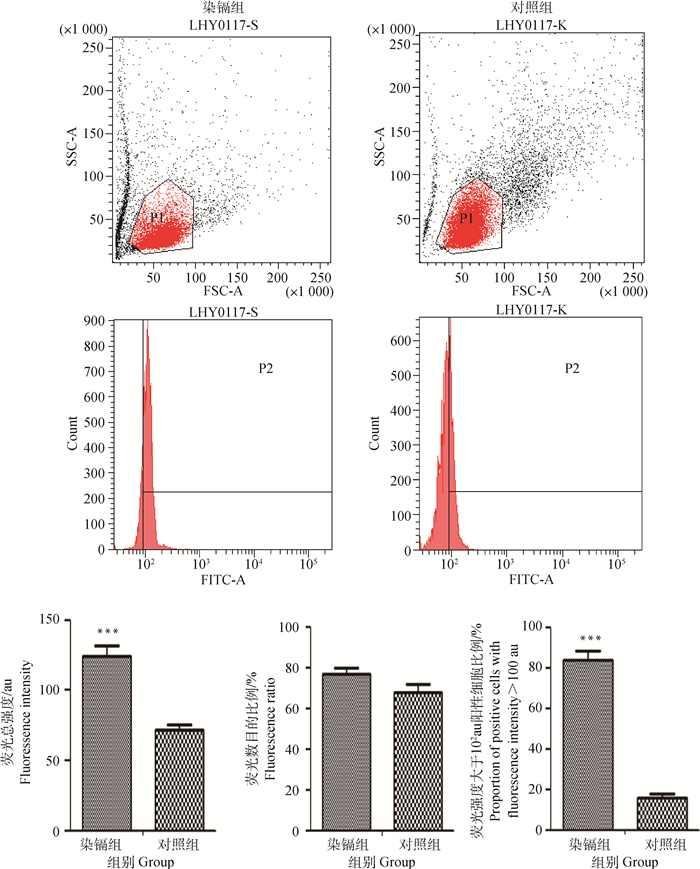
|
图 7 流式细胞术检测雏鸡的外周血淋巴细胞chTLR3的表达 Fig. 7 The expression changes of chTLR3 in peripheral blood of chickens by FCM |
研究chTLR3在鸡体内的分布、表达,对阐明chTLR3参与鸡的多种疾病的发病机制具有重要意义,因此能与天然结构的chTLR3蛋白特异性结合的单克隆抗体是必备的物质条件之一。鉴于DNA免疫的优势,笔者采用chTLR3重组真核质粒为免疫原,制备了抗chTLR3的单克隆抗体,该抗体具有良好的生物学活性。
与传统的蛋白质免疫或多肽免疫相比较,DNA免疫技术能够使带有目的基因序列的质粒DNA直接转入动物体内并得以表达,诱导机体免疫应答,从而获得专一性和稳定性更高的单克隆抗体[14-15]。本试验使用的免疫原是已经成功构建的、能够在细胞中大量表达的重组真核质粒pVAX1-Igk-chTLR3,是将chTLR3全长基因亚克隆到真核表达载体pVAX1中而获得。鉴于chTLR3为跨膜蛋白[16],细胞内表达量较小,而鼠源IgG kappa链信号肽可辅助蛋白靶向细胞膜,形成分泌蛋白,提高表达量,所以在chTLR3基因前面插入了一段鼠类IgG kappa链信号肽(大小为60 bp),形成Igk-chTLR3融合蛋白,此融合蛋白能够大量分泌到胞外,进入细胞间隙,有效地刺激小鼠机体免疫应答[17]。
在本研究中,以筛选的阳性杂交瘤细胞上清作为一抗,使用Western blot来检测该单克隆抗体与chTLR3胞外区原核蛋白反应,结果显示,在预期的55 ku处出现单一的条带,表明该抗体能够与chTLR3原核蛋白反应。同时,对该抗体与鸡外周血淋巴细胞中chTLR3蛋白反应性进行检测,结果显示在预期大小处出现单一条带[13],表明该单克隆抗体能够与鸡组织中的天然chTLR3蛋白特异性结合。上述结果表明已成功制备具有天然活性的抗chTLR3单克隆抗体。
单克隆抗体以其理化性状高度均一、生物活性单一、与抗原结合的特异性强、便于人为处理和质量控制等优点被广泛应用于各种实验室检测手段中。梁文花等[18]以纯化的、H1N1亚型猪流感病毒的全病毒蛋白免疫BALB/c小鼠,制备了抗H1N1猪流感病毒血凝素蛋白的单克隆抗体,应用间接免疫荧光试验发现该抗体能够与H1N1猪流感病毒血凝素蛋白发生反应,提示可以将制备的抗体进一步应用于抗H1N1猪流感病毒的感染及开展病毒抗原性变异的分子基础研究中。蔡瑞丽等[19]在成功制备抗毛细血管形态发生基因2(capillary morphogenesis gene 2,CMG2)单克隆抗体的基础上,尝试应用此抗体建立可用于胃癌组织和细胞中CMG2检测的流式细胞术、Western blot、免疫荧光及免疫组织化学方法,结果发现该抗体适用于流式细胞术、免疫荧光及免疫组织化学方法,却不适用于Western blot检测方法,分析可能与蛋白样品在裂解变性过程中抗原的结构发生变化而使抗体无法识别有关,从而推测该抗体所针对的CMG2蛋白抗原表位可能为构象表位而非线性表位。在本研究中,制备的抗chTLR3抗体能够与chTLR3原核表达蛋白反应,说明chTLR3蛋白至少含有一个线性表位且能够被该抗体识别,因此,采用Western blot方法在对照组和染镉组雏鸡脾以及外周血淋巴细胞中均能检测到chTLR3的表达变化。同时,采用间接免疫荧光技术及流式细胞术也检测到雏鸡体内chTLR3的表达变化,提示该抗体既针对chTLR3蛋白的线性表位、又针对chTLR3蛋白的构象表位,可用于Western blot、间接免疫荧光技术及流式细胞术研究chTLR3在鸡组织细胞的分布定位、表达变化,为进一步研究chTLR3在鸡疾病发病机制中的作用提供了重要的物质基础。
4 结论成功制备了具有天然活性的chTLR3单克隆抗体,利用此抗体可采用Western blot、间接免疫荧光技术及流式细胞术研究chTLR3在鸡组织细胞的分布定位、表达变化,为示踪chTLR3蛋白表达及其在雏鸡疾病发病机制中的作用奠定了重要的物质基础。
| [1] | AKIRA S, TAKEDA K. Toll-like receptor signalling[J]. Nat Rev Immunol, 2004, 4(7): 499–511. DOI: 10.1038/nri1391 |
| [2] | AKIRA S, UEMATSU S, TAKEUCHI O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4): 783–801. DOI: 10.1016/j.cell.2006.02.015 |
| [3] | ALEXOPOULOU L, HOLT A C, MEDZHITOV R, et al. Recognition of double-stranded RNA and activation of NF-κB by Toll-like receptor 3[J]. Nature, 2001, 413(6857): 732–738. DOI: 10.1038/35099560 |
| [4] | JIN M S, LEE J O. Structures of TLR-ligand complexes[J]. Curr Opin Immunol, 2008, 20(4): 414–419. DOI: 10.1016/j.coi.2008.06.002 |
| [5] | RAUF A, KHATRI M, MURGIA M V, et al. Differential modulation of cytokine, chemokine and Toll like receptor expression in chickens infected with classical and variant infectious bursal disease virus[J]. Vet Res, 2011, 42(1): 85–96. DOI: 10.1186/1297-9716-42-85 |
| [6] |
王成成, 王杲强, 葛铭, 等. 感染传染性法氏囊病病毒的DF-1细胞中chTLR3表达的动态变化[J]. 中国兽医科学, 2014, 44(12): 1304–1308.
WANG C C, WANG G Q, GE M, et al. Dynamic changes of chTLR3 expression in DF-1 cells infected with infectious bursal disease virus[J]. Chinese Veterinary Science, 2014, 44(12): 1304–1308. (in Chinese) |
| [7] | JANEWAY C A Jr, MEDZHITOV R. Innate immune recognition[J]. Annu Rev Immunol, 2002, 20: 197–216. DOI: 10.1146/annurev.immunol.20.083001.084359 |
| [8] | FITZGERALD K A, MCWHIRTER S M, FAIA K L, et al. IKKε and TBK1 are essential components of the IRF3 signaling pathway[J]. Nat Immunol, 2003, 4(5): 491–496. DOI: 10.1038/ni921 |
| [9] | LIU W J, GE M, HU X Q, et al. The effects of Agaricus blazei murill polysaccharides on cadmium-induced apoptosis and the TLR4 signaling pathway of peripheral blood lymphocytes in chicken[J]. Biol Trace Elem Res, 2017, 180(1): 153–163. DOI: 10.1007/s12011-017-0969-3 |
| [10] |
郭虹, 陈观今, 郑焕钦, 等. 弓形虫ROP1基因真核表达重组质粒免疫小鼠后的免疫应答[J]. 中国寄生虫学与寄生虫病杂志, 1999, 17(6): 334–337.
GUO H, CHEN G J, ZHENG H Q, et al. Immune responses in mice vaccinated with recombinant plasmid pcDNA3 containing ROP1 gene from Toxoplasma GondⅡ[J]. Chinese Journal of Parasitology and Parasitic Diseases, 1999, 17(6): 334–337. (in Chinese) |
| [11] |
岳锋, 杨健, 周娟娟, 等. 抗猪PD-L1单克隆抗体的制备与其生物学特性鉴定[J]. 基因组学与应用生物学, 2018, 37(6): 2368–2373.
YUE F, YANG J, ZHOU J J, et al. Preparation of anti-porcine PD-L1 monoclonal antibody and identification of its biological characteristics[J]. Genomics and Applied Biology, 2018, 37(6): 2368–2373. (in Chinese) |
| [12] | HU X Q, ZHANG R L, XIE Y Y, et al. The protective effects of polysaccharides from Agaricus blazei murill against Cadmium-induced oxidant stress and inflammatory damage in chicken livers[J]. Biol Trace Elem Res, 2017, 178(1): 117–126. DOI: 10.1007/s12011-016-0905-y |
| [13] |
陈建忠, 朱海红, 陈智, 等. 小鼠TLR3真核表达质粒的构建及其活性初步鉴定[J]. 中华微生物学和免疫学杂志, 2004, 24(6): 447–450.
CHEN J Z, ZHU H H, CHEN Z, et al. Construction of eukaryotic expression plasmid of murine TLR3 and identification of its biological activity[J]. Chinese Journal of Microbiology and Immunology, 2004, 24(6): 447–450. DOI: 10.3760/j:issn:0254-5101.2004.06.010 (in Chinese) |
| [14] | VAINE M, WANG S X, HACKETT A, et al. Antibody responses elicited through homologous or heterologous prime-boost DNA and protein vaccinations differ in functional activity and avidity[J]. Vaccine, 2010, 28(17): 2999–3007. DOI: 10.1016/j.vaccine.2010.02.006 |
| [15] |
刘淑颖, 陈雨欣, 王世霞, 等. DNA免疫技术在高质量单克隆抗体诱导开发中的应用进展[J]. 药学进展, 2017, 41(9): 662–669.
LIU S Y, CHEN Y X, WANG S X, et al. Progress in application of DNA immunization technique in R&D of high-quality monoclonal antibodies[J]. Progress in Pharmaceutical Sciences, 2017, 41(9): 662–669. (in Chinese) |
| [16] | ALEXOPOULOU L, HOLT A C, MEDZHITOV R, et al. Recognition of double-stranded RNA and activation of NF-κB by Toll-like receptor 3[J]. Nature, 2001, 413(6857): 732–738. DOI: 10.1038/35099560 |
| [17] |
郑泓, 韩双艳, 林影, 等. 质粒DNA单次脾内注射制备单克隆抗体[J]. 生物工程学报, 2007, 23(4): 710–714.
ZHENG H, HAN S Y, LIN Y, et al. Preparation of monoclonal antibody based on single intrasplenic immunization of plasmid DNA[J]. Chinese Journal of Biotechnology, 2007, 23(4): 710–714. DOI: 10.3321/j.issn:1000-3061.2007.04.028 (in Chinese) |
| [18] |
梁文花, 贾云慧, 许程志, 等. 两株H1N1亚型猪流感病毒HA蛋白中和性单克隆抗体的制备及抗病毒活性研究[J]. 畜牧兽医学报, 2018, 49(7): 1460–1466.
LIANG W H, JIA Y H, XU C Z, et al. Preparation and antiviral activity of two neutralizing monoclonal antibodies against HA protein of H1N1 swine influenza virus[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(7): 1460–1466. (in Chinese) |
| [19] |
蔡瑞丽, 王帅, 缪静雅, 等. 抗CMG2单克隆抗体的制备及其初步应用[J]. 免疫学杂志, 2018, 34(7): 630–635.
CAI R L, WANG S, MIAO J Y, et al. Preparation of mouse anti-CMG2 monoclonal antibody and its preliminary application[J]. Immunological Journal, 2018, 34(7): 630–635. (in Chinese) |



