2. 河南省动物性食品安全重点实验室, 郑州 450002;
3. 许昌海关, 许昌 461000
2. Henan Animal Food Safety Key Laboratory, Zhengzhou 450002, China;
3. Xuchang Customs, Xuchang 461000, China
猪δ冠状病毒(PDCoV)是一种新发的猪肠道病毒,属于冠状病毒科,deltacoronavirus病毒属,为有囊膜的单股正链RNA病毒。PDCoV最早于2012年从猪粪便样品中检测到,研究人员随后进行了该病毒全基因组序列测定[1]。2014年,美国俄亥俄州、伊利诺伊州等地猪场相继暴发仔猪腹泻,之后在美国20多个州的猪场陆续检测到PDCoV[2-3],并进行了PDCoV的首次分离[4]。随后在韩国、泰国[5-6]等多个亚洲国家以及我国境内[7-8]也检测到PDCoV感染仔猪的情况,说明PDCoV感染已成为养猪场普遍存在的现象。PDCoV的感染范围很广,可以感染不同年龄段的猪,但以新生仔猪为主,临床症状与PEDV及TGEV非常相似[9-11],主要表现为呕吐、腹泻,是当前严重危害世界各国养猪业的重要病毒性腹泻病毒之一,给养猪业带来了一定的经济损失。
目前,PDCoV的检测方法主要有ELISA[12]、RT-PCR[13-14]、巢氏RT-PCR[15]等,这些方法在PDCoV的临床检测中发挥了重要作用,有助于与PEDV、TGEV感染进行区分。但这些方法灵敏性不高、稳定性较差,在该病毒的初期感染检测应用中受到很大限制。本研究旨在建立一种快速、便捷、特异性高的PDCoV TaqMan荧光定量RT-PCR检测方法,并用此方法对河南地区收集的100份猪场腹泻临床样品病料进行检测,为当地PDCoV流行病学调查提供一定的依据。
1 材料与方法 1.1 试验材料 1.1.1 病料与毒株临床检测病料100份,为2017—2018年间河南不同地区猪场收集到的腹泻猪的粪样、肠道组织等。PDCoV(CH-01)、PEDV、TGEV、猪圆环病毒2型(porcine circovirus type2,PCV2)、猪圆环病毒3型(porcine circovirus type3,PCV3)、猪伪狂犬病病毒(pseudorabies virus,PRV)、猪瘟病毒(classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(porcine reproductive respiratory syndrome virus,PRRSV)均由河南省动物性食品安全重点实验室鉴定并保存。
1.1.2 实验动物5日龄健康仔猪3头,购自河南某商品养猪场。
1.1.3 主要试剂及仪器RNA提取试剂盒购自上海捷瑞生物技术有限公司;反转录试剂盒购自QIAGEN生化科技公司(北京);DL2000 DNA Marker购自康为世纪生物科技有限公司(北京);Premix Ex TaqTM、pMD18-T载体、DH5α感受态细胞购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒、质粒提取试剂盒购自北京博大泰克生物公司;CFX96实时荧光定量PCR仪购自Bio-Rad公司(美国)。
1.1.4 标准质粒构建根据GenBank中登录的PDCoV基因组序列(JQ065043),以M基因为目的片段,设计扩增引物PDCoV-F1、PDCoV-R1(表 1),引物和探针由上海生工生物工程技术服务有限公司合成。以PDCoV(CH-01) cDNA为模板,PCR扩增得到包含M基因全长的一段序列片段(715 bp),将该片段克隆到pMD18-T载体中,进行阳性克隆筛选并测序,证实所得到的片段为PDCoV M基因。将重组质粒用Nano drop进行浓度测定,并计算拷贝数,用去离子水将重组质粒稀释成1.0×100~1.0 ×109拷贝·μL-1,作为模板标准品,用来绘制标准曲线。
|
|
表 1 PDCoV相关引物与探针 Table 1 The primers and probe of PDCoV |
根据“1.1.4”中构建的标准质粒PDCoV基因序列,应用Primer 5.0基因分析软件设计一对特异性引物PDCoV-F2、PDCoV-R2和TaqMan探针(表 1)。引物和探针由上海生工生物工程技术服务有限公司合成。
1.2 试验方法 1.2.1 荧光定量RT-PCR反应条件与反应体系优化以浓度1.0×105拷贝·μL-1的标准质粒为模板,反应体系设为25 μL,在反应体系中加入引物F2/R2,使其终浓度分别为0.20、0.40、0.60、1.00 μmol·L-1;加入探针,使其终浓度分别为0.10、0.20、0.30、0.40 μmol·L-1,根据扩增曲线进行引物浓度与探针浓度的优化筛选。再将优化后的反应体系分别以54、56、58、60、62 ℃的不同熔解温度进行反应,优化反应条件,最终确定最佳反应体系与反应条件。
1.2.2 构建标准曲线将构建的重组质粒进行倍比稀释,以浓度为1.0×101~1.0×109拷贝·μL-1的标准质粒为模板,采用“1.2.1”中优化后的反应体系与反应条件进行荧光定量RT-PCR扩增,根据所得的Ct值与对应的标准质粒浓度,绘制标准曲线。
1.2.3 灵敏性试验以1.0×100~1.0×109拷贝·μL-1的标准质粒分别作为模板,进行该方法的敏感性测定,根据所得熔解曲线,获得本检测方法的最低检出拷贝数。
1.2.4 特异性试验按照“1.2.1”建立的反应体系,分别以PEDV、TGEV、PCV2、PCV3、PRV、CSFV、PRRSV核酸为模板,同时设1.0×104拷贝·μL-1标准质粒为阳性对照,以去离子水为阴性对照,进行RT-PCR扩增以检测该方法的特异性。
1.2.5 重复性试验选取1.0×102、1.0×104、1.0×105拷贝·μL-1的标准质粒分别作为模板,进行3次批内与批间荧光定量RT-PCR反应扩增,根据Ct值计算变异系数,进行该方法重复性的验证。
1.2.6 临床病料检测收集2017—2018年间河南省不同猪场的100份腹泻病料,应用本研究建立的TaqMan荧光定量RT-PCR方法进行检测,与本实验室已经建立的PDCoV SYBR Green Ⅰ荧光定量检测方法进行比较[16],验证该方法的临床检测效果。
1.2.7 攻毒结果检测取5日龄健康仔猪3头,2头灌服15 mL PDCoV(TCID50·0.1 mL-1= 6.5),1头为阴性对照,取仔猪攻毒后1~4 d粪样进行荧光定量RT-PCR反应,并与普通RT-PCR[17]扩增结果进行比较。
2 结果 2.1 反应条件与反应体系优化通过改变反应体系中引物与探针的浓度,反应过程中的熔解温度、对反应条件与反应体系进行优化,最终确定优化后的最佳反应体系为2×Premix Ex Taq 12.5 μL,F2/R2(10 μmol·L-1)各1 μL,TaqMan Probe(5 μmol·L-1)1 μL,cDNA模板2 μL,加去离子水至25 μL。最终确定的反应参数:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。
2.2 标准曲线的建立将建立的TaqMan荧光定量RT-PCR检测方法对1.0×101~1.0×109拷贝·μL-1的标准质粒进行定量检测,以读取的Ct值为Y轴,以标准质粒浓度1.00×lg(拷贝·μL-1)为X轴绘制标准曲线,获得标准方程y=-3.272x + 42.37,相关系数R2为0.993(图 1),结果表明Ct值与倍比稀释的标准质粒之间具有良好的线性关系。
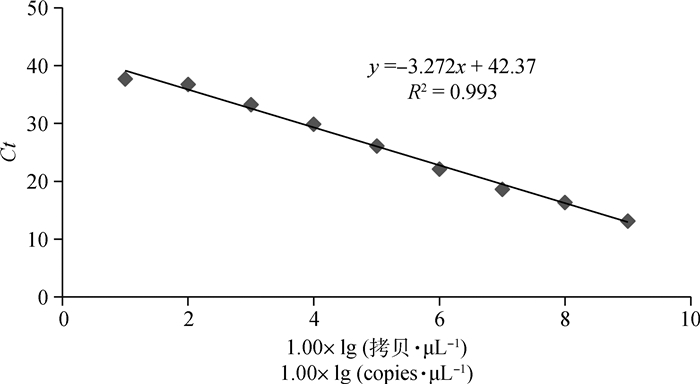
|
图 1 PDCoV TaqMan荧光定量RT-PCR标准曲线 Fig. 1 Standard curve of PDCoV by TaqMan real-time RT-PCR |
用建立的TaqMan荧光定量RT-PCR方法对1.0×100~1.0×109拷贝·μL-1的标准质粒进行敏感性检测。结果显示该方法的最低检出量为1.0×101拷贝·μL-1(图 2),敏感性高于本实验室之前建立的PDCoV SYBR Green Ⅰ荧光定量检测方法[15]。
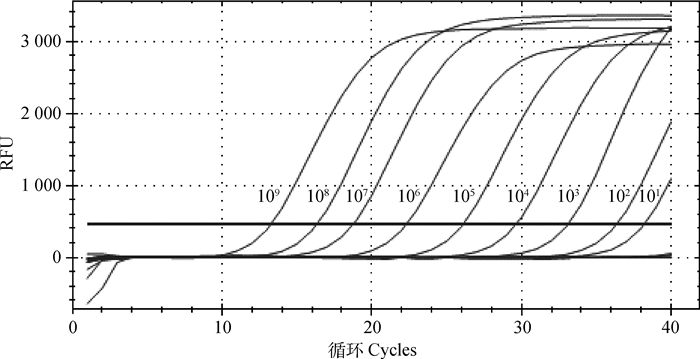
|
图 2 PDCoV TaqMan荧光定量RT-PCR敏感性试验 Fig. 2 Sensitivity test of PDCoV by TaqMan real-time RT-PCR |
应用建立的荧光定量RT-PCR反应体系检测PEDV、TGEV、PCV2、PCV3、PRV、CSFV、PRRSV核酸样品,以1.0×104拷贝·μL-1标准质粒为阳性对照,发现其余病毒均未出现阳性扩增(图 3),结果表明该方法具有良好的特异性。
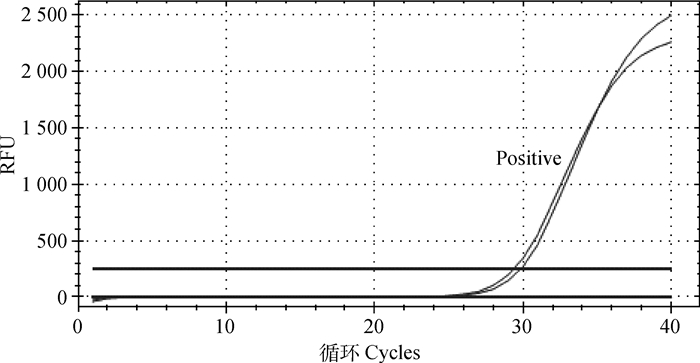
|
图 3 PDCoV TaqMan荧光定量RT-PCR特异性试验 Fig. 3 Specificity test of PDCoV M gene by TaqMan real-time RT-PCR |
将建立的TaqMan荧光定量RT-PCR检测方法进行重复性试验。以1.0×103、1.0×105、1.0×108拷贝·μL-1的标准质粒分别作为模板,进行3次批内与批间荧光定量RT-PCR反应扩增,同一质粒浓度的扩增Ct值在批次内与批次间都非常稳定。计算批内与批间Ct值的变异系数,并进行统计学分析,发现3次重复的变异系数(CV)均小于1%(表 2),表明本方法的重复性较好。
|
|
表 2 荧光定量RT-PCR重复性试验 Table 2 Reproducibility test of PDCoV M gene by TaqMan real-time RT-PCR |
取2017—2018年间河南省不同猪场收集的100份腹泻病料,应用本研究建立的TaqMan荧光定量RT-PCR方法进行检测,结果显示,PDCoV的阳性检出率为23%(23/100),与本实验室已经建立的PDCoV SYBR GreenⅠ荧光定量检测方法结果一致,二者的相符率为100%。随机选取3份阳性样本,经测序鉴定后,证实为PDCoV,表明此次建立的方法可用于PDCoV的临床流行病学调查。
2.7 攻毒后粪样检测对2头5日龄健康仔猪攻毒后,取1~4 d粪样进行荧光定量RT-PCR检测(表 3)与普通RT-PCR检测(图 4)。结果表明,在感染后第1天应用TaqMan荧光定量RT-PCR检测方法已从仔猪粪样中检测到病毒,并随着时间推移病毒排量逐渐提高,人工感染后第3天,仔猪已出现明显的腹泻症状,对照猪没有临床可见症状。而常规RT-PCR检测的灵敏度则大大降低,至第3天有明显腹泻后,扩增有较弱的特异性条带。
|
|
表 3 荧光定量RT-PCR检测结果 Table 3 Detection of PDCoV M gene by TaqMan real-time RT-PCR |

|
M. DNA相对分子质量标准; P.阳性对照; 1~8.攻毒1~4天粪样检测结果;9. MEM对照;N.阴性对照 M.DNA marker; P. Positive control; 1-8. Results of DPI 1-4;9. MEM control; N. Negative control 图 4 普通RT-PCR检测结果 Fig. 4 PDCoV detection results by common RT-PCR |
PDCoV是当前引起猪群腹泻,尤其是仔猪腹泻的主要病原之一,在我国猪群中普遍存在,具有流行范围广、传播速度快、感染率高等特点,给养猪业造成一定的经济损失。在临床检测中,PDCoV与PEDV、TGEV的混合感染情况非常普遍,且无论是自然感染还是人工感染,猪感染这三种病毒后的表现症状均以腹泻、呕吐为主,因此很难通过临床症状与病理变化对这三种病原进行区分,对该病的确诊必须依靠实验室方法。因此,建立一种快速、便捷、灵敏、稳定的检测方法对于PDCoV的诊断非常必要。本研究以PDCoV防控为目的,选取PDCoV M基因保守序列,建立了TaqMan荧光定量RT-PCR检测方法,可用于该病毒的分子流行病学调查和疫病的检测监控,及时了解该病毒在我国的流行情况。
目前PDCoV已经建立的检测方法有逄凤娇等[18]建立的RT-PCR检测方法,最低检测限为4.05×103拷贝·μL-1;陈小金等[19]建立的SYBR Green Ⅰ荧光定量PCR检测方法,最低检测限为24.9拷贝·μL-1。本研究建立的TaqMan荧光定量RT-PCR检测方法,最低检测限为10拷贝·μL-1,具有极高的敏感性,敏感性远远高于常规PCR检测方法。此外,相较于已经建立的SYBR Green Ⅰ荧光PCR检测方法,TaqMan探针荧光定量RT-PCR技术稳定性更高,特异性更强,敏感性也要优于前者。本研究建立方法的重复性试验表明,变异系数CV均小于1%,具有更好地重复性。通过临床样本检测的验证,也进一步确保了所建立方法的可靠性。
用本研究建立的TaqMan探针荧光定量RT-PCR检测方法和实验室已有的SYBR Green Ⅰ荧光定量RT-PCR检测方法,同时对100份猪腹泻病料样品核酸进行检测,发现二者的检出结果一致,阳性检出率为23%(23/100),符合率100%,但方法的敏感性要明显优于SYBR Green Ⅰ荧光定量RT-PCR检测方法,这对于猪群的早期感染或者没有明显临床症状时的检测具有重要的意义。该检测结果与韩丽等[20]报道的河南省111份腹泻病料中PDCoV的阳性率为19.82%,韦学雷等[17]报道的河南省176份猪腹泻病料中PDCoV阳性率为18.18%相比,检出率已经有了明显升高。本方法检测的样品均为暴发腹泻的猪群中收集得到,表明PDCoV是当前引起猪群腹泻的重要病原之一,当前河南省不同地区猪场的PDCoV的感染情况较为普遍,且有上升的趋势。对健康仔猪进行PDCoV人工感染,进行TaqMan探针荧光定量RT-PCR检测方法与常规RT-PCR检测方法的比较。结果显示,本研究建立的方法在灵敏度上要远远优于常规RT-PCR检测。PDCoV在仔猪体内的感染及致病性是不容忽视的问题,在猪病防控中应当引起重视。也进一步证实此次建立的TaqMan探针荧光定量RT-PCR检测方法灵敏性更高,可用于临床PDCoV的流行病学调查和监测,对于该病原的监视和流行趋势判断可提供一定的技术支持。
4 结论成功建立一种PDCoV TaqMan荧光定量RT-PCR检测方法,可以用于临床样品中PDCoV快速准确的检测,有助于PDCoV的监测和防控。
| [1] | WOO P C Y, LAU S K P, LAM C S F, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of Alphacoronavirus and Betacoronavirus and avian coronaviruses as the gene source of Gammacoronavirus and Deltacoronavirus[J]. J Virol, 2012, 86(7): 3995–4008. DOI: 10.1128/JVI.06540-11 |
| [2] | SINHA A, GAUGER P, ZHANG J Q, et al. PCR-based retrospective evaluation of diagnostic samples for emergence of porcine deltacoronavirus in US swine[J]. Vet Microbiol, 2015, 179(3-4): 296–298. DOI: 10.1016/j.vetmic.2015.06.005 |
| [3] | WANG L Y, BYRUM B, ZHANG Y. Porcine coronavirus HKU15 detected in 9 US states, 2014[J]. Emerg Infect Dis, 2014, 20(9): 1594–1595. DOI: 10.3201/eid2009.140756 |
| [4] | HU H, JUNG K, VLASOVA A N, et al. Isolation and characterization of porcine deltacoronavirus from pigs with diarrhea in the United States[J]. J Clin Microbiol, 2015, 53(5): 1537–1548. DOI: 10.1128/JCM.00031-15 |
| [5] | LEE S, LEE C. Complete genome characterization of korean porcine deltacoronavirus strain KOR/KNU14-04/2014[J]. Genome Announc, 2014, 2(6): e01191–14. |
| [6] | SAENG-CHUTO K, LORSIRIGOOL A, TEMEEYASEN G, et al. Different lineage of porcine deltacoronavirus in Thailand, Vietnam and Lao PDR in 2015[J]. Transbound Emerg Dis, 2017, 64(1): 3–10. DOI: 10.1111/tbed.2017.64.issue-1 |
| [7] | DONG N, FANG L R, YANG H, et al. Isolation, genomic characterization, and pathogenicity of a Chinese porcine deltacoronavirus strain CHN-HN-2014[J]. Vet Microbiol, 2016, 196: 98–106. DOI: 10.1016/j.vetmic.2016.10.022 |
| [8] | WANG Y W, YUE H, FANG W H, et al. Complete genome sequence of porcine deltacoronavirus strain CH/Sichuan/S27/2012 from mainland China[J]. Genome Announc, 2015, 3(5): e00945–15. |
| [9] | MA Y M, ZHANG Y, LIANG X Y, et al. Origin, evolution, and virulence of porcine deltacoronaviruses in the United States[J]. MBio, 2015, 6(2): e00064–15. |
| [10] | CHEN Q, GAUGER P, STAFNE M, et al. Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets[J]. Virology, 2015, 482: 51–59. DOI: 10.1016/j.virol.2015.03.024 |
| [11] | LI W T, LI H, LIU Y B, et al. New variants of porcine epidemic diarrhea virus, China, 2011[J]. Emerg Infect Dis, 2012, 18(8): 1350–1353. DOI: 10.3201/eid1803.120002 |
| [12] | THACHIL A, GERBER P F, XIAO C T, et al. Development and application of an ELISA for the detection of porcine deltacoronavirus IgG antibodies[J]. PLoS One, 2015, 10(4): e0124363. DOI: 10.1371/journal.pone.0124363 |
| [13] | JUNG K, HU H, EYERLY B, et al. Pathogenicity of 2 porcine deltacoronavirus strains in gnotobiotic pigs[J]. Emerg Infect Dis, 2015, 21(4): 650–654. DOI: 10.3201/eid2104.141859 |
| [14] | HU H, JUNG K, WANG Q H, et al. Development of a one-step RT-PCR assay for detection of pancoronaviruses (α-, β-, γ-, and δ-coronaviruses) using newly designed degenerate primers for porcine and avian `fecal samples[J]. J Virol Methods, 2018, 256: 116–122. DOI: 10.1016/j.jviromet.2018.02.021 |
| [15] | SONG D, ZHOU X, PENG Q, et al. Newly emerged porcine Deltacoronavirus associated with diarrhoea in swine in China:identification, prevalence and full-length genome sequence analysis[J]. Transbound Emerg Dis, 2015, 62(6): 575–580. DOI: 10.1111/tbed.2015.62.issue-6 |
| [16] |
张利卫, 曹贝贝, 李炳晓, 等. 新发猪Delta冠状病毒和猪流行性腹泻病毒SYBR Green Ⅰ双重荧光RT-PCR检测方法的建立及应用[J]. 中国兽医学报, 2018, 38(4): 618–624.
ZHANG L W, CAO B B, LI B X, et al. Establishment and application of a duplex SYBR Green Ⅰ real-time RT-PCR assay for simultaneous detection of emerging PDCoV and PEDV[J]. Chinese Journal of Veterinary Science, 2018, 38(4): 618–624. (in Chinese) |
| [17] |
韦学雷, 梁青青, 曹贝贝, 等. 猪Delta冠状病毒、猪传染性胃肠炎病毒和猪流行性腹泻病毒多重RT-PCR检测方法的建立及应用[J]. 中国兽医学报, 2018, 38(1): 11–16.
WEI X L, LIANG Q Q, CAO B B, et al. Establishment and application of a multiplex RT-PCR assay for simultaneous detection of porcine delta coronavirus, porcine transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J]. Chinese Journal of Veterinary Science, 2018, 38(1): 11–16. (in Chinese) |
| [18] |
逄凤娇, 俞正玉, 何孔旺, 等. 猪Deltacoronavirus RT-PCR检测方法的建立及其应用[J]. 中国预防兽医学报, 2015, 37(9): 683–686.
PANG F J, YU Z Y, HE K W, et al. Development and application of a RT-PCR assay for detection of porcine deltacoronavirus[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(9): 683–686. DOI: 10.3969/j.issn.1008-0589.2015.09.08 (in Chinese) |
| [19] |
陈小金, 张霞, 王玉玲, 等. 猪德尔塔冠状病毒荧光定量PCR检测方法的建立[J]. 中国动物检疫, 2018, 35(9): 95–100.
CHEN X J, ZHANG X, WANG Y L, et al. Development of fluorescence quantitative PCR assay for detection of porcine deltacoronavirus[J]. China Animal Health Inspection, 2018, 35(9): 95–100. DOI: 10.3969/j.issn.1005-944X.2018.09.024 (in Chinese) |
| [20] |
韩丽, 周雍, 李炳晓, 等. 猪Delta冠状病毒和猪流行性腹泻病毒双重RT-PCR诊断方法的建立及初步应用[J]. 中国兽医科学, 2017, 47(5): 557–562.
HAN L, ZHOU Y, LI B X, et al. Establishment and preliminary application of a duplex reverse transcription-PCR for the detection of porcine deltacoronavirus and porcine epidemic diarrhea virus[J]. Chinese Veterinary Science, 2017, 47(5): 557–562. (in Chinese) |



