2. 贵州大学动物科学学院, 贵阳 550025;
3. 贵州省种畜禽种质测定中心, 贵阳 550018
2. College of Animal Science, Guizhou University, Guiyang 550025, China;
3. Guizhou Province Livestock and Poultry Germplasm Determination Center, Guiyang 550018, China
LYRM1基因属于线粒体LYRM(complex1_lyr-like motif)蛋白超家族成员,作为线粒体功能的辅助因子控制线粒体稳态,并在诱导细胞凋亡、钙稳态、调控细胞周期和细胞凋亡等方面发挥重要作用[1-2]。研究显示,LYRM1是一种肥胖相关基因,参与脂肪组织的平衡与肥胖相关的胰岛素抵抗,以及脂肪细胞的分化和生长,具有胰岛素抵抗作用,并可作为胰岛素抵抗的靶基因[3-4]。LYRM1过度表达能显著降低胰岛素刺激的葡萄糖转运和成熟脂肪细胞对葡萄糖的摄取[5]。LYRM1基因广泛表达于不同组织中,特异性高表达于肥胖者的脂肪组织中,并具有调节前体脂肪细胞池大小和稳态的潜力[6]。Zhang等[7]研究认为,LYRM1基因具有促进3T3-L1前体脂肪细胞增殖和抑制其凋亡的作用。沉默LYRM1可增加细胞活性氧水平和降低线粒体膜电位,抑制P19细胞向心肌细胞分化[8]。此外,朱冠忠等[9]研究表明,LYRM1基因沉默可部分影响成熟脂肪细胞线粒体形态,LYRM1基因已作为探究二型糖尿病、肥胖等人类健康疾病的相关靶基因。Li等[10]对LYRM1基因多态性的研究显示,LYRM1基因多态性对秦川牛的体重和肉质性状有显著影响,认为该基因可作为影响秦川牛屠宰性能的候选基因进行分子遗传标记辅助选育。全基因组关联分析发现,LYRM1基因可作为影响北京油鸡体质量性状的重要候选基因[11]。白洗猪为贵州省优良的地方猪种,对白洗猪种质特性研究表明,白洗猪具有产肉性能好,脂肪含量适中,肌肉嫩度好,肉味鲜美等特点[12]。关于LYRM1基因的研究虽有报道,但其mRNA在白洗猪各组织中的表达水平,对脂肪沉积的影响及相关基因的调节作用鲜有报道,且与猪脂肪沉积的关系亦尚待探讨。
本研究通过qRT-PCR技术检测LYRM1基因在白洗猪不同组织中的表达,构建pEGFP-N3-LYRM1重组质粒,瞬时转染白洗猪皮下脂肪前体细胞,通过检测培养基中三酰甘油的浓度、细胞凋亡水平、脂肪沉积相关基因的mRNA表达,探究LYRM1基因对脂肪沉积的影响,为进一步挖掘猪脂肪沉积相关基因提供理论依据。
1 材料与方法 1.1 试验材料白洗猪选自贵州省施秉县白洗猪种质资源保护基地,选取父母本为纯正血统的白洗猪同一窝仔猪(共10只),在仔猪5日龄时选取1只用于皮下脂肪前体细胞的分离培养,剩余9只按照当地传统饲养方法进行饲养,在10月龄时检测脂肪沉积相关基因在白洗猪不同组织中的表达,饲养方法为28日龄进行断奶,1~3月龄饲喂仔猪全价饲料,3~10月龄进行熟食饲养,每日分别在9:00和15:00进行饲喂,主要饲喂玉米面、地瓜、南瓜、豆粕等,至10月龄时,参照国家《生猪屠宰操作规程》(GB/T17236-1998)标准进行屠杀,采取心、肝、脾、肺、肾等组织样,锡箔纸包好放入液氮中,带回实验室。
限制性快速内切酶Kpn Ⅰ、Xho Ⅰ及T4 DNA ligase购自大连宝生物工程有限公司;PBS磷酸盐缓冲液、青链霉素、细胞筛、培养瓶、培养板、0.2%的Ⅱ型胶原酶、油红O染料、MTT试剂、台盼蓝购自贵州鼎国生物有限公司;胎牛血清、0.25%胰蛋白酶、DMEM/basic培养基购自GIBCO公司;OPTI-MEM、LipofectamineTM3000CD Reagent、Revert AidTMFirstStrand cDNA Synthesis试剂盒购自Invitrogen公司;无内毒素质粒提取试剂盒购自OMEGA公司;胰岛素、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)、异丙醇购自Sigma公司;三酰甘油检测试剂购自南京建成试剂公司。
1.2 试验方法 1.2.1 基因克隆及qRT-PCR引物设计以GAPDH(NM:001206359.1)基因为内参,参照GenBank中收录的猪LYRM1(XM:005662096.2)、PPARγ(NM:214379.1)、ATGL(EU:373817.1)、FAS(NC:010456.4)基因的mRNA序列,运用Primer Premier 5.0和NCBI Primer-BLAST在线软件设计特异性克隆引物及qRT-PCR引物(表 1)。引物由上海生工生物工程技术服务有限公司合成。
|
|
表 1 LYRM1基因克隆及qRT-PCR引物 Table 1 LYRM1 gene cloning and qRT-PCR primers |
Trizol法提取10月龄白洗猪各组织总RNA,参照Revert AidTM First Strand cDNA Synthesis试剂盒对总RNA进行逆转录,合成cDNA。
1.2.3 实时荧光定量PCR(qRT-PCR)利用qRT-PCR技术检测LYRM1基因在白洗猪心、肝、脾、肺等不同组织中的表达水平。qRT-PCR反应采用10 μL体系:2×UItraSYBR Mixture(With ROX)5.4 μL,上下游引物各(10 μmol ·L-1)0.6 μL,cDNA 2 μL,灭菌水补充至总体积10 μL。qRT-PCR反应程序:95 ℃预变性10 min;95 ℃变性13 s,57 ℃退火28 s,72 ℃延伸32 s,45个循环;95 ℃变性15 s。采用2-△△Ct方法处理数据。
1.2.4 pEGFP-N3-LYRM1真核表达载体构建PCR扩增白洗猪LYRM1基因的CDS区,胶回收,连接转化TOP10感受态细胞,平板涂布,37 ℃过夜培养,选取白色菌落PCR验证,双酶切,连接pEGFP-N3真核表达载体,选取白色菌落培养,送上海生工生物工程技术服务有限公司进行测序检验。
1.2.5 皮下脂肪前体细胞的分离培养及鉴定皮下脂肪前体细胞的分离培养参考文献[13],选取5日龄白洗猪,禁食禁水12 h,75%的酒精清洗全身,前肢腋下静脉放血致死,超净工作台中取颈部皮下脂肪组织,生理盐水清洗,清除血管和结缔组织,将其剪成1 mm3左右的小块;0.2%的Ⅱ型胶原酶,37 ℃水浴消化45~60 min,分散细胞,10%完全培养基终止消化;200目细胞筛过滤,收集细胞滤液,1 500×g,离心10 min,收集皮下脂肪前体细胞;1 500×g差速离心10 min,分离血细胞和结缔细胞,除去非脂肪细胞;10%完全培养基重悬细胞沉淀,调整细胞浓度,转移至细胞培养瓶中,37 ℃,5% CO2培养箱中培养。观察细胞生长密度,当达到90%左右的汇合度时,进行细胞传代,加入0.25%的胰蛋白酶消化2~3 min,倒置显微镜下观察细胞状态,震荡培养瓶,当90%的细胞能够脱落时,加10%的细胞完全培养基终止消化,将细胞悬液以1:2的比例分瓶;当细胞达到生长抑制时,将细胞完全培养基更换为细胞诱导培养基进行培养,培养4 d后更换为分化维持培养基,直到80%左右的细胞中形成脂滴,进行油红O染色。
1.2.6 pEGFP-N3-LYRM1重组质粒转染细胞将细胞接种至6孔板中进行培养,待细胞生长至90%左右的汇合度时,更换为无抗生素的完全培养基,利用LipofectamineTM3000CD Reagent脂质体转染试剂盒,将重组质粒pEGFP-N3-LYRM1与脂质体混合物滴加入细胞培养板中,37 ℃,5% CO2培养箱中培养24 h,倒置荧光显微镜下观察细胞的转染情况。
1.2.7 超表达LYRM1基因对三酰甘油生成的影响收集未转染任何质粒的空白对照组细胞和转染试验组细胞培养24 h后的细胞培养基,标记为0 h,诱导培养基培养24、48、72和96 h后的2组细胞培养基,1 000×g离心5 min,收集上清,参照三酰甘油检测试剂盒说明书,用酶标仪在510 nm波长下检测吸光度。每组设6个重复对照。
1.2.8 超表达LYRM1基因对细胞凋亡的影响检测细胞凋亡水平方法参照文献[14],将空白对照组细胞和转染试验组培养24 h后的细胞,标记为0 h,培养基更换为不含血清的DMEM/basic基础培养基,血清饥饿法培养12和24 h,倒置显微镜下观察细胞状态,对比凋亡细胞与活细胞的形态变化;收集血清饥饿法培养的细胞,Hanks液配制0.1%台盼蓝溶液(现配现用),胰蛋白酶消化制备单细胞悬液,将空白对照组细胞和转染试验组细胞每孔滴加1滴染液,室温下染1~2 min;于显微镜下观察细胞颜色变化;MTT法测定细胞数,加入MTT 20 μL,37 ℃、5% CO2培养箱中培养4 h,弃孔内溶液,加入DMSO 150 μL,震荡10 min,在490 nm波长处读取OD值,设置空白孔调零,计算各孔吸光度值的平均值,绘制线形图,即得空白对照组细胞和转染试验组细胞的凋亡曲线。
1.2.9 超表达LYRM1基因对脂肪沉积相关基因表达的影响收集空白对照组细胞和转染pEGFP- N3-LYRM1重组质粒的细胞,Trizol法提取细胞RNA,逆转录合成cDNA,qRT-PCR检测脂肪沉积相关基因LYRM1、PPARγ、ATGL、FAS的mRNA在两组细胞中的表达量。
1.2.10 数据处理分析基因mRNA的表达水平按照2-△△Ct法计算,用SPSS Statistics 19.0软件进行差异显著性分析,P < 0.05表示差异显著,P < 0.01表示差异极显著。
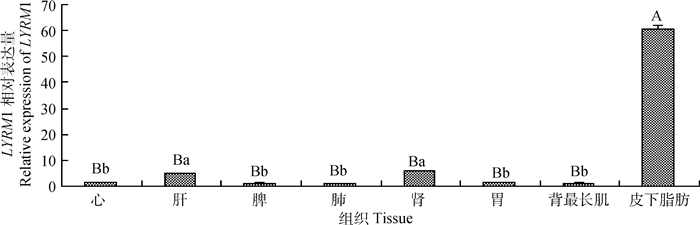
2 结果 2.1 LYRM1基因在白洗猪不同组织中的表达对白洗猪心、肝、脾、肺、肾、胃、背最长肌和皮下脂肪8个组织中LYRM1基因的表达水平检测结果如图 1所示,不同组织间表达水平对比分析可知,LYRM1基因在白洗猪的不同组织中均有表达,表现为在脂肪组织中表达量最高,与其他组织之间的差异达到极显著水平(P < 0.01),相对高表达于肝和肾(P < 0.05),其他组织间无显著差异。
|
不同大写字母表示差异极显著(P < 0.01),不同小写字母表示差异显著(P < 0.05),无字母或字母相同表示差异不显著(P>0.05)。下同 Different uppercase letters indicate the extremely significant difference(P < 0.01), different lowercase letters indicate the significant difference (P < 0.05), and no letter or the same letter indicate no significant difference(P>0.05). The same as below 图 1 LYRM1基因在白洗猪不同组织中的表达 Fig. 1 Expression of LYRM1 gene in different tissues of Baixi pig |
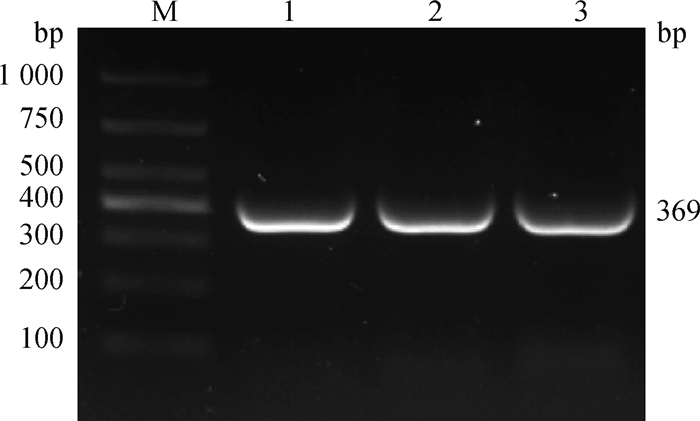
LYRM1基因CDS区的PCR扩增凝胶电泳结果见图 2,由图 2可知,扩增产物条带清晰度高、特异性强,未发现有引物二聚体,扩增片段与目的片段大小一致,可初步判定为目的扩增片段,可用于下一步试验。重组载体pEGFP-N3-LYRM1经限制性内切酶Kpn Ⅰ、Xho Ⅰ双酶切,获得约4 693和369 bp的2个条带,其分别为pEGFP-N3载体和LYRM1基因CDS区片段,表明真核表达载体构建成功(图 3)。对pEGFP-N3-LYRM1重组质粒送上海生工生物工程公司测序,结果显示,白洗猪LYRM1基因与NCBI上传的猪LYRM1基因的序列吻合度达99.8%(图 4),可用于下一步试验。
|
M. DNA相对分子质量标准;1~3.扩增的LYRM1基因CDS区 M. DL1000 marker; 1-3. Cloned CDS region of LYRM1 gene 图 2 LYRM1基因PCR克隆结果 Fig. 2 PCR clone results of LYRM1 gene |

|
M.DNA相对分子质量标准;1~5.重组质粒pEGFP-N3- LYRM1双酶切 M. DL1000 marker; 1-5. The double enzyme digestion of recombinant plasmid pEGFP-N3-LYRM1 图 3 pEGFP-N3-LYRM1重组质粒双酶切验证结果 Fig. 3 Results of double enzyme digestion of recombinant plasmid pEGFP-N3-LYRM1 |

|
图 4 白洗猪LYRM1部分重组质粒与NCBI上传序列对比结果 Fig. 4 Comparison of partial recombinant plasmids sequence from Baixi pig LYRM1 with NCBI uploaded sequence |
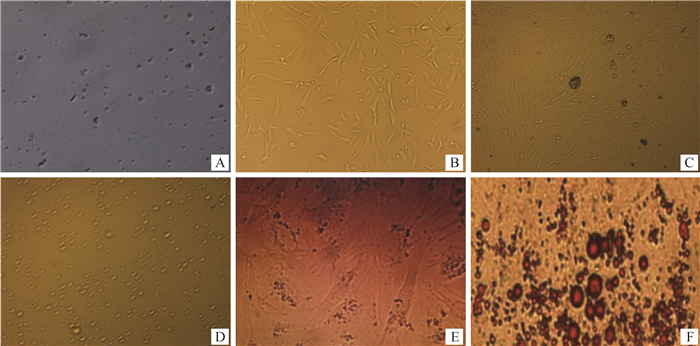
采用差速离心法分离纯化提取的皮下脂肪前体细胞,培养24 h后,倒置显微镜下观察细胞呈透明的圆点状,贴附于培养瓶底部(图 5A);细胞培养8 d后,生长速度加快,出现形态变化,部分细胞呈梭形(图 5B),培养12 d后,细胞汇合成单层紧密平行排列细胞或旋涡状(图 5C),表明细胞分离培养成功。细胞生长汇合度达90%左右时进行传代。倒置显微镜下观察消化细胞形态变化,当细胞边缘收缩变为透明状圆点时可终止消化(图 5D)。细胞达到生长抑制时,更换为诱导培养基进行诱导,在诱导分化维持8 d时细胞内出现“葡萄串”状脂滴(图 5E),继续培养使细胞内脂滴聚集,至12 d时细胞内形成较大脂滴泡。经油红O染色,细胞内脂滴呈红色(图 5F),证明该细胞为脂肪前体细胞。
|
A.细胞培养24 h;B.细胞培养8 d;C.细胞培养12 d;D.细胞传代;E.诱导分化8 d;F.诱导分化12 d, 油红O染色 A.Cell culture for 24 h; B. Cell culture for 8 d; C. Cell culture for 12 d; D. Cell passage; E. Inducing differentiation for 8 d; F. Inducing differentiation for 12 d, Oil red O staining 图 5 细胞培养、传代与鉴定(100×) Fig. 5 Cell culture, passage and identification(100×) |
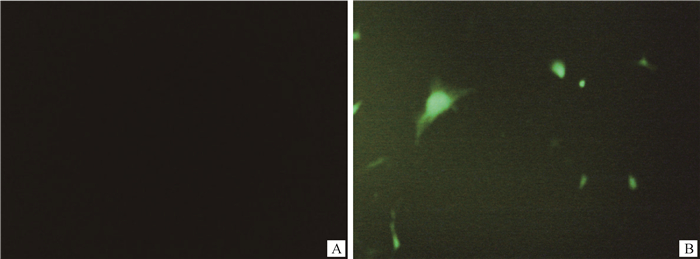
倒置荧光显微镜下观察转染24 h后的细胞,结果表明,重组pEGFP-N3-LYRM1质粒成功转染至皮下脂肪前体细胞,显微镜下观察空白对照细胞无任何光亮,呈漆黑状(图 6A),转染重组质粒的细胞发明亮的荧光且细胞核位置亮度较高,表明LYRM1基因可能位于细胞核内(图 6B)。
|
A.空白对照细胞;B.转染pEGFP-N3-LYRM1重组质粒细胞 A.Blank control cell; B. Recombination plasmid cell transfected with pEGFP-N3-LYRM1 图 6 皮下前体细胞的转染(400×) Fig. 6 Transfection of subcutaneous precursor cells (400×) |
试验证明,超表达LYRM1基因后,白洗猪皮下脂肪前体细胞经诱导培养,三酰甘油生成量大于空白对照组(图 7),在诱导培养24 h后,三酰甘油表达量达到最高,在24、48和96 h时分别达到显著差异水平(P < 0.05),表明高水平表达LYRM1基因可促进三酰甘油的生成,进而促进脂肪的沉积,与前期研究结果LYRM1基因超表达于肥胖者的腹网膜脂肪组织相统一[15]。

|
图 7 对照组细胞与转染试验组细胞三酰甘油浓度检测结果 Fig. 7 Triglyceride concentration in control group cells and transfection test group cells |
转染pEGFP-N3-LYRM1重组质粒后,进行血清饥饿法培养细胞,显微镜下观察;细胞边缘收缩,呈透明圆点状漂浮在培养基中,随晃动的培养基晃动表明细胞凋亡;未凋亡细胞呈梭形或多边形贴在培养瓶底部(图 8),当细胞死亡时,由于细胞膜结构发生破损,可透过台盼蓝染料,死亡或失去活力的细胞因此着色为蓝色,未死亡的细胞因不能透过台盼蓝染料呈透明状,倒置显微镜下放大100倍观察(图 9)。MTT比色法检测6孔细胞培养板中活细胞吸光度值,计算细胞凋亡速率,图 10为未凋亡细胞的吸光度值,结果表明,空白对照组细胞和转染试验组细胞凋亡速率一致,未见显著差异,表明超表达LYRM1基因不影响细胞的凋亡速度。

|
图 8 细胞凋亡观察(100×) Fig. 8 Cell apoptosis observation(100×) |

|
图 9 台盼蓝染色凋亡细胞(100×) Fig. 9 Trypan blue staining apoptotic cells(100×) |

|
图 10 对照组细胞与转染试验组细胞的凋亡检测 Fig. 10 Apoptosis detection of control group cells and transfection test group cells |
qRT-PCR检测脂肪沉积相关基因LYRM1、PPARγ、ATGL、FAS的mRNA表达水平,结果显示,转染试验组细胞LYRM1基因mRNA表达水平极显著高于空白对照组细胞(P < 0.01),表明转染成功。转染试验组细胞FAS、ATGL、PPARγ基因的mRNA表达水平极显著高于空白对照组(P < 0.01),表明超表达LYRM1基因可促进脂肪沉积相关基因的表达,间接促进脂肪的沉积(图 11)。
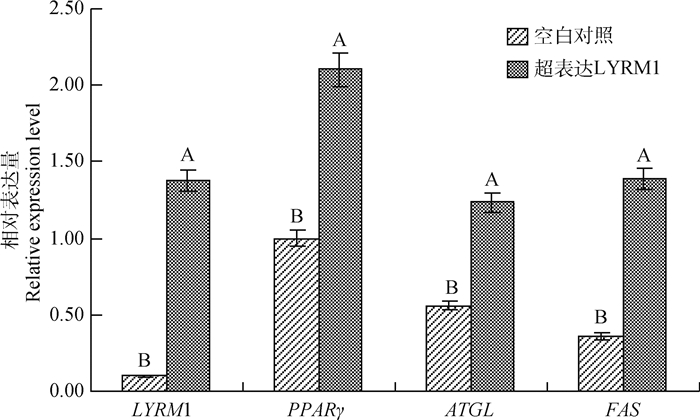
|
图 11 超表达LYRM1基因对脂肪沉积相关基因表达的影响 Fig. 11 Expression of genes related to fat deposition after overexpression of LYRM1 gene |
细胞是构成机体生命活动的基本单位,对细胞的深入研究是揭开生命奥秘的关键。Heams[16]从鸡胚中分离细胞被认为是组织细胞培养的萌芽,Harrison等[17]以青蛙淋巴液为培养基,成功培养蛙胚神经组织且长达数周,开辟了动物组织细胞体外培养的先例。脂肪组织主要由脂肪前体细胞、含血管内皮细胞的结缔组织和血细胞等组成,分离纯化单一的脂肪细胞成为探究脂肪沉积的准备工作。脂肪细胞经诱导分化后细胞内脂滴能够被油红O染为红色[18],本试验结果显示,细胞内形成红色脂滴,表明分离提取的细胞为皮下前体脂肪细胞。脂肪积累表现为脂肪细胞体积的增大和数目的增多[19],脂肪沉积相关基因LYRM1在白洗猪的心、肝、脾、肺、肾、胃、背最长肌及皮下脂肪中均有表达,但在皮下脂肪中表达量最高,且极显著高于其他组织,说明LYRM1基因在猪的组织中具有广泛表达性,但特异性高表达于皮下脂肪。白洗猪皮下脂肪前体细胞超表达LYRM1基因结果表明,超表达LYRM1基因可提高脂肪沉积相关基因PPARγ与FAS的mRNA表达水平,表明增加LYRM1基因的表达可协同促进脂肪沉积,也与LYRM1基因是从肥胖者腹网膜脂肪中筛选出的差异性高表达基因及高表达于人脂肪瘤诱导分化的后期结果相统一[20]。
脂肪前体细胞为未分化成熟的脂肪细胞,具有高度的增殖和分化能力[13],而脂肪沉积能力受脂肪细胞的数量、大小、分化和分解速度等因素影响[21]。超表达LYRM1基因荧光定位显示,其可能位于细胞核内,与Qiu等[6]对LYRM1蛋白的亚细胞定位分析及LYRM1的绿色荧光融合蛋白以及蛋白质印迹在细胞核中的亚细胞定位研究一致。Zhu等[22]研究表明,超表达LYRM1基因能够显著增加胚胎干细胞P19的增殖,调节细胞生长,抑制细胞凋亡和心发育的潜力;Chen等[8]研究显示,沉默LYRM1基因对P19细胞增殖有明显的抑制作用,流式细胞仪和caspase-3测量活性显示,沉默LYRM1后,P19细胞凋亡增加,抑制P19细胞向心肌细胞分化。本研究表明,白洗猪皮下脂肪前体细胞超表达LYRM1基因,血清饥饿法检测细胞凋亡,转染试验组细胞与空白对照组细胞凋亡速率大致相等,未出现显著差异,这是否和种属特异性有关还需进一步验证。
脂肪沉积由三酰甘油积累形成,三酰甘油含量的高低与脂肪沉积具有密切关系。研究表明,脂肪沉积的水平与血浆中三酰甘油浓度变化相一致,随其增加而增加,降低而减少[23-24]。邱洁[15]对人的前体细胞株超表达LYRM1基因研究显示,诱导分化第2天时,LYRM1基因的核酸和蛋白表达水平显著上调;LYRM1基因的mRNA表达量与游离脂肪酸的表达水平成正协同效应[7]。本研究结果显示,超表达LYRM1基因24 h后其mRNA水平显著高于空白对照组,诱导24 h后三酰甘油产生量达到最高值,试验结果与其一致。PPARγ基因处于脂肪调控网络的中心位置,不仅是调控脂肪组织中脂肪前体细胞分化的关键因子,在脂肪细胞分化早期也起到不可或缺的作用,可被胰岛素激活,促进脂肪合成[25-26]。LYRM1重组质粒转染皮下脂肪前体细胞24 h后检测脂肪沉积相关基因mRNA表达水平,结果显示,PPARγ mRNA表达水平最高且极显著高于对照组细胞的表达量(P < 0.01),表明超表达LYRM1基因,可极大的促进PPARγ mRNA表达,进而促进脂肪的分化与合成。相关研究表明,血清中三酰甘油的表达水平随PPARγ基因的mRNA表达水平的变化而变化[27],此结果与本试验对细胞培养基中三酰甘油的浓度检测结果相一致,表明超表达LYRM1基因可增加PPARγ mRNA表达水平,并协同增加三酰甘油的表达量;ATGL(三酰甘油脂肪酶)是近年来研究发现的启动脂肪动员分解的又一关键酶,被认为是三酰甘油水解过程的限速酶[28]。研究显示,其与三酰甘油的表达成动态变化,且存在时序差异[29],超表达LYRM1基因24 h后ATGL的表达水平极显著高于对照组(P < 0.01),三酰甘油浓度也显著高于对照组,诱导48 h后三酰甘油浓度下降,其是否与ATGL基因mRNA的表达水平提高有关,还需进一步验证;FAS活性的高低直接控制着动物合成脂肪能力的强弱,FAS表达水平的升髙能够显著增加三酰甘油在体内的沉积[30]。Jang[31]研究显示,三酰甘油的表达水平与PPARγ、FAS的蛋白表达量相一致。研究表明,FAS mRNA表达水平与三酰甘油的浓度相一致,但在3T3-L1细胞超表达LYRM1基因,结果显示,不显著增加PPARγ、FAS的mRNA表达水平,这是否与细胞不同有关还需进一步研究证实。本试验结果表明,超表达LYRM1基因可提高三酰甘油的生成水平,提高脂肪沉积相关基因PPARγ、ATGL、FAS的mRNA表达水平,间接促进脂肪沉积。
4 结论本研究通过构建pEGFP-N3-LYRM1重组质粒,并转染白洗猪皮下脂肪前体细胞,发现超表达LYRM1基因可提高皮下脂肪前体细胞三酰甘油的生成水平,但对细胞凋亡率无显著影响(P>0.05);对脂肪沉积相关基因的mRNA表达水平进行检测,结果显示可增加PPARγ、ATGL、FAS的mRNA表达水平,间接提高脂肪沉积水平,说明LYRM1基因对脂肪沉积具有一定的调控作用。因此,认为LYRM1基因可作为探究影响脂肪沉积的候选基因。
| [1] | ANGERER H. The superfamily of mitochondrial Complex1_LYR motif-containing (LYRM) proteins[J]. Biochem Soc Trans, 2013, 41(5): 1335–1341. DOI: 10.1042/BST20130116 |
| [2] | ANGERER H. Eukaryotic LYR proteins interact with mitochondrial protein complexes[J]. Biology, 2015, 4(1): 133–150. DOI: 10.3390/biology4010133 |
| [3] | ZHU G Z, ZHANG M, KOU C Z, et al. Effects of LYRM1 knockdown on mitochondrial function in 3T3-L1 murine adipocytes[J]. J Bioenerg Biomembr, 2012, 44(1): 225–232. DOI: 10.1007/s10863-012-9404-9 |
| [4] | KOU C Z, CAO X G, QIN D N, et al. Over-expression of LYRM1 inhibits glucose transport in rat skeletal muscles via attenuated phosphorylation of PI3K (p85) and Akt[J]. Mol Cell Biochem, 2011, 348(1-2): 149–154. DOI: 10.1007/s11010-010-0649-5 |
| [5] | CAO X G, KOU C Z, ZHAO Y P, et al. Overexpression of LYRM1 induces mitochondrial impairment in 3T3-L1 adipocytes[J]. Mol Genet Metab, 2010, 101(4): 359–399. |
| [6] | QIU J, GAO C L, ZHANG M, et al. LYRM1, a novel gene promotes proliferation and inhibits apoptosis of preadipocytes[J]. Eur J Endocrinol, 2009, 160(2): 177–184. DOI: 10.1530/EJE-08-0518 |
| [7] | ZHANG M, ZHAO H M, QIN Z Y, et al. Regulation of LYRM1 gene expression by free fatty acids, adipokines, and rosiglitazone in 3T3-L1 adipocytes[J]. Exp Diabetes Res, 2012, 2012: 820989. |
| [8] | CHEN Y M, LI X, SONG G X, et al. Effect of LYRM1 knockdown on proliferation, apoptosis, differentiation and mitochondrial function in the P19 cell model of cardiac differentiation in vitro[J]. J Bioenerg Biomembr, 2016, 48(1): 33–41. DOI: 10.1007/s10863-015-9638-4 |
| [9] |
朱冠忠, 朱金改, 史春梅, 等. LYRM1基因沉默对成熟脂肪细胞线粒体形态及其相关基因的影响[J]. 实用儿科临床杂志, 2012, 27(19): 1474–1476.
ZHU G Z, ZHU J G, SHI C M, et al. Influences of LYRM1 knockdown on mitochondrial morphology and mitochondria-related genes in murine adipocytes[J]. Chinese Journal of Applied Clinical Pediatrics, 2012, 27(19): 1474–1476. DOI: 10.3969/j.issn.1003-515X.2012.19.005 (in Chinese) |
| [10] | LI Y K, HUANGPU Y F, GAO J B, et al. New polymorphisms in the novel LYRM1 gene are associated with body measurement and meat quality traits in Qinchuan cattle[J]. Genet Mol Res, 2014, 13(3): 6926–6936. DOI: 10.4238/2014.March.12.18 |
| [11] |
吴丹, 刘冉冉, 赵桂苹, 等. 鸡体质量性状基因的全基因组关联研究[J]. 畜牧兽医学报, 2012, 43(12): 1887–1896.
WU D, LIU R R, ZHAO G P, et al. Genome-wide association study of genes affecting body weight in chicken[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(12): 1887–1896. (in Chinese) |
| [12] |
丁玫, 孙鹃, 杨忠诚, 等. 白洗猪种质特性的研究[J]. 黑龙江畜牧兽医, 2016(1): 77–80.
DING M, SUN J, YANG Z C, et al. Study on germplasm characteristics of Baixi pig[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(1): 77–80. (in Chinese) |
| [13] |
孙成娟, 许厚强, 段志强, 等. 从江香猪FoxO 4基因真核表达载体的构建及其在皮下脂肪前体细胞中的表达[J]. 畜牧兽医学报, 2017, 48(12): 2268–2276.
SUN C J, XU H Q, DUAN Z Q, et al. Construction of recombinant eukaryotic expression vector of FoxO 4 gene from Congjiang Xiang pig and its expression in subcutaneous preadipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(12): 2268–2276. (in Chinese) |
| [14] | FOROUTAN-RAD M, KHADEMVATAN S, SAKI J, et al. Holothuria leucospilota extract induces apoptosis in Leishmania major promastigotes[J]. Iran J Parasitol, 2016, 11(3): 339–349. |
| [15] |
邱洁. 人类肥胖相关新基因LYRM1的生物学特性及功能研究[D]. 南京: 南京医科大学, 2009.
QIU J. The biological characteristic and functional research of Lyrm1, a novel gene related with human obesity[D]. Nanjing: Nanjing Medical University, 2009. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10312-1010011682.htm |
| [16] | HEAMS T. Selection within organisms in the nineteenth century:Wilhelm Roux's complex legacy[J]. Prog Biophys Mol Biol, 2012, 110(1): 24–33. |
| [17] | HARRISON R G, GREENMAN M J, MALL F P, et al. Observations of the living developing nerve fiber[J]. Anat Rec, 2010, 1(5): 116–128. |
| [18] |
张宁芳, 成志敏, 乐宝玉, 等. 猪肌源性前体脂肪细胞的分离培养和成脂诱导分化研究[J]. 畜牧兽医学报, 2018, 49(12): 2612–2221.
ZHANG N F, CHENG Z M, LE B Y, et al. Isolation, culture and adipogenic differention of pig myogenic preadipocytes cell[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(12): 2612–2221. (in Chinese) |
| [19] |
曹功明. 葡萄糖和肾上腺素对大鼠前体脂肪细胞增殖分化及转录因子表达的影响[D]. 兰州: 西北民族大学, 2010.
CAO G M. The effects of glucose and epinephrine on pro-liferation, differentiation and transcription factor expression of rat preadipocytes[D]. Lanzhou: Northwest Minzu University, 2010. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10742-1011039987.htm |
| [20] | YIN C Y, XIAO Y F, ZHANG W, et al. DNA microarray analysis of genes differentially expressed in adipocyte differentiation[J]. J Biosci, 2014, 39(3): 415–423. DOI: 10.1007/s12038-014-9412-5 |
| [21] | DEPREESTER E, DE KOSTER J, VAN POUCKE M, et al. Influence of adipocyte size and adipose depot on the number of adipose tissue macrophages and the expression of adipokines in dairy cows at the end of pregnancy[J]. J Dairy Sci, 2018, 101(7): 6542–6555. DOI: 10.3168/jds.2017-13777 |
| [22] | ZHU C, LIU Y Q, CHEN F K, et al. LYRM1, a gene that promotes proliferation and inhibits apoptosis during heart development[J]. Molecules, 2010, 15(10): 6974–6982. DOI: 10.3390/molecules15106974 |
| [23] | KOBAYASHI S, TERASHIMA Y, ITOH H. The effects of dietary chitosan or glucosamine HCl on liver lipid concentrations and fat deposition in broiler chickens[J]. J Poult Sci, 2006, 43(2): 156–161. DOI: 10.2141/jpsa.43.156 |
| [24] | HANDAYANI D, CHEN J, MEYER B J, et al. Dietary shiitake mushroom (Lentinus edodes) prevents fat deposition and lowers triglyceride in rats fed a high-fat diet[J]. J Obes, 2011, 2011: 258051. |
| [25] | LEHRKE M L, LAZAR M A. The many faces of PPARγ[J]. Cell, 2005, 123(6): 993–999. DOI: 10.1016/j.cell.2005.11.026 |
| [26] | TONTONOZ P, SPIEGELMAN B M. Fat and beyond:The diverse biology of PPARγ[J]. Annu Rev Biochem, 2008, 77(1): 289–312. DOI: 10.1146/annurev.biochem.77.061307.091829 |
| [27] |
张岩. PPARα/γ信号通路在高脂性脂肪性肝炎发病机制中的作用研究[D]. 苏州: 苏州大学, 2015.
ZHANG Y. Studies on the role of PPARα/γ signaling pathway in the pathogenesis of hyperlipidemic steatohepatitis[D]. Suzhou: Suzhou University, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10285-1016027748.htm |
| [28] |
胡深强, 潘志雄, 王继文. 脂肪甘油三酯脂肪酶(ATGL)的生物学功能及调控机制[J]. 中国生物化学与分子生物学报, 2011, 27(8): 721–727.
HU S Q, PAN Z X, WANG J W. Biological functions and regulatory mechanism of adipose triacylglyceride lipase[J]. Chinese Journal of Biochemistry and Molecular Biology, 2011, 27(8): 721–727. (in Chinese) |
| [29] | ZIMMERMANN R, STRAUS J G, HAEMMERLE G, et al. Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J]. Science, 2004, 306(5700): 1383–1386. DOI: 10.1126/science.1100747 |
| [30] | SMITH S, WITKOWSKI A, JOSHI A K. Structural and functional organization of the animal fatty acid synthase[J]. Prog Lipid Res, 2003, 42(4): 289. DOI: 10.1016/S0163-7827(02)00067-X |
| [31] | JANG B C. Artesunate inhibits adipogeneis in 3T3-L1 preadipocytes by reducing the expression and/or phosphorylation levels of C/EBP-α, PPAR-γ, FAS, perilipin A, and STAT-3[J]. Biochem Biophys Res Commun, 2016, 474(1): 220–225. DOI: 10.1016/j.bbrc.2016.04.109 |



