毛囊是动物皮肤中重要的附属结构,是毛发生长和发育的基础[1]。毛发的生长是由多种调控信号分子参与的复杂过程[2],其中成纤维细胞生长因子(fibroblast growth factor, FGF)及其受体发挥着重要作用。根据生化功能、氨基酸序列相似性和进化关系,FGF家族可分为7个亚家族,其中FGF21属于FGF19(19、21、23)亚家族[3],根据现有研究可知,FGF19亚家族中某些成员在糖代谢及皮肤伤口愈合方面起重要作用[4]。FGF21作为近年来最新发现的家族成员,对其研究主要集中于肝及肥胖问题,对毛囊的作用几乎没有研究,仅有2016年张平[5]发现,FGF21在次级毛囊发育中促进转变成退行期。成纤维细胞生长因子受体家族(fibroblast growth factor receptors, FGFRs)由FGFR1、2、3、4组成,其中FGFR1、FGFR2是FGF21的已知受体[6],且均由跨膜域、细胞外配体结合域及胞内结构域组成,氨基酸序列相对保守且功能相近,可激活许多信号转导级联兴奋,调控毛发生长、胚胎发育、伤口愈合等。依据前期对小鼠毛囊周期结构的研究,结合本试验中小鼠毛囊生长情况,确定小鼠毛囊第1生长周期的划分大致为出生后第1~11天为毛囊生长期,第12~17天为毛囊退化期,第18~21天为毛囊静止期,第22天开始毛囊进入下个生长周期[7]。而在小鼠毛囊第1生长周期,FGF21及其受体FGFR1和FGFR2对毛囊生长周期的影响及作用未见报道。
本研究选取1、3、5、8、12、17、21、23日龄的小鼠作为试验材料,通过免疫组织化学、荧光定量PCR技术及蛋白免疫印迹技术,对FGF21及其受体FGFR1和FGFR2在小鼠不同时期背部皮肤中进行定位与定量分析,旨在探究FGF21及其受体FGFR1和FGFR2对小鼠毛囊第1生长周期的影响,为进一步揭示小鼠毛囊调控机制奠定基础。
1 材料与方法 1.1 试验动物从太原医科大学购买ICR小白鼠,饲养一段时间,待小鼠无明显应激反应后,在1个鼠笼中放入1只雄鼠与3只雌鼠,进行合笼饲养。取1、3、5、8、12、17、21和23日龄小鼠,每次随机选取3只日龄相同的小鼠处死后,取背部皮肤组织,将其分为3部分,其中2部分标记后放入液氮中保存,用于提取RNA和总蛋白,其余组织转移至Bouin氏固定液中,固定包埋后,制作6 μm厚的切片,用于免疫组化分析。
1.2 材料FGF21兔抗单克隆抗体(abcam,ab171941);FGFR1兔抗多克隆抗体(BBI,D120628);FGFR2兔抗多克隆抗体(Thermo Fisher,CD332);兔Streptavidin-HRP试剂盒(康为公司);Trizol Reagent(Invitrogen公司);SYBR Premix Ex Taq Ⅱ;PrimeScriptTM RT reagent Kit with gDNA Eraser (TaKaRa);RIPA蛋白裂解液和凝胶制备试剂盒(碧云天公司);HRP-山羊抗兔IgG,HRP-山羊抗鼠IgG,β-actin鼠抗单克隆抗体,eECL Western blot Kit高灵敏度化学发光检测试剂盒(康为公司)。
1.3 免疫组织化学以兔Streptavidin-HRP试剂盒的说明书作为指南,将脱蜡后的组织切片与试剂一起孵育。将组织切片的一侧与下列抗体孵育:兔抗FGF21单克隆抗体(1:500),兔抗FGFR1多克隆抗体(1:300),兔抗FGFR2多克隆抗体(1:800),另一侧滴加同样体积的PBS缓冲液,4 ℃过夜。室温放置30 min,将组织切片置摇床上用PBS缓冲液冲洗3 min×3次。滴加羊抗兔二抗工作液,室温放置10 min。洗涤后,将组织切片分别滴加DAB显色液,随时观察显色状况,将染色控制在最佳效果。用LEICA DM LB2的Leica光学显微镜采集图像。
1.4 实时荧光定量PCR使用TRIzol LS试剂,从不同天数的小鼠皮肤组织的样品中分离总RNA。使用NanoDrop 1000微量核酸蛋白测定仪(NanoDrop Technologies)测定总RNA浓度。使用PrimeScriptTM RT reagent Kit with gDNA Eraser合成FGF21、FGFR1、FGFR2互补DNA(cDNA)。用SYBR Premix Ex TaqTMII扩增特异性DNA序列。根据基因的扩增动力学曲线确定扩增效果。通过2-△△CT计算小鼠胚胎期FGF21、FGFR1、FGFR2基因的表达差异。引物序列见表 1。
|
|
表 1 目的基因与内参β-actin引物序列 Table 1 Primer sequences of target genes and β-actin |
取液氮保存的小鼠皮肤组织,按总蛋白提取试剂盒提供的操作步骤提取小鼠皮肤的总蛋白,使用ND-1000微量核酸蛋白测定仪测定其浓度。每个样品的总蛋白量为300 μg,在12%的SDS-PAGE中进行电泳分离,转移至NC膜。将NC膜放入5%的脱脂蛋白干粉封闭1 h,4 ℃孵育一抗过夜(FGF21兔抗单克隆抗体1:1 000;FGFR1兔抗多克隆抗体1:500;FGFR2兔抗多克隆抗体1:500;β-actin鼠抗单克隆抗体1:3 000)。次日复温30 min后,用TBST洗膜10 min×3次。加入经TBST溶液稀释的二抗(1:10 000,HRP-山羊抗兔IgG、HRP-山羊抗鼠IgG),37 ℃孵育1 h。用TBST洗膜5 min×6次。运用ECL试剂盒在暗室中进行曝光之后对其信号条带扫描。利用Image J分析FGF21、FGFR1、FGFR2蛋白和β-actin蛋白条带灰度值。
1.6 数据分析利用2-ΔΔCT法计算基因表达量,免疫组化光密度值、实时荧光定量PCR、Western blot统计结果利用SPSS17.0统计分析软件进行单因素方差分析。P<0.05表示差异显著,P<0.01表示差异极显著。
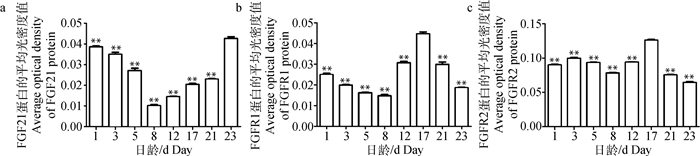
2 结果 2.1 FGF21、FGFR1和FGFR2在小鼠背部皮肤组织中的定位 2.1.1 FGF21在小鼠背部皮肤组织中的定位免疫组织化学结果显示,FGF21主要表达于毛囊毛乳头、毛基质、内外根鞘以及毛囊周围的结缔组织中(图 1)。在1日龄小鼠的毛乳头及毛囊周围的结缔组织中FGF21有较强阳性反应,其中阳性反应是指相对于阴性对照组变黄的部分(图 1 A)。在3日龄小鼠的毛基质、毛乳头、内根鞘及毛囊周围的结缔组织中检测到阳性反应(图 1 B)。在5日龄小鼠的毛乳头、毛基质、外根鞘及毛囊周围结缔组织中均有阳性反应(图 1 C)。在8日龄小鼠的内外根鞘及毛乳头中有阳性反应,但在毛囊周围结缔组织中几乎没有阳性反应(图 1 D)。12日龄小鼠毛基质和内外根鞘有阳性反应,毛囊周围结缔组织中几乎没有阳性反应(图 1 E)。17及21日龄小鼠的毛乳头、内外根鞘及毛囊周围结缔组织中有阳性反应(图 1 F~G)。23日龄小鼠主要在毛囊周围结缔组织处有阳性反应(图 1 H)。在对照组均未见FGF21的阳性反应(图 1 a~h)。光密度数据分析结果显示,FGF21蛋白在1~5日龄表达量较高;23日龄表达量最高,极显著高于其他日龄的表达量(P<0.01,图 4 a)。

|
A~H.试验组;a~h.对照组。A和a.1 d;B和b.3 d;C和c.5 d;D和d.8 d;E和e.12 d;F和f.17 d;G和g.21 d;H和h.23 d。1.毛乳头;2.毛基质;3.内根鞘;4.外根鞘;5.皮脂腺。下同 A-H.Experimental groups; a-h.Control groups. A and a.1 d; B and b.3 d; C and c.5 d; D and d.8 d; E and e.12 d; F and f.17 d; G and g.21 d; H and h.23 d.1.Dermal papilla; 2.Hair matrix; 3.Inner root sheath; 4.Outer root sheath; 5.Sebaceous gland. The same as below 图 1 FGF21蛋白在小鼠背部皮肤组织中的定位(20×) Fig. 1 Localization of FGF21 protein in mice back skin(20×) |

|
图 2 FGFR1蛋白在小鼠背部皮肤组织中的定位(20×) Fig. 2 Localization of FGFR1 protein in mice back skin(20×) |

|
图 3 FGFR2蛋白在小鼠背部皮肤组织中的定位(20×) Fig. 3 Localization of FGFR2 protein in mice back skin(20×) |
|
与23日龄比较(a),与17日龄比较(b、c): *.P<0.05,**.P<0.01。下同 Compared to 23(a), 17(b, c)day old: *.P < 0.05, **.P < 0.01.The same as below 图 4 FGF21(a)、FGFR1(b)和FGFR2(c)蛋白在小鼠皮肤的平均光密度分析 Fig. 4 Average optical density analysis of FGF21 (a), FGFR1 (b) and FGFR2 (c) proteins in mice skin |
免疫组织化学结果显示,FGFR1在毛囊各部均有表达(图 2)。在1、3、5、8、21、23日龄小鼠毛乳头,毛基质,内外根鞘,毛囊周围的结缔组织中有阳性反应(图 2 A~D,G~H),在12、17日龄小鼠毛基质,内外根鞘处有很强的阳性反应,而毛囊周围结缔组织中阳性反应较弱,在21日龄小鼠的内外根鞘处有较强的阳性反应(图 2 E~G)。在对照组均未见FGFR1的阳性反应(图 2 a~h)。光密度数据分析结果显示,FGFR1蛋白在1、3、5、8、12、21、23日龄的表达量极显著低于17日龄小鼠(P<0.01,图 4 b)。
2.1.3 FGFR2在小鼠背部皮肤组织中的定位免疫组织化学结果显示,FGFR2在小鼠背部皮肤毛乳头、毛基质、内外根鞘、周围结缔组织中广泛表达(图 3A~H),在对照组均未见FGFR2的阳性反应(图 3 a~h)。光密度数据分析结果显示,FGFR2蛋白在1、3、5、8、12、21和23日龄的表达量极显著低于17日龄小鼠(P<0.01图 4 c)。
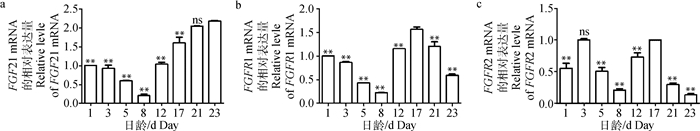
2.2 FGF21、FGFR1和FGFR2 mRNA在小鼠背部皮肤中的表达通过实时荧光定量PCR检测FGF21、FGFR1和FGFR2 mRNA在小鼠背部皮肤中的相对表达量,β-actin作为内参基因。结果见图 5,FGF21在1、3、5、8、12、17日龄的表达量极显著低于23日龄(P<0.01),在21日龄的表达量低于23日龄,差异不显著(P>0.05,图 5 a)。FGFR1在1、3、5、8、12、21、23日龄的表达量极显著低于17日龄(P<0.01,图 5 b)。FGFR2在1、5、8、12、21和23日龄的表达量极显著低于17日龄(P<0.01),在3日龄的表达量低于17日龄,差异不显著(P>0.05,图 5 c)。
|
ns. P>0.05,下同 ns. P > 0.05, The same as below 图 5 FGF21(a)、FGFR1(b)和FGFR2(c)mRNA在小鼠皮肤的相对表达量 Fig. 5 Relative expression of FGF21 (a), FGFR1 (b) and FGFR2 (c) mRNA in mice skin |
通过Western blot检测小鼠背部皮肤组织中的蛋白表达量发现:在不同日龄小鼠背部皮肤中均有FGF21、FGFR1、FGFR2蛋白的存在,大小分别为22、92、92 ku(图 6A)。FGF21在1~5日龄和23日龄表达量较高,即FGF21在毛囊第1生长周期的生长期表达量高于退化期和静止期。FGF21蛋白在1、3、5、8、12、17和21日龄的表达量极显著低于23日龄小鼠(P<0.01,图 6B)。FGFR1的表达量从12日龄开始上升,在17日龄时达到最高,之后又呈下降趋势,即从生长期末至退化期FGFR1表达量逐渐增加,但进入静止期时,FGFR1表达量开始减少。FGFR1蛋白在1、3、5、8和23日龄的表达量极显著低于17日龄的小鼠(P<0.01),在12和21日龄的表达量低于17日龄小鼠,差异不显著(P>0.05,图 6C)。FGFR2在1~17日龄都有较高表达。FGFR2蛋白在1、5、8、12、21和23日龄的表达量极显著低于17日龄小鼠(P<0.01),在3日龄表达量低于17日龄,差异不显著(P>0.05)(图 6D)。

|
A.Western blot检测; B. FGF21;C. FGFR1;D. FGFR2 A. Western blot test; B. FGF21;C. FGFR1;D. FGFR2 图 6 FGF21、FGFR1和FGFR2蛋白在小鼠皮肤的相对表达量 Fig. 6 Relative expression of FGF21, FGFR1 and FGFR2 proteins in mice skin |
出生后小鼠毛囊的生长发育表现出一种周期性的活动模式,这种周期性循环的模式称为毛发周期,包括生长期、退化期和静止期[8]。在生长期,干细胞被激活,临近真皮乳头的细胞增殖,毛球形成。随后内根鞘和毛干分化,毛囊生长。在退化期,分化停止,毛乳头缩小,毛基质与毛乳头分离。毛囊进入静止期,此时没有重要的增殖、凋亡、分化,真皮乳头位于干细胞附近,毛囊进入休眠期[9]。
FGF21是FGF家族的新成员,是一种可分泌蛋白[10]。肝被认为是FGF21产生和释放入血液的主要部位[11]。通过免疫组织化学试验发现:FGF21主要表达于毛乳头、毛基质、内外根鞘以及毛囊周围的结缔组织中。而毛乳头、毛基质、内外根鞘是毛囊结构的主要构成成分,表明FGF21对于毛囊发育有至关重要的作用。而且FGF21在结缔组织中的表达呈周期性变化,在生长期前期表达量较高,随着周期进行表达量逐渐降低直到静止期,从静止期开始到下个生长周期前期,FGF21在毛囊周围结缔组织中的表达呈上升趋势,随后再次开始降低。已有研究发现毛囊周围结缔组织对毛囊的发育有影响[12]。结合毛囊周期性变化的形态特征[9]推测FGF21对参与毛囊形成的成纤维细胞的增殖和分化具有重要作用,且主要作用于生长期。实时荧光定量PCR和Western blot结果表明,FGF21在1~5和23日龄表达量较高,即FGF21在毛囊第1生长周期的生长期表达量高于退化期和静止期,表明FGF21在毛囊第1生长周期的生长期发挥着重要作用。FGF21在糖代谢过程通过MAPK途径发挥重要作用[13],Holland等[14]也发现,FGF21通过FGF21-脂联素-神经酰胺轴控制小鼠的能量消耗和胰岛素作用。推测FGF21在毛囊周围组织中通过各种信号通路调节,为毛囊发育提供能量,促使毛基质与毛乳头分离,从而诱导毛囊由生长期进入退化期。
FGFR1是一种酪氨酸激酶受体, 通过与成纤维细胞生长因子结合,可以激活下游的一系列通路[15]。通过免疫组织化学试验发现:FGFR1在毛囊中呈现广泛性表达,在退化期和静止期主要表达于内外根鞘中。Goodman[16]指出,在毛囊形成及发育过程中,角质细胞生长使包裹毛干的内根鞘结构致密,与毛囊峡部确定了毛囊生长方向。结合试验结果推测FGFR1在毛囊第1生长周期中,对内外根鞘细胞的增殖、分化有着明显作用,同时影响着被毛生长方向。Pirvola等[17]研究发现,FGFR1是感觉上皮细胞(包括毛细胞和支持细胞)发育所必需的。毛发周期受各种分子调节,其中FGF5促进毛囊从生长期到退化期的转变。而FGFR1是具有酪氨酸激酶活性的FGF5的跨膜受体,定位于毛囊的毛囊乳头中[18]。推测FGFR1与FGF5对毛发周期具有相似作用。结合实时荧光定量PCR和Western blot结果,FGFR1的表达量从12日龄开始上升,在17日龄时达到最高,之后又呈下降趋势。表明生长期末到退化期FGFR1表达量逐渐增加,但进入静止期时,FGFR1表达量开始减少。FGFR1在毛囊第1生长周期的退化期与静止期表达量明显高于生长期。表明FGFR1在毛囊第1生长周期的退化期和静止期发挥重要作用。推测FGFR1诱导毛囊由退化期进入静止期。
FGFR2也作为酪氨酸激酶受体家族成员之一,在正常细胞活动信号转导中起着重要的作用[19]。FGFR2b表达于表皮角质形成细胞,毛囊和皮脂腺[20]。FGFR2b缺失会导致毛囊形成迟钝并减少[21]。通过免疫组织化学试验发现:像FGFR1一样,FGFR2在小鼠背部皮肤毛乳头、毛基质、内外根鞘、毛囊周围结缔组织中广泛表达,这与前人研究结果一致。Mansukhani等[22]发现,FGFR2可以控制成骨细胞增殖和分化。除此以外,FGFR2-IIIb信号传导对毛囊所需前体细胞数量有调节作用,对毛囊发育的分析表明,缺乏FGFR2-IIIb的小鼠在毛囊的数量和分布方面都表现出缺陷,并且产生异常毛发[23]。推测FGFR2对毛囊内细胞增殖、分化具有重要作用。FGF10是FGFR2的一种配体[24]。牛姝等[7]发现,FGF10可能对于诱导小鼠毛囊进入新的循环周期起重要作用,推测FGFR2可能有相似功能。FGFR2是FGF21的功能受体之一,在多种信号通路中受到FGF21的调控[6]。本研究结合实时荧光定量PCR和Western blot结果,FGFR2在1~17日龄都有较高表达,表明FGFR2在生长期和退化期发挥主要作用。推测FGFR2通过与FGF21的受配体作用,产生相关信号因子,诱导毛囊内细胞分化、凋亡,促使毛囊由生长期和退化期进入静止期。
FGF21、FGFR1和FGFR2 mRNA和蛋白表达趋势十分相似,但不完全相同,表达趋势十分相似表明FGF21与FGFR1和FGFR2可能有配受体关系,这与任桂萍等[6]的研究结果一致。不完全相同表明FGF21与FGFR1、FGFR2可能不是直接的配受体关系。有研究表明,FGF21并不能与FGFR直接结合,还需要跨膜蛋白KLB的辅助,FGF21才能发挥作用[25]。也就是说FGF21传导信号需要FGFR与KLB共同介导。FGF21与FGFR1、FGFR2之间的具体作用机制仍需进一步研究证实。
4 结论在小鼠毛囊第1生长周期中,FGF21、FGFR1和FGFR2对毛囊发育均有重要作用。FGF21对于参与毛囊形成的成纤维细胞的增殖和分化具有重要作用,诱导毛囊由生长期进入退化期;FGFR1对内外根鞘细胞的增殖、分化有明显作用,诱导毛囊由退化期进入静止期;FGFR2对毛囊内细胞增殖、分化具有重要作用,诱导毛囊由生长期和退化期进入静止期。
| [1] |
王春亮, 贺建宁, 程明, 等. Eph家族在哺乳动物皮肤毛囊中的研究进展[J]. 中国畜牧杂志, 2015, 51(17): 86–90.
WANG C L, HE J N, CHENG M, et al. Research progress on eph family in hair follicle of mammalian skin[J]. Chinese Journal of Animal Science, 2015, 51(17): 86–90. DOI: 10.3969/j.issn.0258-7033.2015.17.018 (in Chinese) |
| [2] |
姜维.太行黑山羊毛囊生长-退行期皮肤组织差异表达基因的筛选与鉴定[D].杨凌: 西北农林科技大学, 2012.
JIANG W.Screening and identifying regulatory genes associated with Taihang black goat hair follicle anagen-catagen transition[D]. Yangling: Northwest A&F University, 2012. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-1012437604.htm |
| [3] | BEENKEN A, MOHAMMADI M. The structural biology of the FGF19 subfamily[J]. Adv Exp Med Biol, 2012, 728: 1–24. DOI: 10.1007/978-1-4614-0887-1 |
| [4] | TOMIYAMA K I, MAEDA R, URAKAWA I, et al. Relevant use of Klotho in FGF19 subfamily signaling system in vivo[J]. Proc Natl Acad Sci U S A, 2010, 107(4): 1666–1671. DOI: 10.1073/pnas.0913986107 |
| [5] |
张平.利用CRISPR-Cas9技术构建FGF21基因敲除小鼠及其对毛发生长的作用研究[D].呼和浩特: 内蒙古大学, 2016.
ZHANG P.Construction of FGF21 knockout mice using the CRISPR-Cas9 system and the study of its effect of hair growth action[D]. Hohhot: Inner Mongolia University, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10126-1016122693.htm |
| [6] |
任桂萍, 尹杰超, 王文飞, 等. FGF受体-1和FGF受体-2介导成纤维细胞生长因子-21信号传导[J]. 中国科学:生命科学, 2010, 40(4): 332–341.
REN G P, YIN J C, WANG W F, et al. Fibroblast growth factor (FGF)-21 signals through both FGF receptor-1 and 2[J]. Science China: Life Sciences, 2010, 40(4): 332–341. (in Chinese) |
| [7] |
牛姝, 程笳琪, 高淑媛, 等. FGF7亚家族在小鼠毛囊第一生长周期的表达[J]. 畜牧兽医学报, 2018, 49(3): 515–524.
NIU S, CHENG J Q, GAO S Y, et al. Expression profile of fibroblast growth factor 7 sub-family in the first hair follicle cycle of mice skin[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(3): 515–524. (in Chinese) |
| [8] |
王宁, 李进, 雷明星, 等.c-Myc在小鼠毛囊形成和毛发生长过程中的作用研究[C]//中华医学会医学细胞生物学分会第三届全国学术会议论文集.南宁: 中华医学会, 2011.
WANG N, LI J, LEI M X, et al.The role of c-Myc in mouse hair follicle formation and hair growth[C]//National Academic Conference of Medical Cell Biology Branch of Chinese Medical Association.Nanning: Chinese Medical Association, 2011. (in Chinese) |
| [9] |
马馨, 陈洋, 姜怀志. 哺乳动物毛囊结构特征及调控机制[J]. 中国草食动物科学, 2013, 33(1): 53–56.
MA X, CHEN Y, JIANG H Z. Structural characteristics of hair follicles and its regulation mechanism in mammals[J]. China Herbivore Science, 2013, 33(1): 53–56. DOI: 10.3969/j.issn.2095-3887.2013.01.015 (in Chinese) |
| [10] |
付宏歧.利用转基因烟草和红花表达成纤维细胞生长因子21(FGF21)的研究[D].长春: 吉林农业大学, 2011.
FU H Q.Expression of fibroblast growth factor 21(FGF21) in transgenic tobacco and safflower[D]. Changchun: Jilin Agricultural University, 2011. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10193-1011211211.htm |
| [11] | HONDARES E, IGLESIAS R, GIRALT A, et al. Thermogenic activation induces FGF21 expression and release in brown adipose tissue[J]. J Biol Chem, 2011, 286(15): 12983–12990. DOI: 10.1074/jbc.M110.215889 |
| [12] | JULIAN D, MBBS S, LRCP M. Micrograft size and subsequent survival[J]. Dermatol Surg, 1997, 23(9): 757–762. DOI: 10.1111/j.1524-4725.1997.tb00411.x |
| [13] | CHAPNIK N, GENZER Y, FROY O. Relationship between FGF21 and UCP1 levels under time-restricted feeding and high-fat diet[J]. J Nutr Biochem, 2017, 40: 116–121. DOI: 10.1016/j.jnutbio.2016.10.017 |
| [14] | HOLLAND W L, ADAMS A C, BROZINICK J T, et al. An FGF21-adiponectin-ceramide axis controls energy expenditure and insulin action in mice[J]. Cell Metab, 2013, 17(5): 790–797. DOI: 10.1016/j.cmet.2013.03.019 |
| [15] | BROOKS A N, KILGOUR E, SMITH P D. Molecular pathways:fibroblast growth factor signaling:a new therapeutic opportunity in cancer[J]. Clin Cancer Res, 2012, 18(7): 1855–1862. DOI: 10.1158/1078-0432.CCR-11-0699 |
| [16] | GOODMAN L. Getting under your skin[J]. J Clin Invest, 2004, 113(8): 1073. DOI: 10.1172/JCI21697 |
| [17] | PIRVOLA U, YLIKOSKI J, TROKOVIC R, et al. FGFR1 is required for the development of the auditory sensory epithelium[J]. Neuron, 2002, 35(4): 671–680. DOI: 10.1016/S0896-6273(02)00824-3 |
| [18] | TSUBOI R, YAMAZAKI M, MATSUDA Y, et al. Antisense oligonucleotide targeting fibroblast growth factor receptor (FGFR)-1 stimulates cellular activity of hair follicles in an in vitro organ culture system[J]. Int J Dermatol, 2007, 46(3): 259–263. |
| [19] |
魏文珍. 成纤维细胞生长因子受体2在胃癌中的研究进展[J]. 医学综述, 2016, 22(12): 2331–2334.
WEI W Z. Research progress of FGFR2 and gastric cancer[J]. Medical Recapitulate, 2016, 22(12): 2331–2334. DOI: 10.3969/j.issn.1006-2084.2016.12.013 (in Chinese) |
| [20] | KELLER U A D, KRAMPERT M, KVMIN A, et al. Keratinocyte growth factor:effects on keratinocytes and mechanisms of action[J]. Eur J Cell Biol, 2004, 83(11-12): 607–612. DOI: 10.1078/0171-9335-00389 |
| [21] | RICHARDSON G D, BAZZI H, FANTAUZZO K A, et al. KGF and EGF signalling block hair follicle induction and promote interfollicular epidermal fate in developing mouse skin[J]. Development, 2009, 136(13): 2153–2164. DOI: 10.1242/dev.031427 |
| [22] | MANSUKHANI A, AMBROSETTI D, HOLMES G, et al. Sox2 Induction by FGF and FGFR2 activating mutations inhibits wnt signaling and osteoblast differentiation[J]. J Cell Biol, 2005, 168(7): 1065–1076. DOI: 10.1083/jcb.200409182 |
| [23] | PETIOT A, CONTI F J A, GROSE R, et al. A crucial role for FGFR2-Ⅲb signalling in epidermal development and hair follicle patterning[J]. Development, 2003, 130(22): 5493–5501. DOI: 10.1242/dev.00788 |
| [24] | ARMAN E, HAFFNER-KRAUSZ R, GORIVODSKY M, et al. Fgfr2 is required for limb outgrowth and lung-branching morphogenesis[J]. Proc Natl Acad Sci U S A, 1999, 96(21): 11895–11899. DOI: 10.1073/pnas.96.21.11895 |
| [25] | KHARITONENKOV A, DUNBAR J D, BINA H A, et al. FGF-21/FGF-21 receptor interaction and activation is determined by βKlotho[J]. J Cell Physiol, 2008, 215(1): 1–7. DOI: 10.1002/jcp.v215:1 |



