2. 贵州大学动物疫病研究所, 贵阳 550025;
3. 贵州省动物疫病研究室, 贵阳 550025;
4. 贵州省畜禽资源遗传管理站, 贵阳 550025;
5. 贵州都匀市动物疫病预防控制中心, 都匀 558000
2. Institute of Animal Diseases, Guizhou University, Guiyang 550025, China;
3. Guizhou Animal Disease Laboratory, Guiyang 550025, China;
4. Guizhou Province Livestock and Poultry Resource Genetic Management Station, Guiyang 550025, China;
5. Animal Disease Prevention and Control Center of Duyun City, Duyun 558000, China
沙门菌(Salmonella)是革兰阴性杆菌中的一种,具有极强的感染力与致病性,能够导致人、畜禽的一系列诸如伤寒、腹泻等的肠道细菌类疾病[1-2]。该种类细菌在自然界之中广泛存在,菌型种类较多,在当前已达2 600余种,在我国已出现了300个血清型的相关报道[3-4]。而sRNA是近年来发现的可被转录但不编码蛋白质的一类RNA分子,大小一般为30~500 nt[5],可分为顺式编码sRNA与反式编码sRNA。其中反式编码sRNA在一种保守的RNA分子伴侣蛋白Hfq协同作用下,进行对细菌生长增殖、糖转运[6]、压力应答、营养物质吸收、毒性毒力和环境应激等基因的表达[7]。Hfq蛋白能够通过调节sRNAs与靶标mRNAs的互作来调节mRNAs的稳定性,也可以通过结合靶标mRNAs的poly(A)尾, 促进poly(A)的腺苷酰化作用, 导致靶标mRNAs的降解, 从而进一步调控一些功能蛋白的表达[8]。当伴侣蛋白Hfq缺失时,细菌的调控会出现改变,从而致使细菌信号通路发生改变。正是因为拥有复杂精密的信号通路来应对环境变化,细菌才能够在动植物无法存活的恶劣环境生长。
细菌趋化系统是一个依赖于偶联蛋白的典型信号转导系统,能反映细菌寻找食源和逃避毒性环境的能力。细菌趋化性,能够使细菌进行朝向或远离特定化学物质的运动,有运动能力的细菌其膜表面存在各种具有专一性的化学受体,细菌可以通过它们检测到胞外环境中化学物质浓度的变化,并通过胞内的信号传递系统将感应到的化学信息转变成细胞内的信号,从而控制细菌鞭毛的运动方向,蛋白质的磷酸化级联机制控制着细菌体内趋化性信号处理和传递[9-10],产生趋向或逃避的行为,在生存上更具竞争力,对细菌生物膜的形成、致病机制具有重要作用[11]。细菌分泌依赖分泌通路进行蛋白质跨胞浆膜(即内膜)转运,其分泌独立因子以帮助细菌更好地在宿主体内生存、繁殖和扩散。在目前,已经发现了九种分泌系统,其中T3SS(the type Ⅲ secretion system,也作TTSS)是所有已知蛋白分泌系统中最复杂的[12-13]。细菌可利用T3SS将效应蛋白直接注入到宿主细胞细胞质中,从而调节宿主细胞功能、信号转导途径,破坏宿主防御机制,促进细菌增殖,导致疾病的发生。在沙门菌中,有两种T3SS:一为入侵宿主细胞,建立含沙门菌的液泡(SCV),抑制宿主细胞凋亡的SPI-1 T3SS;二为操纵SCV的运输和成熟,促进细胞内生存与复制的SPI-2 T3SS。而细菌双组分通路同样是细菌中重要的信号通路之一,广泛存在于原核和真核细胞中的信号转导通路中,调控了细菌绝大多数生理过程,包括细菌的趋化性、感知渗透压、孢子的形成、营养元素的代谢以及次级代谢产物的生物合成等,在细菌入侵宿主时会对环境持续进行监控,根据环境各种理化因素的变化调节自身的结构和生理行为,以适应新环境和更好地生存繁殖。
因此,在鼠伤寒沙门菌hfq基因缺失株转录组测序结果[14]的基础上,使用实时荧光定量PCR验证转录组测序结果,并且对细菌的趋化性通路、细菌双组分通路、细菌分泌通路进行深入分析,筛选出相关的重要调控基因,为鼠伤寒沙门菌sRNA及其伴侣蛋白Hfq的调控机制研究和沙门菌的防控工作提供理论依据。
1 材料与方法 1.1 试验菌株鼠伤寒沙门菌标准株LT2、鼠伤寒沙门菌hfq基因缺失株(基因型yifk::MudK △hfq::cat)(人为构建[15]),均由法国国家科学研究中心(CNRS)分子遗传学Bossi实验室馈赠。
1.2 主要试剂Trizol、PrimeScriptTMII1st strand cDNA Synthesis Kit、SYBR®Premix Ex TaqTMII(Tli RNaseH Plus),均购自大连宝生物(TaKaRa)公司。
1.3 转录组测序结果验证随机选择5个差异表达基因,根据GenBank上的基因序列,设计引物(表 1)。
|
|
表 1 验证引物序列 Table 1 Sequence of validation primers |
按Trizol法提取说明书,提取鼠伤寒沙门菌标准株和hfq基因缺失株的RNA,再根据cDNA合成试剂盒说明进行反转录。
将提取到的对数期、稳定期鼠伤寒沙门菌标准株和鼠伤寒沙门菌hfq基因缺失株总RNA样本反转录后得到的cDNA作为模板,参考SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒说明书,进行两步法反应,反应条件为:扩增条件为95 ℃预变性30 s后,进入95 ℃变性5 s和51~60 ℃退火30 s的40个循环;每个样本进行3次重复。
对样本数值按照2-△△Ct法,计算相关基因mRNA转录水平,即Fold change,△Ct=目的基因的Ct值-相应cDNA模板的内参基因Ct值,△△Ct=目的基因的Ct值-参考基因的△Ct值,结果进行显著性分析。结果用GraphPad统计软件,数据按x±s形式以图形表示(Livak&Schmittgen,2001)。
1.4 鼠伤寒沙门菌hfq基因缺失株相关基因的筛选为筛选鼠伤寒沙门菌hfq基因缺失株相关重要调控基因,本研究首先在差异表达基因参与的GO-Term及Pathway信号通路基础上,筛选与鼠伤寒沙门菌hfq基因已知调控功能相关的生物学过程及信号通路,再筛选鼠伤寒沙门菌hfq基因缺失株在对数期和稳定期均差异表达的较重要表达基因,最后将较重要表达基因映射这些生物学过程与信号通路,筛选鼠伤寒沙门菌sRNA伴侣蛋白Hfq的相关重要调控基因。
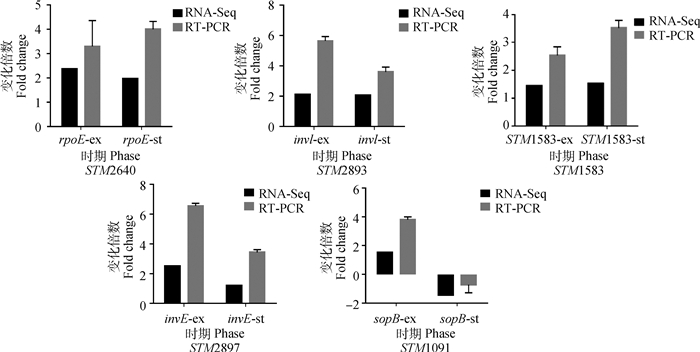
2 结果 2.1 鼠伤寒沙门菌hfq基因缺失株转录组测序结果可靠性验证为验证转录组测序结果的可靠性,本研究随机选取差异表达基因5个:STM2640、STM2893、STM1583、STM2897和STM1091基因,以GAPDH为内参基因,采用实时荧光定量PCR方法检测对数期和稳定期的鼠伤寒沙门菌标准株与hfq基因缺失株5个以上差异表达基因的表达情况,结果见图 1。结果显示5个差异表达基因的相对表达量与转录组测序结果基本一致,说明测序结果可靠。
|
ex.对数期;st.稳定期 ex.Exponential growth phase; st.Stationary phase 图 1 5个差异表达基因的RT-PCR验证 Fig. 1 Verification of 5 differentially expressed genes by RT-PCR |
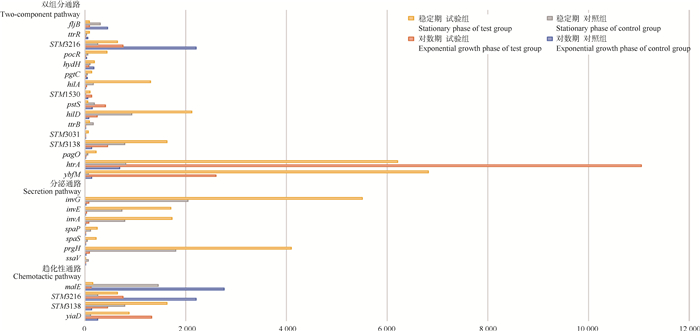
统计对数期和稳定期富集在细菌趋化性通路的差异表达基因,对数期有20个差异表达基因,筛选出显著差异表达基因12个,其中显著上调基因2个,显著下调基因10个;稳定期有6个显著差异表达基因,其中显著上调基因4个,显著下调基因2个;在对数期的表达量中,yiaD和STM3138这2个基因出现不同程度的表达量上调;STM3216和malE这2个基因出现不同程度的表达量下调,在稳定期的表达量中,yiaD、STM3138和STM3216这3个基因出现不同程度的表达量上调,而malE基因出现不同程度的表达量下调。如图 2所示,在细菌趋化性通路有4个基因在两个时期均出现差异表达,分别是yiaD、STM3138、STM3216和malE基因,其中对数期、稳定期中上调基因均以编码外膜脂蛋白的yiaD基因表达量差异变化最大。
|
图 2 细菌不同时期共表达基因表达量 Fig. 2 Coexpression of gene expression levels in different phases of bacteria |
统计对数期和稳定期富集在细菌分泌通路的差异表达基因,对数期共筛选出11个差异表达基因,其中显著上调基因10个,显著下调基因1个;稳定期共筛选出15个差异表达基因,其中显著上调基因7个,显著下调基因8个;对数期中上调基因以编码ATP合成酶SpaL的invG基因表达量差异变化最大,下调基因以编码细胞质蛋白质的STM3131基因表达量差异变化最大;稳定期中上调基因以Ⅲ型分泌系统蛋白SpaS的spaS基因表达量差异变化最大,下调基因中以编码Ⅲ型分泌系统蛋白SsaM的ssaM基因表达量差异变化最大。如图 2所示,在细菌分泌通路中有7个基因在两个时期均出现差异表达,分别是spaP、invA、prgH、invE、spaS、invG和ssaV基因。在两个时期均有6个基因出现不同程度的表达量上调,分别是spaP、invA、invE、spaS、invG和ssaV基因,有1个基因出现不同程度的表达量下调,是prgH基因。总体而言在分泌通路中,基因表达量上调数多于基因表达量下调数。
2.4 不同时期细菌双组分通路共表达基因筛选统计对数期和稳定期富集在双组分系统通路的差异表达基因,对数期有68个差异表达基因,稳定期有56个差异表达基因,在对数期和稳定期中上调基因均编码外膜转运壳寡糖的ybfM基因表达量差异变化最大,对数期中下调基因以编码硝酸还原酶亚基α的narG基因表达量差异变化最大,稳定期中下调基因以编码细胞色素泛醇氧化酶亚基I的STM0360基因表达量差异变化最大。如图 2所示,在细菌双组分通路中,有16个基因在两个时期均出现差异表达,分别是ybfM、STM3031、STM1530、pocR、hilA、htrA、ttrB、pagO、pgtC、ttrR、STM3216、hilD、STM3138、hydH、fljB和pstS基因,在对数期中有10个基因出现不同程度的表达量上调,分别是ybfM、htrA、pagO、STM3138、STM3031、ttrB、hilD、pstS、STM1530和hilA基因,有6个基因出现不同程度的表达量下调,分别是pgtC、hydH、pocR、STM3216、ttrR和fljB基因;在稳定期中有14个基因出现不同程度的表达量上调,分别是ybfM、htrA、pagO、STM3138、STM3031、ttrB、hilD、STM1530、hilA、pgtC、hydH、pocR、STM3216和ttrR基因,有2个基因出现不同程度的表达量下调,分别是pstS和fljB基因。
3 讨论近年来,揭示相关基因的功能,在分子水平上阐明其代谢调控途径已经开始成为沙门菌研究的主要方向。而在sRNA研究领域中,伴侣蛋白Hfq直接或间接地参与了细菌多种代谢的调控, 影响多种生理生化过程的正常进行,但Hfq蛋白对sRNA的具体调控机制并不明确,只能推测大致的影响结果。因此,探明伴侣蛋白Hfq的调控机制对探究sRNA与Hfq蛋白的调控机制有着重要的意义。
本次研究中,针对细菌趋化性通路筛选出的四个基因yiaD、STM3138、STM3216和malE,结合NCBI (National Center for Biotechnology Information),yiaD能够编码OmpA家族蛋白(OmpA蛋白具有重要的致病作用,包括细菌黏附、侵袭或细胞内存活,以及逃避宿主防御或促炎症细胞因子产生的刺激物[16])、STM3138与STM3216能编码甲基化受体趋化蛋白(MCP)[17], malE能编码麦芽糖转运蛋白。同时趋化性主要与甲基化受体趋化蛋白(MCP)有关,当MCP的胞外连接位点被排斥物占据时,CheA激酶自磷酸化的抑制解除,磷酸化的CheA之后将磷酸基团转移到能够自由扩散的调节蛋白CheY的Asp57残基上,磷酸化的CheY(CheY-P)与鞭毛马达开关蛋白结合,从而诱发鞭毛进行顺时针的翻转导致细菌的运动方向改变。所以可认为hfq能够通过yiaD、STM3138、STM3216和malE改变相关蛋白的表达量,从而影响细菌的运动性。而在细菌分泌通路中,根据Deng等[18]的研究,T3SS跨越了细菌内外膜和宿主细胞膜,其组成可分为含有细胞溶质ATP酶复合物、细胞质环、内在膜出口装置、细胞基体(位于细菌的内外膜中,环绕着一根内杆和一根针)、宿主细胞膜中的易位孔。该通路中所筛选出的基因invG、prgH编码的蛋白参与了基体的构成,分别为膜外环与膜内环;spaP、spaS、invA、ssaV所编码的蛋白参与了内在膜出口装置的构成,为膜内重要的组成元件;invE则在调节功能中发挥作用。对此,认为hfq能够抑制spaP、invA、invE、spaS、invG和ssaV等基因表达,调控prgH的表达,进而改变T3SS的形成,最后影响分泌通路,使细菌通过Ⅲ型分泌系统进行分泌效应蛋白进入外界环境的能力减弱。双组分系统由组氨酸激酶(HK)和反应调控蛋白(RR)组成,先通过传感器组氨酸激酶和反应调控蛋白之间的识别,再利用组氨酸和天门冬氨酸磷酸化的信号系统,来参与对环境刺激作出的多种信号转导过程[19]。而组氨酸激酶分为典型、混合型、非传统型和CheA家族4类,反应调控蛋白分为24个不同家族,以OmpR、CheY和NarL家族占大多数。本次在双组分系统中筛选的16个差异表达基因,ybfM编码相应的膜蛋白控制几丁质蛋白进入膜内[20-21];htrA编码了丝氨酸蛋白酶,对调节细菌的应激反应和控制其胞质蛋白质量具有重要意义[22];hilD、hilA参与了SPI-1之中[Akbar等[23]提出SPI-1编码的转录调控因子(hilD、hilC、hilA、inv),能以一种有序的方式协同激活SPI-1 TTSS的表达:hilD和hilC撤销hilA转录,hilA激活编码TTS装置组成部分的invF和SPI-1基因,然后,InvF激活编码SPI1 TTS装置分泌的蛋白质的基因;在这种体系中,hilD和hilC通过影响hilA的表达,间接激活SPI1 TTS装置及其分泌底物的表达];hydH编码了感觉组胺酸激酶,参与了一个锌和铅响应的双组分调控系统[24];ttrR编码了DNA结合蛋白反应调节器;pgtC编码了信号传输蛋白;pstS编码了磷酸盐ABC转运蛋白底物结合蛋白;fljB参与鞭毛蛋白的合成;STM3138、STM3216在趋化性通路有所体现;pocR参与了信号转导机制中;ttrB参与了四硫酸还原酶亚单位B;STM1530能够编码一种外膜蛋白;pagO能帮助EamA家族的运输。基因调控细菌的性状由大量庞大而复杂的网络共同构成,细菌中双组分种类繁多,相互之间或有所联系,但也无关联,故对此分析有所欠缺,需要进一步的研究。在本次研究中,认为hfq可能对某些基因直接进行调控,如STM3138、STM3216;而某些基因则可能是与蛋白Hfq结合相互作用,需要更为深入的调查。由于sRNA伴侣蛋白Hfq常与sRNA协同发挥作用,因此本研究丰富鼠伤寒沙门菌hfq基因的调控基因数,通过初步筛选较为重要的差异表达基因,寻找了可能靶基因。同时,为沙门菌中的sRNA与hfq后续研究及沙门菌的防治奠定一定基础。
4 结论通过筛选在鼠伤寒沙门菌野生型菌株LT2与鼠伤寒沙门菌hfq基因缺失株在趋化性通路、细菌双组分通路、细菌分泌通路中出差异表达的基因,其中在细菌对数期和稳定期细菌趋化性通路中筛选出yiaD、STM3138、STM3216和malE等4个共表达基因,该群基因能够编码OmpA家族蛋白与MCP调控细菌的趋化性;在细菌对数期和稳定期细菌分泌通路中筛选出spaP、invA、prgH、invE、spaS、invG和ssaV等7个共表达基因,该群基因能够参与了T3SS的构成与调控,影响细菌的分泌通路;在细菌双组分通路中筛选出ybfM、htrA、pagO、STM3138、STM3031、ttrB、hilD、pstS、STM1530、hilA、pgtC、hydH、pocR、STM3216、ttrR和fljB等16个共表达基因, 伴侣蛋白Hfq能够对这些基因进行调控,从而影响相关表达,如运动性、毒力等,为沙门菌中的sRNA与Hfq后续研究及沙门菌的防治奠定了一定基础。
| [1] | BRENNER F W, VILLAR R G, ANGULO F J, et al. Salmonella nomenclature[J]. J Clin Microbiol, 2000, 38(7): 2465–2467. |
| [2] | HUANG Z W, PAN X Y, XU N, et al. Bacterial chemotaxis coupling protein: structure, function and diversity[J]. Microbiol Res, 2019, 219: 40–48. DOI: 10.1016/j.micres.2018.11.001 |
| [3] | ISSENHUTH-JEANJEAN S, ROGGENTIN P, MIKOLEIT M, et al. Supplement 2008-2010 (no. 48) to the White-Kauffmann-Le Minor scheme[J]. Res Microbiol, 2014, 165(7): 526–530. DOI: 10.1016/j.resmic.2014.07.004 |
| [4] | BUMANN D, SCHOTHORST J. Intracellular Salmonella metabolism[J]. Cell Microbiol, 2017, 19(10): e12766. DOI: 10.1111/cmi.12766 |
| [5] |
陈斌杰, 王亨, 陈艳飞, 等. 沙门菌非编码小RNA RyhB研究进展[J]. 畜牧兽医学报, 2019, 50(1): 21–27.
CHEN B J, WANG H, CHEN Y F, et al. Research progress on small non-coding RNA RyhB of Salmonella[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(1): 21–27. (in Chinese) |
| [6] | DELIHAS N, FORST S. MicF: an antisense RNA gene involved in response of Escherichia coli to global stress factors[J]. J Mol Biol, 2001, 313(1): 1–12. |
| [7] | SITTKA A, LUCCHINI S, PAPENFORT K, et al. Deep sequencing analysis of small noncoding RNA and mRNA targets of the global post-transcriptional regulator, Hfq[J]. PLoS Genet, 2008, 4(8): e1000163. DOI: 10.1371/journal.pgen.1000163 |
| [8] | SANTIAGO-FRANGOS A, WOODSON S A. Hfq chaperone brings speed dating to bacterial sRNA[J]. WIREs RNA, 2018, 9(4): e1475. DOI: 10.1002/wrna.1475 |
| [9] | ROSKO J, MARTINEZ V A, POON W C K, et al. Osmotaxis in Escherichia coli through changes in motor speed[J]. Proc Natl Acad Sci U S A, 2017, 114(38): E7969–E7976. DOI: 10.1073/pnas.1620945114 |
| [10] | KAVITA K, DE METS F, GOTTESMAN S. New aspects of RNA-based regulation by Hfq and its partner sRNAs[J]. Curr Opin Microbiol, 2018, 42: 53–61. DOI: 10.1016/j.mib.2017.10.014 |
| [11] |
刘晓琳, 刘卫, 解志红. 细菌趋化信号通路中的磷酸酯酶CheZ[J]. 微生物学报, 2017, 57(1): 15–23.
LIU X L, LIU W, XIE Z H. Advances in phosphatase CheZ of bacterial chemotaxis signaling pathway[J]. Acta Microbiologica Sinica, 2017, 57(1): 15–23. (in Chinese) |
| [12] | SILVA-HERZOG E, DETWEILER C S. Salmonella enterica replication in hemophagocytic macrophages requires two type three secretion systems[J]. Infect Immun, 2010, 78(8): 3369–3377. DOI: 10.1128/IAI.00292-10 |
| [13] | TAMPAKAKI A P, SKANDALIS N, GAZI A D, et al. Playing the "Harp": evolution of our understanding of hrp/hrc genes[J]. Annu Rev Phytopathol, 2010, 48: 347–370. DOI: 10.1146/annurev-phyto-073009-114407 |
| [14] |
李晨, 王开功, 周碧君, 等. sRNA伴侣蛋白Hfq敲除条件下沙门菌的转录组分析[J]. 中国兽医学报, 2019, 39(3): 461–469.
LI C, WANG K G, ZHOU B J, et al. Transcriptome analysis of sRNA chaperone Hfq deletion mutant in Samonella[J]. Chinese Journal of Veterinary Science, 2019, 39(3): 461–469. (in Chinese) |
| [15] | FIGUEROA-BOSSI N, LEMIRE S, MALORIOL D, et al. Loss of Hfq activates the σE-dependent envelope stress response in Salmonella enterica[J]. Mol Microbiol, 2006, 62(3): 838–852. |
| [16] | CONFER A W, AYALEW S. The OmpA family of proteins:roles in bacterial pathogenesis and immunity[J]. Vet Microbiol, 2013, 163(3-4): 207–222. DOI: 10.1016/j.vetmic.2012.08.019 |
| [17] | FRYE J, KARLINSEY J E, FELISE H R, et al. Identification of new flagellar genes of Salmonella enterica serovar Typhimurium[J]. J Bacteriol, 2006, 188(6): 2233–2243. DOI: 10.1128/JB.188.6.2233-2243.2006 |
| [18] | DENG W Y, MARSHALL N C, ROWLAND J L, et al. Assembly, structure, function and regulation of type Ⅲ secretion systems[J]. Nat Rev Microbiol, 2017, 15(6): 323–337. DOI: 10.1038/nrmicro.2017.20 |
| [19] | GROISMAN E A. Feedback control of two-component regulatory systems[J]. Annu Rev Microbiol, 2016, 70: 103–24. DOI: 10.1146/annurev-micro-102215-095331 |
| [20] | TSAI Y L, WANG M C, HSUEH P R, et al. Overexpression of an outer membrane protein associated with decreased susceptibility to carbapenems in Proteus mirabilis[J]. PLoS One, 2015, 10(3): e0120395. DOI: 10.1371/journal.pone.0120395 |
| [21] | VOGEL J. An RNA trap helps bacteria get the most out of chitosugars[J]. Mol Microbiol, 2009, 73(5): 737–741. DOI: 10.1111/j.1365-2958.2009.06806.x |
| [22] | BACKERT S, BERNEGGER S, SKÍRKO-GLONEK J, et al. Extracellular HtrA serine proteases:an emerging new strategy in bacterial pathogenesis[J]. Cell Microbiol, 2018, 20(6): e12845. DOI: 10.1111/cmi.12845 |
| [23] | AKBAR S, SCHECHTER L M, LOSTROH C P, et al. AraC/XylS family members, HilD and HilC, directly activate virulence gene expression independently of HilA in Salmonella typhimurium[J]. Mol Microbiol, 2003, 47(3): 715–728. |
| [24] | LEONHARTSBERGER S, HUBER A, LOTTSPEICH F, et al. The hydH/G Genes from Escherichia coli code for a zinc and lead responsive two-component regulatory system[J]. J Mol Biol, 2001, 307(1): 93–105. |



