喙是禽类的一种富含多种感受器(包括机械感受器、热感受器、伤害感受器)的复杂的功能性结构。禽类利用喙啄食饮水,维持生命;利用喙梳理羽毛,进行自我修饰;也利用喙叨啄同类,建立社会关系,维持社会秩序。断喙(beak trimming,BT)是现代集约化养禽业的一项重要饲养管理措施,其主要目的是减少集约化生产中禽的啄癖和同类相残,提高动物福利[1-4]。但是,断喙也给禽类带来了应激、感染和急慢性疼痛等负作用[5-7]。家禽养殖过程中是否进行断喙,仍是一个备受争议的话题。1999年,欧盟一些国家规定断喙必须在雏鸡出生后10 d内完成,而挪威、瑞士、瑞典、芬兰、丹麦等一些国家施行了全面禁止断喙[8-9]。在中国,绝大多数公司和养殖场基于管理需求和经济利益会给商品蛋鸡、种鸡、慢生长肉鸡进行断喙[10]。
我国养禽业使用的断喙方式主要是传统热刀人工断喙和红外线断喙。传统热刀人工断喙是国内小型养鸡场常用的一种断喙方式,根据物理剪切加高温烧烙止血消毒的原理,在雏鸡7~10日龄时利用热刀断喙仪进行断喙[11]。其优点是仪器便宜,仅300~500元,体积小,移动方便。然而这一方法也存在很多不足:首先断喙效率低,每次只能对1只雏鸡进行断喙;其次断喙质量取决于操作人员技术熟练程度和经验;再者,断喙后雏鸡形成开放性伤口,有出血感染风险,疼痛和应激反应强烈[6-7];另外,断喙后易形成疤痕组织和神经瘤,导致长期的慢性疼痛[12];还有的鸡断喙后喙还会再生长或形成畸形喙[13],在10周龄左右进行二次断喙,引起更为严重的疼痛和应激反应[14]。
红外线断喙法是在雏鸡1日龄时使用全自动红外线断喙仪进行自动断喙,操作人员将1日龄鸡头部约束固定在仪器上特制的断喙面罩内,高强度红外线光束穿透鸡喙硬的外壳层(角质层),直至喙的基础组织。断喙后,鸡喙角质层仍保持完整,1~2周后,鸡在正常的啄食饮水活动中喙部外层脱落,露出逐渐硬结的内层[15]。该方法不切断或烧灼喙部组织,无创面,不出血,不会导致细菌感染。研究显示,红外线断喙对蛋鸡的生产性能和蛋品质几乎无影响[14]。国内一些大型种鸡场已经采用该方法进行断喙[10, 15]。
不同断喙方式对蛋鸡行为和生产性能的影响已经比较清楚,但对鸡免疫功能的影响报道较少。因此,本研究主要研究红外线断喙、传统热刀断喙和不断喙三种方式对蛋雏鸡免疫功能的影响。
1 材料与方法 1.1 试验动物与饲养720只1日龄京粉1号蛋雏鸡随机分为不断喙对照组(control group, CG),1日龄红外线断喙组(infrared beak trimming group, IBT)和8日龄热刀断喙组(hot-blade beak trimming group, HBT),每组240只,饲喂在8个雏鸡笼中,每个笼子30只。1日龄时所有鸡进行马立克病-传染性法氏囊病二联苗注射免疫和新城疫-传染性支气管炎二联苗喷雾免疫,严格根据峪口京粉蛋鸡饲养手册进行饲养管理。
1.2 动物生长性能测定与样品收集在试验第2、7、9、16、23和30天测量雏鸡上喙长度,以直尺为参考物,将雏鸡头部平行于直尺,拍照,使用Image J测量鸡上喙最前端到鼻孔前缘的长度[16]。试验第4、11、18和25天称量雏鸡体重,雏鸡体重=每笼雏鸡总体重/数量。当日同时测量雏鸡采食量和饲料浪费量。在每个雏鸡笼下布设清洁的垫纸,早上8:00清空食槽,准确称量饲料给予量,第2天称量食槽中的饲料剩余量,将垫纸上的粪便去除,称量饲料浪费量,采食量=给予量-剩余量-浪费量。
在第8、15、29天随机从每个笼中抽取3只鸡进行心脏采血,制备EDTA抗凝血,涂抹血涂片,每个样品制备2张血涂片;剩余血液离心后制备血浆。采血后雏鸡拉颈致死,采集脾和法氏囊,称其质量,并计算其相对质量,部分脾组织保存4%甲醛溶液中,用于制作组织切片,另有部分脾组织保存于-80 ℃冰箱,用于Real-time PCR检测相关基因的变化。
1.3 血细胞计数检查血涂片进行瑞氏染色,用光学显微镜(10×100)仔细观察白细胞形态,计数异嗜性粒细胞(heterophils)和淋巴细胞(lymphocytes),每个血涂片总共计数100个白细胞(异嗜性粒细胞和淋巴细胞),每个样品计数2张血涂片,并计算异嗜性粒细胞和淋巴细胞的比值。
1.4 血浆中蛋白、T细胞分化簇、细胞因子及抗体滴度检测用生化分析仪(Olympus AU400,日本)检测血液中总蛋白(total protein,TP)和白蛋白(albumin,ALB)含量,计算球蛋白(globulin,GLB)含量及白球比(ALB/GLB,A/G)。球蛋白=总蛋白-白蛋白。
用ELISA试剂盒(慧嘉生物,厦门)检测血液中T细胞分化簇sCD3、sCD4、sCD8,细胞因子白细胞介素-1(IL-1)、IL-2、IL-6、肿瘤坏死因子-α(TNF-α)以及新城疫病毒抗体滴度(NDV Ab)和传染性法氏囊病毒抗体滴度(IBDV Ab)。
1.5 组织切片观察取脾组织常规制备3 μm石蜡切片(使用莱卡组织切片机),HE染色,光学显微镜下观察不同断喙方式雏鸡脾组织结构的影响。
1.6 Real-time PCR检测脾中基因的转录变化提取脾总RNA,反转录合成cDNA,利用核酸蛋白仪(IMPLEN P33O,德国)检测其质量和浓度。Real-time PCR仪(CFX96 TouchTM Real-time,美国Bio-Rad公司)分析脾中IL-1、IL-2、Bcl-2(B-cell lymphoma-2)、Bax(Bcl-2 assaciated X protein)的基因转录量,设置内参基因β-actin。△Ct定量分析不同断喙方式对基因IL-1、IL-2、Bcl-2、Bax相对转录量的影响(表 1),计算公式为:2-△Ct =2-(目的基因Ct-内参基因Ct)。
|
|
表 1 Real-time PCR分析所用引物 Table 1 The primers used for real-time PCR analyses |
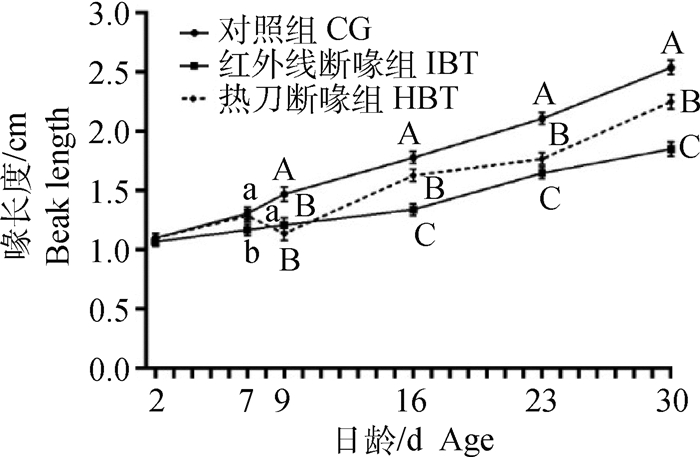
喙长度测量发现,1日龄雏鸡红外线断喙后喙长度始终短于未断喙组鸡的喙长度,且7日龄时表现出显著性降低(P < 0.05),9日龄以后表现为极显著降低(P < 0.01)。8日龄雏鸡经热刀断喙后的喙长度也始终极显著短于未断喙组鸡的喙长度(P < 0.01);在9日龄时,热刀断喙组鸡的喙长度与红外线断喙组鸡的无显著差异(P>0.05),但随着日龄的增加,热刀断喙组鸡的喙长度极显著长于红外线断喙组鸡的(P < 0.01)。在雏鸡30日龄时,对照组喙长度为2.54 cm±0.14 cm,热刀断喙组喙长度为2.25 cm±0.11 cm,红外线断喙组喙长度为1.85 cm±0.13 cm,且组间差异极显著(P < 0.01,图 1)。
|
不同小写字母表示组间差异显著,P < 0.05;不同大写字母表示组间差异极显著,P < 0.01 Different lowercase letters indicate significant difference between groups, P < 0.05;Different capital letters indicate extremely significant difference between groups, P < 0.01 图 1 不同断喙方式对雏鸡喙长度的影响 Fig. 1 Effect of different beak-trimming methods on beak length of chicks |
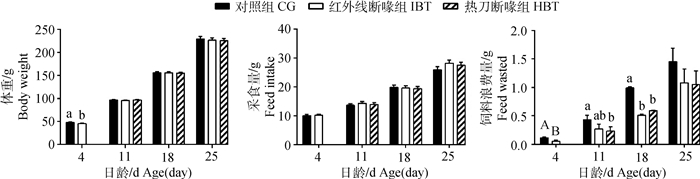
相对于未断喙组,1日龄红外线断喙后第4天的雏鸡体重显著降低(P=0.03,图 2左图),但当雏鸡11日龄后,不同组别的体重无显著性差异(P>0.05,图 2左图)。而不同断喙方式对雏鸡采食量无显著性影响(P>0.05,图 2中图)。相对于对照组,红外线断喙和热刀断喙均能显著减少雏鸡饲料浪费量(P < 0.05,图 2右图),而热刀断喙组与红外线断喙组之间无显著性差异(P>0.05)。
|
不同小写字母表示组间差异显著,P < 0.05;不同大写字母表示组间差异极显著,P < 0.01 Different lowercase letters indicate significant difference between groups (P < 0.05); Different capital letters indicate very significant difference between groups (P < 0.01) 图 2 不同断喙方式对雏鸡体重、采食量、浪费量的影响(x±sx) Fig. 2 Effects of different beak-trimming methods on body weight, feed intake and feed wasted of chicks (x±sx) |
检测8、15、29日龄雏鸡白细胞分类数目发现,1日龄红外线断喙和8日龄热刀断喙两种方式对雏鸡血液异嗜性粒细胞和淋巴细胞数均无显著影响(P>0.05,表 2)。但相对于对照组,红外线断喙组8日龄雏鸡异嗜性粒细胞数有升高的趋势(P=0.07),而淋巴细胞数有降低的趋势(P=0.09),且异嗜性粒细胞与淋巴细胞的比值有升高的趋势(P=0.10);热刀断喙组29日龄雏鸡异嗜性粒细胞数有升高趋势(P=0.07),淋巴细胞数有降低趋势(P=0.06),且异嗜性粒细胞与淋巴细胞的比值有升高的趋势(P=0.07)。
|
|
表 2 不同断喙方式对雏鸡血液中异嗜性粒细胞数和淋巴细胞数的影响 Table 2 Effects of different ways of beak-trimming on percentage of heterophils and lymphocytes in blood of chicks |
相比对照组,8日龄红外线断喙组雏鸡血浆中TP、ALB、GLB含量有下降的趋势(P>0.05,表 3)。而本试验任何年龄段雏鸡血浆中sCD3、sCD4、sCD8、IL-1、IL-6和TNF-α未受断喙的影响(P>0.05)。
|
|
表 3 不同断喙方式对雏鸡血浆中蛋白、T细胞分化簇和细胞因子的影响 Table 3 Effects of different ways of beak-trimming on plasma concentration of protein, CD and cytokine in chicks |
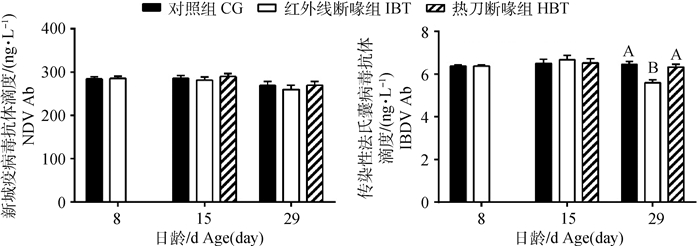
血浆中抗体滴度检测显示,红外线断喙组29日龄雏鸡血浆中IBDV抗体滴度比对照组和热刀断喙组低,且差异极显著(P < 0.01,图 3)。
|
不同大写字母表示组间差异极显著,P < 0.01 Different capital letters indicate very significant difference between groups (P < 0.01) 图 3 不同断喙方式对血液中新城疫病毒和传染性法氏囊病毒抗体滴度的影响(x±sx) Fig. 3 Effects of different ways of beak-trimming on plasma concentration of NDV Ab and IBDV Ab of chicks(x±sx) |
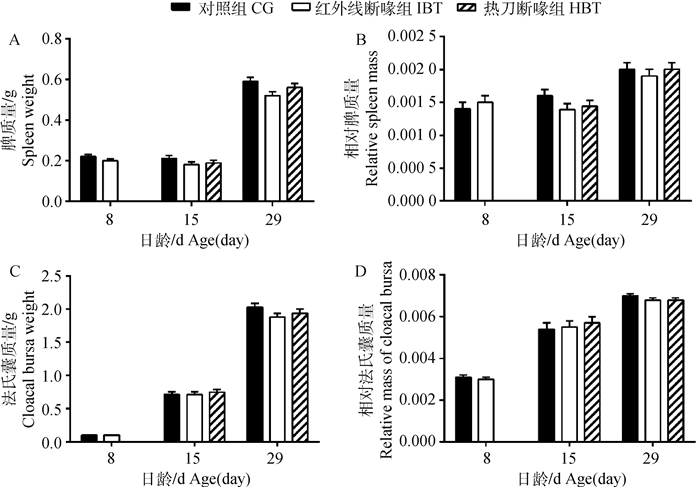
不同断喙方式对脾和法氏囊的质量和器官相对指数无显著性影响(P>0.05,图 4)。但是,红外线断喙组15日龄雏鸡脾器官质量(P=0.06)和相对指数(P=0.06)相对于未断喙组有降低的趋势。不同断喙方式雏鸡脾显微结构无显著差异(图 5)。
|
图 4 不同断喙方式对脾和法氏囊质量和器官指数的影响(x±sx) Fig. 4 The influence of different ways of beak-trimming on the weight and mass of spleen and cloacal bursa of chicks (x±sx) |
|
A、B、C分别为对照组、红外线断喙组和热刀断喙组 A, B, C were control group, infrared beak trimming group, and hot-blade beak trimming group 图 5 脾组织结构(HE,400×) Fig. 5 The structure of spleen tissue (HE, 400×) |
Real-time PCR检测脾中的炎性因子和凋亡因子发现,不同断喙方式对脾中炎症因子IL-1和IL-2,凋亡因子Bcl-2和Bax的基因转录及Bcl-2/Bax指数无显著影响(P>0.05,表 4)。
|
|
表 4 不同断喙方式对雏鸡炎性因子和凋亡因子基因转录的影响 Table 4 Effects of different beak-trimming methods on Bcl-2, Bax, IL-1 and IL-2 mRNA transcription in chicks |
本试验显示红外线断喙和热刀断喙均不影响雏鸡的采食量,红外线断喙引起4日龄雏鸡体重增长缓慢,但该影响随着日龄的增加而消失,同时断喙可有效减少雏鸡的饲料浪费量。相似地,Marchant-Forde和Cheng[17]的研究显示,断喙可引起雏鸡采食量减少,体重增长缓慢,但在7~10周龄后,这些影响逐渐消失,且热刀断喙和红外线断喙后蛋鸡的饲料浪费量始终低于不断喙蛋鸡。这些结果说明,断喙可能作为一个应激源,引起了雏鸡应激反应,降低了饲料利用率,导致雏鸡体重暂时性增长缓慢。但随着蛋鸡喙伤口的愈合和鸡对断喙的适应,断喙引起的应激反应逐渐消失,体重逐渐恢复到标准状况。重要的是,热刀断喙和红外线断喙均可显著减少饲料浪费量,可有效的降低养禽业生产成本,有利于增加养禽业经济效益。
异嗜性粒细胞是禽类中主要的多形核细胞,其功能与哺乳动物中的中性粒细胞相似,具有很强的吞噬能力和广谱抗菌活性[18]。异嗜性粒细胞/淋巴细胞(H/L)比值常用来评价动物福利和机体的应激反应,当鸡遭受应激时异嗜性粒细胞数量增加,淋巴细胞数量减少,H/L比值增加[19-22]。最近的研究也显示H/L值与抗病能力和免疫能力有关,机体H/L值低,免疫应答反应能力和抗病能力更高[23-24]。本试验中红外线断喙组8日龄雏鸡淋巴细胞数呈下降趋势,异嗜性粒细胞数呈升高趋势,表明红外线断喙引起了雏鸡的应激反应,并使雏鸡的免疫能力和抗病能力有降低趋势。
此外,研究发现红外线断喙组8日龄雏鸡血浆总蛋白、白蛋白、球蛋白和sCD3含量有下降的趋势。白蛋白主要由肝分泌,维持机体的营养和渗透压,已被广泛用作肝功能指标[25],而球蛋白具有免疫作用,白蛋白/球蛋白比值常用来评价机体状况和免疫功能[25-26]。红外线断喙组8日龄雏鸡的白蛋白和球蛋白均有降低趋势,说明雏鸡的营养状况和免疫能力有降低的趋势。CD3是T细胞表面的重要分子之一,通常与T细胞受体(TCR)结合形成TCR/CD3复合物,在T细胞信号传导过程中发挥着重要的作用[27-29]。红外线断喙组8日龄雏鸡sCD3相比对照组有降低趋势,表明红外线断喙对8日龄雏鸡T细胞的功能造成一定的影响,阻碍了T细胞对抗原的识别和信号传导过程。综合以上免疫功能指标检测结果,提示红外线断喙可导致8日龄雏鸡免疫功能呈下降趋势,但该负作用随着日龄的增加而逐渐消失。8日龄雏鸡的脾质量和器官指数无明显变化,而在15日龄时,雏鸡脾的质量和器官指数出现下降的趋势,可能是因为器官指数的变化稍滞后于免疫因子的变化。
在本试验观察期间,断喙对新城疫病毒抗体滴度无显著影响。而在29日龄时,红外线断喙组雏鸡的传染性法氏囊病毒抗体滴度相比未断喙对照组和8日龄热刀断喙组雏鸡显著下降。传染性法氏囊病毒具有高度传染性,感染雏鸡会导致雏鸡严重的免疫抑制和高死亡率[30],因此需注意防范。该结果可能是因为雏鸡在1日龄时同时进行疫苗免疫和红外线断喙,红外线断喙造成的应激引起了早期的免疫抑制,可能不利于维持高效价抗体滴度。李福伟等[31]报道,雏鸡35和45日龄时,1日龄红外线断喙组雏鸡的鸡新城疫病毒抗体滴度显著低于同批次在15日龄人工断喙的雏鸡,但传染性法氏囊病毒抗体滴度并未受断喙方式的影响。其结果与本试验结果不完全一致,可能与检测时间和疫苗的品牌、批次有关,更多的研究有待开展。
在本次试验中,虽未发现传统热刀断喙对免疫功能的任何不利影响,但并不认为传统热刀断喙是一个比红外线断喙更好的方法。本试验测定9日龄雏鸡断喙长度发现,传统热刀断喙组9日龄雏鸡喙长度与红外线断喙组无显著差异,但在检查16日龄雏鸡喙长度时,热刀断喙组显著高于红外线断喙组,其主要原因是红外线断喙鸡的喙是在断喙后7~15 d才逐渐脱落,这表明本次热刀断喙后的雏鸡喙初始长度高于红外线断喙组。热刀断喙由人工操作,其断喙效果和整齐度由技术员的熟练程度和经验决定,保留的喙过长或断喙不整齐可能会导致雏鸡长大后形成畸形喙、交叉喙,或因喙过长需要二次断喙等情况[13, 32],这会对青年鸡造成更大的应激和疼痛。
4 结论传统热刀断喙和红外断喙均可显著减少饲料浪费,节约生产成本,而红外线断喙能更有效地保障断喙效果,符合现代规模化养殖需求。1日龄红外线断喙影响第1周蛋雏鸡的体重增长和免疫功能,但随着鸡的生长,该影响逐渐消失。此外,1日龄同时进行红外线断喙和疫苗接种,不利于所接种疫苗在鸡体内维持高的抗体效价,因此需进一步研究在采用1日龄红外线断喙工艺时,如何更好地提高新生雏鸡的免疫力。
| [1] | JENDRAL M J, ROBINSON F E. Beak trimming in chickens:historical, economical, physiological and welfare implications, and alternatives for preventing feather pecking and cannibalistic activity[J]. Avian Poult Biol Rev, 2004, 15(1): 9–23. DOI: 10.3184/147020604783637444 |
| [2] | GUESDON V, AHMED A M H, MALLET S, et al. Effects of beak trimming and cage design on laying hen performance and egg quality[J]. Br Poult Sci, 2006, 47(1): 1–12. DOI: 10.1080/00071660500468124 |
| [3] | THAXTON Y V, CHRISTENSEN K D, MENCH J A, et al. Symposium:animal welfare challenges for today and tomorrow[J]. Poult Sci, 2016, 95(9): 2198–2207. DOI: 10.3382/ps/pew099 |
| [4] | RIBER A B, HINRICHSEN L K. Welfare consequences of omitting beak trimming in barn layers[J]. Front Vet Sci, 2017, 4: 222. DOI: 10.3389/fvets.2017.00222 |
| [5] | HUGHES B O, GENTLE M J. Beak trimming of poultry:its implications for welfare[J]. World Poult Sci J, 1995, 51(1): 51–61. |
| [6] | MCKEEGAN D E F, PHILBEY A W. Chronic neurophysiological and anatomical changes associated with infrared beak treatment and their implications for laying hen welfare[J]. Anim Welf, 2012, 21(2): 207–217. DOI: 10.7120/09627286.21.2.207 |
| [7] | KUENZEL W J. Neurobiological basis of sensory perception:welfare implications of beak trimming[J]. Poult Sci, 2007, 86(6): 1273–1282. DOI: 10.1093/ps/86.6.1273 |
| [8] | JANCZAK A M, RIBER A B. Review of rearing-related factors affecting the welfare of laying hens[J]. Poult Sci, 2015, 94(7): 1454–1469. DOI: 10.3382/ps/pev123 |
| [9] | BESSEI W. Impact of animal welfare on worldwide poultry production[J]. World Poult Sci J, 2018, 74(2): 211–224. |
| [10] |
李杜, 王珏, 李春红. 雏鸡1日龄红外断喙管理[J]. 家禽科学, 2017(10): 22–23.
LI D, WANG J, LI C H. Management of 1-day-old infrared beak breaking of chicks[J]. Poultry Science, 2017(10): 22–23. DOI: 10.3969/j.issn.1673-1085.2017.10.007 (in Chinese) |
| [11] | GLATZ P C. Beak trimming methods - Review[J]. Asian Australas J Anim Sci, 2000, 13(11): 1619–1637. DOI: 10.5713/ajas.2000.1619 |
| [12] | LUNAM C A, GLATZ P C, HSU Y J. The absence of neuromas in beaks of adult hens after conservative trimming at hatch[J]. Aust Vet J, 1996, 74(1): 46–49. DOI: 10.1111/j.1751-0813.1996.tb13734.x |
| [13] | YAMAUCHI Y, YOSHIDA S, MATSUYAMA H, et al. Morphologically abnormal beaks observed in chickens that were beak-trimmed at young ages[J]. J Vet Med Sci, 2017, 79(9): 1466–1471. DOI: 10.1292/jvms.17-0287 |
| [14] | PELICIA K, GARCIA E A, SANTOS T A, et al. Beak trimming by infrared radiation of layers[J]. Braz J Poult Sci, 2019, 21(1). DOI: 10.1590/1806-9061-2017-0618 |
| [15] |
GOMERA. 规模化蛋鸡场红外断喙技术的应用[J]. 中国家禽, 2014, 36(3): 34–36.
GOMER A. Application of infrared beak breaking technology in large-scale layer farm[J]. China Poult, 2014, 36(3): 34–36. DOI: 10.3969/j.issn.1004-6364.2014.03.010 (in Chinese) |
| [16] | FAHEY A G, MARCHANT-FORDE R M, CHENG H W. Relationship between body weight and beak characteristics in one-day-old White Leghorn chicks:its implications for beak trimming[J]. Poult Sci, 2007, 86(7): 1312–1315. DOI: 10.1093/ps/86.7.1312 |
| [17] | MARCHANT-FORDE R M, CHENG H W. Different effects of infrared and one-half hot blade beak trimming on beak topography and growth[J]. Poult Sci, 2010, 89(12): 2559–2564. DOI: 10.3382/ps.2010-00890 |
| [18] | HARMON B G. Avian heterophils in inflammation and disease resistance[J]. Poult Sci, 1998, 77(7): 972–977. DOI: 10.1093/ps/77.7.972 |
| [19] | GROSS W B, SIEGEL H S. Evaluation of the heterophil/lymphocyte ratio as a measure of stress in chickens[J]. Avian Dis, 1983, 27(4): 972–979. DOI: 10.2307/1590198 |
| [20] | CAMPO J L, DAVILA S G. Effect of photoperiod on heterophil to lymphocyte ratio and tonic immobility duration of chickens[J]. Poult Sci, 2002, 81(11): 1637–1639. DOI: 10.1093/ps/81.11.1637 |
| [21] | VOSLAROVA E, BEDANOVA I, PISTEKOVA V, et al. Changes in selected biochemical indices, leukocyte profile, and pterins as biomarkers of immune system activity due to antipecking measures in pheasants[J]. Poult Sci, 2013, 92(7): 1699–1705. DOI: 10.3382/ps.2012-02874 |
| [22] | COTTER P F. An examination of the utility of heterophil-lymphocyte ratios in assessing stress of caged hens[J]. Poult Sci, 2015, 94(3): 512–517. DOI: 10.3382/ps/peu009 |
| [23] | ZHU B, LI Q H, LIU R R, et al. Genome-wide association study of H/L traits in chicken[J]. Animals, 2019, 9(5): 260. DOI: 10.3390/ani9050260 |
| [24] |
营凡, 李鹏, 邢思远, 等. 不同异嗜性粒细胞与淋巴细胞比值雏鸡对肠炎沙门菌抗性差异的分析[J]. 畜牧兽医学报, 2017, 48(8): 1529–1534.
YING F, LI P, XING S Y, et al. The Analysis of the difference of Salmonella resistance between high and low heterophil/lymphocyte ratio in chickens[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(8): 1529–1534. (in Chinese) |
| [25] | BAHRAMI A, MOEINI M M, GHAZI S H, et al. The effect of different levels of organic and inorganic chromium supplementation on immune function of broiler chicken under heat-stress conditions[J]. J Appl Poult Res, 2012, 21(2): 209–215. DOI: 10.3382/japr.2010-00275 |
| [26] | WU Y N, YAN F F, HU J Y, et al. The effect of chronic ammonia exposure on acute-phase proteins, immunoglobulin, and cytokines in laying hens[J]. Poult Sci, 2017, 96(6): 1524–1530. DOI: 10.3382/ps/pew454 |
| [27] | BERRY R, HEADEY S J, CALL M J, et al. Structure of the chicken CD3∈δ/γ heterodimer and its assembly with the αβT cell receptor[J]. J Biol Chem, 2014, 289(12): 8240–8251. DOI: 10.1074/jbc.M113.544965 |
| [28] | MEDDENS M B M, MENNENS S F B, CELIKKOL F B, et al. Biophysical characterization of CD6-TCR/CD3 interplay in T cells[J]. Front Immunol, 2018, 9: 2333. DOI: 10.3389/fimmu.2018.02333 |
| [29] | GOYETTE J, NIEVES D J, MA Y Q, et al. How does T cell receptor clustering impact on signal transduction?[J]. J Cell Sci, 2019, 132(4): jcs226423. DOI: 10.1242/jcs.226423 |
| [30] | LI Y, YANG D, JIA Y, et al. Effect of infectious bursal disease virus infection on energy metabolism in embryonic chicken livers[J]. Br Poult Sci, 2019. DOI: 10.1080/00071668.2019.1647586 |
| [31] |
李福伟, 高金波, 刘玮, 等. 不同断喙方式对育雏鸡生产性能和抗体滴度的影响[J]. 山东农业科学, 2017, 49(8): 136–138.
LI F W, GAO J B, LIU W, et al. Effects of different beak trimming on production performance and antibody titer of brooding chicks[J]. Shandong Agricultural Sciences, 2017, 49(8): 136–138. (in Chinese) |
| [32] | MARCHANT-FORDE R M, FAHEY A G, CHENG H W. Comparative effects of infrared and one-third hot-blade trimming on beak topography, behavior, and growth[J]. Poult Sci, 2008, 87(8): 1474–1483. DOI: 10.3382/ps.2006-00360 |



