2. 江苏高校动物重要疫病与人兽共患病防控协同创新中心, 扬州 225009;
3. 扬州大学教育部农业与农产品安全国际合作联合实验室, 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Contrlol of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China;
3. Joint International Research Laboratory of Agriculture and Agri-Product Safety of the Ministry of Education of China, Yangzhou University, Yangzhou 225009, China
多种家畜代谢综合征发病都与肝脂质代谢紊乱有密切联系,如鸡脂肪肝出血综合征、围产期奶牛脂肪肝综合征[1-2]等。过量游离脂肪酸蓄积在肝,超过肝的代谢能力时对细胞产生脂毒性,并可能诱导脂肪肝的发生。但游离脂肪酸诱导肝发生脂肪变性的机制尚未明确。棕榈酸(palmitic acid,PA)是大部分哺乳动物体内游离脂肪酸的重要组成部分,其作为含量最高的饱和脂肪酸,参与游离脂肪酸在体内的脂质生物合成过程。
研究表明,HepG2暴露于高浓度PA可导致细胞脂质代谢紊乱,诱导肝细胞凋亡[3]。除对细胞有脂毒性,诱导细胞发生内质网应激、凋亡外,PA与油酸共处理可促进SREBP-1c和PPARγ表达诱导肝细胞发生脂肪变性[4]。参与脂肪从头合成及三酰甘油(TG)生物合成的生物酶有很多,其中乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)是一种生物素依赖酶,催化长链脂肪酸合成过程;脂肪酸合成酶(fatty acid synthase,FAS)是脂质合成关键酶,催化脂肪从头合成过程。研究发现,AMPK激活ACC/FAS信号通路对促进脂质堆积起正调控作用[5-6];胰岛素类似物Exendin-4可通过下调ACC、FAS、SREBP-1c表达而降低由胰岛素引起的HepG2细胞TG含量升高程度[7],减轻脂肪变性程度。而硬脂酰辅酶A去饱和酶1(stearoyl-coenzyme A desaturase,SCD1)是一种内质网蛋白,SCD1敲减小鼠组织TG含量显著降低,提示SCD1内源性合成单不饱和脂肪酸对TG合成具有重要作用[8];甘油-3-磷酸酰基转移酶1(1-acylglycerol-3-phosphate O-acyltransferase,GPAT1)、二酰基甘油酰基转移酶2(diacylglycerol acyltransferase 2,DGAT2)是参与二酰甘油(DAG)/TG生物合成的关键限速酶[9],促进GPAT1、DGAT2表达可增加TG合成,引起脂质积累[10];这些脂质合成相关酶对肝细胞中脂肪酸合成及TG生物合成起重要作用。
本试验用不同浓度(0、0.2、0.4、0.6 mmol·L-1)PA处理BRL 3A细胞24 h,探究PA致BRL 3A细胞脂肪变性的作用机制,为动物肝脂质代谢紊乱性疾病的防治提供理论基础。
1 材料与方法 1.1 细胞株大鼠肝细胞系(BRL 3A)细胞,购自中国科学院上海细胞库(ATCC)。
1.2 主要试剂与仪器DMEM(美国Technologies公司)。胎牛血清(Hyclone公司)。棕榈酸(美国Sigma公司)。油红O染色试剂盒(索莱宝公司)。F-actin、DAPI(上海碧云天生物)。CCK-8细胞检测试剂盒(上海同仁生物公司)。TG检测试剂盒(南京建成生物工程研究所)。FAS、ACC兔多克隆抗体及HRP标记山羊抗家兔IgG抗体(CST公司);SCD1、GPAM鼠单克隆抗体(Santa公司);DGAT2兔多克隆抗体(ABclonal公司)。其他试剂均为国产优质分析纯。所有PCR引物均由华大基因有限公司合成。
二氧化碳培养箱(美国Thermo公司)。5810R R型冷冻离心机(美国Eppendorf公司)。WYJ-875BR型医用净化工作台(苏州金燕净化设备厂)。Sunrise-basic型酶标仪(澳大利亚Tecan公司)。xCELLigence细胞实时分析系统(瑞士Roche公司)。蛋白电泳仪(美国Bio-Rad公司)。
1.3 细胞培养与处理将BRL 3A细胞接种于含血清DMEM培养基中, 在5% CO2、37 ℃条件下培养。待细胞处于对数生长期时,分为对照组和不同浓度PA组用于后续试验。
1.4 CCK-8法、RTCA技术检测细胞增殖情况CCK-8法检测细胞增殖率:将BRL 3A细胞接种到96孔板上,细胞长至60%融合后将细胞分为对照组和不同浓度PA组(0.2、0.4、0.6 mmol·L-1 PA)处理12、24、36 h,更换培养基加入探针孵育,酶标仪测定后计算细胞存活率。
RTCA技术检测细胞的增殖指数:设置实验相关参数,在E-plate中每孔加入培养基,检测培养板基线。每孔中添加BRL 3A细胞悬液检测,细胞达到对数生长期时暂停并弃去原来的培养基,添加按照试验要求配制的含不同浓度(0.2、0.4、0.6 mmol·L-1)PA的无血清培养基,每组重复4次。
1.5 油红O染色观察脂滴生成情况细胞接种于六孔板,0、0.2、0.4、0.6 mmol·L-1PA处理12、24、36 h后,按照试剂盒说明书操作,PBS清洗,配制试剂一,现用现配。试剂一染色20 min,37 ℃ DDW清洗,试剂二复染液染色5 min,常温DDW清洗,水性封固剂封片,镜检。在显微镜下,细胞核被染成深蓝色,脂滴被染成鲜红色,其他组织被染成淡蓝色。
1.6 DAPI/F-actin染色观察细胞核/骨架形态细胞接种于提前铺好含无菌爬片的24孔板上,细胞长至60%融合,分别用0、0.2、0.4、0.6 mmol·L-1 PA处理细胞24 h。弃培养基,PBS洗涤,多聚甲醛固定,Triton X-100透膜,PBS洗涤,5% BSA封闭液室温封闭;加入F-actin探针室温孵育,PBS洗涤;DAPI复染细胞核室温孵育;PBS洗涤,滴加防荧光淬灭剂;封片,激光共聚焦显微镜下观察。细胞核为蓝色荧光,细胞骨架为红色荧光。
1.7 TG含量的检测将细胞接种于培养皿中,0、0.2、0.4、0.6 mmol·L-1 PA处理24 h,预冷PBS清洗,收集细胞,离心(1 000 r·min-1,5 min)弃上清,分别加入等量PBS在冰浴条件下超声破碎(300 W,5 s·次-1,间隔30 s,重复4次),制备好匀浆后,酶标仪检测,每组重复3次,计算出各组TG含量。
1.8 RT-PCR检测脂肪合成关键基因转录水平将细胞接种于培养皿中,0、0.2、0.4、0.6 mmol·L-1 PA处理24 h后收集细胞,采用细胞总RNA小量制备试剂盒提取总RNA,按说明书步骤进行。根据260 nm处吸光度值和A260 nm/A280 nm值确定提取的RNA浓度和纯度。根据PrimeScriptTMRT试剂盒说明书进行反转录,得到相应的cDNA。根据ChamQTM Universal SYBR® qPCR Master Mix说明书在荧光定量PCR仪上检测基因的Ct值,2-△△Ct法计算基因表达差异。合成引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences |
将细胞接种于培养皿中,0、0.2、0.4、0.6 mmol·L-1 PA处理24 h后,PBS清洗,加入含蛋白酶抑制剂的细胞裂解液,收集细胞,冰上裂解30 min,超声裂解30 s,4 ℃离心(12 000 r·min-1,10 min),收集上清,用BCA法检测蛋白浓度,将各组蛋白浓度调至一致,加入SDS-PAGE Loading Buffer,煮沸10 min,存放于-80 ℃备用。将蛋白样品进行SDS-PAGE电泳分离,转膜,5%脱脂乳TBST封闭液封闭1.5 h;分别加入一抗4 ℃孵育过夜,TBST洗涤五次,5 min·次-1;二抗结合2 h (1:5 000),ECL显色。
1.10 Image lab分析灰度值用Excel2000和SPSS 22.0中ANOVA程序对试验结果进行方差分析和Duncan多重比较,以P < 0.05(差异显著)、P < 0.01(差异极显著)作为差异显著性判断标准。数据以“x±s”表示。
2 结果 2.1 棕榈酸对BRL 3A细胞增殖的影响CCK-8结果如图 1A所示,随PA浓度升高,作用时间增长,细胞存活率逐渐降低;0.4 mmol·L-1 PA作用于细胞24 h,对细胞增殖活性无影响。RTCA结果如图 1B所示,与对照组相比,0.2、0.4 mmol·L-1 PA对细胞增殖无抑制作用,0.6 mmol·L-1 PA对细胞增殖有抑制作用。
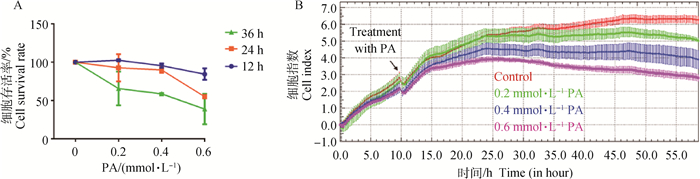
|
图 1 棕榈酸对BRL 3A细胞增殖的影响 Fig. 1 Effects of PA on proliferation of BRL 3A cells |
油红O染色法结果如图 2所示,与对照组相比,同一作用时间点,随PA浓度增加,细胞内脂滴生成量增加,细胞存活率降低;同一浓度作用时,随作用时间增加,细胞内脂滴生成量增加,细胞存活率降低。当0.4 mmol·L-1 PA作用24 h时,细胞存活率较高且细胞内脂滴生成量较多,结合“2.1”的结果,以下试验选择24 h作为处理时间点。
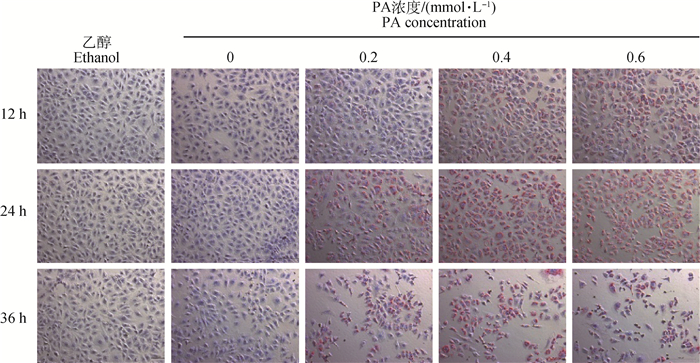
|
图 2 棕榈酸对BRL 3A脂滴生成的影响(油红O染色) Fig. 2 Effect of palmitic acid on the formation of lipid droplets in BRL 3A(Oil red O staining) |
DAPI/F-actin双染结果显示:对照组细胞核呈近圆形,结构清晰,核染色质均匀分布;随PA浓度升高,细胞核发生肿胀,皱缩,变形,破裂,损伤程度呈上升趋势(图 3A);对照组细胞骨架完整,微丝(F-actin)集结成束,PA处理后细胞骨架被破坏,微丝收缩、断裂(图 3B)。
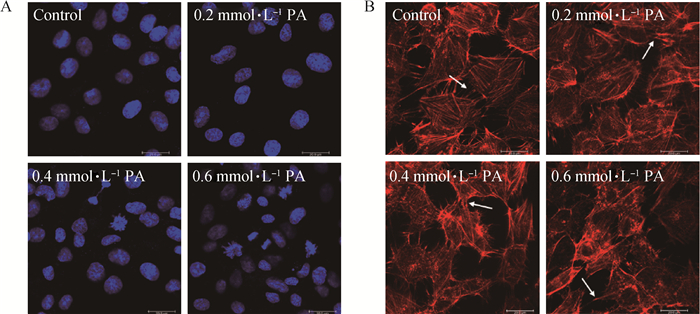
|
A.细胞核形态变化;B.细胞骨架形态变化;标尺=200 μm A. Morphological changes of the nucleus; B. Morphological changes of the cytoskeleton; Bar=200 μm 图 3 棕榈酸对BRL 3A细胞核/骨架形态的影响 Fig. 3 Effect of palmitic acid on the morphology of nucleus/cytoskeleton in BRL 3A |
检测细胞内TG含量结果如图 4所示,与对照组相比,随着PA浓度的升高,细胞内TG含量极显著增加(P < 0.01)。
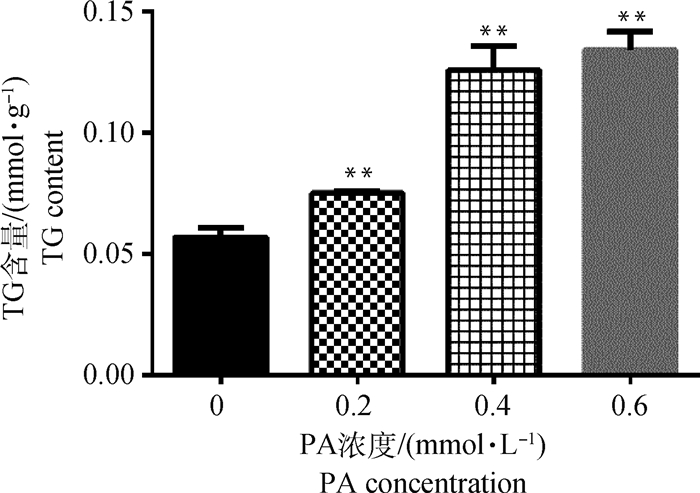
|
与对照组相比,*.P < 0.05,**.P < 0.01,下同 *.P < 0.01, **.P < 0.01, versus control, the same as below 图 4 棕榈酸对BRL 3A细胞内TG含量的影响 Fig. 4 Effect of palmitic acid on TG content in BRL 3A |
荧光定量PCR检测Acaca、Fasn、Dgat2和Gapdh mRNA表达量结果如图 5所示,与对照组相比,PA处理组(0.2、0.4、0.6 mmol·L-1)Acaca、Fasn转录水平差异显著升高(P < 0.05),PA处理组(0.4、0.6 mmol·L-1)Dgat2转录水平差异显著升高(P < 0.05)。

|
图 5 棕榈酸对脂肪合成关键基因转录水平的影响 Fig. 5 Effect of palmitic acid on transcriptional level of key genes in fat synthesis |
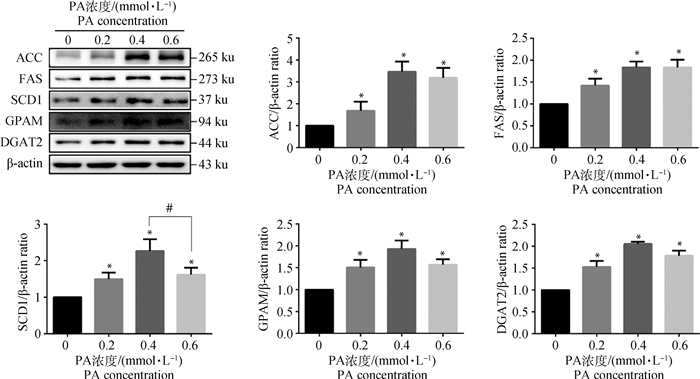
Western blot检测ACC、FAS、SCD1、GPAM、DGAT2蛋白表达水平结果,见图 6,与对照组相比,PA处理组ACC、FAS、SCD1、GPAM、DGAT2蛋白表达水平均显著升高(P < 0.05);0.6 mmol·L-1 PA组与0.4 mmol·L-1 PA组相比SCD1的表达显著降低(P < 0.05)。
|
图 6 棕榈酸对脂肪合成关键蛋白表达水平的影响 Fig. 6 Effect of palmitic acid on the expression level of key proteins in fat synthesis |
非酒精性脂肪肝病(NAFLD)是一种与胰岛素抵抗、氧化应激、脂质过氧化有密切关系的慢性肝疾病[11-12],以弥漫性肝实质细胞脂肪变性和脂质过度沉积为主要特征。大部分研究学者认为NAFLD的发病机制为“二次打击学说”,NAFLD病程中的单纯性脂肪变性与肝脂质代谢有密切关系的家畜代谢综合征,如奶牛酮病、肥胖母牛综合征、蛋鸡脂肪肝出血综合征等在发病机制上有相似性,都有肝细胞内脂滴蓄积,TG含量高等现象。近年来,畜禽肝脂质代谢障碍影响畜禽生产性能及乳品质量,造成严重经济损失,影响国民生活质量。因此探究肝脂肪变性的具体发病机制已成为当务之急。游离脂肪酸在肝中通过酯化为TG合成脂蛋白[13],再转移到肝外组织利用。大量游离脂肪酸及其代谢产物蓄积于肝时可诱导肝细胞发生脂肪变性,但其中的具体作用机制尚不清楚。因此本研究以不同浓度PA处理BRL 3A探究其细胞毒性作用及致细胞脂肪变性的作用机制。
本试验中PA对BRL 3A细胞增殖毒性随作用时间增加及浓度升高而增强,高浓度PA处理细胞存活率下降,这与刘涛等[14]的研究结果一致;刘涛等[14]研究发现,PA作用于心肌细胞(12~48 h)细胞增殖率随时间增加而显著降低,线粒体膜电位逐渐降低,细胞凋亡增加。而细胞核及细胞骨架的变化是评价细胞形态学变化的一个重要指标,本研究中随PA浓度增加,细胞核及细胞骨架损伤越严重,这与前人对PA诱导细胞损伤及凋亡的研究结果[15]一致。PA不仅对细胞增殖及细胞形态有影响,Yin等[16]报道显示PA处理HepG2后胰岛素/AST/ALT/TC/TG增加,炎症相关通路蛋白表达升高;Varshney等[17]研究显示PA可引起胰岛素调节β细胞脂滴蓄积,脂滴外壳表达蛋白PLIN2表达升高;本研究中PA作用细胞内TG含量极显著增加(P < 0.05),脂滴蓄积程度随PA浓度升高和作用时间增加而升高,这与Yin及Varshney等的研究相符。综合以上说明一定时间内低浓度PA对BRL 3A细胞的增殖无影响,对细胞形态有损伤;故本研究选择0.4 mmol·L-1 PA作用24 h诱导细胞脂肪变性,进一步探究PA诱导BRL 3A脂肪变性的分子作用机制。
ACC、FAS、SCD1都是参与催化脂肪酸合成代谢和TG生物合成等多种体内代谢的生物酶,在多组织中表达,尤其在脂肪合成代谢旺盛的组织高表达。Abu-Elheiga等[18]研究发现ACC-小鼠心、骨骼肌及肝中的脂肪β氧化增加,体重较对照组减轻;Tian等[19]发现ACC、FAS、SCD1活性增加,细胞内脂质代谢异常,诱导脂肪变性发生,这些研究都提示ACC、FAS、SCD1在脂肪合成代谢过程中起关键性作用。DGAT2是ACC/FAS信号通路下游蛋白,在白色脂肪、骨骼肌、肝中表达最多[20]。激活的DGAT2参与细胞质TG合成最后一步,有研究发现烟酸通过非竞争性抑制DGAT2活性从而降低HepG2细胞TG含量[21]。本试验结果中,PA通过上调Acaca、Fasn、Dgat2基因转录水平及ACC、FAS、SCD1、GPAM、DGAT2蛋白表达水平,增加TG合成,诱导BRL 3A细胞发生脂肪变性,这与前人研究结果一致。值得一提的是,PA处理组与对照组相比,SCD1蛋白表达水平均显著升高(P < 0.05),但0.6 mmol·L-1 PA组与0.4 mmol·L-1 PA组相比,SCD1蛋白表达水平显著降低(P < 0.05);有报道显示SCD1过表达可减轻PA引起的细胞凋亡[22],SCD1的敲除增强了PA在HTR8/SVneo细胞中的促凋亡活性[23],故猜测这可能是由于高浓度PA处理细胞凋亡增加,细胞内脂毒性作用强于脂肪变性作用。
4 结论PA对BRL 3A有细胞增殖毒性,损伤BRL 3A细胞核及细胞骨架;0.4 mmol·L-1 PA处理BRL 3A 24 h可通过上调Acaca、Fasn、Dgat2转录水平和ACC、FAS、SCD1、GPAM和DGAT2蛋白表达水平促进TG合成,诱导BRL 3A发生脂肪变性。
| [1] |
樊瑞锋.奶牛胰岛素抵抗与脂肪肝发病关系的研究[D].泰安: 山东农业大学, 2014.
FAN R F. Investigation of the relationship between insulin resistance and fatty liver in dairy cows[D]. Tai'an: Shandong Agricultural University, 2014. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10434-1014346301.htm |
| [2] | YANG F, RUAN J, WANG T, et al. Improving effect of dietary soybean phospholipids supplement on hepatic and serum indexes relevant to fatty liver hemorrhagic syndrome in laying hens[J]. Anim Sci J, 2017, 88(11): 1860–1869. DOI: 10.1111/asj.12832 |
| [3] | YAN P S, TANG S, ZHANG H F, et al. Palmitic acid triggers cell apoptosis in RGC-5 retinal ganglion cells through the Akt/FoxO1 signaling pathway[J]. Metab Brain Dis, 2017, 32(2): 453–460. DOI: 10.1007/s11011-016-9935-6 |
| [4] | RICCHI M, ODOARDI M R, CARULLI L, et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes[J]. J Gastroenterol Hepatol, 2009, 24(5): 830–840. DOI: 10.1111/j.1440-1746.2008.05733.x |
| [5] | DIHINGIA A, BORDOLOI J, DUTTA P, et al. Hexane-Isopropanolic extract of Tungrymbai, a North-East Indian fermented soybean food prevents hepatic steatosis via regulating AMPK-mediated SREBP/FAS/ACC/HMGCR and PPARα/CPT1A/UCP2 pathways[J]. Sci Rep, 2018, 8: 10021. DOI: 10.1038/s41598-018-27607-7 |
| [6] | MOTTILLO E P, DESJARDINS E M, FRITZEN A M, et al. FGF21 does not require adipocyte AMP-activated protein kinase (AMPK) or the phosphorylation of acetyl-CoA carboxylase (ACC) to mediate improvements in whole-body glucose homeostasis[J]. Mol Metab, 2017, 6(6): 471–481. DOI: 10.1016/j.molmet.2017.04.001 |
| [7] |
苏寒, 张美家, 王怀杰, 等. Exendin-4对胰岛素抵抗人肝癌HepG2细胞脂代谢相关因子基因表达的影响[J]. 吉林大学学报:医学版, 2018, 44(1): 36–40.
SU H, ZHANG M J, WANG H J, et al. Effects of Exendin-4 on expressions of lipid metabolism related genes in HepG2 cells with insulin resistance[J]. Journal of Jilin University:Medicine Edition, 2018, 44(1): 36–40. (in Chinese) |
| [8] | SUN Q, LI M H, YANG X, et al. Dietary Salecan reverts partially the metabolic gene expressions and NMR-based metabolomic profiles from high-fat-diet-induced obese rats[J]. J Nutr Biochem, 2017, 47: 53–62. DOI: 10.1016/j.jnutbio.2017.04.015 |
| [9] | MCFIE P J, BANMAN S L, STONE S J. Diacylglycerol acyltransferase-2 contains a c-terminal sequence that interacts with lipid droplets[J]. Biochim Biophys Acta Mol Cell Biol Lipids, 2018, 1863(9): 1068–1081. DOI: 10.1016/j.bbalip.2018.06.008 |
| [10] | LE BACQUER O, COMBE K, MONTAURIER C, et al. Muscle metabolic alterations induced by genetic ablation of 4E-BP1 and 4E-BP2 in response to diet-induced obesity[J]. Mol Nutr Food Res, 2017, 61(9): 1700128. DOI: 10.1002/mnfr.201700128 |
| [11] |
张哲滔, 车念聪, 郑亚琳, 等. 菖蒲郁金汤化裁方对2型糖尿病合并非酒精性脂肪肝大鼠SREBP-1c表达和胰岛素抵抗的影响[J]. 北京中医药, 2019, 38(1): 17–20, 97.
ZHANG Z T, CHE N C, ZHENG Y L, et al. Effect of Changpu Yujin Decoction on insulin resistance and expression of SREBP-1c of rats with type 2 diabetes mellitus (T2DM) complicated with nonalcoholic fatty liver disease[J]. Beijing Journal of Traditional Chinese Medicine, 2019, 38(1): 17–20, 97. DOI: 10.3969/j.issn.1006-2157.2019.01.004 (in Chinese) |
| [12] | MANN J P, RAPONI M, NOBILI V. Clinical implications of understanding the association between oxidative stress and pediatric NAFLD[J]. Expert Rev Gastroenterol Hepatol, 2017, 11(4): 371–382. DOI: 10.1080/17474124.2017.1291340 |
| [13] |
邓清华. NEFAs对犊牛原代肝细胞糖脂代谢的调控机制[D].长春: 吉林大学, 2015.
DENG Q H. The regulatory mechanism of NEFAs on glucolipid metabolism in bovine hepatocytes in vitro[D]. Changchun: Jilin University, 2015. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10183-1015590918.htm |
| [14] |
刘涛, 李晶, 鲍翠玉. 高脂通过线粒体通路诱导H9c2心肌细胞损伤[J]. 中国药理学通报, 2019, 35(4): 494–499.
LIU T, LI J, BAO C Y. High fatty acid induced H9c2 cardiomyocytes injury through mitochondrial pathways[J]. Chinese Pharmacological Bulletin, 2019, 35(4): 494–499. DOI: 10.3969/j.issn.1001-1978.2019.04.010 (in Chinese) |
| [15] | ZHANG Y, MIAO L S, ZHANG H J, et al. Chlorogenic acid against palmitic acid in endoplasmic reticulum stress-mediated apoptosis resulting in protective effect of primary rat hepatocytes[J]. Lipids Health Dis, 2018, 17(1): 270. DOI: 10.1186/s12944-018-0916-0 |
| [16] | YIN H F, HUANG L H, OUYANG T, et al. Baicalein improves liver inflammation in diabetic db/db mice by regulating HMGB1/TLR4/NF-κB signaling pathway[J]. Int Immunopharmacol, 2018, 55: 55–62. DOI: 10.1016/j.intimp.2017.12.002 |
| [17] | VARSHNEY R, VARSHNEY R, MISHRA R, et al. Kaempferol alleviates palmitic acid-induced lipid stores, endoplasmic reticulum stress and pancreatic β-cell dysfunction through AMPK/mTOR-mediated lipophagy[J]. J Nutr Biochem, 2018, 57: 212–227. DOI: 10.1016/j.jnutbio.2018.02.017 |
| [18] | ABU-ELHEIGA L, MATZUK M M, ABO-HASHEMA K A H, et al. Continuous fatty acid oxidation and reduced fat storage in mice lacking acetyl-CoA carboxylase 2[J]. Science, 2001, 291(5513): 2613–2616. DOI: 10.1126/science.1056843 |
| [19] | TIAN S C, LI B L, LEI P, et al. Sulforaphane improves abnormal lipid metabolism via both ERS-dependent XBP1/ACC & SCD1 and ERS-independent SREBP/FAS pathways[J]. Mol Nutr Food Res, 2018, 62(6): 1700737. DOI: 10.1002/mnfr.201700737 |
| [20] | BHATT-WESSEL B, JORDAN T W, MILLER J H, et al. Role of DGAT enzymes in triacylglycerol metabolism[J]. Arch Biochem Biophys, 2018, 655: 1–11. DOI: 10.1016/j.abb.2018.08.001 |
| [21] | GANJI S H, TAVINTHARAN S, ZHU D M, et al. Niacin noncompetitively inhibits DGAT2 but not DGAT1 activity in HepG2 cells[J]. J Lipid Res, 2004, 45(10): 1835–1845. DOI: 10.1194/jlr.M300403-JLR200 |
| [22] |
蔡德丰, 范建高, 马东礼, 等. 硬脂酰辅酶A去饱和酶-1过表达影响高脂诱导的肝细胞凋亡[J]. 中华肝脏病杂志, 2014, 22(1): 48–52.
CAI D F, FAN J G, MA D L, et al. SCD1 over-expression inhibits palmitic acid-induced apoptosis of rat BRL hepatocytes[J]. Chinese Journal of Hepatology, 2014, 22(1): 48–52. DOI: 10.3760/cma.j.issn.1007-3418.2014.01.011 (in Chinese) |
| [23] | YANG C, LIM W, BAZER F W, et al. Down-regulation of stearoyl-CoA desaturase-1 increases susceptibility to palmitic-acid-induced lipotoxicity in human trophoblast cells[J]. J Nutr Biochem, 2018, 54: 35–47. DOI: 10.1016/j.jnutbio.2017.11.005 |



