马立克病(Marek’s disease,MD)是由马立克病病毒(Marek’s disease virus,MDV)血清Ⅰ型毒株引起的淋巴增生性疾病,是危害世界养禽业最严重的病毒性肿瘤性传染病之一。MD是目前为止通过疫苗有效控制病毒引发肿瘤疾病的成功典范,其作为研究病毒致瘤的理想动物模型,受到病毒界、医学界、兽医界的广泛重视。随着MDV毒力的不断增强,导致MD零星发病,它是目前乃至将来相当长的一段时间里养鸡业中最具经济意义的疾病之一;在肉鸡养殖环节,由于饲养周期短,MDV感染虽不能形成肿瘤,但导致免疫器官萎缩[1],引起显著的免疫抑制[2]。
热休克蛋白(heat shock protein,HSPs),又称应激蛋白,在各种生物中普遍存在且高度保守,按相对分子质量不同,HSPs可以分为HSP27、HSP40、HSP60、HSP70、HSP90及大分子HSPs(HSP110和糖化蛋白170)[3]。HSPs除产生于细胞受到冷热[4]、病原体[5-6]、运输[7-8]等应激原的刺激外,正常生理条件下也有表达,在细胞蛋白正确折叠、转运等过程中发挥重要生理功能[9]。研究发现,HSPs与肿瘤的发生、发展有着密切的相关性[10-12]。在MDV引发肿瘤的过程中,HSP60表达量在肾[13]、肝[14]中显著升高,且主要定位于肿瘤细胞的细胞质,暗示着HSP60对肿瘤细胞的增殖发挥着重要的生物学作用。目前对HSP60与肿瘤细胞凋亡的作用及分子机制在前列腺癌、乳腺癌、肺癌等腺癌细胞中研究较多[15-16],对淋巴细胞癌内HSP60与肿瘤细胞凋亡的研究鲜有报道。
MSB-1细胞是MD成淋巴细胞样细胞系。本课题通过人工感染建立马立克病肿瘤模型,利用病理组织学、免疫组织化学方法研究肿瘤病变及HSP60细胞内定位,通过设计合成HSP60的siRNA干扰序列,干扰HSP60转录和表达水平,初步探索HSP60的生物学作用,为进一步明确HSP60在淋巴细胞癌中的生物学作用奠定基础。
1 材料与方法 1.1 实验材料SPF雏鸡,购自山东省农业科学院;MDV毒株(MDV-RB1B),山东农业大学崔治中教授惠赠;MSB-1购自上海宏顺细胞生物有限公司;1640培养基购自HyClone公司;DH5α感受态细胞、pMD-18 T Vetcor载体试剂盒均购自宝生物技术(北京)有限公司;HSP60 monoclonal antibody (ADI-SPA-806)、Goat anti-mouse Ig(ADI-SAB-100)购自艾美捷(Enzo lifesciences)科技有限公司;Anti-beta Actin抗体(mAbcam8226)购自艾博抗(Abcam)(上海)贸易有限公司。Annexin V-APC/PI细胞凋亡检测试剂盒,购自凯基生物有限公司。
1.2 动物感染试验1日龄SPF雏鸡40只,随机分为感染组(30只)和对照组(10只)。感染组,1日龄时皮下注射MDV(约1 200 PFU)。感染组与对照组隔离饲养,自由饮水和采食。感染后20和30 d时,各剖杀对照组4只,感染组10只,记录剖检变化。采集心肌、脾、腺胃和肺,中性福尔马林固定,进行病理组织学检查,选择有明显肿瘤病变的组织,进行免疫组织化学检查。
1.3 病理组织学检测常规病理学检测,显微镜下观察并拍照。
1.4 免疫组织化学检测根据文献[14]的方法进行免疫组织化学检测,HSP60抗体工作浓度为1:50。利用PBS代替HSP60抗体,作为阴性对照。
1.5 慢病毒构建根据NCBI公布的HSP60序列(NM_001012-916.2),设计3条RNA干扰片段[HSPD1-RNAi(5146)、HSPD1-RNAi(5147)、HSPD1-RNAi(5148)],同时设计1条对照序列,序列信息见表 1。RNA干扰慢病毒构建由上海吉凯基因生物有限公司完成。
|
|
表 1 RNA干扰序列信息 Table 1 The siRNA sequence for HSP60 |
将生长状态良好的细胞,1 200 r·min-1离心5 min,分别用1640完全培养基或ENi.S.稀释细胞浓度至5×104个·mL-1;用ENi.S.将对照序列慢病毒稀释为1×108、1×107、1×106 TU·mL-13种梯度浓度;制备含50 μg·mL-1 Polyberene的1640完全培养基(PM)和ENi.S.溶液(PE)。
A1~A3组,含1640完全培养基细胞液90 μL,分别含106~108TU·mL-1对照序列慢病毒液10 μL;B1~B3组,含1640细胞液80 μL,PM液10 μL,分别含106~108 TU·mL-1对照序列慢病毒液10 μL;C1~C3组,含ENi.S.细胞液90 μL,分别含106~108 TU·mL-1对照序列慢病毒液10 μL;D1~D3组,含ENi.S.细胞液80 μL,PE液10 μL,分别含106~108TU·mL-1对照序列慢病毒液10 μL。每组设3个重复,培养8~12 h,观察细胞状态,并更换为常规培养基;感染48 h后,观察荧光表达情况及细胞状态,确定细胞感染条件和感染参数。
1.7 干扰序列筛选按照优化的慢病毒最佳转染条件进行转染,分组如下:空白细胞对照组、对照序列慢病毒转染组、5146序列慢病毒转染组、5147序列慢病毒转染组、5148序列慢病毒转染组,每组3个重复;转染后36、48、72、96 h时观察转染细胞状态及荧光情况并拍照,提取总RNA和总蛋白,利用荧光定量PCR、Western blot检测HSP60转录、表达水平。
1.8 下调HSP60对细胞凋亡的影响根据最佳转染条件及序列干扰效果,选取最佳干扰序列慢病毒,转染MSB-1细胞,设空白细胞对照组和对照序列慢病毒组,每组3个重复。转染后48 h时,利用荧光定量PCR、Western blot以及流式细胞技术,检测HSP60转录、表达水平以及细胞凋亡水平。
1.9 荧光定量PCR检测根据文献[13]方法,合成HSP60、GAPDH引物。HSP60上游引物:5′-TACAGCCAAAGGGC-AGAAATG-3′,下游引物:5′-ACAGCAACAACCTGAAGACCAAC-3′;GAPDH上游引物:5′-TGAAAGTCGGAGTCAACGGAT-3′,下游引物:5′-ACGCTCCTGGAAGATAGTGAT-3′。引物由上海生工生物有限公司合成。利用TRIzol提取细胞总RNA,PCR产物连接pMD18-T Vetor,转化DH5α感受态细胞,提取质粒,PCR鉴定重组质粒;梯度稀释重组阳性质粒,建立标准曲线;根据标准曲线计算PCR反应模板量。GAPDH基因作为内参,HSP60 mRNA水平利用GAPDH mRNA水平进行归一化。
1.10 Western blot检测根据文献[17]方法检测HSP60表达水平,β-actin蛋白作为内参蛋白。HSP60和β-actin单克隆抗体作用浓度皆为1:5 000。利用Image J软件进行Western blot条带灰度值分析,各组HSP60蛋白表达水平利用β-actin蛋白水平进行归一化。
1.11 流式细胞术检测收集各组细胞,2 000 r·min-1离心5 min,用PBS洗涤3次,收集5×105细胞。再向各组分别加入Binding Buffer 500 μL,Annexin V-APC 5 μL,PI 5 μL,混匀。室温下避光反应15 min,用流式细胞仪上机检测,激发波长为633 nm。每组设3个重复。
1.12 统计分析利用SPSS22软件对数据进行单因素ANOVA检验分析。
2 结果 2.1 组织学检测在20和30日龄剖杀时,感染组分别有4(4/10)和6只(6/10)鸡可见明显的肿瘤组织生长;经组织学检测,可见肿瘤细胞在脾、肾、腺胃、心内呈局灶性或弥散性生长(图 1)。对照组试验鸡各脏器中未见肿瘤细胞。
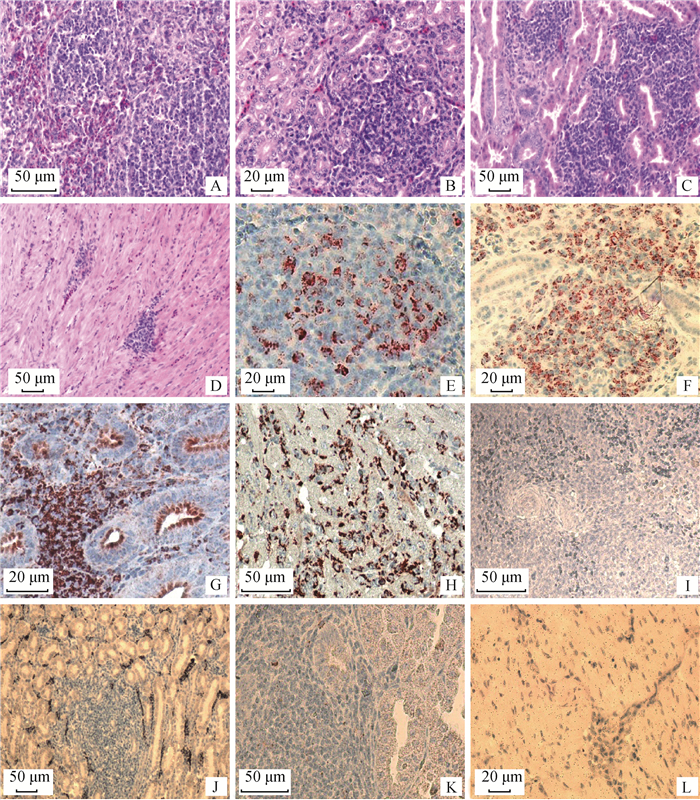
|
A~D.组织学检测,分别为脾、肾、腺胃、心,肿瘤细胞浸润性生长;E~H.免疫组织化学检测,分别为脾、肾、腺胃、心,HSP60在肿瘤细胞的细胞质内强表达;I~L.免疫组织化学阴性对照,分别为脾、肾、腺胃、心 A-D. Tissues of spleen, kidney, proventriculus and myocardium detected by histopathology assay. Infiltrative growth of tumor cells in the tissues; E-H. Tissues of spleen, kidney, proventriculus and myocardium detected by immunohistochemistry assay. HSP60 expressed preferentially in the cytoplasm of tumor cell; I-L. Negative control of spleen, kidney, proventriculus and myocardium 图 1 组织学及免疫组织化学检测 Fig. 1 Tissues detected by histopathology and immunohistochemistry assay |
由图 1可见,HSP60主要在肿瘤细胞细胞质内强表达;在肾中,肾小管内皮细胞上有HSP60表达,在其他组织的非肿瘤细胞内未见明显表达。
2.3 慢病毒转染条件的优化转染48 h时,发现ENi.S.及Polyberene对MSB-1细胞具有一定毒性,导致细胞固缩和坏死,细胞碎片增多,且并无明显的促转染作用;对不同浓度的慢病毒进行转染效果对比,结果显示慢病毒浓度为1×108 TU·mL-1时,转染效果最佳(图 2)。
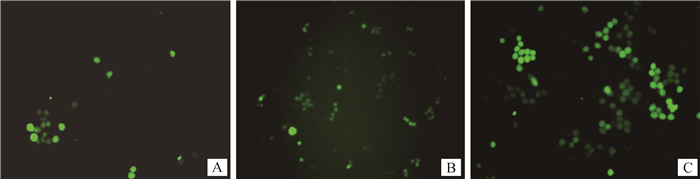
|
A~C.慢病毒浓度分别为106~108 TU·mL-1 A-C. Lentivirus concentration are 106, 107, 108 TU·mL-1, respectively 图 2 慢病毒转染条件优化 Fig. 2 Optimization of lentivirus vector transfection |
通过构建重组质粒,建立标准曲线,GAPDH的标准曲线:y=-2.716x+34.015,一致系数为0.990;HSP60的标准曲线:y=-2.658x+35.596,一致系数为0.997。由图 3、4可见,5147序列慢病毒干扰效果最佳,在转染后36~72 h HSP60转录水平均极显著(P < 0.01)低于对照序列慢病毒干扰组,96 h时仍显著(P < 0.05)低于对照序列组;转染后36~96 h(篇幅所限,图 4仅展示36~72 h数据),HSP60蛋白表达水平明显降低。
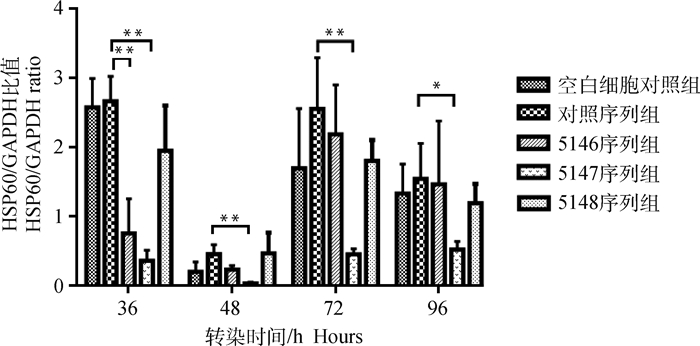
|
*.差异显著(P<0.05);**.差异极显著(P<0.01) *. Significant difference (P < 0.05); **. Extremely significant difference (P < 0.01) 图 3 荧光定量PCR检测HSP60 mRNA水平 Fig. 3 Level of HSP60 mRNA detected by fluorescence quantitative PCR |
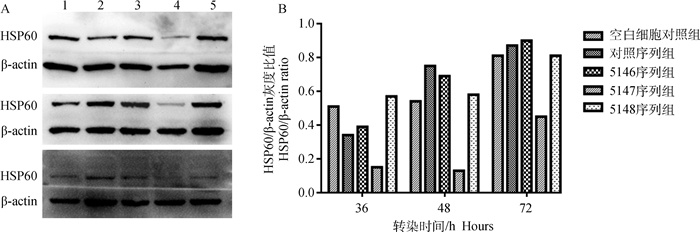
|
A.不同重组慢病毒转染对HSP60表达水平的影响(上:转染后36 h;中:转染后48 h;下:转染后72 h;1~5分别为空白细胞对照组、对照序列组、5146序列组、5147序列组和5148序列组);B. HSP60蛋白灰度扫描结果 A. Effect of lentivirus to the expression of HSP60 (Up: 36 h after transfected; Middle: 48 h after transfected; Down: 72 h after transfected; 1-5. Control cell, control sequence lentivirus, 5146 sequence lentivirus, 5147 sequence lentivirus, 5148 sequence lentivirus, respectively); B. The intensity band ratio of HSP60 to β-actin 图 4 Western blot检测转染后不同时间各组HSP60表达水平 Fig. 4 Expression level of HSP60 at different time post lentivirus transfection by Western blot |
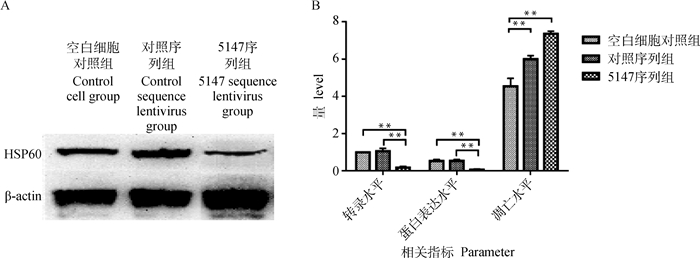
由图 5可见,利用5147序列慢病毒干扰,转染48 h时,HSP60转录水平和蛋白表达水平皆极显著低于对照序列慢病毒干扰组(P<0.01)和空白细胞对照组(P<0.01),而细胞凋亡水平皆极显著高于对照序列慢病毒干扰组(P<0.01)和空白细胞对照组(P<0.01)。
|
A. Western blot检测HSP60表达水平;B. HSP60转录、表达及MSB-1细胞凋亡水平,**.差异极显著(P<0.01) A. The expression level of HSP60 after transfection; B. The transcription and expression level of HSP60 and apoptosis level of MSB-1 after transfection, **. Extremely significant difference (P < 0.01) 图 5 下调HSP60表达对MSB-1细胞凋亡的影响 Fig. 5 Effect of down-regulation of HSP60 on apoptosis of MSB-1 cells |
在肿瘤细胞中,多种HSPs表达量升高[10, 18],抑制肿瘤细胞凋亡和降低放化疗效果[19],目前研究较多的是HSP90,HSP90抑制剂已在多种肿瘤细胞上进行应用,并取得良好效果[20-21]。但HSP60与细胞凋亡的关系存在争议[22-23]。在多种肿瘤细胞中,HSP60表达量增高,对肿瘤细胞增殖发挥保护作用[24]。但也有研究表明,在HeLa细胞中,HSP60复合物通过激活procaspase-3,促进凋亡[25];在食管鳞状上皮细胞癌[26]、卵巢癌[27]组织中,HSP60高表达,预示着预后良好。说明在不同细胞、不同组织中,HSP60对细胞凋亡的调节作用存在差异。目前对HSP60与肿瘤细胞凋亡的作用及分子机制在前列腺癌、乳腺癌、肺癌等腺癌细胞中研究较多[15-16],对淋巴细胞癌内HSP60与肿瘤细胞凋亡的研究鲜有报道。MD是由MDV血清Ⅰ型毒株引起的淋巴增生性疾病,在MDV导致肿瘤的发生发展过程中,HSP60表达量持续升高,且组织内定位与肿瘤细胞具有明显的相关性[13-14]。本文研究结果表明,在MD病例心、腺胃、脾、肾肿瘤组织内,HSP60主要在肿瘤细胞的细胞质内强表达,与文献报道[13-14]相符。MD主要表现为淋巴样细胞增生,本文初次研究了HSP60在MD淋巴组织脾中的组织细胞定位,结果显示HSP60在脾肿瘤细胞细胞质内强表达,在其他淋巴细胞内未见明显表达,证明HSP60的强表达与肿瘤细胞的增生存在密切关系,暗示着HSP60与肿瘤的发生、发展具有重要的生物学作用。
为进一步明确HSP60在MD肿瘤细胞中的生物学作用,本试验利用慢病毒介导的RNAi技术沉默MSB-1细胞中HSP60的表达,MSB-1细胞凋亡水平与空白细胞对照组、对照序列慢病毒组相比,显著升高,说明MSB-1细胞中HSP60基因的表达降低或缺失可使肿瘤细胞的凋亡水平增加。而抑制非肿瘤细胞内HSP60的表达,对细胞的凋亡无显著影响[16]。因此,HSP60可作为MD肿瘤治疗的理想靶点之一。
4 结论在马立克病鸡的心、腺胃、脾、肾肿瘤组织内,HSP60在肿瘤细胞的细胞质内强表达;筛选并应用HSP60 RNA干扰序列,发现HSP60转录、表达水平极显著降低,MSB-1细胞凋亡水平极显著升高。可见在马立克病肿瘤发生、发展过程中,HSP60组织细胞定位与肿瘤细胞具有明显的相关性,降低HSP60表达水平能够导致MSB-1细胞凋亡升高。
| [1] | BERTHAULT C, LARCHER T, HARTLE S, et al. Atrophy of primary lymphoid organs induced by Marek's disease virus during early infection is associated with increased apoptosis, inhibition of cell proliferation and a severe B-lymphopenia[J]. Vet Res, 2018, 49: 31. DOI: 10.1186/s13567-018-0526-x |
| [2] |
蔡秀磊, 李玉保, 李娟, 等. 马立克病毒感染对鸡体液免疫的影响[J]. 黑龙江畜牧兽医, 2014(8): 143–144.
CAI X L, LI Y B, LI J, et al. Effect of Marek's disease virus infection on chicken humoral immunity[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(8): 143–144. (in Chinese) |
| [3] | WU J M, LIU T E, RIOS Z, et al. Heat shock proteins and cancer[J]. Trends Pharmacol Sci, 2017, 38(3): 226–256. DOI: 10.1016/j.tips.2016.11.009 |
| [4] |
李玉保, 王志亮, 鲍恩东. 热应激对SH-SY5Y细胞中PrP及HSP90 mRNA转录水平的影响[J]. 扬州大学学报:农业与生命科学版, 2006, 27(1): 14–18.
LI Y B, WANG Z L, BAO E D. Influence of heat stress on transcription of PrP and HSP90 mRNA in SH-SY5Y cells[J]. Journal of Yangzhou University: Agricultural and Life Science Edition, 2006, 27(1): 14–18. (in Chinese) |
| [5] | BATRA J, TRIPATHI S, KUMAR A, et al. Human heat shock protein 40 (Hsp40/DnaJB1) promotes influenza a virus replication by assisting nuclear import of viral ribonucleoproteins[J]. Sci Rep, 2016, 6: 19063. DOI: 10.1038/srep19063 |
| [6] | MANZOOR R, KURODA K, YOSHIDA R, et al. Heat shock protein 70 modulates influenza A virus polymerase activity[J]. J Biol Chem, 2014, 289(11): 7599–7614. DOI: 10.1074/jbc.M113.507798 |
| [7] | LI Y B, BAO E D, WANG Z L, et al. Detection of HSP mRNA transcription in transport stressed pigs by fluorescence quantitative RT-PCR[J]. Agric Sci China, 2007, 6(3): 361–367. DOI: 10.1016/S1671-2927(07)60057-1 |
| [8] |
李玉保, 裴兰英, 鲍恩东, 等. 运输应激猪HSPs mRNA转录、分布及免疫器官病理性损伤相关性研究[J]. 中国农业科学, 2008, 41(6): 1832–1837.
LI Y B, PEI L Y, BAO E D, et al. Relationship between distribution, transcription level of HSPs mRNA and immunity tissue pathological lesion of transport stressed pigs[J]. Scientia Agricultura Sinica, 2008, 41(6): 1832–1837. DOI: 10.3864/j.issn.0578-1752.2008.06.034 (in Chinese) |
| [9] | HARTL F U, HAYER-HARTL M. Molecular chaperones in the cytosol:from nascent chain to folded protein[J]. Science, 2002, 295(5561): 1852–1858. DOI: 10.1126/science.1068408 |
| [10] | ZHOU C, SUN H W, ZHENG C, et al. Oncogenic HSP60 regulates mitochondrial oxidative phosphorylation to support Erk1/2 activation during pancreatic cancer cell growth[J]. Cell Death Dis, 2018, 9(2): 161. DOI: 10.1038/s41419-017-0196-z |
| [11] | CAPPELLO F, DE MACARIO E C, RAPPA E, et al. Immunohistochemistry of human Hsp60 in health and disease: from autoimmunity to cancer[M]//CALDERWOOD S K, PRINCE T L. Chaperones: Methods and Protocols. New York: Humana Press, 2018: 293-305. |
| [12] | TANG H P, TENG R F, ZHAO X Y, et al. Isotope tracing assisted metabolic profiling:Application to understanding HSP60 silencing mediated tumor progression[J]. Anal Chim Acta, 2019, 1047: 93–103. DOI: 10.1016/j.aca.2018.09.067 |
| [13] |
李娟, 李玉保, 吴晓东, 等. 鸡MD肾组织肿瘤病变与HSP60表达的相关性研究[J]. 畜牧兽医学报, 2013, 44(4): 610–616.
LI J, LI Y B, WU X D, et al. Relationship between expression of HSP60 and tumor lesion of Chickens kidney in progress of MD[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(4): 610–616. (in Chinese) |
| [14] |
段世豪, 路建彪, 李旭勇, 等. 鸡马立克病肝组织肿瘤病变与热休克蛋白转录、表达的相关性研究[J]. 畜牧兽医学报, 2019, 50(2): 415–421.
DUAN S H, LU J B, LI X Y, et al. Relationship between liver tissues pathological lesion and expression level of HSPs in progress of marek's disease[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(2): 415–421. (in Chinese) |
| [15] | CHUN J N, CHOI B, LEE K W, et al. Cytosolic Hsp60 is involved in the NF-κB-dependent survival of cancer cells via IKK regulation[J]. PLoS One, 2010, 5(3): e9422. DOI: 10.1371/journal.pone.0009422 |
| [16] | GHOSH J C, DOHI T, KANG B H, et al. Hsp60 regulation of tumor cell apoptosis[J]. J Biol Chem, 2008, 283(8): 5188–5194. DOI: 10.1074/jbc.M705904200 |
| [17] | YIN B, TANG S, SUN J R, et al. Vitamin C and sodium bicarbonate enhance the antioxidant ability of H9C2 cells and induce HSPs to relieve heat stress[J]. Cell Stress Chaperones, 2018, 23(4): 735–748. DOI: 10.1007/s12192-018-0885-2 |
| [18] | WENG D S, CALDERWOOD S K, GONG J L. A novel heat shock protein 70-based vaccine prepared from DC-tumor fusion cells[M]//CALDERWOOD S K, PRINCE T L. Chaperones: Methods and Protocols. New York: Humana Press, 2018: 359-369. |
| [19] | SNIGIREVA A V, VRUBLEVSKAYA V V, SKARGA Y Y, et al. Cell surface heparan sulfate proteoglycans are involved in the extracellular Hsp90-stimulated migration and invasion of cancer cells[J]. Cell Stress Chaperones, 2019, 24(2): 309–322. DOI: 10.1007/s12192-018-0955-5 |
| [20] | NAGARAJU G P, WU C, MERCHANT N, et al. Epigenetic effects of inhibition of heat shock protein 90 (HSP90) in human pancreatic and colon cancer[J]. Cancer Lett, 2017, 402: 110–116. DOI: 10.1016/j.canlet.2017.05.021 |
| [21] | DJUZENOVA C S, BLASSL C, ROLOFF K, et al. Hsp90 inhibitor NVP-AUY922 enhances radiation sensitivity of tumor cell lines under hypoxia[J]. Cancer Biol Ther, 2012, 13(6): 425–434. DOI: 10.4161/cbt.19294 |
| [22] | RICCI C, CARROTTA R, RAPPA G C, et al. Investigation on different chemical stability of mitochondrial Hsp60 and its precursor[J]. Biophys Chem, 2017, 229: 31–38. DOI: 10.1016/j.bpc.2017.07.008 |
| [23] | ZHANG L X, PELECH S, UITTO V J. Bacterial GroEL-like heat shock protein 60 protects epithelial cells from stress-induced death through activation of ERK and inhibition of caspase 3[J]. Exp Cell Res, 2004, 292(1): 231–240. DOI: 10.1016/j.yexcr.2003.08.012 |
| [24] | CHANDRA D, CHOY G, TANG D G. Cytosolic accumulation of HSP60 during apoptosis with or without apparent mitochondrial release:evidence that its pro-apoptotic or pro-survival functions involve differential interactions with caspase-3[J]. J Biol Chem, 2007, 282(43): 31289–31301. DOI: 10.1074/jbc.M702777200 |
| [25] | SAMALI A, CAI J Y, ZHIVOTOVSKY B, et al. Presence of a pre-apoptotic complex of pro-caspase-3, Hsp60 and Hsp10 in the mitochondrial fraction of jurkat cells[J]. EMBO J, 1999, 18(8): 2040–2048. DOI: 10.1093/emboj/18.8.2040 |
| [26] | FARIED A, SOHDA M, NAKAJIMA M, et al. Expression of heat-shock protein Hsp60 correlated with the apoptotic index and patient prognosis in human oesophageal squamous cell carcinoma[J]. Eur J Cancer, 2004, 40(18): 2804–2811. DOI: 10.1016/j.ejca.2004.08.013 |
| [27] | SCHNEIDER J, JIMÉNEZ E, MARENBACH K, et al. Immunohistochemical detection of HSP60-expression in human ovarian cancer. Correlation with survival in a series of 247 patients[J]. Anticancer Res, 1999, 19(3A): 2141–2146. |



