2. 中国农村技术开发中心, 北京 100045
2. China Rural Technology Development Center, Beijing 100045, China
沙门菌(Salmonella)是一种重要的人畜共患病原菌,不仅可以感染多种畜禽及其他动物,甚至可以通过污染各种食品引起人类食物中毒,可在全球范围内导致不同程度的暴发和流行[1-2]。据报道,我国每年因沙门菌感染而导致的食物中毒事件占细菌性食物中毒的70%~80%[3]。在美国,沙门菌病是导致人类食源性疾病的第二大原因[4],每年约有100万例病例,19 336例住院治疗和378例死亡,沙门菌感染是全世界重要的公共卫生问题[2]。
到目前为止,世界范围内已发现超过2 600种沙门菌血清型,几乎所有沙门菌都可导致人类和动物发生疾病[5]。其中肯塔基沙门菌是一种肠道沙门菌血清型,最初发现于家禽中,随后相继在各种食源性动物与临床患者体内检出,尤其是在家禽及其相关产品[6]。肯塔基沙门菌已在全球范围内发生广泛传播,且在进化过程中对多种抗菌药物产生抗性,先后在埃塞俄比亚、尼日利亚、摩洛哥、波兰和德国等国家的鸡或火鸡中检出多重耐药的肯塔基沙门菌,尤其是对抗菌药物环丙沙星产生的抗性引起了高度关注[7-8]。在中国,曾有研究者在中毒病人以及零售鸡肉中检出肯塔基沙门菌[9-10],但未曾对肯塔基沙门菌进行流行性与耐药性系统的研究。因此本研究对广东省肯塔基沙门菌的流行与耐药情况进行了系统研究,为沙门菌的深入研究、临床治疗用药以及风险预测控制提供基础数据。
1 材料与方法 1.1 材料 1.1.1 样品来源2016年6月至12月,每月从广东省5个市(广州市、深圳市、韶关市、河源市、云浮市)零售市场采样,共采集生鲜鸡肉样品245份。采样方式:每个月从5个城市分别随机挑选一个零售市场采集鸡肉样品8~10份,尽可能在零售市场的不同档口采集鸡肉样品。
1.1.2 主要试剂缓冲蛋白胨水(BPW)、四硫磺酸钠煌绿增菌液基础(TTB)、XLT4琼脂基础培养基、沙门菌显色培养基均购自青岛海博生物技术有限公司;沙门菌诊断血清,泰国S & A公司产品;脉冲场凝胶(PFGE)电泳级琼脂糖(SeaKem Gold Agarose)为Bio-Rad公司产品;Gelred核酸染料为美国Biotium公司产品;限制性内切酶Xbal Ⅰ为宝日医生物技术有限公司产品。
1.1.3 药物氨苄西林(ampicillin, AMP)、头孢他啶(ceftazidime, CAZ)、环丙沙星(ciprofloxacin, CIP)、庆大霉素(gentamicin, GEN)、氟苯尼考(florfenicol, FFC)、亚胺培南(imipenem, IPM)、萘啶酸(nalidixic acid, NAL)、氧氟沙星(ofloxacin, OFX)、多黏菌素B(polymyxin B, PB)、四环素(tetracycline, TET)、阿米卡星(amikacin, AMK)、氯霉素(chloramphenicol, CHL)、磺胺异噁唑(sulfafurazole,SUL)购自赛飞世尔科技(中国)有限公司。
1.1.4 工程菌株药敏试验质控菌株:大肠埃希菌ATCC25922和大肠埃希菌ATCC35218,本实验室保藏;PFGE Marker标准菌株:鼠伤寒沙门菌H9812,本实验室保藏。
1.2 方法 1.2.1 分离鉴定将在零售市场不同档口随机采集的鸡肉样品装入无菌采样袋,在8 h内低温运送至实验室。往无菌采样袋中加入BPW增菌液,37 ℃、100 r·min-1培养6~8 h,取1 mL BPW增菌液于10 mL TTB增菌液中,42 ℃培养18~24 h,再用接种环蘸取适量TTB增菌液接种于XLT4培养基上,37 ℃培养18~24 h,挑取疑似沙门菌菌落(典型形态:色泽黑亮、周围有白色透明环)接种于沙门菌显色培养基上进行纯化,取纯化后的疑似沙门菌进行聚合酶链式反应(PCR)鉴定[11-12]。
1.2.2 血清型鉴定选择泰国S & A公司的血清产品,根据沙门菌血清诊断操作步骤对沙门菌分离株进行血清分型,所得的抗原式根据S & A公司提供的沙门菌抗血清诊断附录,对比后确定沙门菌的血清型[5, 11]。
1.2.3 药敏试验选用13种常见的抗菌药物用琼脂稀释法测肯塔基沙门菌的药物敏感性。按照实验室临床化标准委员会(Clinical and Laboratory Standards Institute,CLSI)2016年版的指导原则进行操作,质控菌株为大肠埃希菌ATCC25922,最小抑菌浓度(minimum inhibitory concentration,MIC)值以CLSI规定的折点值判定结果。
1.2.4 耐药基因检测利用水煮法提取20株肯塔基沙门菌基因组DNA。选择喹诺酮耐药决定区基因(quinolone resistance determining regions, QRDRs)gyrA、gyrB、parC、parE和质粒介导的喹诺酮类耐药基因(plasmid-mediated quinolone resistance, PMQR)qnrA、qnrB、qnrS、qnrC、qnrD、qepA、oqxAB、aac(6')-Ib为扩增对象,β-内酰胺类耐药基因blaTEM、blaCTX-M、blaCMY、blaOXA为扩增对象,引物由广州艾基生物技术有限公司合成,引物设计与PCR反应体系参照相关文献[13-14],扩增后的产物进行琼脂糖凝胶电泳检测,结果为阳性的PCR产物直接送广州市艾基生物技术有限公司测序。测序结果通过NCBI网站(https://www.ncbi.nlm.nih.gov)进行Blast分析,与GenBank上对应基因序列进行比对。
1.2.5 脉冲场凝胶电泳分型操作步骤参考文献[15],将20株肯塔基沙门菌参考文献标准操作规程进行PFGE试验。菌悬液浓度为4.0~4.5麦氏浊度,取400 μL菌悬液及等量的胶制备胶块。将制备好的小胶块放置于有限制性内切酶Xbal Ⅰ的酶切液于37 ℃水浴孵育至少2 h;将酶切后的胶块上样放入盛有2.2 L 0.5×TBE缓冲液的电泳槽中,以国际标准菌株H9812 Xbal Ⅰ酶切片段为PFGE相对分子质量标准。脉冲场电泳反应,电泳液温度为14 ℃,脉冲时间2.16~63.8 s,电泳18~19 h。电泳结束后,取出凝胶,用Gelred染液染色20~30 min,凝胶成像仪读取电泳图谱,以UPGMA方法(unweighted pair-group mean arithmetic,UPGMA)进行聚类分析,根据BioNumerics5.1分析软件绘制的菌株间关系的树状图,判定菌株间的亲缘关系。
2 结果 2.1 分离鉴定及血清型鉴定从广东省五个地级市零售市场采集到鸡肉样品共245份,经分离鉴定得到152份沙门菌阳性样品,阳性率为62.04%(152/245)。通过Kauffmann-White法共鉴定出19种血清型(表 1),其中主要血清型有阿贡纳(29/152,19.08%)、科瓦利斯(25/152,16.45%)以及肯塔基(20/152,13.16%)。
|
|
表 1 152株沙门菌血清型鉴定结果 Table 1 Serotype identification results of 152 strains of Salmonella |
药物敏感性试验结果如图 1所示,肯塔基沙门菌对大部分β-内酰胺类药物、喹诺酮类药物以及四环素类药物耐药严重,其耐药率均超过50%。主要药物耐药率如下:磺胺异噁唑100%(20/20),萘啶酸90%(18/20),四环素75%(15/20),氨苄西林65%(13/20),头孢他啶55%(11/20),环丙沙星55%(11/20),氧氟沙星55%(11/20);对氨基糖苷类药物与酰胺醇类耐药水平较低,其对庆大霉素耐药率为30%(6/20),氟苯尼考30%(6/20),氯霉素35%(7/20),而对阿米卡星完全敏感;对亚胺培南、多黏菌素B这两种药物完全敏感。20株肯塔基沙门菌显示多种多重耐药表型,如表 2所示,其中有85%(17/20)的菌株对3种及3种以上的抗菌药物耐药,共有11种耐药模式,其中以AMP-CAZ-CIP-NA-OFX-CN-SUL-TE(15%)、AMP-CAZ-NA-SUL-TE(15%)为主,其次是FFC-C-SUL-TE(10%)、CIP-NA-OFX-SUL-TE(10%)、AMP-CAZ-CIP-NA-OFX-FFC- C-SUL(10%),最长的耐药模式为AMP-CAZ-CIP-NA-OFX-CN-FFC-C-SUL-TE。

|
图 1 20株肯塔基沙门菌耐药率 Fig. 1 Drug resistance rate of 20 strains of Salmonella Kentucky |
|
|
表 2 20株肯塔基沙门菌多重耐药谱 Table 2 Multiple antibiotic resistance profiles of 20 strains of Salmonella Kentucky |
通过对20株肯塔基沙门菌喹诺酮耐药决定区基因(QRDRs)突变检测发现gyrA、parC基因中共检测出65个突变位点,95%的菌株同时发生gyrA、parC突变,gyrB、parE未检测到突变。95%的菌株发生gyrA突变,突变类型有Ser83Phe(95%)、Asp87Asn(40%)、Asp87Gly(25%);100%的菌株发生parC突变,突变类型有Tyre62Ser(100%)、Ser85Ile(65%)。质粒介导的耐药基因(PMQR)检测结果:aac(6')-Ib-cr(40%)、qnrB(10%)、oqxAB(10%)、qnrS(5%),20株分离菌中均未检测到qnrA、qnrC、qnrD、qepA耐药基因。β-内酰胺类耐药基因的检测结果:blaTEM-1的检出率是20%,blaOXA-1的检出率是10%,blaCTX-M-55的检出率是5%,均未检测到blaCMY-1耐药基因。
2.4 脉冲场凝胶电泳(PFGE分型)肯塔基沙门菌的基因组DNA用Xbal Ⅰ酶切后,进行脉冲场凝胶电泳,将电泳图谱进行聚类分析后绘制成树状图(图 2),按照80%的相似度进行基因分簇,PFGE结果显示,肯塔基沙门菌可分为17个不同的PFGE基因型,相似性最低为44%,最高为100%,将相似性大于等于80%的基因型归为同一个基因簇,则共分成4个基因簇(A、B、C、D簇)与只含单个菌株不成簇的三个基因型(E、F、G型)。其中菌株15091326与菌株SH17SDD163分别来源于韶关市与深圳市,二者相似性为100%,同来自韶关的菌株15091314与广州荔湾的菌株20160707YXC12、20160707YXC4一样,说明耐药菌株分散在不同环境中,并保持一定程度的传播能力,有很大可能通过交通运输、人流活动等途径发生跨地区传播。该20株肯塔基沙门菌PFGE图谱的聚类分析显示菌株之间不同的亲缘关系,并体现了遗传多样性。
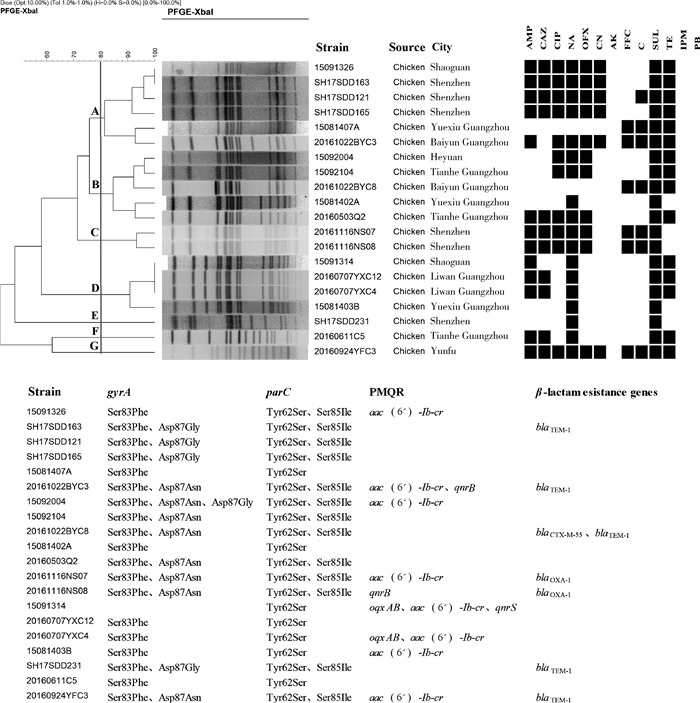
|
图 2 20株肯塔基沙门菌聚类分析图谱 Fig. 2 20 strains of Salmonella Kentucky cluster analysis |
肯塔基沙门菌自1937年报道以来一直与家禽密切相关,近年来多重耐药的肯塔基沙门菌广泛流行于欧洲[6]、北非[16]、北美[8]等地区,特别是耐喹诺酮类药物(环丙沙星)和三代头孢菌素肯塔基沙门菌流行。禽源肯塔基沙门菌在欧美地区备受关注,然而在我国鲜有文献报道。我国曾从腹泻患者粪便和市售鸡肉中分离到高度同源的肯塔基沙门菌[17],这意味着多重耐药肯塔基沙门菌在人和动物之间可能发生了一定散播,对公共卫生造成威胁。通过研究发现肯塔基沙门菌在广东省市售鸡肉沙门菌分离株中属位列前三的血清型[12],表明广东省市售鸡肉中肯塔基沙门菌污染较为严重,因此通过监测广东省零售市场鸡肉中肯塔基沙门菌的流行与耐药情况,对广东地区的食品安全与公共卫生具有重要意义。
20株肯塔基沙门菌药敏试验结果发现其中对萘啶酸、四环素、氨苄西林等传统药物耐药率均大于65%,与此前报道鸡源沙门菌对传统药物的耐药率基本一致[18-20]。由于喹诺酮类药物在促进畜禽生长、预防疾病方面有一定效果, 导致该类药物在畜禽养殖中广泛使用,细菌在药物长期的选择压力下已造成严重耐药[11],本研究中菌株对喹诺酮类药物如环丙沙星耐药率高达55%,这与加拿大在2008-2009年分离到肯塔基沙门菌耐药率相当[8],MIC≥32 mg·L-1,属于高水平环丙沙星耐药的肯塔基沙门菌,该特性此前已在国际上引起高度关注[8, 21];头孢菌素作为沙门菌感染的临床一线治疗用药,具有高效的广谱抗菌作用[22]。值得注意的是,部分菌株已经对三代头孢产生严重的耐药现象,对头孢他啶产生的耐药率达55%,对三代头孢的耐药率较美国屠宰肉鸡中的肯塔基沙门菌高出3倍[23],这将会给临床用药选择带来极大的挑战。而本研究中对于氨基糖苷类药物(庆大霉素、氯霉素、阿米卡星)以及酰胺醇类药物(氟苯尼考)耐药水平较低,对实际禽肉生产过程中指导用药有重要意义;由于抗菌药物在畜禽养殖过程中的广泛使用及滥用,导致能抵抗多种抗菌药的菌株愈来愈多[24-25],在本研究中发现有85%(17/20)的菌株对3种及3种以上的抗菌药物同时耐药,其中有1株来源于广东云浮的菌株耐药最多,可同时耐10种药物。20株肯塔基沙门菌表现出11种耐药谱型,无明显优势耐药谱型。
在抗菌药物的作用压力下,动物源性耐药沙门菌不断增加,细菌的耐药机制相当繁杂,但耐药表型与耐药基因之间往往存在着密切联系[26]。氟喹诺酮类药物对微生物最主要的作用靶位是DNA解旋酶A亚基和B亚基(gyrA和gyrB)及拓扑异构酶Ⅳ C亚基和E亚基(parC和parE),一般来说,gyrA和parC基因的突变是细菌对喹诺酮类抗生素耐药最常见的机制[27]。在本研究中gyrA基因发生有三种突变类型:Ser83Phe(95%)、Asp87Asn(40%)、Asp87Gly(25%),有57.89%(11/19)的菌株发生gyrA双突变,5.26%(1/9)发生gyrA三突变;100%的菌株发生parC突变,突变类型有Tyre62Ser(100%)、Ser85Ile(65%)。gyrA基因突变位点与耐环丙沙星肯塔基沙门菌的相关报道一致,尤其是第87位点突变会导致环丙沙星耐药性增加[16];然而对于parC基因常发生突变位点为Ser80Ile与Tyr57Ser等,与本研究中parC基因突变位点不同。在本研究中parC基因中Tyre62Ser(100%)位点突变对肯塔基沙门菌意义不大,而突变位点Ser85Ile的发生与环丙沙星耐药具有很大的相关性。值得注意的是,本研究中对于萘啶酸和环丙沙星的耐药率分别为90%、55%,DRQRs突变结果与耐药结果基本相符,发现当gyrA与parC同时发生双突变时可高度介导环丙沙星耐药。另外,也有可能是部分菌株中存有质粒,因为质粒可借助自身固有的特性在细菌间通过接合和转化的方式携带耐药基因发生转移,这可能与沙门菌耐药率上升密切相关[25]。本试验中,未检出qnrA、qnrC、qnrD、qepA耐药基因。aac(6')-Ib-cr耐药基因的检出率是40%,其多以整合子的形式存在于多重耐药质粒的基因盒上[28],本研究中发现有20%菌株发生aac(6')-Ib-cr耐药基因与ESBLs耐药基因共存,这与多重耐药表型相符。qnr基因并不改变药物在菌体内的蓄积,也不影响外膜蛋白的结构,而是通过保护DNA促旋酶和拓扑异构酶Ⅳ不受药物的抑制来降低细菌对喹诺酮类药物的敏感性,qnrB、qnrS耐药基因在肯塔基沙门菌的检出率分别是10%、5%,这与此前张增峰等[29]的报道基本一致。oqxAB基因是耐药结节分化超家族多重耐药外排泵,oqxAB在本研究中的检出率为10%,可介导细菌对喹诺酮类药物的耐药性[30]。ESBLs是由质粒介导的酶,可以水解氨曲南等单环β-内酰胺类抗生素以及头孢他啶和头孢噻肟等第三代头孢菌素,ESBLs的检出率不断增加使临床治疗面临着极大的挑战[31]。本试验中β-内酰胺类耐药基因的检出率为35%,这与氨苄西林和头孢他啶耐药结果有一定的出入,有可能存在其他耐药机制介导对β-内酰胺类抗生素耐药。
在许多细菌性病原体的流行病学调查中,PFGE一直被证明是一种高度区别性的亚型分型方法。在本研究中对20株肯塔基沙门菌进行脉冲场凝胶电泳,聚类分析结果显示肯塔基沙门菌基因型相似性在44%~100%。另外,从不同地区采集的肯塔基沙门菌分离株中发现了2种相同的PFGE模式,提示鸡肉中可能存在沙门菌沿生产链水平传播的情况。但值得注意的是,同源度高的菌株在耐药特征(携带的PMQR、ESBLs基因或耐药谱)上并无明显吻合性,这与张丽华等[32]的研究一致。
本研究可为畜禽养殖临床用药提供理论指导,为防控食品安全做好预警工作,加强市售鸡肉的安全管控,对保障公共卫生安全及其人类健康具有重要意义。
4 结论广东省零售市场鸡肉中沙门菌污染情况严重,血清型众多。肯塔基沙门菌是位列前三的主要流行血清型,具有多种多重耐药表型,尤其是对环丙沙星与头孢他啶高度耐药,其大部分耐药表型与耐药基因之间关系密切。不同地区的部分菌株同源性高,亲缘关系密切。
| [1] |
贾华云, 王岚, 张红, 等. 食源性沙门菌耐药性研究进展[J]. 实用预防医学, 2017, 24(11): 1401–1404.
JIA H Y, WANG L, ZHANG H, et al. Progress on antibiotic resistance of foodborne Salmonella isolates[J]. Practical Preventive Medicine, 2017, 24(11): 1401–1404. DOI: 10.3969/j.issn.1006-3110.2017.11.036 (in Chinese) |
| [2] | SCALLAN E, HOEKSTRA R M, ANGULO F J, et al. Foodborne illness acquired in the united states—major pathogens[J]. Emerg Infect Dis, 2011, 17(1): 7–15. DOI: 10.3201/eid1701.P11101 |
| [3] |
曾晓芳. 畜产品中沙门氏菌污染的检测与控制[J]. 四川畜牧兽医, 2003, 30(4): 28–29.
ZENG X F. Infection & control of Salmonella pollution in domestic animal products[J]. Sichuan Animal & Veterinary Sciences, 2003, 30(4): 28–29. DOI: 10.3969/j.issn.1001-8964.2003.04.019 (in Chinese) |
| [4] | TACK D M, MARDER E P, GRIFFIN P M, et al. Preliminary incidence and trends of infections with pathogens transmitted commonly through food-foodborne diseases active surveillance network, 10 U. S. Sites, 2015-2018[J]. Am J Transplantat, 2019, 19(6): 1859–1863. DOI: 10.1111/ajt.15412 |
| [5] |
王嘉炜, 肖英平, 杨华, 等. 鸡肉源沙门氏菌血清型、药敏性及部分耐药基因研究[J]. 食品科学, 2017, 38(15): 140–146.
WANG J W, XIAO Y P, YANG H, et al. Serotyping, antibiotic susceptibility and some genes associated with quinolones and fluoroquinolines resistance of chicken-borne Salmonella[J]. Food Science, 2017, 38(15): 140–146. DOI: 10.7506/spkx1002-6630-201715023 (in Chinese) |
| [6] | LE HELLO S, HENDRIKSEN R S, DOUBLET B, et al. International spread of an epidemic population of Salmonella enterica serotype Kentucky ST198 resistant to ciprofloxacin[J]. J Infect Dis, 2011, 204(5): 675–684. DOI: 10.1093/infdis/jir409 |
| [7] |
徐耀辉, 邓同炜, 齐亚如, 等. 三黄种鸡场孵化死胚中沙门菌的分离鉴定与耐药性分析[J]. 畜牧兽医学报, 2018, 49(5): 1081–1088.
XU Y H, DENG T W, QI Y R, et al. Isolation, identification and antimicrobial resistance of Salmonella from dead chicken embryos in Sanhuang breeder farms[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 1081–1088. (in Chinese) |
| [8] | MULVEY M R, BOYD D A, FINLEY R, et al. Ciprofloxacin-resistant Salmonella enterica serovar Kentucky in Canada[J]. Emerg Infect Dis, 2013, 19(6): 999–1001. DOI: 10.3201/eid1906.121351 |
| [9] |
王清, 代彦, 张勇. 首次在四川地区食物中毒中检出肯塔基沙门菌分析[J]. 现代预防医学, 2010, 37(20): 3914–3916.
WANG Q, DAI Y, ZHANG Y. Detection analysis on Salmonella Kentucky in food poisoning on the first time in the Sichuan region[J]. Modern Preventive Medicine, 2010, 37(20): 3914–3916. (in Chinese) |
| [10] |
杨小鹃, 吴清平, 张菊梅, 等. 广东部分零售畜禽产品沙门菌生化型和血清型分析[J]. 卫生研究, 2013, 42(4): 615–618.
YANG X J, WU Q P, ZHANG J M, et al. Biochemical and serological characterization Salmonella from retail meats in Guangdong province[J]. Journal of Hygiene Research, 2013, 42(4): 615–618. (in Chinese) |
| [11] | RAHN K, DE GRANDIS S A, CLARKE R C, et al. Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella[J]. Mol Cell Prob, 1992, 6(4): 271–279. DOI: 10.1016/0890-8508(92)90002-F |
| [12] | ZHANG L, FU Y, XIONG Z, et al. Highly prevalent multidrug-resistant Salmonella From chicken and pork meat at retail markets in Guangdong, China[J]. Front Microbiol, 2018, 9: 2014. DOI: 10.3389/fmicb.2018.02014 |
| [13] |
张文慧. aac(6')-Ib-cr基因对氟喹诺酮类药物耐药的作用研究[D].广州: 华南农业大学, 2016: 21-25.
ZHANG W H. Characteristic of the aac(6')-Ib-cr gene on fluoroquinolone resistance[D]. Guangzhou: South China Agricultural University, 2016: 21-25. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923610.htm |
| [14] |
宁家宝, 陈建红, 张济培, 等. 鸡白痢沙门杆菌对β-内酰胺类药物耐药性和耐药基因检测分析[J]. 黑龙江畜牧兽医, 2014(17): 151–152.
NING J B, CHEN J H, ZHANG J P, et al. Detection of β-lactam drug resistance and drug resistance genes in Salmonella pullorum[J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(17): 151–152. (in Chinese) |
| [15] |
唐攀, 崔恩慧, 刘万华, 等. 鸡源沙门菌PFGE分型及耐药性研究[J]. 动物医学进展, 2013, 34(11): 1–5.
TANG P, CUI E H, LIU W H, et al. Study on PFGE typing and drug resistance of chicken Salmonella[J]. Progress in Veterinary Medicine, 2013, 34(11): 1–5. DOI: 10.3969/j.issn.1007-5038.2013.11.001 (in Chinese) |
| [16] | LE HELLO S, HARROIS D, BOUCHRIF B, et al. Highly drug-resistant Salmonella enterica serotype Kentucky ST198-X1: a microbiological study[J]. Lancet Infect Dis, 2013, 13(8): 672–679. DOI: 10.1016/S1473-3099(13)70124-5 |
| [17] |
杨元斌, 高红, 章丹阳, 等. 浙江省宁波市多重耐药肯塔基沙门菌的检出及病原学分析[J]. 疾病监测, 2018, 33(6): 510–514.
YANG Y B, GAO H, ZHANG D Y, et al. Etiology of multi-drug resistant Salmonella Kentucky isolates from retail chicken and a patient in Ningbo[J]. Disease Surveillance, 2018, 33(6): 510–514. (in Chinese) |
| [18] |
徐耀辉, 齐亚如, 周俊豪, 等. 河南省种鸡场鸡白痢沙门菌的耐药性分析[J]. 中国兽医杂志, 2018, 54(7): 69–73.
XU Y H, QI Y R, ZHOU J H, et al. Antimicrobial resistance analysis of Salmonella pullorum in breeding chicken farms in Henan[J]. Chinese Journal of Veterinary Medicine, 2018, 54(7): 69–73. (in Chinese) |
| [19] |
罗薇, 黄翠颖, 王洋, 等. 某规模化种鸡场沙门菌流行病学调查和耐药性分析[J]. 中国家禽, 2019, 41(2): 49–52.
LUO W, HUANG C Y, WANG Y, et al. Epidemiological investigation and drug resistance analysis of Salmonella in a Large-scale Chicken Farm[J]. China Poultry, 2019, 41(2): 49–52. (in Chinese) |
| [20] |
张博. 禽源沙门氏菌对四环素耐药分析[J]. 中国畜禽种业, 2018, 14(5): 38.
ZHANG B. Analysis of resistance to tetracycline by avian Salmonella[J]. The Chinese Livestock and Poultry Breeding, 2018, 14(5): 38. DOI: 10.3969/j.issn.1673-4556.2018.05.032 (in Chinese) |
| [21] | ABGOTTSPON H, ZURFLUH K, NVESCH-INDERBINEN M, et al. Quinolone resistance mechanisms in Salmonella enterica serovars Hadar, Kentucky, Virchow, Schwarzengrund, and 4, 5, 12:i:-, isolated from humans in Switzerland, and identification of a novel qnrD variant, qnrD2, in S.Hadar[J]. Antimicrob Agents Chemother, 2014, 58(6): 3560–3563. DOI: 10.1128/AAC.02404-14 |
| [22] |
孙刚. 第三代头孢菌素类抗菌药物的药理作用及临床应用[J]. 临床合理用药杂志, 2019, 12(6): 116–117, 119.
SUN G. Pharmacological action and clinical application of third-generation cephalosporin antibacterials[J]. Chinese Journal of Clinical Rational Drug Use, 2019, 12(6): 116–117, 119. (in Chinese) |
| [23] | LADELY S R, MEINERSMANN R J, BALL T A, et al. Antimicrobial susceptibility and plasmid replicon typing of Salmonella enterica serovar Kentucky isolates recovered from broilers[J]. Foodborne Pathog Dis, 2016, 13(6): 309–315. DOI: 10.1089/fpd.2015.2102 |
| [24] | VO A T T, VAN DUIJKEREN E, FLUIT A C, et al. Distribution of Salmonella enterica Serovars from humans, livestock and meat in Vietnam and the Dominance of Salmonella Typhimurium Phage Type 90[J]. Vet Microbiol, 2006, 113(1-2): 153–158. DOI: 10.1016/j.vetmic.2005.10.034 |
| [25] |
杨保伟, 盛敏, 席美丽, 等. 沙门氏菌抗生素抗性机理研究进展[J]. 微生物学通报, 2008, 35(9): 1479–1484.
YANG B W, SHENG M, XI M L, et al. Progress on studies of mechanism of antibiotic resistance of Salmonella[J]. Microbiology China, 2008, 35(9): 1479–1484. DOI: 10.3969/j.issn.0253-2654.2008.09.024 (in Chinese) |
| [26] |
侯雪娇, 吴科敏, 莫国东, 等. 食源性沙门氏菌耐药表型与耐药基因的研究[J]. 食品科学, 2016, 37(19): 166–170.
HOU X J, WU K M, MO G D, et al. Evaluation of drug-resistant phenotypes and genes in foodborne Salmonella isolates[J]. Food Science, 2016, 37(19): 166–170. DOI: 10.7506/spkx1002-6630-201619028 (in Chinese) |
| [27] | JACOBY G A, STRAHILEVITZ J, HOOPER D C. Plasmid-mediated quinolone resistance[J]. Microbiol Spectr, 2014, 2(5). DOI: 10.1128/microbiolspec.PLAS-0006-2013 |
| [28] | PERILLI M, FORCELLA C, CELENZA G, et al. Evidence for qnrB1 and aac(6')-Ib-cr in CTX-M-15-producing uropathogenic enterobacteriaceae in an Italian teaching hospital[J]. Diagnost Microbiol Infect Dis, 2009, 64(1): 90–93. DOI: 10.1016/j.diagmicrobio.2009.01.009 |
| [29] |
张增峰, 孟晓风, 杨保伟, 等. 鸡肉源沙门氏菌对(氟)喹诺酮类抗生素的耐药性及相关基因[J]. 中国食品学报, 2015, 15(3): 158–165.
ZHANG Z F, MENG X F, YANG B W, et al. Resistance of chickenborne Salmonella to quinolone and fluoroquinolones and related genes[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(3): 158–165. (in Chinese) |
| [30] | YAMANE K, WACHINO J I, SUZUKI S, et al. New plasmid-mediated fluoroquinolone efflux pump, QepA, found in an Escherichia coli clinical isolate[J]. Antimicrob Agents Chemother, 2007, 51(9): 3354–3360. DOI: 10.1128/AAC.00339-07 |
| [31] | BUSH K, JACOBY G A. Updated functional classification of β-Lactamases[J]. Antimicrob Agents Chemother, 2010, 54(3): 969–976. DOI: 10.1128/AAC.01009-09 |
| [32] |
张丽华, 朱学海, 郭主声, 等. 市售活鸡和腹泻患者中非伤寒沙门菌分子特征和耐药性研究[J]. 中国食品卫生杂志, 2014, 26(6): 605–609.
ZHANG L H, ZHU X H, GUO Z S, et al. Investigation on the molecular characteristics and drug resistance of non-typhoidal Salmonella isolates from commercial chickens and diarrhea patients[J]. Chinese Journal of Food Hygiene, 2014, 26(6): 605–609. (in Chinese) |



