外泌体(exosome)是一种能被大多数细胞分泌的微小膜泡,具有脂质双层膜结构,直径大约40~100 nm,而且广泛存在于各种体液中,包括血液、唾液、尿液、精液、乳汁、羊水、阴道液、卵泡液、输卵管腔液、子宫液等,而且几乎哺乳动物所有类型的细胞均可产生外泌体,其内部含有丰富的与其来源细胞或者环境性质相关的蛋白质、脂质、mRNA和miRNA等多种生物成分,可以作为细胞间进行物质和信息传递的“介质”,调节靶细胞的功能,近年来受到了科研工作者的广泛关注与青睐。研究表明,人、小鼠、猪、反刍动物(牛/羊)的子宫腔、卵泡腔、输卵管腔以及胎盘外泌体可能调控受精、胚胎发育、胚胎附植、子宫内膜着床前的一系列发育过程,也会影响子宫内膜着床的相关免疫过程、妊娠期胎盘血管的形成过程等[1-7],而且动物妊娠过程中胎盘特异性外泌体还可以作为妊娠过程中生理/病理上的诊断标志物[8-12]。伴随着科研工作的不断深入,发现外泌体在动物妊娠过程中的作用显得愈发重要,因此本文将从外泌体的发现、发展、在动物妊娠过程中的生物学作用及外泌体与妊娠相关疾病的关系等方面进行阐述,以期为外泌体在妊娠中的研究提供一定的参考。
1 外泌体的发现及研究进展1981年, Trams等[13]通过电镜在鼠源肿瘤细胞中观察到许多直径在40 nm的微小膜泡,1987年,Johnstone等[14]在绵羊的网织红细胞成熟过程中观察到直径在50~100 nm的小膜泡,命名为外泌体,随后,科研人员也分别从猪、大鼠、兔子、豚鼠网织红细胞成熟过程中分离得到外泌体[15-16],由于起初人们一直认为外泌体只是机体释放废物的一种方式,当时并没有引起科研工作者的广泛关注,直到1996年Raposo等[17]和1998年Zitvogel等[18]分别在B淋巴细胞和树突细胞中发现其外泌体在体内具有抗原递呈作用,这才使得外泌体逐渐引起了科研工作者的关注。由于外泌体起初发现于网织红细胞成熟过程中,科研工作者对于外泌体可能在网织红细胞成熟过程中的作用也进行了一定的探索,他们发现,外泌体表面蛋白整合素α4β1(integrin,α4β1)和热应激同源蛋白70(heat shock cognate 70,HSC70)可能在网织红细胞成熟过程中具有重要作用[19-20]。随后几年,人们对于外泌体在肿瘤细胞免疫治疗中可能的作用进行了大量研究。2001年,Pisitkun等[21]通过对尿液中外泌体的分离鉴定及蛋白质组学的分析,认为尿液中的外泌体可能具有作为疾病诊断标志物的潜在作用。2005年,Caby等[22]首次证明了人血浆中外泌体的存在,2006年,Thry等[23]对细胞培养上清及不同体液中外泌体的分离纯化方法进行了系统的描述,为以后外泌体的分离纯化及相关研究奠定了一定的基础,直到2007年Valadi等[24]发现,外泌体来源的RNA(exosomal shuttle RNA,esRNA)可以在细胞间进行传递,影响受体细胞的功能,这一发现极大地促进了外泌体的研究,逐渐引起了外泌体研究的“大爆发”。2009年,Luo等[25]验证了胎盘衍生的外泌体可以携带miRNA进入母体循环,作为妊娠诊断的标志物。2014年,Burns等[4]从绵羊子宫腔中分离得到外泌体,并发现其能够调节孕体滋养外胚层发育,2015年,Vilella等[2]发现,子宫内膜分泌的外泌体能够使胚胎黏附能力增强。由此可见,外泌体在抗原递呈、肿瘤的生长与迁移、组织的损伤修复及胚胎附植等过程中具有重要作用,因此,有必要对其进行更为深入的研究。
2 外泌体在哺乳动物妊娠中的生物学功能具有脂质双层膜结构的外泌体能够很好地防止其内部蛋白质、脂质、核酸的降解,能够作为信号分子改变受体细胞的功能,而且外泌体的功能通常与其来源细胞或者微环境的性质相关。研究发现,附睾液、输卵管腔、卵泡腔、子宫腔中的外泌体可能影响配子发育与胚胎附植。由于哺乳动物的胚胎附植是一个非常复杂且涉及许多基因表达产物的生理过程,涉及到胚胎与母体子宫联系的建立;多年来,科研工作者在胚胎、胎盘的发育及胎盘血管的形成等方面取得了一定的研究成果,但具体机制仍不十分清楚。随着人、小鼠、猪、反刍动物(牛、羊)不同生理阶段子宫液外泌体功能的不断发现与探索,其为研究胚胎附植的机理带来了新的曙光。外泌体在哺乳动物妊娠中的生物学功能见图 1。
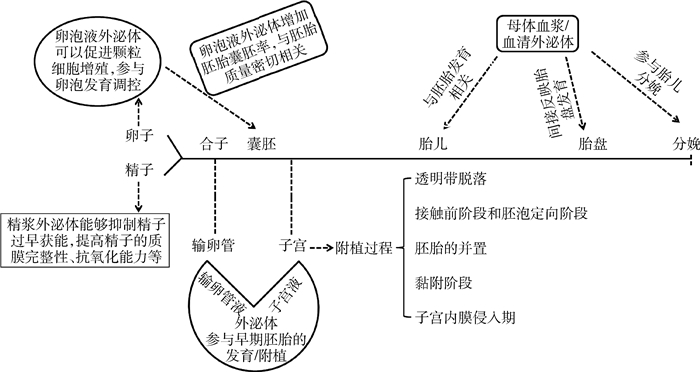
|
图 1 外泌体在哺乳动物妊娠中的作用 Fig. 1 The role of exosomes in mammalian pregnancy |
哺乳动物能否成功妊娠受到多种因素的影响,包括配子的发生和早期胚胎的发育。Sohel等[26]利用亮甲酚蓝(BCB)染色液筛选出利用率高的BCB+牛卵母细胞和利用率低的BCB-牛卵母细胞,并对其外泌体进行miRNA测序,发现miR-526b*、miR-373和miR-654-5p、miR-640分别在BCB+和BCB-卵母细胞中高表达,当其外泌体与牛颗粒细胞共培养时,发现颗粒细胞可以对外泌体进行摄取,能够使颗粒细胞中miR-526b*、miR-373和miR-654-5p、miR-640水平增加,进而改变颗粒细胞中mRNA水平,从而达到对卵母细胞生长发育的调控。而且,牛卵泡中外泌体的浓度随着卵泡大小的增加而降低,通过miRNA测序,发现小卵泡中的miRNA可能主要参与细胞的增殖[27]。随后首次证明,牛卵泡液中的外泌体可能通过Src激酶(Src kinase,Src)/磷脂酰肌醇3激酶(phosphoinositide 3-kinases,PI3K)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路刺激颗粒细胞增殖,而且相比于大卵泡,从小卵泡中分离的外泌体更容易被颗粒细胞摄取[28]。利用卵泡液外泌体处理胚胎,发现其会增加胚胎囊胚率,改变胚胎的总体甲基化水平[29],但其具体的作用机制还有待进一步研究。此外,卵泡液外泌体中的miRNA可以作为成功受精及受精第3天胚胎质量的标志物,Martinez等[30]认为,hsa-miR-92a和hsa-miR-130b与受精状态有关,而hsa-miR-888、hsa-miR-214和hsa-miR-454与受精第3天的胚胎质量密切相关。
Du等[31]利用猪精浆外泌体处理精子,发现外泌体可以抑制精子过早获能,提高精子的质膜完整性和抗氧化能力。利用精浆外泌体处理猪子宫内膜上皮细胞, 发现精浆外泌体可以调控子宫内膜中CCL20和AMCF-II表达,进而调控子宫内膜的免疫和炎症反应,从而为受精做好准备[32]。而且精液外泌体中的miRNA可以作为精子产生障碍的标志物,其中miR-31-5p、miR-539-5p和miR-941与生精障碍高度相关[33]。
2.2 外泌体在胚胎发育过程中的作用研究表明,输卵管作为精子获能、卵子受精以及卵裂的重要场所,其输卵管液外泌体在早期胚胎的发育中具有重要的调控作用。通过对排卵后期、黄体早期、黄体晚期和排卵前期输卵管液中的外泌体进行分离鉴定,发现4个阶段均存在外泌体,而且其miRNA的种类和表达可能受到激素的调节,对外泌体中的miRNA进行高通量测序分析,发现相比于排卵后期,黄体晚期和排卵前期bta-miR-10b、bta-miR-423-3p、bta-miR-125b-2-5p高表达,而bta-miR-449a、bta-miR-200b-3p低表达,暗示其可能在配子、受精/早期胚胎发育中具有重要作用,对输卵管液中外泌体的蛋白质进行分析,发现膜联蛋白A2(annexin A2,ANXA2)、人输卵管糖蛋白-1(oviductal glycoprotein 1,OVGP1)、热休克蛋白8(heat shock 70kDa protein 8,HSPA8)、热休克蛋白90(heat shock protein 90,HSP90)、HSC70等均存在于输卵管液外泌体中,其中ANXA2、OVGP1及热休克蛋白(HSPs)等均被发现在受精和早期胚胎发育中具有重要作用[34-37]。随后用新鲜和冻存过的输卵管液外泌体与早期胚胎进行共培养,发现新鲜和冻存过的输卵管液外泌体均可提高胚胎质量,延长胚泡存活时间,但意外的是冻存后的输卵管液外泌体对体外培养的胚胎效果更好[38]。将输卵管上皮细胞分泌的外泌体(新鲜和冻存的外泌体)添加到体外培养的早期胚胎中,引起PAG1基因表达上调,提高早期胚胎存活率、增加细胞总数和ICM/TE比率,从而有利于早期胚胎的发育[39]。基于以上发现,将从输卵管液中分离的外泌体同样添加到体外培养的早期胚胎中,基本得到与上述试验相同的结果,而且添加外泌体后能够诱导胚胎中AQP3、DNMT3A和SNRPN基因表达水平的升高,提高胚胎的质量[40]。胚胎移植在畜牧业上的应用相对广泛,但其较低的成功率显著限制了这一技术的推广,随着生殖液中外泌体功能的逐渐探索,研究者们对生殖液外泌体可改善胚胎移植成功率低这一现象提出了新的研究方向。Qu等[41]通过对受体和供体小鼠输卵管液中的外泌体进行分离,发现供体小鼠输卵管液中的外泌体浓度显著高于受体小鼠,供体小鼠输卵管液中外泌体能够引起胚胎BAX表达水平下降和BCL-2、OCT-4表达水平升高,可提高胚胎抗凋亡和分化水平,进而提高胚胎的囊胚率、ICM/TE比率和出生率等,改善移植胚胎的存活率。
在胚胎附植前期和附植期,子宫液作为母体环境为胎儿提供营养及漂浮胚胎等,而且作为一种“媒介”很可能在母胎对话中起“信息”传递的作用。人子宫内膜细胞产生的外泌体释放到子宫腔,能够被滋养层细胞摄取,增强其黏附能力,而且子宫内膜细胞产生的外泌体中所含的活性物质受到雌激素和孕激素的调节[42]。研究者通过提取子宫液的外泌体培养小鼠胚胎,发现小鼠胚胎可通过滋养外胚层摄取外泌体,体外试验证实,利用外泌体中miR-30d处理的小鼠胚胎黏附能力增强[2],对其进一步的研究表明,核不均一核糖核蛋白(heterogeneous nuclear ribonucleoprotein C,hnRNPC1)可能影响miR-30d加载到外泌体中,进而影响胚胎的发育[43]。而且,不同生理阶段子宫液外泌体的浓度不同,其作用可能也存在差异。通过比较妊娠与非妊娠小鼠子宫液外泌体的含量,发现妊娠小鼠子宫液中外泌体的含量更加丰富,miR-21的表达量更高,当抑制miR-21的表达后,体外胚胎发育滞缓,利用妊娠小鼠子宫液外泌体处理体外胚胎能够引起胚胎BAX表达水平的下降和BCL-2、OCT-4表达水平的升高,提高胚胎的抗凋亡水平[44]。牛妊娠不同阶段子宫液外泌体对子宫内膜细胞作用不同,利用植入前(妊娠17天)子宫液外泌体处理子宫内膜细胞能够诱导子宫内膜细胞中BAX、CASP3、TNFA和TP53表达水平升高,引起子宫内膜细胞凋亡,而植入后(妊娠19和22天)子宫液外泌体能够诱导子宫内膜细胞中黏附分子VCAM1表达水平升高,从而保证胚胎植入的顺利进行[45],外泌体参与调控哺乳动物胚胎附植机制的研究目前还不多,今后仍需大量科研力量的投入。
近几十年来,体细胞核移植(somatic cell nuclear transfer, SCNT)技术并没有很大的技术突破,随着2018年1月25日《Cell》期刊发表的首例体细胞克隆猴的诞生,使SCNT技术有了一定的提高,而且近几年生殖液外泌体的功能不断被探索,以上研究可能有望改善体细胞克隆胚胎发育效率低、克隆成功率低等技术难点。Qiao等[46]研究发现,牛子宫液外泌体能够诱导体细胞核移植胚胎中IFNτ和Acrogranin基因表达水平升高,HSP70、BAX和BIP的表达水平降低,提高体细胞核移植胚胎的囊胚率、孵化率、ICM/TE比率以及降低胚胎细胞的凋亡,从而保证胚胎的正常发育,同样也为体细胞核移植研究带来了新的方向。
2.3 外泌体与妊娠期子宫内膜免疫的关系哺乳动物能否成功的妊娠依赖于适当的子宫免疫微环境,异常的炎症性免疫反应可能导致妊娠失败,如早期胚胎丢失、复发性流产和早产等。因此,妊娠过程中母胎界面的免疫耐受力是妊娠建立和维持的重要保证。牛胎盘外泌体中的bta-miR-499能够通过靶向Lin28B,经多种途径抑制NF-κB信号通路的激活:1)通过靶向Lin28B,直接抑制NF-κB信号通路的激活;2)通过靶向Lin28B,间接引起bta-let-7 miRNAs家族表达量的升高,进而抑制NRAS的表达,从而达到抑制NF-κB信号通路的激活。胎盘外泌体通过抑制NF-κB信号通路的激活,达到抑制子宫内皮细胞中促炎因子TNF-α和IL-6的表达,从而调控妊娠过程中母胎界面的免疫反应[1]。分娩时母体子宫对胎儿又呈现出免疫排斥的状态,当利用羊膜上皮细胞分泌的外泌体与子宫肌层细胞、蜕膜细胞、滋养层细胞共培养时,能引起子宫肌层细胞、蜕膜细胞中NF-κB信号通路的激活,引起子宫肌层细胞、蜕膜细胞中 IL-6、IL-8、PGE2水平的升高,但不能诱使滋养层细胞中NF-κB信号通路的激活,继而达到促进分娩的作用[47]。因此,羊膜上皮细胞分泌的外泌体能够通过引起母体子宫的炎症反应诱发分娩。
2.4 外泌体与妊娠期胎盘及胎盘血管形成的关系胎盘在妊娠过程中是胎儿发育、生长的重要保障,在妊娠早期,胎儿生长缓慢,主要是胎盘的生长发育,而胎盘血管的形成对维持妊娠同样具有重要作用。Liu等[48]研究发现,随着妊娠的发生及发展母体血液循环中胎盘外泌体的浓度逐渐增加,当对小于胎龄儿(small for gestational age,SGA)和胎儿宫内生长受限(fetal growth restriction,FGR)的母体和胎儿血液循环中总外泌体及胎盘外泌体浓度进行定量,发现母体血液循环中总外泌体及胎盘外泌体浓度不受年龄、胎次的影响,胎儿血液循环中总外泌体及胎盘外泌体浓度不受性别、胎次的影响,而且研究认为,母体血液循环中胎盘外泌体浓度的定量可能反映胎儿及胎盘的生长状况[11]。妊娠早期,母体循环中的胎盘外泌体能够被血管内皮细胞摄取,影响妊娠早期母胎间的“交流”[49-51],暗示其外泌体可能参与血管的形成。Bidarimath等[5]发现,猪滋养外胚层细胞分泌的外泌体能够被猪主动脉内皮细胞摄取并促进其增殖,而且猪滋养外胚层细胞和主动脉内皮细胞分泌的外泌体中miR-16及miR-126-5P显著高表达,而miR-16及miR-126-5P是已经被广泛报道参与胎盘发育及血管形成的miRNA,但其滋养外胚层细胞分泌的外泌体中,miR-16及miR-126-5P是否是引起主动脉内皮细胞增殖的主要原因及其具体的调控机制仍有待于进一步的探究。先兆子痫与胎盘异常和胎盘血管障碍密切相关,Xiong等[52]利用人脐带间充质干细胞分泌的外泌体处理先兆子痫大鼠,显著改善了大鼠先兆子痫胎盘组织的病变,减少了胎盘组织细胞的凋亡,并且引起先兆子痫大鼠血清中VEGF表达升高以及sFlt1的表达抑制,从而促进胎盘血管的生成。
3 外泌体与妊娠相关疾病的关系 3.1 外泌体与先兆子痫的关系先兆子痫作为哺乳动物妊娠过程中的一种常见病,早期预测可为其治疗及预防提供依据。血液循环中的胎盘miRNA可以作为先兆子痫的生物标志物,而目前的研究发现,具有脂质双层膜结构的外泌体由于能够很好地保护内部的活性物质,妊娠期母体血液循环中的外泌体miRNA同样可以作为先兆子痫的生物标志物。研究表明,与正常妊娠相比,先兆子痫患者血液循环中总外泌体的浓度显著增高,迟发性先兆子痫患者血液循环中胎盘外泌体的浓度显著低于早发性先兆子痫患者[53],但具体的调控原因和机制并不清楚。同样,先兆子痫患者血液循环外泌体中总miRNA浓度显著高于正常组,相比于正常组,先兆子痫患者血液循环外泌体中hsa-miR-210-3p的表达量显著增高,而且其程度越严重hsa-miR-210-3p的表达量越高,暗示hsa-miR-210-3p可能是先兆子痫的标志物[54]。Salomon等[55]研究认为,妊娠期母体血液循环外泌体中的hsa-miR-486-1-5p和hsa-miR-486-2-5p可以作为先兆子痫的标志物,由于目前外泌体在先兆子痫中的作用机制并未阐明,所以外泌体中的miRNA能否作为先兆子痫患者特异性的生物标志物,还有待于进一步研究。
3.2 外泌体与早产的关系早产会对孕妇及胎儿造成极大的危害,研究表明,相比于足月剖腹产胎儿,早产胎儿羊水中有较高比率的外泌体来源于胎盘,对早产、胎膜早破、正常足月妊娠、足月剖腹产胎儿羊水外泌体中的差异蛋白质进行通路分析,发现相比于早产、正常足月妊娠胎儿,胎膜早破产妇肝脏X受体/类维生素AX受体通路被激活,相比于足月剖腹产,正常足月妊娠补体系统下调[56],羊水外泌体也许能够提供正常和异常分娩的信息,但具体的调控机制仍有待进一步研究。通过对SCNT早期胚胎丢失组、SCNT足月妊娠组、体外受精足月妊娠组奶牛血液循环外泌体miRNA进行分析,发现SCNT早期胚胎丢失组相比于其他两组miRNA丰度明显较低,暗示外泌体miRNA可能与早期胚胎丢失高度相关,但具体导致miRNA低丰度的机制并不清楚,通过对其miRNA靶基因进行生物信息学分析,发现其主要富集到Wnt、TGF-β、p53等信号通路中[57],暗示这些外泌体miRNA可能在胚胎附植和发育中具有作用。
4 展望目前,外泌体研究主要集中于免疫中的抗原递呈、肿瘤的生长与迁移、组织损伤的修复等。外泌体在哺乳动物受精、胚胎发育、子宫内膜着床的相关免疫、妊娠期胎盘血管的形成、胚胎附植等方面的研究正处于起步阶段,相比于啮齿类动物和人,其在家畜上的研究就更匮乏了,而且目前对于外泌体在哺乳动物妊娠过程中作用的分子机制研究依然不足,因此,对进一步揭示外泌体所包含的内容物在哺乳动物妊娠过程中的作用机制的研究,依旧需要大量科研力量的投入。相信随着生殖液外泌体在哺乳动物中作用的不断研究,将在胚胎的体外培养、胚胎移植、SCNT等方面取得突破,有望推动畜牧业的进一步发展。
| [1] | ZHAO G, YANG C, YANG J, et al. Placental exosome-mediated bta-miR-499-Lin28B/let-7 axis regulates inflammatory bias during early pregnancy[J]. Cell Death Dis, 2018, 9(6): 704. DOI: 10.1038/s41419-018-0713-8 |
| [2] | VILELLA F, MORENO-MOYA J M, BALAGUER N, et al. Hsa-miR-30d, secreted by the human endometrium, is taken up by the pre-implantation embryo and might modify its transcriptome[J]. Development, 2015, 142(18): 3210–3221. DOI: 10.1242/dev.124289 |
| [3] | BURNS G W, BROOKS K E, SPENCER T E. Extracellular vesicles originate from the conceptus and uterus during early pregnancy in sheep[J]. Biol Reprod, 2016, 94(3): 56. |
| [4] | BURNS G, BROOKS K, WILDUNG M, et al. Extracellular vesicles in luminal fluid of the ovine uterus[J]. PLoS One, 2014, 9(3): e90913. DOI: 10.1371/journal.pone.0090913 |
| [5] | BIDARIMATH M, KHALAJ K, KRIDLI R T, et al. Extracellular vesicle mediated intercellular communication at the porcine maternal-fetal interface:a new paradigm for conceptus-endometrial cross-talk[J]. Sci Rep, 2017, 7(1): 40476. |
| [6] | NAKAMURA K, KUSAMA K, BAI R, et al. Induction of IFNT-stimulated genes by conceptus-derived exosomes during the attachment period[J]. PLoS One, 2016, 11(6): e0158278. DOI: 10.1371/journal.pone.0158278 |
| [7] | ZHANG Y, WANG Q, WANG H M, et al. Uterine fluid in pregnancy:a biological and clinical outlook[J]. Trends Mol Med, 2017, 23(7): 604–614. DOI: 10.1016/j.molmed.2017.05.002 |
| [8] | VARGAS A, ZHOU S F, ÉTHIER-CHIASSON M, et al. Syncytin proteins incorporated in placenta exosomes are important for cell uptake and show variation in abundance in serum exosomes from patients with preeclampsia[J]. FASEB J, 2014, 28(8): 3703–3719. DOI: 10.1096/fj.13-239053 |
| [9] | CLEYS E R, HALLERAN J L, MCWHORTER E, et al. Identification of microRNAs in exosomes isolated from serum and umbilical cord blood, as well as placentomes of gestational day 90 pregnant sheep[J]. Mol Reprod Dev, 2014, 81(11): 983–993. DOI: 10.1002/mrd.22420 |
| [10] | RODOSTHENOUS R S, BURRIS H H, SANDERS A P, et al. Second trimester extracellular microRNAs in maternal blood and fetal growth:an exploratory study[J]. Epigenetics, 2017, 12(9): 804–810. DOI: 10.1080/15592294.2017.1358345 |
| [11] | MIRANDA J, PAULES C, NAIR S, et al. Placental exosomes profile in maternal and fetal circulation in intrauterine growth restriction - Liquid biopsies to monitoring fetal growth[J]. Placenta, 2018, 64: 34–43. DOI: 10.1016/j.placenta.2018.02.006 |
| [12] | FALLEN S, BAXTER D, WU X G, et al. Extracellular vesicle RNAs reflect placenta dysfunction and are a biomarker source for preterm labour[J]. J Cell Mol Med, 2018, 22(5): 2760–2773. DOI: 10.1111/jcmm.13570 |
| [13] | TRAMS E G, LAUTER C J, SALEM N Jr, et al. Exfoliation of membrane ecto-enzymes in the form of micro-vesicles[J]. Biochim Biophys Acta, 1981, 645(1): 63–70. DOI: 10.1016/0005-2736(81)90512-5 |
| [14] | JOHNSTONE R M, ADAM M, HAMMOND J R, et al. Vesicle formation during reticulocyte maturation.Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem, 1987, 262(19): 9412–9420. |
| [15] | JOHNSTONE R M, BIANCHINI A, TENG K. Reticulocyte maturation and exosome release:transferrin receptor containing exosomes shows multiple plasma membrane functions[J]. Blood, 1989, 74(5): 1844–1851. DOI: 10.1182/blood.V74.5.1844.1844 |
| [16] | VIDAL M, SAINTE-MARIE J, PHILIPPOT J R, et al. Asymmetric distribution of phospholipids in the membrane of vesicles released during in vitro maturation of guinea pig reticulocytes:evidence precluding a role for "aminophospholipid translocase"[J]. J Cell Physiol, 1989, 140(3): 455–462. DOI: 10.1002/jcp.1041400308 |
| [17] | RAPOSO G, NIJMAN H W, STOORVOGEL W, et al. B lymphocytes secrete antigen-presenting vesicles[J]. J Exp Med, 1996, 183(3): 1161–1172. DOI: 10.1084/jem.183.3.1161 |
| [18] | ZITVOGEL L, REGNAULT A, LOZIER A, et al. Eradication of established murine tumors using a novel cell-free vaccine:dendritic cell derived exosomes[J]. Nat Med, 1998, 4(5): 594–600. DOI: 10.1038/nm0598-594 |
| [19] | RIEU S, GÉMINARD C, RABESANDRATANA H, et al. Exosomes released during reticulocyte maturation bind to fibronectin via integrin α4β1[J]. Eur J Biochem, 2000, 267(2): 583–590. DOI: 10.1046/j.1432-1327.2000.01036.x |
| [20] | GÉMINARD C, NAULT F, JOHNSTONE R M, et al. Characteristics of the interaction between Hsc70 and the transferrin receptor in exosomes released during reticulocyte maturation[J]. J Biol Chem, 2001, 276(13): 9910–9916. DOI: 10.1074/jbc.M009641200 |
| [21] | PISITKUN T, SHEN R F, KNEPPER M A. Identification and proteomic profiling of exosomes in human urine[J]. Proc Natl Acad Sci U S A, 2004, 101(36): 13368–13373. DOI: 10.1073/pnas.0403453101 |
| [22] | CABY M P, LANKAR D, VINCENDEAU-SCHERRER C, et al. Exosomal-like vesicles are present in human blood plasma[J]. Int Immunol, 2005, 17(7): 879–887. DOI: 10.1093/intimm/dxh267 |
| [23] | THÉRY C, AMIGORENA S, RAPOSO G, et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[J]. Curr Protoc Cell Biol, 2006, 30(3): 3.22.1–3.22.29. |
| [24] | VALADI H, EKSTROM K, BOSSIOS A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007, 9(6): 654–659. DOI: 10.1038/ncb1596 |
| [25] | LUO S S, ISHIBASHI O, ISHIKAWA G, et al. Human villous trophoblasts express and secrete placenta-specific microRNAs into maternal circulation via exosomes[J]. Biol Reprod, 2009, 81(4): 717–729. DOI: 10.1095/biolreprod.108.075481 |
| [26] | SOHEL M M H, HOELKER M, NOFERESTI S S, et al. Exosomal and non-exosomal transport of extra-cellular micrornas in follicular fluid:implications for bovine oocyte developmental competence[J]. PLoS One, 2013, 8(11): e78505. DOI: 10.1371/journal.pone.0078505 |
| [27] | NAVAKANITWORAKUL R, HUNG W T, GUNEWARDENA S, et al. Characterization and small RNA content of extracellular vesicles in follicular fluid of developing bovine antral follicles[J]. Sci Rep, 2016, 6(1): 25486. DOI: 10.1038/srep25486 |
| [28] | HUNG W T, NAVAKANITWORAKUL R, KHAN T, et al. Stage-specific follicular extracellular vesicle uptake and regulation of bovine granulosa cell proliferation[J]. Biol Reprod, 2017, 97(4): 644–655. DOI: 10.1093/biolre/iox106 |
| [29] | DA SILVEIRA J C, ANDRADE G M, DEL COLLADO M, et al. Supplementation with small-extracellular vesicles from ovarian follicular fluid during in vitro production modulates bovine embryo development[J]. PLoS One, 2017, 12(6): e0179451. DOI: 10.1371/journal.pone.0179451 |
| [30] | MARTINEZ R M, LIANG L M, RACOWSKY C, et al. Extracellular microRNAs profile in human follicular fluid and IVF outcomes[J]. Sci Rep, 2018, 8(1): 17036. DOI: 10.1038/s41598-018-35379-3 |
| [31] | DU J, SHEN J, WANG Y X, et al. Boar seminal plasma exosomes maintain sperm function by infiltrating into the sperm membrane[J]. Oncotarget, 2016, 7(37): 58832–58847. |
| [32] | BAI R L, LATIFI Z, KUSAMA K, et al. Induction of immune-related gene expression by seminal exosomes in the porcine endometrium[J]. Biochem Biophys Res Commun, 2018, 495(1): 1094–1101. DOI: 10.1016/j.bbrc.2017.11.100 |
| [33] | BARCELÍ M, MATA A, BASSAS L, et al. Exosomal microRNAs in seminal plasma are markers of the origin of azoospermia and can predict the presence of sperm in testicular tissue[J]. Hum Reprod, 2018, 33(6): 1087–1098. DOI: 10.1093/humrep/dey072 |
| [34] | ALMIÑANA C, TSIKIS G, LABAS V, et al. Deciphering the oviductal extracellular vesicles content across the estrous cycle:implications for the gametes-oviduct interactions and the environment of the potential embryo[J]. BMC Genomics, 2018, 19(1): 622. DOI: 10.1186/s12864-018-4982-5 |
| [35] | TEIJEIRO J M, IGNOTZ G G, MARINI P E. Annexin A2 is involved in pig (Sus scrofa)sperm-oviduct interaction[J]. Mol Reprod Dev, 2009, 76(4): 334–341. DOI: 10.1002/mrd.20958 |
| [36] | ALGARRA B, MAILLO V, AVILES M, et al. Effects of recombinant OVGP1 protein on in vitro bovine embryo development[J]. J Reprod Dev, 2018, 64(5): 433–443. DOI: 10.1262/jrd.2018-058 |
| [37] | CHOUDHARY S, KUMARESAN A, KUMAR M, et al. Effect of recombinant and native buffalo OVGP1 on sperm functions and in vitro embryo development:a comparative study[J]. J Anim Sci Biotechnol, 2017, 8: 69. DOI: 10.1186/s40104-017-0201-5 |
| [38] | ALMINANA C, CORBIN E, TSIKIS G, et al. Oviduct extracellular vesicles protein content and their role during oviduct-embryo cross-talk[J]. Reproduction, 2017, 154(3): 153–168. |
| [39] | LOPERA-VÁSQUEZ R, HAMDI M, FERNANDEZ-FUERTES B, et al. Extracellular vesicles from BOEC in in vitro embryo development and quality[J]. PLoS One, 2016, 11(2): e0148083. DOI: 10.1371/journal.pone.0148083 |
| [40] | LOPERA-VASQUEZ R, HAMDI M, MAILLO V, et al. Effect of bovine oviductal extracellular vesicles on embryo development and quality in vitro[J]. Reproduction, 2017, 153(4): 461–470. DOI: 10.1530/REP-16-0384 |
| [41] | QU P X, ZHAO Y L, WANG R, et al. Extracellular vesicles derived from donor oviduct fluid improved birth rates after embryo transfer in mice[J]. Reprod Fertil Dev, 2019, 31(2): 324–332. DOI: 10.1071/RD18203 |
| [42] | GREENING D W, NGUYEN H P, ELGASS K, et al. Human endometrial exosomes contain hormone-specific cargo modulating trophoblast adhesive capacity:insights into endometrial-embryo interactions[J]. Biol Reprod, 2016, 94(2): 38. |
| [43] | BALAGUER N, MORENO I, HERRERO M, et al. Heterogeneous nuclear ribonucleoprotein C1 may control miR-30d levels in endometrial exosomes affecting early embryo implantation[J]. Mol Hum Reprod, 2018, 24(8): 411–425. DOI: 10.1093/molehr/gay026 |
| [44] | LV C, YU W X, WANG Y, et al. microRNA-21 in extracellular vesicles contributes to the growth of fertilized eggs and embryo development in mice[J]. Biosci Rep, 2018, 38(4): BSR20180036. DOI: 10.1042/BSR20180036 |
| [45] | KUSAMA K, NAKAMURA K, BAI R L, et al. Intrauterine exosomes are required for bovine conceptus implantation[J]. Biochem Biophys Res Commun, 2018, 495(1): 1370–1375. DOI: 10.1016/j.bbrc.2017.11.176 |
| [46] | QIAO F, GE H, MA X N, et al. Bovine uterus-derived exosomes improve developmental competence of somatic cell nuclear transfer embryos[J]. Theriogenology, 2018, 114: 199–205. DOI: 10.1016/j.theriogenology.2018.03.027 |
| [47] | HADLEY E E, SHELLER-MILLER S, SAADE G, et al. Amnion epithelial cell-derived exosomes induce inflammatory changes in uterine cells[J]. Am J Obstet Gynecol, 2018, 219(5): 471.e1–478.e21. |
| [48] | LIU H Y, KANG M, WANG J J, et al. Estimation of the burden of human placental micro- and nano-vesicles extruded into the maternal blood from 8 to 12 weeks of gestation[J]. Placenta, 2018, 72-73: 41–47. DOI: 10.1016/j.placenta.2018.10.009 |
| [49] | TONG M, CHEN Q, JAMES J L, et al. In vivo targets of human placental micro-vesicles vary with exposure time and pregnancy[J]. Reproduction, 2017, 153(6): 835–845. DOI: 10.1530/REP-16-0615 |
| [50] | TONG M, KLEFFMANN T, PRADHAN S, et al. Proteomic characterization of macro-, micro- and nano-extracellular vesicles derived from the same first trimester placenta:relevance for feto-maternal communication[J]. Hum Reprod, 2016, 31(4): 687–699. DOI: 10.1093/humrep/dew004 |
| [51] | TONG M, STANLEY J L, CHEN Q, et al. Placental nano-vesicles target to specific organs and modulate vascular tone in vivo[J]. Hum Reprod, 2017, 32(11): 2188–2198. DOI: 10.1093/humrep/dex310 |
| [52] | XIONG Z H, WEI J, LU M Q, et al. Protective effect of human umbilical cord mesenchymal stem cell exosomes on preserving the morphology and angiogenesis of placenta in rats with preeclampsia[J]. Biomed Pharmacother, 2018, 105: 1240–1247. DOI: 10.1016/j.biopha.2018.06.032 |
| [53] | PILLAY P, MAHARAJ N, MOODLEY J, et al. Placental exosomes and pre-eclampsia:maternal circulating levels in normal pregnancies and, early and late onset pre-eclamptic pregnancies[J]. Placenta, 2016, 46: 18–25. DOI: 10.1016/j.placenta.2016.08.078 |
| [54] | BIRÍ O, ALASZTICS B, MOLVAREC A, et al. Various levels of circulating exosomal total-miRNA and miR-210 hypoxamiR in different forms of pregnancy hypertension[J]. Pregnancy Hypertens, 2017, 10: 207–212. DOI: 10.1016/j.preghy.2017.09.002 |
| [55] | SALOMON C, GUANZON D, SCHOLZ-ROMERO K, et al. Placental exosomes as early biomarker of preeclampsia:potential role of exosomal microRNAs across gestation[J]. J Clin Endocrinol Metab, 2017, 102(9): 3182–3194. DOI: 10.1210/jc.2017-00672 |
| [56] | DIXON C L, SHELLER-MILLER S, SAADE G R, et al. Amniotic fluid exosome proteomic profile exhibits unique pathways of term and preterm labor[J]. Endocrinology, 2018, 159(5): 2229–2240. DOI: 10.1210/en.2018-00073 |
| [57] | DE BEM T H C, DA SILVEIRA J C, SAMPAIO R V, et al. Low levels of exosomal-miRNAs in maternal blood are associated with early pregnancy loss in cloned cattle[J]. Sci Rep, 2017, 7(1): 14319. |



