2. 北方民族大学生物科学与工程学院, 银川 750021;
3. 国家民委发酵酿造工程生物技术重点实验室, 银川 750021;
4. 宁夏回族自治区兽药饲料监察所, 银川 750011
2. College of Biological Science and Engineering, North Minzu University, Yinchuan 750021, China;
3. Key Laboratory of Fermentation Brewing Engineering and Biotechnology State Nationalities Affairs Commission, Yinchuan 750021, China;
4. Ningxia Institute of Veterinary Drug and Feed Control, Yinchuan 750011, China
直立黄芪(Astragalus adsurgens Pall)又称斜茎黄耆,人工培育品种又称沙打旺[1]。该植物是豆科黄芪属多年生草本植物,在俄罗斯、蒙古、中国、北美、澳大利亚等地区均有分布[2-3]。野生型直立黄芪在我国广泛分布于黑龙江、内蒙古、甘肃、宁夏、西藏等地区[4]。因其环境适应性强,抗寒耐旱,耐盐碱,富含营养等特点,自20世纪70年代以来,直立黄芪被驯化为人工牧草在我国大面积种植。但在美国、澳大利亚等国家,因其含有吲哚里西啶生物碱苦马豆素(Swainsonine,SW)、脂肪族硝基化合物等毒性成分,被划分为疯草(豆科棘豆属和黄芪属有毒植物的统称)[3, 5]。研究表明,我国直立黄芪含有微量脂肪族硝基化合物,属于低毒植物,经长期驯化培养的人工栽培品种可安全饲喂反刍动物,但可引起单胃动物中毒[6]。目前仍不清楚脂肪族硝基化合物是否是我国直立黄芪引起动物中毒的主要原因。苦马豆素是诸多黄芪属疯草的主要毒性成分,可抑制哺乳动物细胞内溶酶体α-甘露糖苷酶和高尔基体甘露糖苷酶Ⅱ的活性,导致低聚糖代谢和糖蛋白合成障碍,造成细胞空泡变性和组织器官功能紊乱[7]。目前北美地区已确定含有苦马豆素的黄芪属植物约有30余种[8-9],我国有2种,分别是变异黄芪和茎直黄芪[10]。我国直立黄芪中是否也含有苦马豆素仍未见报道。
大量研究表明,黄芪属和棘豆属疯草中普遍存在能产生苦马豆素的链格孢属波状芽管孢组内生真菌(Alternaria Section Undifilum sp.), 该类真菌与疯草共生,是疯草中苦马豆素产生的主要因素[11-14]。酵母氨酸氧化酶基因、β-酮脂酰合酶(β-ketoacyl synthase,KS)基因在疯草内生真菌合成苦马豆素的过程中发挥着重要的调控作用[15-16]。目前人们在中国和美国含有苦马豆素的主要黄芪属疯草中均分离或检测到链格孢属波状芽管孢组内生真菌[10, 17]。近年来,李彦忠(Li)等[18]从直立黄芪中分离到一类与链格孢属波状芽管孢组真菌形态非常相似的真菌,该真菌在叶、茎、种子中的分离情况与疯草内生真菌在疯草中的分布情况相似,该菌被认为是导致直立黄芪根茎腐烂和早衰的主要原因之一。根据形态,李彦忠(Li)等[19]将其初步命名黄芪埃里砖格孢(Embellisia astragali)。刘建利(Liu)等[20]进一步研究表明,黄芪埃里砖格孢与疯草内生真菌遗传进化关系紧密,根据GPD、RPB2、TEF-1等序列的遗传进化分析结果,将黄芪埃里砖格孢进一步命名为甘肃链格孢(Alternaria gansuense)。但以上研究均未确定甘肃链格孢能否产生苦马豆素,直立黄芪中是否普遍存在甘肃链格孢。直立黄芪广泛分布于我国各省区,人工种植面积大,搞清楚甘肃链格孢在直立黄芪中的分布情况,确定其是否产生苦马豆素,可为直立黄芪的安全利用提供重要依据。
本研究拟对直立黄芪植物组织中的真菌进行分离,调查各类真菌在直立黄芪中的分布情况;采用α-甘露糖苷酶抑制法和超高效液相色谱-串联质谱法对直立黄芪及从中分离的菌株化学成分进行分析,确定直立黄芪中是否存在产苦马豆素真菌;扩增和测定产苦马豆素菌株ITS、GPD、KS等序列,并基于该序列信息对其进行遗传进化分析,根据形态和遗传进化分析结果对其分类鉴定。本研究可为进一步阐明甘肃链格孢与直立黄芪、疯草内生真菌的关系,及直立黄芪的安全利用提供依据。
1 材料与方法 1.1 材料 1.1.1 植物材料眼观无病变的全株直立黄芪,于2017年8月采自甘肃省环县草原实验站及甘肃省天祝藏族自治州抓喜秀龙牧场,共12株,样品采集后根部用无菌的湿纸巾包裹,放入冰盒中于24 h内带回实验室进行真菌的分离。
1.1.2 对照菌株Alternaria Section Undifilum Oxytropis NX-FEL001菌株,分离自黄花棘豆;Alternaria Section Undifilum Oxytropis NM-UA003菌株,分离自变异黄芪,由本实验室分离鉴定并保存。
1.1.3 培养基马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,氯霉素50 mg·L-1,滤液补足至1 L,121 ℃高压蒸汽灭菌30 min。PCA培养基:马铃薯20 g,胡萝卜20 g,琼脂20 g,氯霉素50 mg·L-1,滤液补足至1 L,121 ℃高压蒸汽灭菌30 min。
1.1.4 试剂和仪器苦马豆素(SW)标准品,由宁夏大学农学院临床兽医学重点学科实验室从变异黄芪中分离和纯化(GC≥98%);DNA提取试剂盒购自OMEGA公司,琼脂糖凝胶回收试剂盒和DNA聚合酶等分子生物学试剂均购自大连宝生物工程有限公司;α-甘露糖苷酶和4-Nitrophenyl α-D-mannopyranoside购自美国Sigma公司;其他有机试剂均为国产色谱纯或分析纯。PCR仪、凝胶成像系统均购自Bio-Rad公司;MK3酶标仪,美国赛默飞世尔公司;Waters UPLC/TQ-S micro超高效液相色谱-串联质谱分析系统,美国Waters公司。
1.2 方法 1.2.1 真菌的分离用自来水将全株直立黄芪冲洗干净,然后用灭菌剪刀将植物的叶、茎、种子、根分离,参照李彦忠(Li)等[19]的方法对其进行表面消毒:70%的乙醇浸泡30 s,1%的次氯酸钠溶液浸泡3 min,无菌水漂洗2次,无菌滤纸吸干。在无菌条件下,将各组织接种于PDA培养基平板上。置于20 ℃恒温黑暗培养,待组织周围长出真菌后,挑取每个菌落边缘菌丝重新接种到新的PDA培养基中反复分离培养,直至得到纯化的菌株,对纯化的菌株依次编号。
1.2.2 真菌的形态观察与初步分类已经纯化的真菌接种于PDA平板上培养2~4周,挑取菌落边缘菌丝于载玻片上,以棉兰乳酸酚或水为浮载剂,显微镜下观察并记录分生孢子及分生孢子梗的形态特征,根据真菌的形态对其进行初步分类。对于不产生分生孢子的真菌,分别采用紫外线照射、扫刷营养体等方法诱导产孢[21]。根据各种菌株在直立黄芪各组织部位的分离数量,计算分离率。
1.2.3 真菌中苦马豆素的提取与检测 1.2.3.1真菌的富集培养与菌丝中苦马豆素的提取:将分离到的真菌菌株分别接种于PDA培养基上,20 ℃富集培养30 d,收集菌丝0.5~1.0 g,65 ℃烘箱烘至恒重。然后将其研磨成粉末,置索式提取器中,70 ℃甲醇提取16 h。将甲醇提取液旋转蒸发仪浓缩挥干,残渣用甲醇溶解,经0.22 μm滤膜过滤后,用甲醇定容至5 mL,制成待检液备用。直立黄芪植物组织经阴干粉碎后也按照上述方法处理,制成待检液。
1.2.3.2α-甘露糖苷酶抑制法测定苦马豆素:参照张蕾蕾等[22]的方法,对各菌株菌丝和直立黄芪植物待检液中的苦马豆素进行定性和定量测定。若待检液对α-甘露糖苷酶具有一定的抑制作用,则表明对应的样品中可能含有苦马豆素,将各样品对ɑ-甘露糖苷酶的抑制率代入标准曲线方程计算出SW在待检样品中含量,每个标品或样品进行三个重复。
1.2.3.3超高效液相色谱-串联质谱分析(UPLC-MS):称取SW标准品,配制成580、290、116、58、29 ng·mL-1的标准品水溶液。将“1.2.3.1”中的待检液用50 ℃氮气吹干,5 mL超纯水溶解并定容,用0.22 μm混合相滤膜过滤于2 mL样品瓶中,制成液相色谱-串联质谱分析待检液。将标准品和样品分别进行超高效液相色谱-串联质谱分析。
色谱条件:Waters Acquity UPLC BEH(2.1 mm×50 mm,粒径1.7 μm)色谱柱,柱温40 ℃,进样量1 μL,流速0.3 mL·min-1,流动相为体积分数100%的甲醇:20 mmol·L-1醋酸铵水溶液=5:95。
质谱条件:离子源为ESCI。毛细管电压2.0 kV,离子源温度150 ℃,脱溶剂气温度400 ℃,雾化气800 L·Hr-1;质谱运行模式为全扫描,扫描范围为70~300 amu,监测离子对为174.2>156.1。
比较真菌、直立黄芪植物待检样品与苦马豆素标准品液相色谱图和质谱图,经液相色谱分离后若样品溶液与苦马豆素标准品中有色谱峰保留时间相同的色谱峰,且该色谱峰对应的质谱图的特征性离子碎片相匹配时,可确定待检样品中含有苦马豆素。以SW的质量浓度(ng·mL-1)为横坐标(x),以标准样品中SW色谱峰峰面积为纵坐标(y),绘制标准曲线。将样品测得的SW色谱峰面积代入标准曲线方程,计算出样品中SW的含量。
1.2.4 产SW真菌的系统发育分析 1.2.4.1产SW真菌ITS、GPD、KS序列的扩增与测序:刮取PDA培养基上的真菌菌丝0.5~1 g放入离心管中并置于冰上,玻璃钻头研磨菌丝至粉末,按照DNA提取试剂盒步骤提取真菌基因组DNA。分别采用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和TIS4(5′-TCCTCCGCTTATTGATATGC -3′),GPD1(5′ -CAACGGCTTCGGTCGCATTG-3′)和GPD2 (5′-GCCAAGCAGTTGGTTGTGC-3′),KS-F (5′-GAGGAAATTGCTATAGTTTCCATGGC-3′)和KS-R(5′-GGCATCCGAAAGACGTTTAAGAAG-3′)扩增真菌的ITS、GPD、KS序列。PCR反应体系均为25 μL:DNA聚合酶0.25 μL,PCR缓冲液2.5 μL,dNTP 2 μL,上、下游引物各1 μL,真菌DNA 0.25 μL,加双蒸水补至25 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,30个循环;最后72 ℃再延伸10 min。PCR产物进行琼脂糖凝胶电泳分析,切取含有目的片段凝胶并用凝胶回收试剂盒进行回收,将纯化回收的PCR产物送上海生工生物技术公司进行正反双向测序,将正反测序结果比对拼接并去除引物序列,得到真菌ITS、GPD和KS序列。
1.2.4.2产SW真菌遗传进化树的构建:登录http//:www.ncbi.nlm.nih.gov数据库,在BLAST程序中分别提交真菌的ITS、GPD和KS序列,与GenBank中的序列进行一致性比较。下载一致性较高的序列和临近属真菌的ITS和GPD序列信息,并用MEGA 6.0软件中的Clustal W程序进行排列比对,采用邻接法(Neighbor-joining, NJ)构建系统发育树,可信度分析为1 000次。
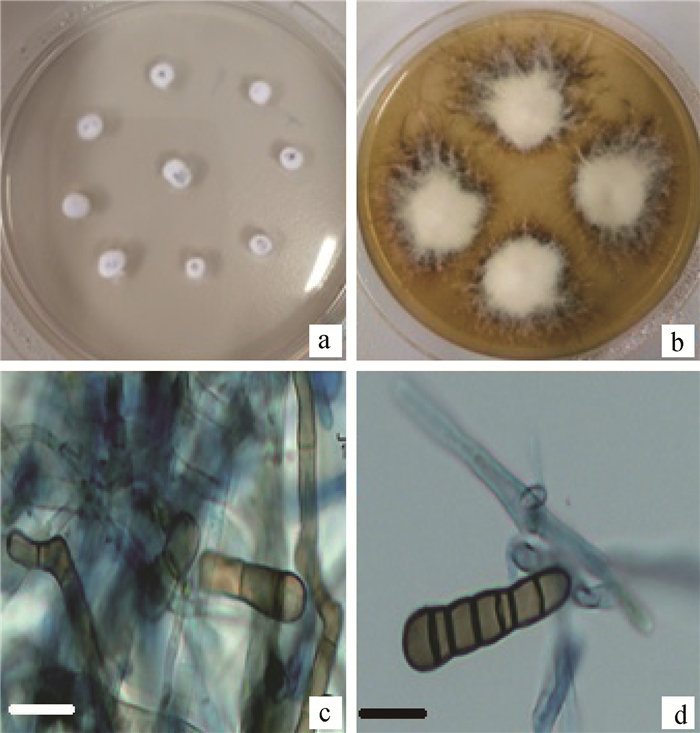
2 结果 2.1 分离的真菌本研究从直立黄芪的叶、茎、根、种子中共分离到43株真菌(表 1),其中25株真菌能够在PDA培养基上恒温培养产生分生孢子和分生孢子梗等结构,根据该类真菌的形态特征,将其初步划分到链格孢属、镰刀菌属、青霉属中;另有18株真菌在PDA等培养基上恒温培养未观察到分生孢子,其中13株真菌在菌落形态、显微形态及生长特性等方面基本一致。这13株真菌菌落在PDA培养基上起初为白色,随着培养时间的延长逐渐变为黄褐色或黑褐色。真菌在培养初期不产生色素(图 1a),随着时间的延长,菌落产生色素将培养基变为黄褐色(图 1b)。真菌在20 ℃黑暗培养条件下生长缓慢,生长率为(0.10±0.02) mm·d-1。显微镜下,真菌菌丝较细,透明,具横隔膜,不见分支,分生孢子梗具较厚横隔膜,呈褐色,可见分支。经PCA培养基,20 ℃培养,每天紫外线照射2 h,黑暗培养22 h,连续培养两周后可产生少量分生孢子,分生孢子呈褐色,长棍棒状,直或稍弯曲,基底细胞近球形,2~8个暗的横隔膜,3~4个的居多,在隔膜处有明显的缢缩,未观察到纵隔膜或斜隔膜(图 1c、1d)。以上特点与已报道的直立黄芪中分离的甘肃链格孢和疯草中分离的链格孢属波状芽管孢组对照菌株NX-FEL001和NM-UA003较为相似。该类真菌在直立黄芪叶、茎、种子中均有分离,种子中分离率最高,为16.67%,但在根中未见分离,在本研究中直立黄芪根中分离的真菌主要为镰刀菌属真菌。
|
|
表 1 直立黄芪各组织中分离的真菌种类及其分离率 Table 1 Fungal species from Astragalus adsurgens Pall and the isolation frequency of fungi |
|
a.产苦马豆素真菌在PDA培养基上培养7 d长出的菌落;b.产苦马豆素真菌在PDA培养基上生长30 d的菌落;c~d.产苦马豆素真菌的分生孢子梗和分生孢子,标尺=4 μm a.The fungal colonies cultured for 7 days; b. The fungal colonies cultured for 30 days; c-d. The fungal Mycelia, conidiophores and conidia, scale= 4 μm 图 1 直立黄芪中分离的产苦马豆素真菌 Figure 1 Swainsonine-producing fungal isolate from Astragalus adsurgens Pall |
以α-甘露糖苷酶抑制率y对苦马豆素质量浓度x得标准曲线方程y=0.813 9x-1.173 8(R2=0.998),α-甘露糖苷酶抑制试验结果表明(表 2),当苦马豆素浓度在0.072~18.400 μg·mL-1范围内时,苦马豆素的浓度与其对α-甘露糖苷酶抑制率呈现良好的线性关系。本研究应用α-甘露糖苷酶抑制法对分离的43株真菌的待检液进行了分析,其中只有与甘肃链格孢相似的13株真菌可对α-甘露糖苷酶产生不同程度的抑制作用(表 3)。在本研究,直立黄芪植物样品待检液未对α-甘露糖苷酶产生抑制作用。α-甘露糖苷酶抑制法测得菌株EA菌丝中苦马豆素含量为(0.004±0.000)mg·g-1,对照菌株Alternaria Section Undifilum Oxytropis NX-FEL001和Alternaria Section Undifilum Oxytropis NM-UA003的苦马豆素含量分别为(0.276±0.012)、(0.800±0.099) mg·g-1。
|
|
表 2 不同浓度苦马豆素标准品对α-甘露糖苷酶的抑制率 Table 2 The inhibiting rates of α-mannosidase by different concentration of swainsonine |
|
|
表 3 各样品对α-甘露糖苷酶抑制率和测定的样品提取液中SW浓度 Table 3 The inhibiting rates of α-mannosidase by different samples and the concentration of swainonine in sample extract |
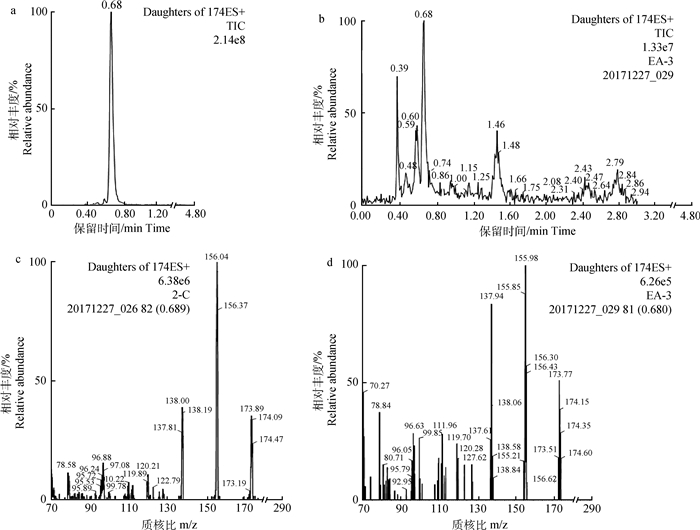
超高效液相色谱-串联质谱分析结果表明,苦马豆素标准品的色谱保留时间为(0.68±0.01)min(图 2a),离子碎片全扫描质谱分析出现了苦马豆素特征离子碎片MH+=(174.00±0.75) amu,该特征离子碎片经二级质谱扫描后,出现了苦马豆素特征性二级质谱粒子碎片MH+ = (156.10±0.75)amu(图 2c)。本研究中分离的EA菌株提取物经色谱分析后,在0.68 min出现与苦马豆素标准品色谱保留时间相同的色谱峰(图 2b),且该色谱峰对应的二级质谱离子碎片质谱图中有苦马豆素的特征性离子碎片(图 2d)。
|
a.苦马豆素标准品液相色谱图,苦马豆素的色谱保留时间为0.68 min;b. EA菌株提取物液相色谱图;c.苦马豆素标准品色谱保留时间为0.68 min时的MH+=174离子碎片二级质谱图;d.菌株EA提取物色谱保留时间为0.68 min时的MH+= 174离子碎片二级质谱图 a. The UPLC-MS/MS chromatogram of swainsonine standard, the retention time of matrine was 0.68 min; b. UPLC-MS/MS chromatogram of the extract of EA isolate; c. MS/MS production spectrum of swainsonine (MH+=174) at 0.68 min; d. MS/MS production spectrum of the extract of EA isolate at 0.68 min 图 2 苦马豆素标准品和产苦马豆素菌株EA提取液超高效液相色谱-串联质谱图 Figure 2 The UPLC-MS/MS spectrometry of swainsonine standard and the extract of swainsonine-producing EA isolate |
以各标准品溶液的质量浓度为横坐标(ng·mL-1),峰面积为纵坐标,获得标准曲线方程为y=468.937x+4 605.51,(R2=0.997 9),表明当苦马豆素质量浓度在29~580 ng·mL-1时,苦马豆素的质量浓度与苦马豆素色谱峰峰面积呈良好的线性关系。根据标准曲线方程和样品溶液测得的峰面积计算得出,产苦马豆素EA菌株菌丝中苦马豆素的含量为(0.005±0.046)mg·g-1,对照菌株Alternaria Section Undifilum Oxytropis NX-FEL001和Alternaria Section Undifilum Oxytropis NM-UA003的苦马豆素含量分别为(0.837±0.014)、(1.123±0.032)mg·g-1。但本研究在直立黄芪植物样品中未检出苦马豆素。
2.3 产SW真菌ITS、GPD、KS序列一致性比较本研究分离的产苦马豆素菌株ITS、GPD和KS基因经核苷酸序列测定,其ITS、GPD和KS基因序列长度分别为565、581、691 bp,将其序列提交GenBank,获得的GenBank序列号分别为MG832574、MG832573、MG832575。ITS序列BLAST比对结果表明,与已报道的从直立黄芪中分离的Embellisia astragali=Alternaria gansuense(KM457057)序列一致性为100%,与疯草中分离的链格孢属波状芽管孢组内生真菌的序列一致性高达99%~100%。GPD序列BLAST比对结果显示,本研究分离的产苦马豆素菌株与已报道的产苦马豆素内生真菌Alternaria Section U. oxytropis NX-FEL001(KF114857)、Alternaria Section U. cinereum 2DBL2010(JN632556)、Alternaria Section U. oxytropis DAOM 237696(FJ357306)、Embellisia astragali= Alternaria gansuense(KM457057)的一致性均高达100%。KS序列BLAST比对结果显示,本研究分离的产苦马豆素菌株与已报道的产苦马豆素疯草内生真菌Alternaria Section U. oxytropis(KY365741)的KS基因序列一致性为98%,12个位点发生了突变,其中9个位点发生了T-C碱基转换突变,3个位点发生了碱基颠换突变。136、179、353、372 nt位点的突变导致了翻译产物4个位点氨基酸的突变。
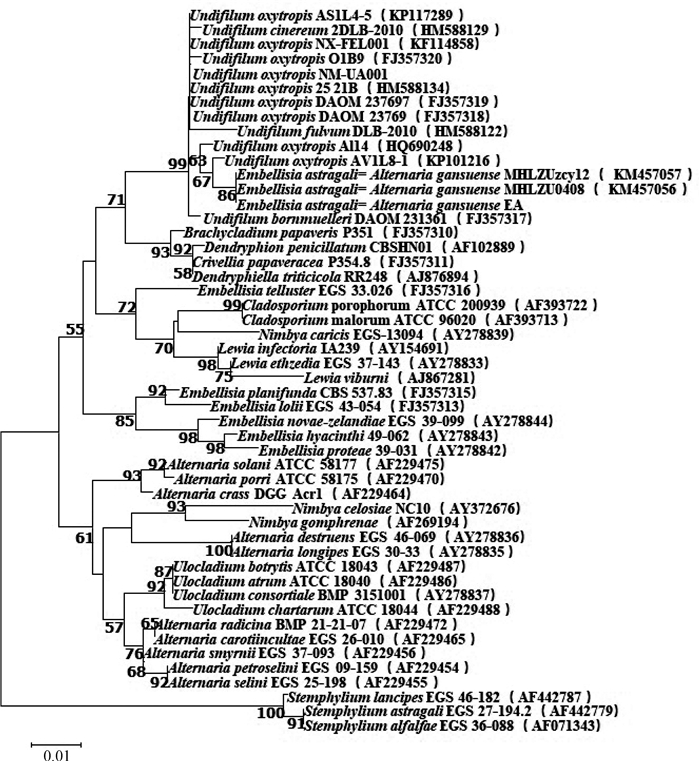
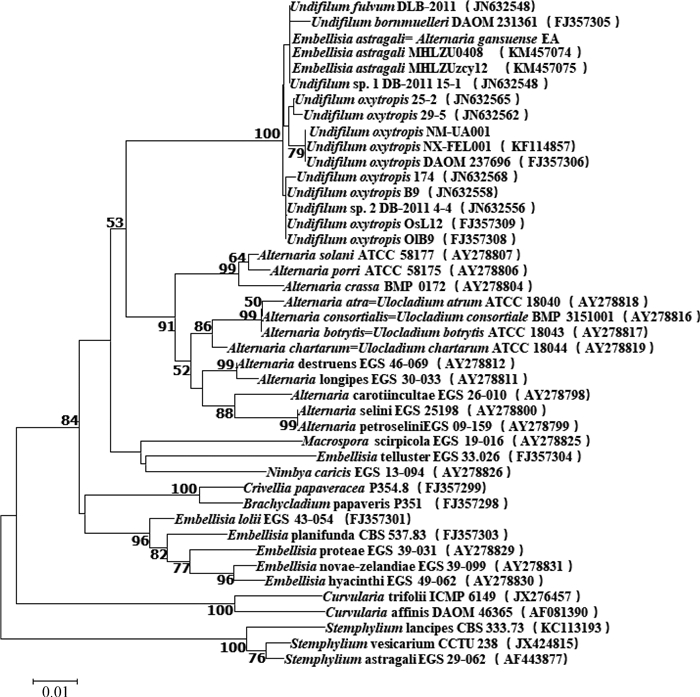
2.4 真菌的遗传进化分析由基于ITS序列构建的NJ系统发育树(图 3)可知,本研究分离的产苦马豆素菌株与链格孢属波状芽管孢组真菌(Alternaria Section Undifilum sp.)聚为同一群落,其自检支持率为99%,与Embellisia astragali= Alternaria gansuense(KM457057)处于同一分支上,自检支持率达到86%,表明本研究分离的产苦马豆素菌株与链格孢属波状芽管孢组真菌和Embellisia astragali=Alternaria gansuense(KM457057)遗传进化距离最近。由基于GPD序列构建的NJ系统发育树(图 4)可知,本研究分离的产苦马豆素菌株与U. fulvum DBL2011(JN236556)、Undifilum bornmuelleri DAOM231361(FJ357305)、Embellisia astragali=Alternaria gansuense(KM457057)等处于同一分支,表明该类菌株与链格孢属波状芽管孢组真菌和Embellisia astragali=Alternaria gansuense (KM457057)的亲缘关系最为密切。
|
比例尺代表碱基替换数;分支处数字代表分类单位聚集在一起的概率(Bootstrap>50%);括号中的序号为各菌株ITS序列在GenBank中的登录号 Horizontal branch represent the expected number of substitution. The numbers of nodes represent the percentages (Bootstrap > 50%) of the taxa to the right are placed together by the program. The serial numbers in the brackets are GenBank accession numbers of the ITS sequences of isolates 图 3 基于ITS序列构建的NJ系统发育树 Figure 3 Phylogenetic tree constructed with the program Neighbor-joining (NJ) based on ITS sequences |
|
比例尺代表碱基替换数;分支处数字代表分类单位聚集在一起的概率(Bootstrap>50%);括号中的序号为各菌株GPD序列在GenBank中的登录号 Horizontal branch represent the expected number of substitution. The numbers of nodes represent the percentages (Bootstrap > 50%) of the taxa to the right are placed together by the program. The serial numbers in the brackets are GenBank accession numbers of the GPD sequences of isolates 图 4 基于GPD序列构建的NJ系统发育树 Figure 4 Phylogenetic tree constructed with the program Neighbor-joining (NJ) based on GPD sequences |
本研究从直立黄芪叶、茎、根、种子中共分离到43株真菌,其中25株不经诱导即可产孢真菌分属于链格孢属、镰刀菌属、青霉属等。18株真菌在PDA培养基上恒温培养不产生分生孢子,其中13株真菌经诱导培养后可产生分生孢子,在菌落形态、显微形态及生长特性方面与已报道的甘肃链格孢相似。α-甘露糖苷酶抑制法和超高效液相色谱-串联质谱分析结果表明,该13株真菌中均含有苦马豆素,其含量为0.004~0.005 mg·g-1。通过对该13株真菌ITS、GPD和KS基因的序列一致性比较和遗传进化分析,进一步确定该类真菌与已报道的直立黄芪病原真菌甘肃链格孢(Alternaria gansuense)和产苦马豆素疯草内生真菌(Alternaria Section Undifilum sp.)遗传关系最为密切。故本研究将分离到的产SW内生真菌划分到链格孢属波状芽管孢组真菌,将其命名为甘肃波状芽管孢(Alternaria Section Undifilum gansuense)。本研究中甘肃波状芽管孢的总分离率为9.03%,在叶、茎、种子中均有分布,种子中的分离率最高,但在根部未分离到该真菌。甘肃波状芽管孢在直立黄芪中分离特征与疯草内生真菌相似,在叶、茎、种子中均有分布,但其分离率显著低于疯草内生真菌[17]。要搞清楚甘肃波状芽管孢在直立黄芪中的分布情况,还需要对不同生境、驯化和野生型直立黄芪内生真菌进行系统研究。
本研究中分离自直立黄芪的甘肃波状芽管孢只含有少量苦马豆素,远远低于两株疯草内生真菌对照菌株中苦马豆素的含量。据Braun等[11]报道,美国疯草内生真菌中苦马豆素含量在0.471~18 mg·g-1,也远远高于甘肃波状芽管孢。真菌中苦马豆素的产生受到多种因素的影响,据Oldrup等[23]报道,低pH(4.5)或高浓度PEG可使链格孢属波状芽管孢组真菌的SW产量显著提高。另有研究表明,L-哌可酸、L-赖氨酸、α-酮戊二酸等底物及其在培养基中的浓度可对链格孢属波状芽管孢组真菌的苦马豆素合成产生显著影响[22]。酵母氨酸氧化酶基因、KS基因在链格孢属波状芽管孢组真菌的苦马豆素合成中具有重要的调控作用[15-16]。在本研究中,EA菌株的KS基因序列与疯草内生真菌Alternaria Section U. oxytropis(KY365741)的KS基因序列一致性为98%,具有高度的同源性,该结果表明,甘肃波状芽管孢中苦马豆素的合成可能也受KS基因的调控。甘肃波状芽管孢与疯草内生真菌遗传进化关系紧密,但其苦马豆素合成能力较低,通过比较甘肃波状芽管孢与疯草内生真菌的相关基因表达水平,将为进一步筛选真菌合成苦马豆素相关基因,阐明苦马豆素在真菌中的合成机制提供重要途径。
本研究在直立黄芪植物组织中未检出苦马豆素。据Gardner等[24]的报道,在色谱-质谱联用分析中,苦马豆素的检测限为0.001%,即当样品中苦马豆素含量较低时,样品中的苦马豆素可能将无法检出。本研究结果表明,从甘肃环县和天祝藏族自治州采集的直立黄芪植物样品中可能不含苦马豆素或所含的苦马豆素质量分数低于0.001%。关于疯草中苦马豆素的含量及其与疯草内生真菌关系研究表明,疯草中普遍存在能产生SW的链格孢属波状芽管孢组内生真菌,SW在疯草不同组织部位、不同品种或不同群落、同一群落的不同植株间含量的差异与该类真菌在疯草中的生物量和真菌产SW能力紧密相关[25-26]。Cook等[13, 27-28]的研究也表明,SW含量较低的疯草中其内生真菌的分离率也较低,有的植物中能检测到产SW真菌却检测不到苦马豆素;本研究从直立黄芪中分离的产SW真菌同属于链格孢属波状芽管蠕孢组,但其苦马豆素合成量显著低于从疯草中分离的产苦马豆素内生真菌。而且该真菌在直立黄芪中的分离率也显著低于已报道的疯草内生真菌在疯草中的分离率。苦马豆素在直立黄芪中的含量可能与甘肃波状芽管孢在宿主植物中的分布和真菌苦马豆素合成能力相关。自20世纪60年代以来,我国开始广泛人工种植直立黄芪。本研究所采集的直立黄芪为人工栽培品种,经过长期的人工选育,其内部的真菌种类可能与野生型直立黄芪存在较大差异。野生型直立黄芪中的真菌种类及其分布情况是否与疯草相似,是否也含有苦马豆素,是否存在导致动物中毒的风险,因此,需要进一步对不同生境的直立黄芪中的苦马豆素、甘肃波状芽管孢真菌及其分布规律进行系统研究,为直立黄芪的安全利用提供重要依据。
4 结论从直立黄芪中共分离到43株真菌,其中有13株菌丝中含有苦马豆素,序列一致性和系统发育分析结果表明,该类真菌与已报道的直立黄芪病原真菌甘肃链格孢(Alternaria gansuense)和产苦马豆素疯草内生真菌(Alternaria Section Undifilum sp.)的亲缘关系最近。直立黄芪中存在能产生苦马豆素的真菌,根据形态特点和遗传进化分析结果,作者将从直立黄芪中分离的产苦马豆素真菌划分到链格孢属波状芽管孢组中,并命名为甘肃波状芽管孢(Alternaria Section Undifilum gansuense)。
致谢: 感谢美国农业部有毒植物研究中心(USDA, ARS, Poisonous Plant Research Laboratory) Danial Cook和Dale R. Gardner博士在超高效液相色谱-质谱联用分析中提供了宝贵的意见和支持。| [1] |
苏盛发.
沙打旺[M]. 北京: 农业出版社, 1985.
SU S F. Astragalus adsurgens[M]. Beijing: Agricultural Press, 1985. (in Chinese) |
| [2] |
中国科学院中国植物志编辑委员会.
中国植物志:第42卷(第2分册)[M]. 北京: 科学出版社, 1998.
Chinese Academy of Botany, Chinese Academy of Sciences. Chinese flora:Volume 42(volume 2)[M]. Beijing: Science Press, 1998. (in Chinese) |
| [3] |
李彦忠, 徐娜, 汪治刚, 等. 沙打旺黄矮根腐病的研究进展[J]. 草业学报, 2017, 26(11): 196–204.
LI Y Z, XU N, WANG Z G, et al. Review ofresearch on yellow stunt and root rot in Astragalus adsurgens[J]. Acta Prataculturae Sinica, 2017, 26(11): 196–204. DOI: 10.11686/cyxb2017037 (in Chinese) |
| [4] |
王兆卿, 李聪, 苏加楷. 野生与栽培型沙打旺品质性状比较[J]. 草地学报, 2001, 9(2): 133–136.
WANG Z Q, LI C, SU J K. Comparison study on several quality characters of wild and cultivatedAstragalus adsurgens Pall[J]. Acta Agrestia Sinica, 2001, 9(2): 133–136. DOI: 10.11733/j.issn.1007-0435.2001.02.011 (in Chinese) |
| [5] | COOK D, RALPHS M H, WELCH K D, et al. Locoweed poisoning in livestock[J]. Rangelands, 2009, 31(1): 16–21. DOI: 10.2111/1551-501X-31.1.16 |
| [6] |
郑尚珍, 孙丽萍, 陈颢, 等. 沙打旺中微量毒素的含量分析[J]. 西北师范大学学报:自然科学版, 1992, 28(2): 34–38.
ZHENG S Z, SUN L P, CHEN H, et al. The content determination of microtoxin in Astragalus Adsurgens pall[J]. Journal of Northwest Normal University:Natural Science, 1992, 28(2): 34–38. (in Chinese) |
| [7] | MOLYNEUX R J, JAMES L F. Loco intoxication:indolizidine alkaloids of spotted locoweed (Astragalus lentiginosus)[J]. Science, 1982, 216(4542): 190–191. DOI: 10.1126/science.6801763 |
| [8] | COOK D, GARDNER D R, PFISTER J A, et al. A screen for swainsonine in select North American Astragalus Species[J]. Chem Biodivers, 2017, 14(4): e1600364. DOI: 10.1002/cbdv.v14.4 |
| [9] | COOK D, GARDNER D R, MARTINEZ A, et al. Screening for swainsonine among South American Astragalus species[J]. Toxicon, 2017, 139: 54–57. DOI: 10.1016/j.toxicon.2017.09.014 |
| [10] | YU Y T, ZHAO Q M, WANG J N, et al. Swainsonine-producing fungal endophytes from major locoweed species in China[J]. Toxicon, 2010, 56(3): 330–338. DOI: 10.1016/j.toxicon.2010.03.020 |
| [11] | BRAUN K, ROMERO J, LIDDELL C, et al. Production of swainsonine by fungal endophytes of locoweed[J]. Mycol Res, 2003, 107(8): 980–988. DOI: 10.1017/S095375620300813X |
| [12] | RALPHS M H, CREAMER R, BAUCOM D, et al. Relationship between the endophyte Embellisia spp. and the toxic alkaloid swainsonine in major locoweed species (Astragalus and Oxytropis)[J]. J Chem Ecol, 2008, 34(1): 32–38. DOI: 10.1007/s10886-007-9399-6 |
| [13] | COOK D, GARDNER D R, RALPHS M H, et al. Swainsoninine concentrations and endophyte amounts of Undifilum oxytropis in different plant parts of Oxytropis sericea[J]. J Chem Ecol, 2009, 35(10): 1272–1278. DOI: 10.1007/s10886-009-9710-9 |
| [14] | PRYOR B M, CREAMER R, SHOEMAKER R A, et al. Undifilum, a new genus for endophytic Embellisia oxytropis and parasitic Helminthosporium bornmuelleri on legumes[J]. Botany, 2009, 87(2): 178–194. DOI: 10.1139/B08-130 |
| [15] | MUKHERJEE S, DAWE A L, CREAMER R. Potential role for saccharopine reductase in swainsonine metabolism in endophytic fungus, Undifilum oxytropis[J]. Fungal Biol, 2012, 116(8): 902–909. DOI: 10.1016/j.funbio.2012.05.007 |
| [16] | COOK D, DONZELLI B G G, CREAMER R, et al. Swainsonine biosynthesis genes in diverse symbiotic and pathogenic fungi[J]. G3(Bethesda), 2017, 7(6): 1791–1797. |
| [17] | COOK D, GARDNER D R, PFISTER J A. Swainsonine-containing plants and their relationship to endophytic fungi[J]. J Agric Food Chem, 2014, 62(30): 7326–7334. DOI: 10.1021/jf501674r |
| [18] | LI Y Z, NAN Z B. Symptomology and etiology of a new disease, yellow stunt, and root rot of standing milkvetch caused by Embellisia sp. in Northern China[J]. Mycopathologia, 2007, 163(6): 327–334. DOI: 10.1007/s11046-007-9002-2 |
| [19] | LI Y Z, NAN Z B. A new species, Embellisia astragali sp. nov., causing standing milk-vetch disease in China[J]. Mycologia, 2007, 99(3): 406–411. DOI: 10.1080/15572536.2007.11832565 |
| [20] | LIU J L, LI Y Z, CREAMER R. A Re-examination of the taxonomic status of Embellisia astragali[J]. Curr Microbiol, 2016, 72(4): 404–409. DOI: 10.1007/s00284-015-0962-z |
| [21] |
方中达.
植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998.
FANG Z D. Research methods of phytopathology[M]. 3rd ed. Beijing: China Agriculture Press, 1998. (in Chinese) |
| [22] |
张蕾蕾, 余永涛, 何生虎, 等. 不同因素对疯草内生真菌合成苦马豆素的影响[J]. 畜牧兽医学报, 2015, 46(1): 163–173.
ZHANG L L, YU Y T, HE S H, et al. Influence of different factors on swainsonine production in fungal endophyte from locoweed[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(1): 163–173. (in Chinese) |
| [23] | OLDRUP E, MCLAIN-ROMERO J, PADILLA A, et al. Localization of endophytic Undifilum fungi in locoweed seed and influence of environmental parameters on a locoweed in vitro culture system[J]. Botany, 2010, 88(5): 512–521. DOI: 10.1139/B10-026 |
| [24] | GARDNER D R, MOLYNEUX R J, RALPHS M H. Analysis of swainsonine:Extraction methods, detection, and measurement in populations of locoweeds (Oxytropis spp.)[J]. J Agric Food Chem, 2001, 49(10): 4573–4580. DOI: 10.1021/jf010596p |
| [25] |
黄鑫, 梁剑平, 高旭东, 等. 苦马豆素的来源、药理作用及检测方法研究进展[J]. 畜牧兽医学报, 2016, 47(6): 1075–1085.
HUANG X, LIANG J P, GAO X D, et al. Research advance on sources, pharmacological effects and detection methods of swainsonine[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(6): 1075–1085. (in Chinese) |
| [26] |
余永涛, 赵清梅, 何生虎, 等. 波状芽管蠕孢属疯草内生真菌研究进展[J]. 中国兽医学报, 2016, 36(9): 1630–1637.
YU Y T, ZHAO Q M, HE S H, et al. Advance on theUndifilum species fungal endophytes from locoweeds[J]. Chinese Journal of Veterinary Science, 2016, 36(9): 1630–1637. (in Chinese) |
| [27] | COOK D, GARDNER D R, GRUM D, et al. Swainsonine and endophyte relationships in Astragalus mollissimus and Astragalus lentiginosus[J]. J Agric Food Chem, 2011, 59(4): 1281–1287. DOI: 10.1021/jf103551t |
| [28] | COOK D, GRUM D S, GARDNER D R, et al. Influence of endophyte genotype on swainsonine concentrations in Oxytropis sericea[J]. Toxicon, 2013, 61: 105–111. DOI: 10.1016/j.toxicon.2012.10.018 |



