胸腺属于中枢免疫器官,是与T淋巴细胞的增殖、分化、发育以及成熟密切相关的重要场所。1961年澳大利亚免疫学家Miller[1]通过切除胸腺的经典试验方法,首次证实了胸腺作为免疫器官在动物机体内的重要地位,对机体细胞免疫具有调节意义。有研究表明,机体胸腺功能是否完善可对性腺的发育以及性机能产生重要影响[2]。
在人[3]、牦牛[4]、鼠[5]以及豚鼠[6]胸腺上进行的相关研究,证明了胸腺对年龄表现出高敏感性,包括组织形态学、基本结构以及基础功能与年龄所表现出的紧密关系。在已有研究的高等脊椎动物,胸腺组织会出现增龄性退化现象[7],所以胸腺的增龄性退化可作为脊椎动物机体免疫衰老的指标性变化之一[8]。尽管胸腺会显著退化,但是功能性胸腺细胞不会因为随年龄增长而完全丧失功能[9]。人胸腺研究表明,正常人机体在1岁前后,胸腺指数达到最大,青春期开始发生生理性退化[3],而类似的试验结果在小鼠上也被证实,自初情期起,小鼠胸腺会出现生理性退化[5, 10]。
S100是胸腺树突状细胞的有效标记蛋白,Caspase-3对胸腺的变化具有重要意义。近年来,有学者提出TP53和CASP-3等基因与胸腺细胞的凋亡可能存在密切关系[11]。目前,有关山羊胸腺的增龄性变化的研究尚未见报道,为此,本试验便从组织学观察、蛋白标记和相关基因mRNA转录水平变化角度对山羊胸腺进行研究和探讨,以丰富胸腺基础研究内容,为胸腺研究提供理论支持。
1 材料与方法 1.1 试验材料DAB显色试剂盒(ZLI-9018)购自北京中杉金桥生物技术有限公司;S100一抗(ab52642)和Caspase-3一抗(ab4051)购自Abcam;免疫组化试剂盒(SC-3945)购自美国Santa Cruz公司;RT试剂盒(PCR-311)、荧光定量PCR试剂盒(QPK-201)和Sybr GreenⅠ染料(P3377)均购自中国上海Shinegene公司。
1.2 试验方法 1.2.1 试验动物试验羊只为安徽白山羊,购自安徽涡阳安欣羊场。试验用羊均为雌性山羊,共分为4个时期:幼龄期(7 d,(1.9±0.24) kg),初情期前(3.5月龄,(9.9±0.39) kg),初情期(5月龄,(18.9±0.43) kg)以及成年期(18月龄,(26.0±1.10) kg),每个时期各3只。在相同季节,相同时间点使用相同的方法进行胸腺组织的采集工作。
1.2.2 样本采集与处理试羊采取侧卧保定,陆眠宁麻醉,称量体重并记录,颈动脉放血处死,采集完整胸腺,量取胸腺长度、重量以及最宽处的值并记录。分别取相同颈段位置和胸段位置胸腺组织,浸泡于4%多聚甲醛溶液,冷藏于4 ℃固定。采集胸段最靠近心基部位置的胸腺部分,每只羊采取3份,剔除脂肪组织,焦碳酸二乙酯(DEPC)水冲洗,放入冻存管,保存于液氮中24 h,转存于-80 ℃冰箱。山羊胸腺为淡粉色,质地柔软,包被有强韧的结缔组织被膜,形状不规则,主要包括颈段和胸段,其颈段起源于颌下腺后方,沿气管腹侧向胸腔入口方向延伸,胸腺颈段分为左右两支,在胸腔入口的连接处融合,胸腺胸段起始于胸腔入口处,后方悬于心包膜的上方,胸腺颈段狭而长,胸段则宽而短。
1.2.3 H.E.染色与免疫组化制作石蜡切片,进行H.E.染色,观察并采集图片。
免疫组化:二甲苯脱蜡(2道)→梯度浓度乙醇脱水→冲洗→抗原修复→H2O2孵育→BSA孵育→一抗(S100为1:200稀释;Caspase-3为1:100稀释)→等量二抗→DAB显色→苏木精染色→脱水、脱蜡→封片→采集图像。每个样本随机选取5个高倍视野(10×100)拍照,通过Image-Pro Pluse软件灰度分析计数,统计阳性细胞数。
1.2.4 荧光定量PCR采用Trizol法提取胸腺RNA,分光光度计检测RNA浓度,凝胶电泳检测RNA质量,使用TaKaRa反转录试剂盒按照说明进行cDNA合成,以cDNA为模板,SYBR GreenⅠ为染料进行qRT-PCR检测。qRT-PCR反应体系:Nuclease-Free Water 3.5 μL;上、下游引物各0.5 μL;DNA模版3.0 μL;GoTaq® qPCR Master Mix 2×7.5 μL。反应条件:95 ℃ 2 min;95 ℃15 s,60 ℃ 1 min,72 ℃15 s(40个循环);收集荧光信号。GAPDH和β-actin为内参基因,使用2-△△Ct法测算目的基因表达量。引物信息见表 1。
|
|
表 1 实时荧光定量PCR扩增产物的引物序列、产物大小 Table 1 Real-time PCR primers and size of the amplification products of target genes |
数据以“平均值±标准误(mean±SE)”表示,通过SPSS17.0软件对数据进行方差分析,统计组间数据差异性,P<0.05表示差异显著。
2 结果 2.1 雌性安徽白山羊胸腺重量、长度、指数、最宽值和胸/颈长度比的变化雌性山羊胸腺重从幼龄期~初情期显著上升(P<0.05),且在初情期达到最大,初情期~成年期,胸腺重显著下降(P<0.05)(图 1A)。胸腺长从幼龄期~初情期前显著上升(P<0.05),初情期前与初情期无显著差异(P>0.05),初情期~成年期,显著下降(P<0.05)(图 1B)。胸腺指数和最宽处值从幼龄期~初情期前显著上升(P<0.05),初情期前~成年期显著下降(P<0.05)(图 1C, D)。胸腺胸/颈段长度比值从幼龄~初情期前显著下降(P<0.05),初情期前与初情期无显著差异(P>0.05),初情期~成年期有回升趋势(图 1E)。

|
不同年龄段比较,不同字母表示差异显著(P<0.05)。下同 Different letters indicate significant difference between different ages (P < 0.05). The same as below 图 1 不同年龄段山羊胸腺重(A)、长度(B)、指数(C)、最宽值(D)和胸/颈长度比(E)的变化 Figure 1 The difference in weight(A), length(B), index(C), maximum width(D) and ratio of thoracic/cervical length (E)of goat thymus between different periods |
H.E.染色结果表明,被膜包被胸腺并深入组织内部形成小叶间隔结缔组织(小叶间隔),把胸腺组织分隔为胸腺小叶,胸腺小叶功能区域可分为皮质区和髓质区,髓质区与小叶中央区域被皮质区包围,髓质区细胞密度小于皮质区,较为松散,且髓质区有散在的胸腺小体。
幼龄期颈段胸腺皮质、髓质无明显分界,胸腺组分细胞排列紧密但胸腺小叶较为疏松,见有少量小的幼稚型胸腺小体(图 2a)。初情期前胸腺组分细胞排列紧密,胸腺小叶紧凑,髓质区直径较小,皮质区厚度较大,皮髓质界限明显(图 2b1,b2)。初情期胸腺皮髓质界限明显,髓质区域变大且有融合趋势,皮质区变薄,胸腺小叶较初情期前变得疏松(图 2c1,c2),在成年期,胸腺皮质薄,髓质区出现大面积融合现象,胸腺小体大量增加,且组织内出现空泡样现象,为脂肪组织填充形成(图 2d)。胸段结果与颈段相似,但与颈段不同的是,初情期(图 2g1,g2)胸段胸腺皮髓质界限明显,单个胸腺小叶较初情期前小(图 2f1,f2),且胸腺组分细胞和胸腺小叶排列均紧密,髓质区域变大但融合趋势不明显(图 2h)。

|
H.E.染色。a、e.幼龄期;b1、b2、f1和f2.初情期前;c1、c2、g1和g2.初情期;d、h.成年期。a~d.胸腺颈段;e~h.胸腺胸段。a、b2、c2、d、e、f2、g2、h标尺=10 μm;b1、c1、f1、g1标尺=100 μm。C.皮质;M.髓质;TC.胸腺小体;F.脂肪组织;ICT.小叶间隔 H.E. staining. a, e. Infancy; b1, b2, f1 and f2. Prepuberty; c1, c2, g1 and g2. Puberty; d, h. Adulthood. a-d. Cervical thymus; e-h. Thoracic thymus. a, b2, c2, d, e, f2, g2, h bar=10 μm; b1, c1, f1, g1 bar=100 μm. C. Cortex; M. Medulla; TC. Thymic corpuscles; F. Fatty tissue; ICT. Interlobular connective tissue 图 2 不同年龄山羊胸腺颈段、胸段组织结构 Figure 2 The histological structure characteristic of cervical and thoracic in thymus in goat during different periods |
在胸腺颈段,幼龄期胸腺小叶中皮髓质区分不明显,S100阳性细胞极少,且分布于胸腺小叶中央区域,边缘区域未见阳性细胞分布(图 3a);在初情期前(图 3b1,b2)、初情期(图 3c)及成年期(图 3d),S100标记的阳性细胞TDCs分布规律相一致,主要分布在胸腺髓质区和皮髓质交界区,在皮质区和小叶间区域未见分布。在胸腺胸段,S100阳性细胞分布规律与颈段相一致,幼龄期S100阳性细胞极少,分布于胸腺小叶中央区域(图 3f);在初情期前(图 3g1、g2)、初情期(图 3h)及成年期(图 3i),S100阳性细胞主要分布在胸腺髓质区和皮髓质交界区,在皮质区和小叶间区域未见分布。S100阳性细胞显示为棕色不规则形状(箭头指示处),可聚集存在,也可散在分布。统计分析表明,幼龄期胸腺颈段和胸段S100阳性细胞数目均显著低于对应部位的其他时期(P<0.05),而其他3个时期间阳性细胞数无显著差异(P>0.05)(表 2)。

|
a、f.幼龄期;b1、b2、g1和g2.初情期前;c、h.初情期;d、i.成年期;e、j.阴性对照。a~e.胸腺颈段;f~j.胸腺胸段。b1、g1标尺=100 μm,a、b2、c、d、e、f、g2、h、i、j标尺=10 μm。C.皮质;M.髓质。箭头指示处为阳性细胞 a, f. Infancy; b1, b2, g1 and g2. Prepuberty; c, h. Puberty; d, i. Adulthood; e, j. Negative control. a-e. Cervical thymus; f-j. Thoracic thymus. b1, g1 bar=100 μm, a, b2, c, d, e, f, g2, h, i, j bar=10 μm. C. Cortex; M. Medulla. Arrows point to the positive cells 图 3 S100在不同年龄山羊胸腺颈段、胸段上的分布 Figure 3 Distribution of S100 in cervical and thoracic segment of thymus of goat during different periods |
|
|
表 2 胸腺颈段和胸段S100阳性细胞数 Table 2 Numbers of S100 positive cells in the cervical and thoracic of thymus |
Caspase-3在胸腺颈段和胸段上的分布特点相似。在颈段,幼龄期胸腺仅有少量Caspase-3阳性细胞散在分布,无法明确区分髓质和皮质区域,但主要见于靠近胸腺小叶中央区域的位置(图 4a);在初情期前(图 4b1,b2)、初情期(图 4c)和成年期(图 4d)颈段胸腺,皮髓质区域区分明显,在皮质、髓质及皮髓质交界区域均有阳性细胞广泛分布,多为散在性分布,少见聚集性分布。在胸段,幼龄期胸腺靠近胸腺小叶中央区域的位置有少量Caspase-3阳性细胞散在分布(图 4f),在初情期前(图 4g1,g2)、初情期(图 4h)和成年期(图 4i)胸段胸腺,皮髓质区域区分明显,在皮质、髓质及皮髓质交界区域均有阳性细胞广泛分布。Caspase-3阳性细胞显示为棕色圆形至椭圆形较为规则的形状(箭头指示处),大小较S100阳性细胞均一。颈段胸腺Caspase-3阳性细胞计数表明,在初情期,阳性细胞数量与初情期前无显著差异(P>0.05),但初情期前和初情期阳性细胞数均显著大于幼龄期(P<0.05);且在成年期,阳性细胞数量显著多于其他3个时期(P<0.05)(表 3)。胸段胸腺Caspase-3阳性细胞计数表明,自幼龄期到成年期,呈现显著增多趋势(P<0.05)(表 3)。

|
a、f.幼龄期;b1、b2、g1和g2.初情期前;c、h.初情期;d、i.成年期;e、j.阴性对照。a~e.胸腺颈段;f~j.胸腺胸段。b1、g1标尺=100 μm,a、b2、c、d、e、f、g2、h、i、j标尺=10 μm。C.皮质;M.髓质。箭头指示处为阳性细胞 a, f. Infancy; b1, b2, g1 and g2. Prepuberty; c, h. Puberty; d, i. Adulthood; e, j. Negative control. a-e. Cervical thymus; f-j. Thoracic thymus. b1, g1 bar=100 μm, a, b2, c, d, e, f, g2, h, i, j bar=10 μm. C. Cortex; M. Medulla. Arrows point to the positive cells 图 4 Caspase-3在不同年龄段山羊胸腺颈段、胸段上的分布 Figure 4 Distribution of Caspase-3 in cervical and thoracic of thymus of goat during different periods |
|
|
表 3 胸腺颈段和胸段Caspase-3阳性细胞数 Table 3 Numbers of Caspase-3 positive cells in the cervical and thoracic of thymus |
幼龄期~初情期前,胸腺CASP-3 mRNA转录水平显著升高(P<0.05)且达到峰值,初情期转录水平较初情期前显著降低(P<0.05),而成年期转录水平与幼龄组和初情期均无显著差异(P>0.05)(图 5A)。幼龄期~初情期前,胸腺CASP-8 mRNA转录水平显著升高(P<0.05)达到峰值,初情期转录水平较初情期前显著降低(P<0.05),在成年期,其转录水平与其他时期相比无显著差异(P>0.05)(图 5B)。在所选取的4个时期,S100 mRNA转录水平均无显著性差异(P>0.05)(图 5C)。幼龄期与初情期前TP53 mRNA转录水平无显著差异(P>0.05),初情期与其他时期转录水平均无显著差异(P>0.05),而成年期TP53 mRNA转录水平显著高于其他时期(P<0.05),且表现出从幼龄期~成年期逐渐升高的趋势(图 5D)。
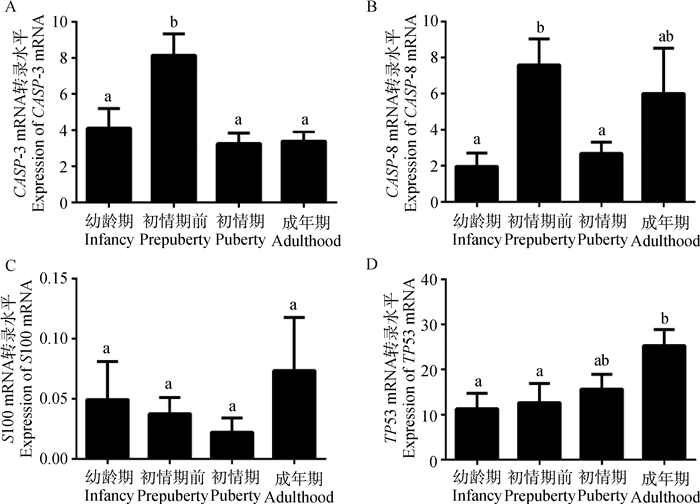
|
图 5 不同年龄阶段雌性山羊胸腺相关基因mRNA的转录水平 Figure 5 The level of relative gene mRNA in thymus of female goat during different periods |
本试验研究了山羊胸腺在增龄性变化中的特点。山羊胸腺为淡粉色非规则条状柔软组织。本研究与在小鼠[12]的研究有些许差异,小鼠小叶间隔极不发达甚至没有,而山羊胸腺被膜和小叶间隔均致密且坚韧。对胸腺重量、大小等的统计分析表明,胸腺重量在初情期达到最大,胸腺指数在初情期前达到峰值,说明雌性山羊胸腺在初情期前达到胸腺/机体相对最大,到初情期达到物理重量最大,随后呈现出重量显著降低趋势,这与在人胸腺研究中得到的人出生后一年胸腺指数达到最大,初情期开始退化趋势[13]的结论和在小鼠的研究结论[14]保持了相对一致性。胸腺最宽处长度在初情期前达到最大,胸/颈段长度比在初情期前和初情期达到最小,随后有所回升,这组数据表明胸腺发生退化早期,胸段退化速度快于颈段,而后期则颈段退化更快。
在H.E.染色结果中,幼龄时期,胸腺皮髓质分界不明显,初情期前和初情期则界限明显,幼龄期和初情期前时期胸腺组分细胞排列紧密,初情期相对疏松,成年期疏松程度更加明显且不完整胸腺小叶增多。初情期和成年期胸腺皮髓质界限明显,髓质区域变大且有融合趋势,皮质区变薄。成年期组织中出现脂肪组织浸润。这与Lubis等[15]在热带牛、张倩等[4]在牦牛及Plećaš-Solarović等[16]在雄性大鼠胸腺研究中观察到的结果相似,但牦牛胸腺在1日龄皮髓质区分界限便非常清晰[4]。山羊胸腺颈段和胸段呈现相似结果,但是初情期单个胸腺小叶较初情期前小,且胸腺组分细胞和胸腺小叶排列均紧密,髓质区域变大但融合趋势不明显,因此,雌性山羊胸腺也存在增龄性退化现象,其退化起始时间在初情期。
S100蛋白被Shinzato等[17]证实可作为TDCs的有效蛋白标记物,在从免疫组化结果可知,在胸腺颈段,S100主要分布在皮髓质交界区域以及髓质区域,胸腺胸段结果与此相似,这与在牦牛胸腺的研究[4]以及在小鼠[18]的研究相一致,但在小鼠的研究表明,S100阳性的TDCs也少量存在于皮质区域。对S100蛋白阳性的TDCs进行统计分析,颈段和胸段结果相同,幼龄阶段阳性细胞计数显著低于初情期前、初情期以及成年期,但是后3个时期统计结果均无显著差异。
Caspase-3蛋白在胸腺皮质区、髓质区以及皮髓质交界区均有分布,除在胸腺颈段初情期前和初情期阶段蛋白表达量差异不显著外,其他各组间差异均显著,且呈现明显的随年龄增长而增多的趋势;在胸腺胸段,幼龄期、初情期前、初情期以及成年期的蛋白表达量均差异显著,同样呈现随年龄增长而显著增加的趋势,这与在牦牛的研究相同[4];此外,Resendes等[19]在猪上的研究发现,从6日龄~2.5月龄的猪胸腺也呈现增多趋势,但是在5月龄时又出现下降趋势;周瑞祥等[20]证实了大鼠胸腺存在完整细胞凋亡信号通路,且Caspase-3在此通路起到重要作用,可引发细胞不可逆凋亡。
本研究检测了S100、CASP-3、CASP-8和TP53 mRNA在胸腺的转录水平,结果表明,S100 mRNA在4个时期转录水平均无显著差异;胸腺CASP-3 mRNA转录水平在初情期前达到峰值;胸腺CASP-8 mRNA转录水平同样在初情期前达到峰值;胸腺TP53 mRNA转录水平在成年期最高。综合4个基因mRNA转录水平的结果,笔者推测,CASP-3和CASP-8在初情期前山羊胸腺具有重要作用,可能对于胸腺发育过程中胸腺细胞更新以及退化早期过程具有调节或诱导作用;CASP-8和TP53 mRNA在成年山羊胸腺的转录水平变化说明其是胸腺增龄性变化重要因素,在增龄性退化过程中可能具有重要调节作用。
4 结论 4.1雌性山羊胸腺自初情期开始呈现增龄性退化现象。
4.2CASP-3和CASP-8可能参与胸腺的发育和细胞更新以及退化早期过程,而CASP-8和TP53对成年后的胸腺退化更具重要作用。
| [1] | MILLER J F A P. Immunological function of the thymus[J]. Lancet, 1961, 278(7205): 748–749. DOI: 10.1016/S0140-6736(61)90693-6 |
| [2] |
苏时萍. GnRH主动免疫对下丘脑-垂体-性腺-胸腺环路的调节机制[D]. 合肥: 安徽农业大学, 2013.
SU S P. The regulation of active immunization against GnRH on hypothalamus-pituitary-gonadal thymus loop[D]. Hefei: Anhui Agricultural University, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2446125 |
| [3] | HAYNES B F, SEMPOWSKI G D, WELLS A F, et al. The human thymus during aging[J]. Immunol Res, 2000, 22(2-3): 253–261. DOI: 10.1385/IR:22:2-3 |
| [4] |
张倩, 余四九, 何俊峰, 等. 牦牛胸腺增龄性变化的形态学观察[J]. 畜牧兽医学报, 2013, 44(8): 1305–1310.
ZHANG Q, YU S J, HE J F, et al. Morphologycal observation of age-associated changes in the thymus of the yak[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(8): 1305–1310. DOI: 10.11843/j.issn.0366-6964.2013.08.019 (in Chinese) |
| [5] |
魏岚, 刘丽, 徐玉东, 等. 小鼠胸腺结构的增龄性变化[J]. 中国老年学杂志, 2007, 27(9): 832–835.
WEI L, LIU L, XU Y D, et al. Ageing changes in thymic structure of mice[J]. Chinese Journal of Gerontology, 2007, 27(9): 832–835. (in Chinese) |
| [6] | HALE L P, CLARK A G, LI J, et al. Age-related thymic atrophy in the guinea pig[J]. Dev Comp Immunol, 2001, 25(5-6): 509–518. DOI: 10.1016/S0145-305X(00)00071-9 |
| [7] | TORROBA M, ZAPATA A G. Aging of the vertebrate immune system[J]. Microsc Res Tech, 2003, 62(6): 477–481. DOI: 10.1002/(ISSN)1097-0029 |
| [8] | GRUVER A L, HUDSON L L, SEMPOWSKI G D. Immunosenescence of ageing[J]. J Pathol, 2007, 211(2): 144–156. DOI: 10.1002/(ISSN)1096-9896 |
| [9] | MACKALL C L, PUNT J A, MORGAN P, et al. Thymic function in young/old chimeras:Substantial thymic T cell regenerative capacity despite irreversible age-associated thymic involution[J]. Eur J Immunol, 1998, 28(6): 1886–1893. DOI: 10.1002/(ISSN)1521-4141 |
| [10] |
刘仰斌, 李启华. 小鼠胸腺形态结构的增龄性变化[J]. 中国组织工程研究与临床康复, 2010, 14(31): 5805–5808.
LIU Y B, LI Q H. Age-related morphology and structure changes of mouse thymus[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(31): 5805–5808. DOI: 10.3969/j.issn.1673-8225.2010.31.026 (in Chinese) |
| [11] | ZIMMER D B, CORNWALL E H, LANDAR A, et al. The S100 protein family:History, function, and expression[J]. Brain Res Bull, 1995, 37(4): 417–429. DOI: 10.1016/0361-9230(95)00040-2 |
| [12] | PEARSE G. Normal structure, function and histology of the thymus[J]. Toxicol Pathol, 2006, 34(5): 504–514. DOI: 10.1080/01926230600865549 |
| [13] | STEINMANN G G. Changes in the human thymus during aging[C]//MÜLLER-HERMELINK H K. The Human Thymus. Berlin, Heidelberg: Springer, 1986: 43-88. |
| [14] | SHANLEY D P, AW D, MANLEY N R, et al. An evolutionary perspective on the mechanisms of immunosenescence[J]. Trends Immunol, 2009, 30(7): 374–381. DOI: 10.1016/j.it.2009.05.001 |
| [15] | LUBIS I, LADDS P W, REILLY L R, et al. Age associated morphological changes in the lymphoid system of tropical cattle[J]. Res Vet Sci, 1982, 32(3): 270–277. |
| [16] | PLEĆAŠ-SOLAROVIĆ B, PEŠIĆ V, RADOJEVIĆ K, et al. Morphometrical characteristics of age-associated changes in the thymus of old male wistar rats[J]. Anat Histol Embryol, 2006, 35(6): 380–386. DOI: 10.1111/ahe.2006.35.issue-6 |
| [17] | SHINZATO M, SHAMOTO M, HOSOKAWA S, et al. Differentiation of Langerhans cells from interdigitating cells using CD1a and S-100 protein antibodies[J]. Biotech Histochem, 1995, 70(3): 114–118. DOI: 10.3109/10520299509108327 |
| [18] |
孙宇, 陆江阳, 王晓虹, 等. 小鼠胸腺树突状细胞的分布与形态学观察[J]. 解放军医学杂志, 2004, 29(9): 813–815.
SUN Y, LU J Y, WANG X H, et al. Observation of the morphology and the distribution of mouse thymus dendritic cells[J]. Medical Journal of Chinese People's Liberation Army, 2004, 29(9): 813–815. (in Chinese) |
| [19] | RESENDES A R, MAJÍ N, SEGALÉS J, et al. Apoptosis in normal lymphoid organs from healthy normal, conventional pigs at different ages detected by TUNEL and cleaved caspase-3 immunohistochemistry in paraffin-embedded tissues[J]. Vet Immunol Immunopathol, 2004, 99(3-4): 203–213. DOI: 10.1016/j.vetimm.2004.02.001 |
| [20] |
周瑞祥, 黄云梅, 刘卉, 等. 胸腺细胞凋亡的死亡信号表达[J]. 解剖学杂志, 2006, 29(2): 171–173, 212.
ZHOU R X, HUANG Y M, LIU H, et al. Expression of death signal pathway in thymocyte apoptosis[J]. Chinese Journal of Anatomy, 2006, 29(2): 171–173, 212. (in Chinese) |



