肠道是机体最大的消化器官,具有双重功能,既是营养物质消化、吸收和代谢的重要场所,又是保持机体内环境稳定的先天性屏障[1-2]。对动物的研究发现,在环境因素的影响下,肠道的先天性屏障很容易发生损伤,从而造成肠道菌群的紊乱,进而引发各种疾病导致其生产性能的下降[2]。牦牛常年生活在高寒和缺氧环境,及饲草变化大(嫩草期和枯草期)等多种应激刺激的条件下,依然能够正常生存与其独特的肠道内环境和消化机能密不可分[3-4],因此研究牦牛肠道适应性的分子调控机制显得非常重要。
热休克蛋白(HSPs)最初发现是果蝇热刺激反应的应激蛋白[5],之后证实在真核和原核生物机体中HSP70存在广泛的表达[6]。目前所发现的HSPs家族按照相对分子质量大小可分为以下6个家族:小HSP(15~30 ku)、HSP40、HSP60、HSP70、HSP90和HSP100[7],其中HSP70作为重要的分子伴侣[8],在细胞中的HSP70能够协助细胞内其他蛋白质发生正确的转位、折叠组装和运输[9];还可通过多种途径与凋亡诱导因子相结合,从而抑制细胞的凋亡[10-11]。现已发现HSP70在多种动物的肠道中有表达,其主要功能是保护肠道细胞免受各种外界的应激刺激[12-15]。目前有关HSP70在肠道中的研究主要集中在受到外界刺激的人[12]、鼠[13]、仔猪[14]和鹅[15]等,而有关健康牦牛肠道中HSP70的定位和表达研究尚未见报道。因此,本研究采用免疫组织化学、蛋白免疫印迹(WB)和实时荧光定量(RT-qPCR),从蛋白质和基因水平检测成年牦牛6段肠道中HSP70定位和定量的变化规律,为进一步探讨HSP70对牦牛肠道的作用机制提供详实的参考资料。
1 材料与方法 1.1 样品采集从青海省西宁市采集6头份健康成年(3~6岁)牦牛肠道组织。在牦牛颈动脉放血致死后,迅速分离出十二指肠、空肠、回肠、盲肠、结肠和直肠组织,生理盐水冲洗干净之后,将用于制作石蜡切片和免疫组织化学试验的样品固定于4%的中性多聚甲醛溶液中。而用于免疫印迹和实时荧光定量试验的样品迅速存放于液氮中,次日移至-80 ℃冰箱中备用。
1.2 主要试剂HSP70(Abcam,ab79852);HRP(Bioss,bs-0295G);β-actin (Bioss,bs-0061R);RIPA(Solarbio,R0010);PMSF(Solarbio,P0100);SP试剂盒(Bioss,sp-0023);DAB试剂盒(ZSGB-bio,ZILZ-9019)。
1.3 组织切片制备样品于4%的中性多聚甲醛溶液中固定7 d以上,组织块经冲洗、脱水、透明、浸蜡、包埋,然后用切片机切成4 μm连续切片。
1.4 免疫组织化学染色石蜡切片脱蜡至水,免疫组织化学染色按照SP试剂盒说明步骤进行。(1)在pH6.0的0.01 mol·L-1柠檬酸盐缓冲液中进行热诱导的微波抗原修复,高火煮沸5 min,然后中火维持3 min,室温下自然冷却;(2)滴加3%过氧化氢溶液(来自SP试剂盒),37 ℃下孵育10 min;(3)滴加10%非免疫性动物血清(SP试剂盒中A液),室温孵育10 min,倾去勿洗;(4)每张切片滴加50 μL兔抗HSP70多克隆抗体稀释液(稀释度1:350),4 ℃过夜;(5)滴加生物素标记的二抗(SP试剂盒中B液),37 ℃下孵育15 min;(6)滴加过氧化物酶标记的链霉亲和素(SP试剂盒中C液),37 ℃下孵育15 min;(7) DAB显色,在显微镜下观察并控制显色,自来水终止反应;(8)苏木素复染,脱水,透明,中性树胶封片。以上步骤除第三步外,其余各步骤间均用PBS洗三次(3 min·次-1);阴性对照用PBS替代一抗孵育。用Olympus DP73显微镜对免疫组织化学染色切片进行观察并拍照。
1.5 蛋白免疫印迹将采取的牦牛十二指肠、空肠、回肠、盲肠、结肠和直肠六段肠道组织分别研磨后,称取0.1 g,并按照1 mL RIPA+10 μL PMSF的比例分别加入RIPA和PMSF,匀浆1.5 h,4 ℃下12 000×g离心5 min,取上清液。用ND-1000(Nano Drop Technologies)测定蛋白质浓度后调整蛋白浓度,按蛋白与4×SDS Buffer 3:1的比例,沸水浴10 min,将蛋白质变性。用等量变性蛋白上样并进行10% SDS-PAGE电泳,转移至PVDF膜上,用5%脱脂奶粉室温封闭2 h。孵育HSP70(1:1 000)抗体4 ℃过夜,内参为β-actin(1:1 000)。清洗后的PVDF膜用HRP标记的二抗(1:2 000)室温下孵育1 h,用ECL化学发光液显色并观察结果。条带结果采用Image J软件测定各条带灰度值,从而得出HSP70在牦牛各段肠道当中的相对表达量。
1.6 实时荧光定量PCR 1.6.1 引物的设计和合成根据GenBank中已报道的牦牛HSP70基因序列及牦牛β-actin内参基因序列,采用Primer Premier 5.0软件设计特异性引物,由北京华大基因合成。所用引物见表 1。
|
|
表 1 目的基因和内参基因的引物序列 Table 1 Primer sequences of target and house-keeping genes |
使用Trizol法提取牦牛六段肠道组织中的总RNA。然后,取不同肠断中的RNA 5 μL,用1%琼脂糖凝胶电泳鉴定其完整性;另取不同肠道组织的RNA 1 μL,使用超微量分光光度计测定其浓度和OD值。将提取的不同组织RNA浓度均调到400 ng·μL-1。根据全式金公司的TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒说明书反转录成cDNA。以反转录得到cDNA为模板进行HSP70和β-actin基因的PCR扩增。PCR反应体系为20 μL:上下游引物各1 μL,模板1 μL,Go Taq Green Master Mix 10 μL,无菌去离子水7 μL。扩增程序:95 ℃ 2 min;95 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。反应结束后取10 μL PCR产物,用1%琼脂糖凝胶电泳检测后,紫外灯下观察,凝胶成像系统采集图像。HSP70的PCR扩增产物为158 bp,β-actin的PCR扩增产物为207 bp。
1.6.3 实时荧光定量以反转录得到的cDNA为模板进行HSP7 0和β-actin的实时荧光定量PCR扩增。定量PCR反应体系为(20 μL体系):2× TransStart Top Green qPCR SuperMix 10 μL,上下游引物各0.5 μL,cDNA样品1 μL,灭菌超纯水8 μL。扩增程序:95 ℃ 5 min;95 ℃ 10 s,62 ℃ 15 s,72 ℃ 15 s,共45个循环;95 ℃ 5 s,65 ℃ 1 min;40 ℃ 30 s。每个样品重复3次。反应结束后以熔解曲线来判定RT-qPCR反应的特异性;获得每个样品的CT值,运用2-ΔΔCT法进行分析,试验数据用“平均值±标准误(x±sx)”表示。ΔCT(目的基因)=CT(目的基因)-CT(内参基因),ΔΔCT=ΔCT(样品组)-ΔCT(十二指肠组)。
1.7 数据分析6头份牦牛每段肠道各选取三个组织块,每个组织块选取5张切片,随机选取10个显微视野,用Image-Pro Plus 6.0图像分析软件测定HSP70在各肠段阳性表达的平均积分光密度。使用IBM SPSS22.0软件对数据进行单因素方差分析。所有数据均以平均值±标准误(x±sx)表示,P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。
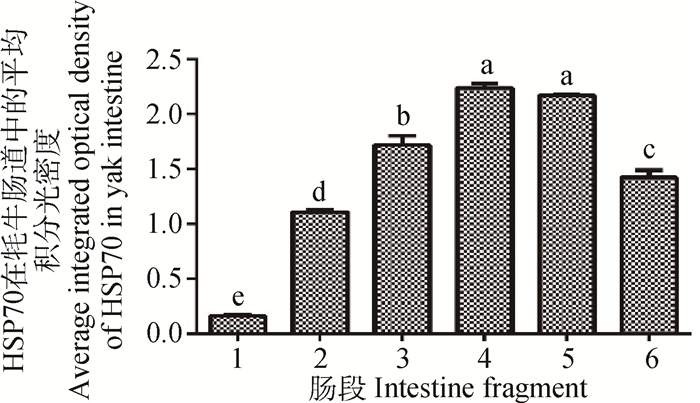
2 结果 2.1 牦牛肠道中HSP70的免疫组织化学观察HSP70在牦牛小肠的黏膜层、黏膜下层和肌层中均有表达(图 1a),其中小肠黏膜上皮的柱状细胞呈强阳性表达,杯状细胞未见表达;小肠腺的肠腺细胞和肌层的平滑肌细胞也呈阳性表达(图 1b~e),阳性反应主要分布于上述细胞的细胞质与细胞核内。HSP70在大肠中的定位表达与小肠相似,在大肠壁黏膜层、黏膜下层和肌层中也均有表达(图 1g),但牦牛大肠中HSP70阳性表达主要位于黏膜上皮和固有膜内散在分布的结缔组织细胞,固有膜内大肠腺细胞仅在细胞核有表达,细胞质呈阴性(图 1f~h)。来自肠道各段的平均积分光密度的分析结果显示,HSP70在牦牛的小肠近端至大肠远端呈现先增高后降低的趋势,在盲肠达到最高,除盲肠和结肠差异不显著外(P>0.05),其余各肠段均差异极显著(P<0.01)(图 2)。

|
a.十二指肠;b.十二指肠上皮;c.十二指肠肠腺;d.空肠肠腺;e.空肠肌层;f.盲肠肠腺;g.结肠;h.直肠;i.阴性对照。→.阳性表达;IG.肠腺;DG.十二指肠腺;IGC.上皮内杯状细胞; TM.肌层 a. Duodenum; b. Duodenal epithelium; c. Duodenal intestinal gland; d. Jejunum intestinal gland; e. Jejunum muscle; f. Cecum intestinal gland; g. Colon; h. Rectum; i. The negative control. →. Positive expression; IG. Intestinal gland; DG. Glandulae duodenales; IGC. Intraepithelial goblet cells; TM. Tunica muscularis 图 1 HSP70在牦牛肠道中表达的免疫组织化学结果 Figure 1 Immunohistochemistry results of HSP70 expression in yak intestine |
|
1.十二指肠;2.空肠;3.回肠;4.盲肠;5.结肠;6.直肠。不同小写字母代表组间差异极显著(P<0.01),相同小写字母代表组间差异不显著(P>0.05) 1.Duodenum; 2.Jejunum; 3.Ileum; 4.Cecum; 5.Colon; 6.Rectum. The different letters mean significant differences between the groups (P < 0.01), the same letters mean no significant differences between the groups (P > 0.05) 图 2 HSP70在牦牛肠道中的平均积分光密度 Figure 2 Average integrated optical density of HSP70 in yak intestine |
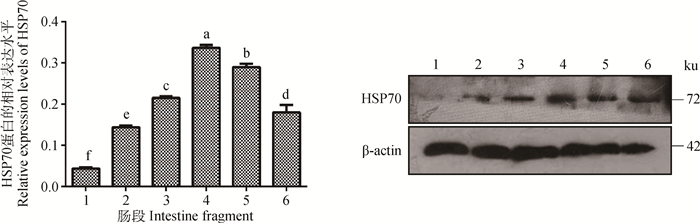
通过蛋白免疫印迹检测成年牦牛十二指肠、空肠、回肠、盲肠、结肠和直肠组织中HSP70的表达,发现从小肠的前端到大肠末端,HSP70的表达呈现先增高后降低的趋势,其中在盲肠中的表达量达到峰值。此外,由图 3可以看出,HSP70的表达量在大肠中极显著高于小肠(P<0.01)。
|
1.十二指肠;2.空肠;3.回肠;4.盲肠;5.结肠;6.直肠。不同小写字母代表组间差异极显著(P<0.01) 1. Duodenum; 2. Jejunum; 3. Ileum; 4. Cecum; 5. Colon; 6. Rectum. The different letters mean significant differences between the groups (P < 0.01) 图 3 HSP70蛋白的相对表达水平 Figure 3 Relative expression levels of HSP70 |
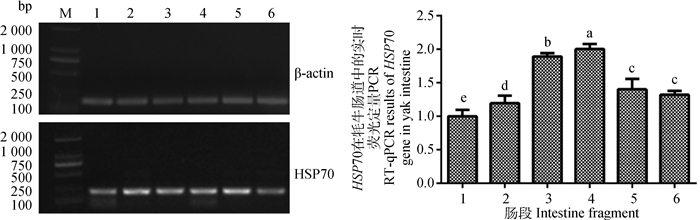
RT-qPCR检测结果发现,HSP70 mRNA在牦牛的6段肠道内均有表达,直肠和结肠间表达差异不显著,其他肠段间相对表达量差异显著(P<0.05),并且HSP70在盲肠内的表达量显著高于其他肠段(P<0.05),分别是十二指、空肠、回肠、结肠和直肠的2、1.68、1.06、1.43和1.52倍(图 4)。
|
M. DL2000 DNA相对分子质量标准;1.十二指肠;2.空肠;3.回肠;4.盲肠;5.结肠;6.直肠;不同小写字母代表组间差异显著(P<0.05),相同小写字母代表组间差异不显著(P>0.05) M. DL2000 DNA marker; 1. Duodenum; 2. Jejunum; 3. Ileum; 4. Cecum; 5. Colon; 6. Rectum; The different letters mean significant differences between the groups (P < 0.05), the same letters mean no significant differences between the groups (P > 0.05) 图 4 HSP70在牦牛肠道中的实时荧光定量PCR Figure 4 RT-qPCR results of HSP70 gene in yak intestine |
实时荧光定量PCR和蛋白免疫印迹结果显示,在牦牛十二指肠、空肠、回肠、盲肠、结肠和直肠组织中均有HSP70 mRNA和蛋白的表达,说明在正常生理条件下,HSP70基因和蛋白广泛存在于牦牛的各段肠道中。Hu等[16]研究发现,在健康小鼠的小肠中几乎检测不到HSP70的表达,尤其是空肠;而王莉等[17]发现仔猪腹泻时与健康仔猪消化道组织中的HSP70差异并不显著。我们的试验结果与上述试验结果有所出入,我们推断可能是由于物种不同及饲料不同引起的HSP70表达出现差异性。令我们欣喜的是,该试验发现HSP70 mRNA和蛋白的相对表达量在牦牛的6段肠道内,从小肠的前端到大肠末端,HSP70的表达呈现先增高后降低的趋势,且在盲肠中的表达量最高。前人研究反刍动物证实,盲肠和结肠是机体内除瘤胃外的发酵消化位点,在其中有大量的微生物菌群存在,且在强酸环境的胃和多种微生物存在的大肠中HSP70极显著表达[18-21]。因此,结合本试验结果笔者推测,HSP70在牦牛盲肠中的高表达可能与肠道微生物菌群有关,在不同肠段表达的差异性一定程度上反映了牦牛肠道消化机能的强弱。
本试验中,通过对HSP70在健康牦牛肠道中的定位表达的研究,笔者发现HSP70在正常的牦牛各段肠道中均有表达,但在牦牛小肠和大肠中的表达模式并不完全相同。在牦牛小肠中,HSP70的阳性表达主要见于黏膜上皮、小肠腺和肌层,在黏膜固有层的结缔组织仅有微弱的表达;而在牦牛大肠中,HSP70的阳性表达主要见于黏膜上皮、固有层结缔组织和肌层,大肠腺腺细胞核中也有阳性反应。我们还发现HSP70在牦牛大肠固有层结缔组织细胞的细胞核中有强烈表达。有研究发现,HSP70参与机体的免疫,属于HSP70的特殊结构蛋白BIP在免疫球蛋白的合成过程中起到关键的作用[22]。一般情况下,HSP70位于细胞质内,当细胞遭受应激作用时,HSP70会迅速移入细胞核内并包围核仁;而应激消除后细胞处于恢复阶段时,细胞核内HSP70又返回细胞质,再次应激又重新返回细胞核[23]。结合肠道的组织学特点,这表明HSP70有可能在牦牛肠道的免疫屏障中发挥着重要作用。有研究报道发现,来自于肠道内容物中的细菌和内毒素等能够在肠道屏障损伤后发生细菌和LPS的移位,进而造成严重的炎症反应,并引发肠道细胞过度凋亡[24-25]。Watanabe等[26]和Oyake等[27]发现HSP70能够保护胃肠道上皮在溃疡和有毒物质的影响下维持其正常的生理状态。同时,Pierzchalski等[28]也发现HSP70的过度表达还可以抑制细胞的凋亡,加速蛋白合成和促进细胞增殖来加速溃疡的愈合速度。因此,综合HSP70在牦牛肠道中的表达特点,我们认为牦牛肠道中HSP70的表达能够保护肠道细胞免受外来刺激、抑制其凋亡以及保护细胞的正常生理状态。
笔者分析了HSP70在牦牛肠道三种分泌细胞中的表达模式,发现在小肠腺细胞细胞质和细胞核中均呈强阳性,大肠腺细胞中仅见细胞核阳性,在杯状细胞中呈阴性。牛的小肠腺主要是分泌消化酶,大肠腺分泌的碱性黏液主要是中和其肠腔内的酸性物质,且其中不含消化酶[29]。而杯状细胞的主要分泌物——黏蛋白是肠道的保护蛋白[30]。HSP70作为分子伴侣能够维持和稳定蛋白前体的基本构象,可以使蛋白保持一种松弛的伸展开来的结构,以便进行蛋白的跨膜转运,在协助蛋白进行跨膜转运等方面发挥着重要作用[9]。黄芬等[31]发现过表达的HSP70能有效促进细胞分泌性蛋白的表达。结合肠道细胞中三种分泌蛋白的表达模式,推测HSP70有可能促进小肠腺消化蛋白酶的分泌,预示着HSP70可能和肠道正常消化相关,其具体机制有待进一步研究。
4 结论HSP70在牦牛肠道中存在广泛性阳性反应,基因和蛋白表达显示在小肠和大肠中呈显著性差异,且在盲肠中表达显著高于其他肠段。结果表明HSP70与牦牛肠道的消化吸收功能有着密切的关联性。
| [1] |
占今舜, 夏晨, 赵国琦. 黑麦草粉颗粒饲料对扬州鹅胃肠道的影响[J]. 广东饲料, 2014, 23(11): 26–28.
ZHAN J S, XIA C, ZHAO G Q. Effects of rye grass pellet feed on gastrointestinal tract of Yangzhou goose[J]. Guangdong Feed, 2014, 23(11): 26–28. DOI: 10.3969/j.issn.1005-8613.2014.11.010 (in Chinese) |
| [2] |
呙于明, 刘丹, 张炳坤. 家禽肠道屏障功能及其营养调控[J]. 动物营养学报, 2014, 26(10): 3091–3100.
GUO Y M, LIU D, ZHANG B K. Intestinal barrier of poultry:Function and modulation[J]. Chinese Journal of Animal Nutrition, 2014, 26(10): 3091–3100. DOI: 10.3969/j.issn.1006-267x.2014.10.021 (in Chinese) |
| [3] |
姬秋梅. 中国牦牛品种资源的研究进展[J]. 自然资源学报, 2001, 16(6): 564–570.
JI Q M. Advances in research of yak resources in China[J]. Journal of Natural Resources, 2001, 16(6): 564–570. DOI: 10.11849/zrzyxb.2001.06.015 (in Chinese) |
| [4] |
左愈臻, 高世杰, 邵建华, 等. 成年牦牛小肠结构及黏膜免疫相关细胞数量变化研究[J]. 畜牧兽医学报, 2011, 42(12): 1776–1781.
ZUO Y Z, GAO S J, SHAO J H, et al. Study on the structure and quantitative changes of mucosal immunity-associated cells in small intestine of the adult yak[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(12): 1776–1781. (in Chinese) |
| [5] | RITOSSA F. A new puffing pattern induced by temperature shock and DNP in drosophila[J]. Experientia, 1962, 18(12): 571–573. DOI: 10.1007/BF02172188 |
| [6] | ADAMS C, RINNE R W. Strees protein formation:Gene expression and environmental interaction with evolutionary significance[J]. Int Rev Cytol, 1982, 79: 305–315. DOI: 10.1016/S0074-7696(08)61677-0 |
| [7] | SNOECKX L H E H, CORNELUSSEN R N, VAN NIEUWENHOVEN F A, et al. Heat shock proteins and cardiovascular pathophysiology[J]. Physiol Rev, 2001, 81(4): 1461–1497. DOI: 10.1152/physrev.2001.81.4.1461 |
| [8] | SAIBIL H. Chaperone machines for protein folding, unfolding and disaggregation[J]. Nature Rev Mol Cell Biol, 2013, 14(10): 630–642. DOI: 10.1038/nrm3658 |
| [9] | YOUNG J C, AGASHE V R, SIEGERS K, et al. Pathways of chaperone-mediated protein folding in the cytosol[J]. Nat Rev Mol Cell Biol, 2004, 5(10): 781–791. DOI: 10.1038/nrm1492 |
| [10] | LI C Y, LEE J S, KO Y G, et al. Heat shock protein 70 inhibits apoptosis downstream of cytochrome c release and upstream of caspase-3 activation[J]. J Biol Chem, 2000, 275(33): 25665–25671. DOI: 10.1074/jbc.M906383199 |
| [11] | BEERE H M, WOLF B B, CAIN K, et al. Heat-shock protein 70 inhibits apoptosis by preventing recruitment of procaspase-9 to the Apaf-1 apoptosome[J]. Nat Cell Biol, 2000, 2(8): 469–475. DOI: 10.1038/35019501 |
| [12] |
陈怡, 冉志华, 黄美兰, 等. 人结肠癌中热休克蛋白70、90α和90β mRNA的表达及其意义[J]. 胃肠病学, 2006, 11(9): 526–529.
CHEN Y, RAN Z H, HUANG M L, et al. Expressions of heat-shock proteins 70, 90α and 90β mRNA in human colon cancer and their significance[J]. Chinese Journal of Gastroenterology, 2006, 11(9): 526–529. (in Chinese) |
| [13] |
周旭春, 孙晓宁, 杨波, 等. 感染后肠易激综合征小鼠肠道热休克蛋白70的表达及意义[J]. 世界华人消化杂志, 2015, 23(26): 4177–4183.
ZHOU X C, SUN X N, YANG B, et al. Expression of heat shock protein 70 in intestinal tissue of mice with post-infectious irritable bowel syndrome[J]. World Chinese Journal of Digestology, 2015, 23(26): 4177–4183. (in Chinese) |
| [14] | ZHONG X, ZHANG X H, LI X M, et al. Intestinal growth and morphology is associated with the increase in heat shock protein 70 expression in weaning piglets through supplementation with glutamine[J]. J Anim Sci, 2011, 89(11): 3634–3642. DOI: 10.2527/jas.2010-3751 |
| [15] |
王丹. 急性热应激对鹅肠道的损伤及热休克蛋白70表达的影响[D]. 长春: 吉林农业大学, 2011.
WANG D. Effect of acute heat stress on intestinal morphology of goose and expression of heat stress protein 70[D]. Changchun: Jilin Agricultural University, 2011. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10193-1011150245.htm |
| [16] | HU S E, WANG Y W, LICHTENSTEIN L, et al. Regional differences in colonic mucosa-associated microbiota determine the physiological expression of host heat shock proteins[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299(6): G1266–G1275. DOI: 10.1152/ajpgi.00357.2010 |
| [17] |
王莉, 汪蕊, 王希彪. 仔猪HSP70蛋白表达与断奶腹泻关系研究[J]. 东北农业大学学报, 2011, 42(12): 29–32.
WANG L, WANG R, WANG X B. Study on relationship between porcine HSP70 protein expression and weaning diarrhoea piglets[J]. Journal of Northeast Agricultural University, 2011, 42(12): 29–32. DOI: 10.3969/j.issn.1005-9369.2011.12.006 (in Chinese) |
| [18] | REN H Y, MUSCH M W, KOJIMA K, et al. Short-chain fatty acids induce intestinal epithelial heat shock protein 25 expression in rats and IEC 18 cells[J]. Gastroenterology, 2001, 121(3): 631–639. DOI: 10.1053/gast.2001.27028 |
| [19] | KOJIMA K, MUSCH M W, REN H Y, et al. Enteric flora and lymphocyte-derived cytokines determine expression of heat shock proteins in mouse colonic epithelial cells[J]. Gastroenterology, 2003, 124(5): 1395–1407. DOI: 10.1016/S0016-5085(03)00215-4 |
| [20] | ARVANS D L, VAVRICKA S R, REN H Y, et al. Luminal bacterial flora determines physiological expression of intestinal epithelial cytoprotective heat shock proteins 25 and 72[J]. Am J Physiol Gastrointest Liver Physiol, 2005, 288(4): G696–G704. DOI: 10.1152/ajpgi.00206.2004 |
| [21] | HUME I D. Digestive strategies of mammals[J]. Acta Zool Sin, 2002, 48(1): 1–19. |
| [22] | MALLOUK Y, VAYSSIER-TAUSSAT M, BONVENTRE J V, et al. Heat shock protein 70 and ATP as partners in cell homeostasis (review)[J]. Int J Mol Med, 1999, 4(5): 463–474. |
| [23] | NERI L M, RIEDERER B M, MARUGG R A, et al. Analysis by confocal microscopy of the behavior of heat shock protein 70 within the nucleus and of a nuclear matrix polypeptide during prolonged heat shock response in HeLa cells[J]. Exp Cell Res, 1995, 221(2): 301–310. DOI: 10.1006/excr.1995.1379 |
| [24] |
朱丽慧, 徐建雄, 陈小连. 细胞凋亡与肠道功能的关系[J]. 动物营养学报, 2011, 23(11): 1862–1869.
ZHU L H, XU J X, CHEN X L. Relationship between apoptosis and intestinal function[J]. Chinese Journal of Animal Nutrition, 2011, 23(11): 1862–1869. DOI: 10.3969/j.issn.1006-267x.2011.11.003 (in Chinese) |
| [25] |
冯若飞, 谈春霞, 邹文辉. 细菌内毒素诱导细胞凋亡的研究进展[J]. 西北民族大学学报:自然科学版, 2005, 26(3): 67–71.
FENG R F, TAN C X, ZOU W H. Progress of cell apoptosis induced by bacterial endotoxin[J]. Journal of Northwest University for Nationalities:Natural Science, 2005, 26(3): 67–71. (in Chinese) |
| [26] | WATANABE D, OTAKA M, MIKAMI K I, et al. Expression of a 72-kDa heat shock protein, and its cytoprotective function, in gastric mucosa in cirrhotic rats[J]. J Gastroenterol, 2004, 39(8): 724–733. DOI: 10.1007/s00535-003-1380-8 |
| [27] | OYAKE J, OTAKA M, MATSUHASHI T, et al. Over-expression of 70-kDa heat shock protein confers protection against monochloramine-induced gastric mucosal cell injury[J]. Life Sci, 2006, 79(3): 300–305. DOI: 10.1016/j.lfs.2006.01.013 |
| [28] | PIERZCHALSKI P, KRAWIEC A, PTAK-BELOWSKA A, et al. The mechanism of heat-shock protein 70 gene expression abolition in gastric epithelium caused by Helicobacter pylori infection[J]. Helicobacter, 2006, 11(2): 96–104. DOI: 10.1111/hel.2006.11.issue-2 |
| [29] |
惠军来. 牛的消化系统及消化腺的功能[J]. 中国畜牧兽医文摘, 2015, 31(1): 36.
HUI J L. Digestive system and digestive gland functions of cattle[J]. China Animal Husbandry and Veterinary Abstracts, 2015, 31(1): 36. (in Chinese) |
| [30] | AUDIE J P, JANIN A, PORCHET N, et al. Expression of human mucin genes in respiratory, digestive, and reproductive tracts ascertained by in situ hybridization[J]. J Histochem Cytochem, 1993, 41(10): 1479–1485. DOI: 10.1177/41.10.8245407 |
| [31] |
黄芬, 安小平, 李存, 等. 过表达热休克蛋白70提高CHO细胞表达抗体的能力[J]. 中国生物工程杂志, 2011, 31(9): 8–13.
HUANG F, AN X P, LI C, et al. Overexpression of heat shock protein70 enhances production of antibody in Chinese hamster ovary cells[J]. China Biotechnology, 2011, 31(9): 8–13. (in Chinese) |



