副猪嗜血杆菌(Haemophilus parasuis, H. parasuis)属于巴氏杆菌科的一种革兰阴性多形性杆菌,是Glässer病的病原体,主要引起猪的多种浆膜炎,如多发性关节炎和脑膜炎[1]。迄今为止,除了不可分型株外,已经鉴定了15种副猪嗜血杆菌血清型[2]。其中,1、5、10、12、13和14是强毒血清型,2、4、8和15是弱毒血清型,3、6、7、9和11被认为是无毒血清型[3]。通过副猪嗜血杆菌不同血清型侵入猪主动脉内皮细胞AOC-45发现,血清型1、2、4和5侵入细胞水平显著高于血清型7、9、10和13型。据此可推测,细菌的毒力可能与其吸附和侵入细胞的能力有关[4]。然而,毒力与吸附/侵入之间的关系尚不清楚。
早期的科学研究已经证实副猪嗜血杆菌可以感染猪肺泡巨噬细胞并与细菌的毒力存在一定的相关性[5]。肺泡巨噬细胞作为先天免疫反应的成员之一,参与机体对外源病原的清除[6]。副猪嗜血杆菌在上呼吸道最初定植之后,在猪感染的早期阶段进入肺[7],并能够被肺泡巨噬细胞吞噬[5, 8]。3D4/21细胞作为猪肺泡巨噬细胞的一种传代细胞系虽然对一些病原菌已失去部分或全部的吞噬能力,但仍能被细菌侵入和保留分泌细胞因子的功能[9],因此,该细胞可以作为副猪嗜血杆菌的侵入模型。
TGF-β1是一种多功能细胞因子,调节广泛的生理过程以及病理过程(例如细胞内鸟分枝杆菌复合物感染细胞等[10])。嗅鞘细胞(OECs)可以分泌抗炎细胞因子TGF-β1,通过整合素/MFG-E8信号通路增强OECs的吞噬活性[11]。甲型流感病毒(IAV)感染细胞后会导致细胞TGF-β1表达升高,同时纤连蛋白(Fn)与α5整合素的表达也随之增加,从而导致了严重的细菌继发感染。Fn是由胶原、纤维蛋白原、纤连蛋白和层黏连蛋白组成的细胞外基质之一。细胞外基质可以与整合素相互作用,而整合素是可以影响细胞吸附、迁移、增殖和分化的大分子复杂混合物[12]。此外,细胞外基质还可以识别微生物表面组分,例如与细菌细胞壁共价连接的黏性基质分子[13],而这些黏附因子均受到TGF-β1的调控[14]。
副猪嗜血杆菌病是当前我国猪群常见的细菌继发感染性疾病,故本研究期望通过副猪嗜血杆菌感染3D4/21细胞试验揭示免疫细胞中TGF-β1表达与副猪嗜血杆菌感染的关系。本研究探讨了猪肺泡巨噬细胞传代细胞系3D4/21中TGF-β1调控Fn/α5整合素表达与副猪嗜血杆菌侵入的关系。
1 材料与方法 1.1 试剂巨噬细胞无血清培养基(Macrophage-SFM)购自赛默飞世尔科技公司;Mouse/Rat/Porcine/Canine TGF-β1 ELISA试剂盒购自安迪生物科技有限公司;Anti-Fibronectin购自艾博抗贸易有限公司;Purified Mouse Anti-Human CD49e购自BD生物科技公司;Alexa Fluor488结合的Affinipure山羊抗小鼠IgG购自Proteintech生物公司。特定的小干扰RNA(siRNA)片段由吉玛生物公司合成。
1.2 细菌菌株和培养条件本研究中使用副猪嗜血杆菌血清标准型5型菌株。将细菌在胰蛋白胨大豆琼脂和含有0.01%烟酰胺腺嘌呤二核苷酸(NAD)和5%灭活牛血清的胰酪胨大豆肉汤(分别为TSA和TSB;OXOID)中37 ℃培养。在使用之前,细菌接种于TSB并在37 ℃摇床以200 r·min-1振荡过夜培养,过夜培养物按1:100接种新鲜培养基,振荡孵育直至OD600 nm≈0.6。
1.3 3D4/21细胞培养将3D4/21细胞在37 ℃ 5% CO2的条件下培养,并用含有10%灭活胎牛血清(FBS,Invitrogen),100 U·mL-1青霉素G(Invitrogen),100 mg·mL-1链霉素(Invitrogen)和MEM非必需氨基酸(Invitrogen)的RPMI 1640(Invitrogen)进行细胞培养。细胞在达到90%密度时进行传代。
1.4 吸附和侵入试验按照已有实验方法修改[15]后进行吸附和侵入试验。将3D4/21细胞(3×105个细胞·孔-1)接种24孔细胞板。感染前,每个孔用PBS洗涤去除抗生素,并用副猪嗜血杆菌以几个感染剂量(10、100、200和400 MOI)感染。将细胞板以800×g离心10 min,并在37 ℃ 5% CO2的温箱中孵育不同时间(吸附:0.5、1、2 h,或侵入:1、2、4 h)。用PBS洗涤5次除去非特异性附着的细菌。
在进行吸附试验时,除去非特异性附着的细菌后,在细胞板中加入100 μL 0.025%胰蛋白酶,37 ℃孵育10 min。胰蛋白酶处理后刮取细胞,转移到无菌离心管中,然后以12 000×g离心1 min。除去上清液,将沉淀重悬于等体积的PBS中。将重悬的液体连续稀释,取100 μL不同浓度稀释液在TSA平板上涂布均匀。平板在37 ℃孵育48 h后进行细菌菌落计数。
在进行侵袭试验时,除去非特异性附着的细菌后向每个细胞孔中加入完全生长培养基(包括100 U·mL-1青霉素G和0.25 mg·mL-1庆大霉素),将细胞板孵育1 h以杀死细胞外副猪嗜血杆菌。将细胞板洗涤3次,如上所述收集细胞进行涂板。
1.5 荧光定量PCR分析应用OMEGA公司的总RNA提取试剂盒分离细胞总RNA,应用HiScript Q RT SuperMix(诺唯赞生物公司)从总RNA合成cDNA,应用ABI 7300荧光定量PCR系统(Applied生物公司)进行荧光定量PCR。使用2-△△Ct方法以β-actin作为内参计算TGF-β1 mRNA相对表达量[16]。TGF-β1序列从Sus_scrofa基因组(GenBank登录号:397078)中获得,参照该基因序列设计相关TGF-β1引物(引物购自赛默飞世尔科技公司) (F: 5′-CGAGCCCTGGATACCAACTA-3′;R: 5′-AGGCTCCAGATGTAGGGACA-3′)建立SYBR-Green荧光定量PCR方法。
1.6 TGF-β1浓度测定将3D4/21细胞(3×105个细胞·孔-1)接种到24孔细胞板中并在巨噬细胞无血清培养基中培养。采用优化后的侵入条件应用副猪嗜血杆菌感染,在12、24、36 h收集细胞上清液(每12 h收集上清液后,加入新培养基)并于-70 ℃保存。通过Mouse/Rat/Porcine/Canine TGF-β1 ELISA试剂盒测定上清液中TGF-β1的浓度,应用标准曲线(根据说明书计算)对上清中的TGF-β1进行定量。
1.7 RNA干扰测定靶向Fn和α5整合素的siRNA片段以及一个非特异性随机片段由吉玛生物公司合成。siRNA序列来自于本实验室前期研究[17],将3D4/21细胞(6×105细胞·孔-1)接种到12孔细胞板中。当细胞密度达到约70%时,将其用Fn和α5整合素的siRNA片段(1.2 μg·孔-1)转染。然后用胰蛋白酶消化细胞并通过流式细胞术分析。
1.8 流式细胞术分析将3D4/21细胞用胰蛋白酶消化,并在37 ℃与Fn和α5整合素特异性抗体孵育0.5 h。用PBS洗涤细胞沉淀2次后将细胞重悬,并与Alexa Fluor 488-结合的Affinipure山羊抗小鼠IgG在37 ℃孵育0.5 h。用PBS洗涤细胞后重悬,然后进行流式细胞术分析。
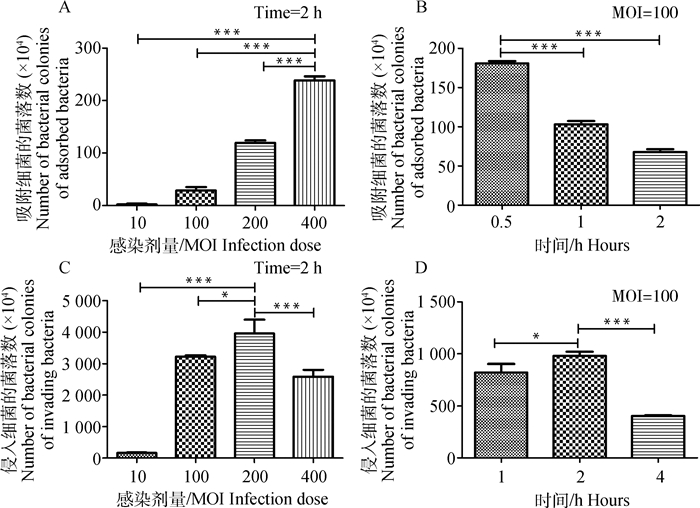
2 结果 2.1 副猪嗜血杆菌吸附和侵入条件的优化吸附和侵入试验(CFU计数结果)表明最佳吸附条件为400 MOI作用0.5 h。最佳侵入条件为200 MOI作用2 h(图 1)。
|
单因素方差分析,Dunnett多重比较检验, ***.P<0.001, *.P<0.05 One-way ANOVA, Dunnett's multiple comparison test, ***.P < 0.001, *.P < 0.05 图 1 副猪嗜血杆菌吸附和侵入条件的优化 Figure 1 Optimized conditions for H. parasuis adherence and invasion |
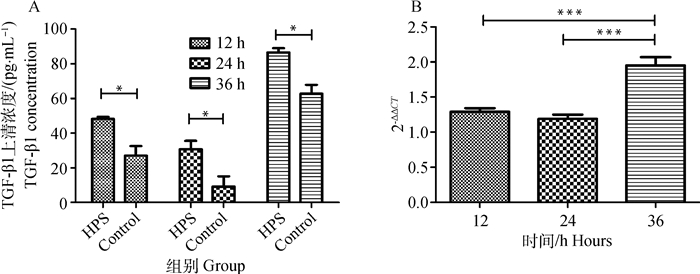
在副猪嗜血杆菌感染的细胞中TGF-β1水平在12、24和36 h分别是未感染细胞的1.36、1.52和1.25倍(P<0.05)(图 2A)。这些数据表明副猪嗜血杆菌感染增加了TGF-β1的表达。与此结果相一致的是荧光定量PCR也显示副猪嗜血杆菌感染增强了TGF-β1 mRNA的表达,且在36 h观察到最高值(P<0.001)(图 2B)。
|
A图:配对t检验, *.P<0.05;B图:单因素方差分析,Dunnett多重比较检验, ***.P<0.001 Fig.A: Paired t test, *.P < 0.05; Fig.B:One-way ANOVA, Dunnett's multiple comparison test, ***.P < 0.001 图 2 副猪嗜血菌感染提高TGF-β1的表达 Figure 2 H. parasuis infection enhances the expression of TGF-β1 in 3D4/21 cells |
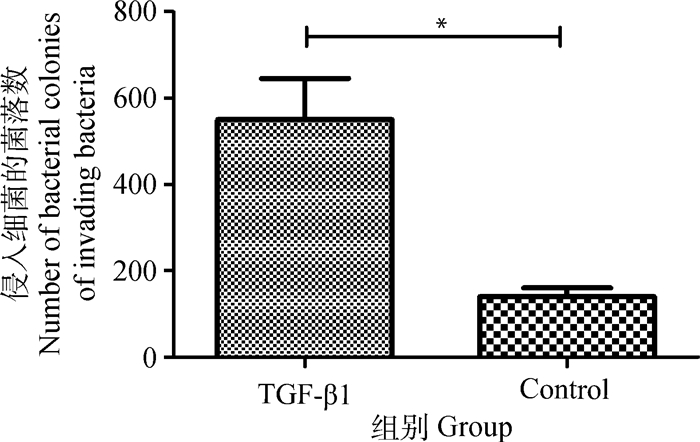
为了证实TGF-β1在侵入中的作用,将重组TGF-β1预处理细胞24 h后用副猪嗜血杆菌感染。结果显示TGF-β1可以显著增加副猪嗜血杆菌对3D4/21细胞的侵入(P<0.05)(图 3)。
|
配对t检验, *.P<0.05 Paired t test, *.P < 0.05 图 3 TGF-β1预处理3D4/21细胞后促进了副猪嗜血杆菌的侵入 Figure 3 Pretreatment of 3D4/21 cells with recombinant TGF-β1 increased the invasion of Haemophilus parasuis |
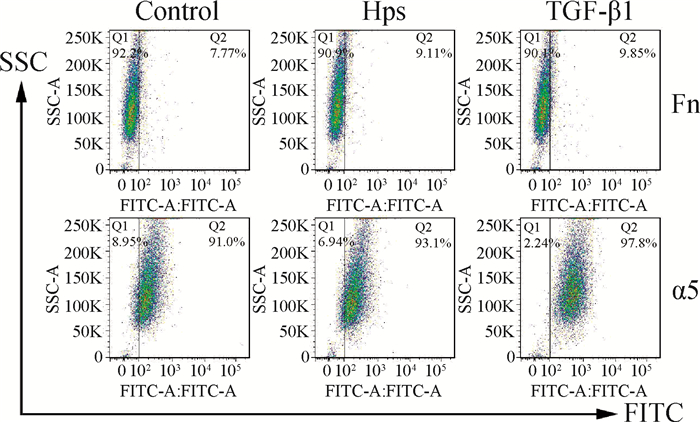
用副猪嗜血杆菌感染3D4/21细胞和用重组TGF-β1处理24 h后,用流式细胞仪分析Fn和α5整合素的表达。与对照组相比,TGF-β1处理增加了Fn(7.77%对9.85%)和α5整合素(91.0%对97.8%)的表达。重要的是,副猪嗜血杆菌感染也增加了Fn(7.77%对9.11%)和α5整合素(91.0%对93.1%)的表达(图 4)。
|
图 4 副猪嗜血杆菌感染和TGF-β1处理可增加3D4/21细胞Fn和α5整合素的表达 Figure 4 H. parasuis infection and TGF-β1 treatment increase expression of Fn and α5 integrin |
为了进一步分析Fn和α5整合素的作用,应用RNA干扰片段下调它们的表达水平。将siRNA干扰片段转染3D4/21细胞后,显著抑制Fn(7.66% vs 4.49%)和α5整合素(12.3% vs 5.48%)的表达(图 5)。
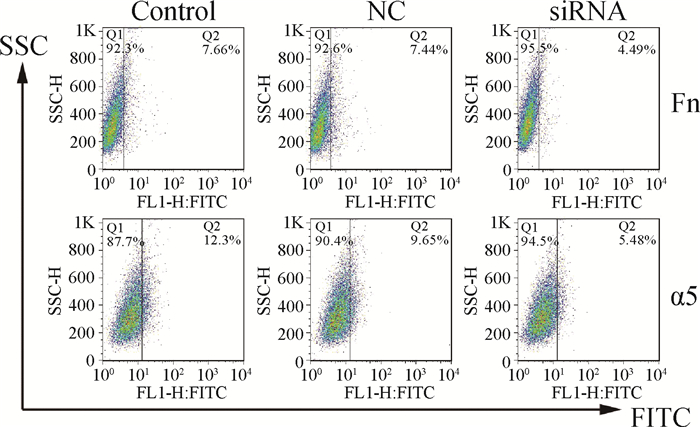
|
图 5 siRNA干扰Fn和α5整合素的表达水平 Figure 5 Expression of Fn and α5 integrin after RNA silencing |
当用靶向α5整合素的siRNA片段转染3D4/21细胞时,副猪嗜血杆菌的吸附和侵入分别下降了8.3%和37.4%。当用靶向Fn的siRNA转染细胞时,副猪嗜血杆菌的吸附没有降低,而侵入降低了15.9%(图 6)。
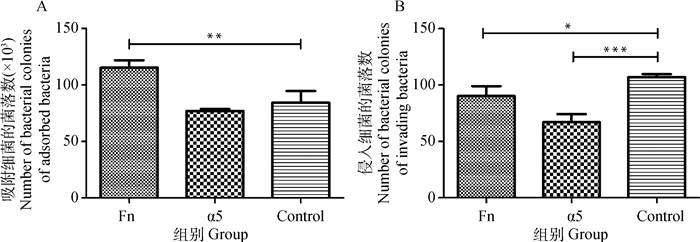
|
单因素方差分析,Dunnett多重比较检验, ***.P<0.001, **.P<0.01, *.P<0.05 One-way ANOVA, Dunnett's multiple comparison test, ***.P < 0.001, **.P < 0.01, *.P < 0.05 图 6 Fn和α5抑制副猪嗜血杆菌的侵入 Figure 6 Expression of α5 integrin and Fn inhibits invasion by H. parasuis |
副猪嗜血杆菌可与上皮细胞和内皮细胞相互作用[17-19]。虽然巨噬细胞是抵御侵入病原体的第一道重要防线,但它们在副猪嗜血杆菌感染中的作用尚不清楚[20]。细菌对宿主细胞的吸附是定植和侵入细胞的重要步骤[20],而且侵入与副猪嗜血杆菌的毒力有关[21]。我们的研究结果显示,副猪嗜血杆菌对3D4/21细胞的最佳吸附条件为400 MOI作用0.5 h,而最佳侵入条件为200 MOI作用2 h。这些结果表明猪传代肺泡巨噬细胞3D4/21细胞在体外能被副猪嗜血杆菌感染,而且初步证明3D4/21细胞在12 h可以完全将侵入其中的副猪嗜血杆菌清除(数据未提供),故3D4/21细胞可以用作研究H. parasuis侵入细胞的模型。
TGF-β1的表达与多种疾病和继发感染相关。在研究Group A Streptococcus(GAS)感染上皮细胞中发现GAS诱导TGF-β1的产生,而TGF-β1上调Fn/α5 整合素增强了GAS对上皮细胞的侵入[14]。TGF-β1的表达与IAV感染后引起细菌继发感染也相关[22]。在我们的研究中,副猪嗜血杆菌感染能显著提高TGF-β1的表达,并在36 h达到高峰,而用TGF-β1预处理3D4/21细胞显著增加副猪嗜血杆菌的侵入。流式细胞结果证实H. parasuis感染和TGF-β1处理可以上调Fn/α5整合素表达,由此我们推测H. parasuis感染3D4/21细胞诱导TGF-β1产生,且TGF-β1上调Fn/α5整合素表达会显著增强H. parasuis对3D4/21细胞的侵入。
为进一步验证Fn和α5整合素与H. parasuis侵入的相关性。应用针对α5和Fn的siRNA片段下调Fn和α5的表达,揭示Fn和α5整合素的表达水平与3D4/21细胞对副猪嗜血杆菌的侵入呈正相关,证实了TGF-β1表达可以调控副猪嗜血杆菌的侵入。然而,副猪嗜血杆菌对细胞的吸附与α5表达相关,但与Fn关联较小。我们推测副猪嗜血杆菌吸附可能与除Fn以外的细胞外基质相关,该推测需要进一步试验验证。
H. parasuis对3D4/21细胞的侵入水平可能会影响机体的抵抗力,细菌侵入细胞后细菌和细胞的相互作用仍需要进一步研究。H. parasuis感染后TGF-β1表达的增加提高了其对3D4/21细胞的侵入,有可能提高机体对细菌的清除水平,这可能是机体维持自身平衡的一个精巧调节机制。
4 结论TGF-β1和Fn/α5整合素的表达促进了副猪嗜血杆菌对3D4/21细胞的侵入,并在此过程中发挥重要作用。
| [1] | MØLLER K, ANDERSEN L V, CHRISTENSEN G, et al. Optimalization of the detection of NAD dependent Pasteurellaceae from the respiratory tract of slaughterhouse pigs[J]. Vet Microbiol, 1993, 36(3-4): 261–271. DOI: 10.1016/0378-1135(93)90093-M |
| [2] | KIELSTEIN P, RAPP-GABRIELSON V J. Designation of 15 serovars of Haemophilus parasuis on the basis of immunodiffusion using heat-stable antigen extracts[J]. J Clin Microbiol, 1992, 30(4): 862–865. |
| [3] | RÚBIES X, KIELSTEIN P, COSTA L, et al. Prevalence of Haemophilus parasuis serovars isolated in Spain from 1993 to 1997[J]. Vet Microbiol, 1999, 66(3): 245–248. DOI: 10.1016/S0378-1135(99)00007-3 |
| [4] | FRANDOLOSO R, PIVATO M, MARTÍNEZ-MARTÍNEZ S, et al. Differences in Haemophilus parasuis adherence to and invasion of AOC-45 porcine aorta endothelial cells[J]. BMC Vet Res, 2013, 9: 207. DOI: 10.1186/1746-6148-9-207 |
| [5] | WANG Y, LIU C, FANG Y, et al. Transcription analysis on response of porcine alveolar macrophages to Haemophilus parasuis[J]. BMC Genomics, 2012, 13: 68. DOI: 10.1186/1471-2164-13-68 |
| [6] | KING P T, SHARMA R. The lung immune response to Nontypeable Haemophilus influenzae (Lung Immunity to NTHi)[J]. J Immunol Res, 2015, 2015: 706376. |
| [7] | BELLO-ORTÍB, HOWELL K J, TUCKER A W, et al. Metatranscriptomics reveals metabolic adaptation and induction of virulence factors by Haemophilus parasuis during lung infection[J]. Vet Res, 2015, 46: 102. DOI: 10.1186/s13567-015-0225-9 |
| [8] | AMANO H, SHIBATA M, KAJIO N, et al. Pathologic observations of pigs intranasally inoculated with serovar 1, 4 and 5 of Haemophilus parasuis using immunoperoxidase method[J]. J Vet Med Sci, 1994, 56(4): 639–644. DOI: 10.1292/jvms.56.639 |
| [9] |
汪伟, 王小敏, 何孔旺, 等. 猪圆环病毒2型体外刺激3D4/21猪肺泡巨噬细胞的炎症相关细胞因子mRNA转录分析[J]. 西南农业学报, 2016, 29(5): 1225–1228.
WANG W, WANG X M, HE K W, et al. Inflammation-associated cytokines mRNA transcriptional profiles of porcine alveolar macrophages cell lines 3D4/21 stimulated by porcine circovirus type 2[J]. Southwest China Journal of Agricultural Sciences, 2016, 29(5): 1225–1228. (in Chinese) |
| [10] | AUNG H, SHERMAN J, TARY-LEHMAN M, et al. Analysis of transforming growth factor-beta 1(TGF-β1) expression in human monocytes infected with Mycobacterium avium at a single cell level by ELISPOT assay[J]. J Immunol Methods, 2002, 259(1-2): 25–32. DOI: 10.1016/S0022-1759(01)00485-9 |
| [11] | LI Y J, ZOU T, XUE L Y, et al. TGF-β1 enhances phagocytic removal of neuron debris and neuronal survival by olfactory ensheathing cells via integrin/MFG-E8 signaling pathway[J]. Mol Cell Neurosci, 2017, 85: 45–56. DOI: 10.1016/j.mcn.2017.08.006 |
| [12] | PATTI J M, ALLEN B L, MCGAVIN M J, et al. MSCRAMM-mediated adherence of microorganisms to host tissues[J]. Annu Rev Microbiol, 1994, 48: 585–617. DOI: 10.1146/annurev.mi.48.100194.003101 |
| [13] | BENITO-JARDÍN M, KLAPPROTH S, GIMENO-LLUCH I, et al. The fibronectin synergy site re-enforces cell adhesion and mediates a crosstalk between integrin classes[J]. eLife, 2017, 6: e22264. |
| [14] | WANG B N, LI S Y, SOUTHERN P J, et al. Streptococcal modulation of cellular invasion via TGF-β1 signaling[J]. Proc Natl Acad Sci U S A, 2006, 103(7): 2380–2385. DOI: 10.1073/pnas.0506668103 |
| [15] | ZHANG B, HE Y B, XU C G, et al. Cytolethal distending toxin (CDT) of the Haemophilus parasuis SC096 strain contributes to serum resistance and adherence to and invasion of PK-15 and PUVEC cells[J]. Vet Microbiol, 2012, 157(1-2): 237–242. DOI: 10.1016/j.vetmic.2011.12.002 |
| [16] | LI F Z, LI L B, ZHONG Y, et al. Relationship between LTR methylation and gag expression of HIV-1 in human spermatozoa and sperm-derived embryos[J]. PLoS One, 2013, 8(1): e54801. DOI: 10.1371/journal.pone.0054801 |
| [17] | LI Y F, ZHANG Y N, XIA Y T, et al. Haemophilus parasuis modulates cellular invasion via TGF-β1 signaling[J]. Vet Microbiol, 2016, 196: 18–22. DOI: 10.1016/j.vetmic.2016.10.012 |
| [18] | FRANDOLOSO R, PIVATO M, MARTÍNEZ-MARTÍNEZ S, et al. Differences in Haemophilus parasuis adherence to and invasion of AOC-45 porcine aorta endothelial cells[J]. BMC Vet Res, 2013, 9: 207. DOI: 10.1186/1746-6148-9-207 |
| [19] | ZHANG B, XU C G, ZHANG L Y, et al. Enhanced adherence to and invasion of PUVEC and PK-15 cells due to the overexpression of RfaD, ThyA and Mip in the △ompP2 mutant of Haemophilus parasuis SC096 strain[J]. Vet Microbiol, 2013, 162(2-4): 713–723. DOI: 10.1016/j.vetmic.2012.09.021 |
| [20] | KAVANOVÁ L, PRODLALOVÁ J, NEDBALCOVÁ K, et al. Immune response of porcine alveolar macrophages to a concurrent infection with porcine reproductive and respiratory syndrome virus and Haemophilus parasuis in vitro[J]. Vet Microbiol, 2015, 180(1-2): 28–35. DOI: 10.1016/j.vetmic.2015.08.026 |
| [21] | FRANDOLOSO R, MARTÍNEZ-MARTÍNEZ S, GUTIÉRREZ-MARTÍN C B, et al. Haemophilus parasuis serovar 5 Nagasaki strain adheres and invades PK-15 cells[J]. Vet Microbiol, 2012, 154(3-4): 347–352. DOI: 10.1016/j.vetmic.2011.07.022 |
| [22] | LI N, REN A H, WANG X S, et al. Influenza viral neuraminidase primes bacterial coinfection through TGF-β-mediated expression of host cell receptors[J]. Proc Natl Acad Sci U S A, 2015, 112(1): 238–243. DOI: 10.1073/pnas.1414422112 |



