2. 贵州大学明德学院, 贵阳 550025
2. College of Mingde, Guizhou University, Guiyang 550025, China
日本乙型脑炎(Japanese encephalitis, JE)是由黄病毒科(Flaviridae)黄病毒属(Flavivitus)日本乙型脑炎病毒(Japanese encephalitis virus, JEV)引起的一种危害严重的自然疫源性、虫媒性人兽共患病[1]。猪是JEV重要的储存宿主与扩增宿主,感染JEV的猪群,大多不会死亡,多表现为生殖障碍。病猪多出现高热,精神沉郁或有神经症状,食欲减退,有的出现后肢麻痹、视力减退、摆头、乱冲撞等[2]。猪JE是引起猪繁殖障碍的主要原因之一[3],该病虽对母猪的致死率不高,但可引起怀孕母猪突然发生流产、产死胎、弱胎或木乃伊胎,公猪感染后睾丸出现急性炎症反应,多为单侧性,初期肿胀,有热痛感,数日后炎症消退,睾丸萎缩变硬,性欲减退,精液带毒,失去配种能力[4-5],造成公猪不育,给养猪业造成严重的经济损害[6]。JE还严重威胁人类健康[7]。
JEV的基因组由10 976个核苷酸组成,长约10.9 kb的单股正链RNA,其基因结构为5′端有帽状结构,3′端无PolyA结构[8],5′端和3′端是病毒的非编码区,两个非编码区之间组成一个开放阅读框(ORF)为RNA编码区,编码一条由3 432个氨基酸组成的多蛋白前体,编码顺序为:5′-C-PrM-E-NS1-NS2a-NS2b-NS3-NS4a-NS4b-NS5-3′。该多蛋白前体经蛋白酶(NS3)切割加工成3个结构蛋白[核衣壳蛋白(C)、膜蛋白(PrM/M)、包膜糖蛋白(E)]和7个非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)[9]。NS1蛋白可能参与病毒复制的早期阶段以及病毒组装和释放,是主要的抗原成分之一,能刺激机体产生保护性体液免疫反应[9]。NS1蛋白的单克隆抗体可产生有效的保护性免疫,相关的动物试验表明,NS1蛋白能够在致死性JEV的攻击下保护动物,能够诱导机体产生较好的保护力[10],有报道称同时分别注射含NS1基因质粒和E基因质粒的免疫效果明显高于仅免疫E蛋白基因质粒[11],NS1基因和E基因联合表达质粒免疫效果明显优于仅免疫E蛋白基因质粒[9]。NS2A相对分子质量约为17 ku,是参与RNA复制的小分子疏水膜蛋白,它顺势切割NS1-NS2A连接处,并参与病毒复制复合物的形成,同时在病毒的组装和释放上也起到至关重要的作用,它能通过抑制IFN信号通路和抑制宿主PKR途径从而调节宿主的抗病毒反应[12]。
JEV不同毒株免疫原性有所不同[13],本研究通过JEV强、弱毒株接种BHK-21细胞分析其细胞病变效应(CPE)的差异,并构建真核表达质粒单独免疫健康小鼠,通过JEV抗体检测和小鼠外周血CD4+、CD8+T淋巴细胞含量检测,比较强、弱毒株非结构蛋白的免疫增强效果,分析强、弱毒株非结构蛋白NS1、NS2A和NS1-2A真核表达差异,寻找JEV的非结构蛋白与其致病机制的关系,以期为JE疫苗的研制奠定基础。
1 材料与方法 1.1 引物JEV贵州分离株(JEV Guizhou株,KC915016),由本实验室分离鉴定和保存;JEV疫苗(成都生物制品研究所生产,生产批号:201606A081-2),由贵州大学校医院赠送;BHK-21细胞,本实验室传代保存;Top10感受态细胞,由贵州大学动物科学学院生物技术试验中心保存;RNA抽提试剂盒、内切酶BamHⅠ、内切酶XhoⅠ及Pfu DNA聚合酶,均购自TaKaRa公司;胶回收试剂盒、质粒提取试剂盒,均购自OMEGA公司;X-gal、IPTG,购自Solarbio公司;猪日本乙型脑炎病毒抗体ELISA检测试剂盒,购自武汉科前生物工程有限公司;JEV多克隆抗体,为中国兽医药品监察所惠赠;其他试剂均为进口或国产分析纯。
1.2 引物的设计与合成根据GenBank上发表的JEV SA14株(登录号:U14163)、SA14-14-2(登录号:AF315119)和JEV GZ株(登录号:KC915016)的NS1、NS2A和NS1-2A基因序列,用Primer5.0软件设计6对特异性引物(表 1),并分别在引物的5′端设计BamHⅠ和XhoⅠ限制性内切酶位点,由上海英潍捷基贸易有限公司合成,PAGE级,OD值为2.0,预扩增片段长分别为1 245、492、1 737 bp。
|
|
表 1 JEV强弱毒株的NS1、NS2A和NS1-2A基因引物核苷酸序列 Table 1 The nucleotide sequences of NS1, NS2A和NS1-2A's primers |
待BHK-21细胞贴壁形成单层时,弃去细胞培养液,分别取0.5 mL处理好的本实验室保存的JEV GZ株的病毒上清和JEV疫苗悬液分别接种BHK-21细胞,置37 ℃、5%CO2培养箱中,每间隔20 min轻轻振摇1次,接毒1 h后轻轻吸去接种液体后,加入5 mL细胞维持液,待细胞出现75%细胞病变效应(CPE)时,收集病毒于-80 ℃反复冻融3次,按Invitrogen公司的TRIzol LS® Reagent试剂盒操作说明书提取总RNA。
1.4 目的基因的克隆及真核表达载体的构建和鉴定采用高保真酶(Pfu)以提取的RNA为模板进行RT-PCR扩增后,用1%的琼脂糖凝胶电泳检测,参照OMEGA公司胶回收试剂盒操作说明书进行目的基因的回收纯化后,再克隆入pMD19-T Simple载体,阳性重组质粒菌液送Invitrogen公司测序。将测序正确的pMD19-T Simple-NS1r、pMD19-T Simple-NS2Ar、pMD19-T Simple-NS1-2Ar和pMD19-T Simple-NS1q、pMD19-T Simple-NS2Aq、pMD19-T Simple-NS1-2Aq阳性重组质粒分别与pcDNA3.1(+)线性片段加入T4 DNA Ligase 16 ℃连接至少12 h,连接产物转化至Top10感受态细胞内,进行蓝白斑筛选,挑选出白色阳性菌落进行菌落PCR鉴定及双酶切鉴定,鉴定为阳性的重组质粒菌液送Invitrogen公司测序。
1.5 动物免疫试验 1.5.1 小鼠的分组及免疫程序选取90只4~5周龄BALB/c小鼠,随机分成9组,每组10只,按照指定的免疫方法和免疫程序进行免疫(质粒含量为1 μg·μL-1):第一组注射pcDNA3.1(+)-NS1r 100 μL·只-1,第二组注射pcDNA3.1(+)-NS2Ar 100 μL·只-1,第三组注射pcDNA3.1(+)-NS1-2Ar 100 μL·只-1,第四组注射pcDNA3.1(+)-NS1q 100 μL·只-1,第五组注射pcDNA3.1(+)-NS2Aq 100 μL·只-1,第六组注射pcDNA3.1(+)-NS1-2Aq 100 μL·只-1,第七组注射JEV减毒活疫苗100 μL·只-1,第八组注射pcDNA3.1(+)空载体100 μL·只-1,第九组注射生理盐水100 μL·只-1,每次免疫间隔两周,在一免前、二免前、三免前及三免后三周,分离血清,-20 ℃保存。
1.5.2 免疫小鼠血常规和T淋巴细胞亚群的检测小鼠末次免疫三周后,每组随机挑选5只小鼠采集抗凝血,送贵阳医学院附属医院测血常规,进行T淋巴细胞亚群检测。于5 mL流式管中,先加入10 μL Rat Anti-Mouse CD3-SPRD,10 μL Rat Anti-Mouse CD4/L3T4-FITC,10 μL Rat Anti-Mouse CD8a/Ly-2-PE,再取50 μL抗凝血,旋涡振荡混匀,室温避光15 min后加入1.0 mL红细胞溶解液,轻弹管壁并上下颠倒离心管3次后避光5 min,再加入1 mL PBS,1 000 r·min-1离心5 min,吸取PBS和红细胞的混合液至流式管划线处;旋涡振荡混匀后,用FACS检测10 000个细胞,根据血常规检测的结果计算出CD4+、CD8+细胞在每立方毫米血液中的相对数,所得数据用SPSS 10.0软件和Microsoft Excel 2000软件进行统计学分析。
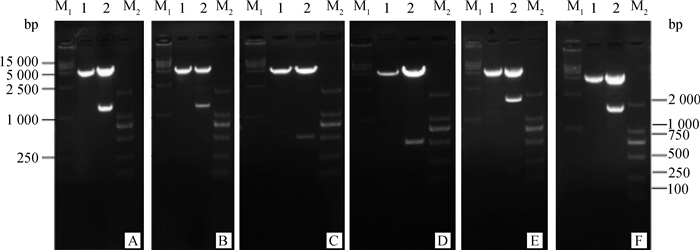
2 结果 2.1 重组质粒pcDNA3.1(+)酶切鉴定将构建的6种真核表达重组质粒用BamHⅠ、XhoⅠ进行双酶切鉴定,经1%琼脂糖凝胶中电泳检测,6种真核表达重组质粒pcDNA3.1(+)-NS1r、pcDNA3.1(+)-NS1q、pcDNA3.1(+)- NS2Ar、pcDNA3.1(+)-NS2Aq、pcDNA3.1(+)-NS1-2Ar、pcDNA3.1(+)-NS1-2Aq的双酶切鉴定结果与预期目的DNA片段的大小相符(图 1A~F)。
|
M1. DL15000相对分子质量标准;M2. DL2000相对分子质量标准;1.对照;2.质粒双酶切产物;A. pcDNA3.1(+)-NS1r;B. pcDNA3.1(+)-NS1q;C. pcDNA3.1(+)-NS2Ar;D. pcDNA3.1(+)-NS2Aq;E. pcDNA3.1(+)-NS1-2Ar;F. pcDNA3.1(+)-NS1-2Aq M1. DL15000 marker; M2. DL2000 marker; 1.Control; 2.The result of double digestion of plasmid; A. pcDNA3.1(+)-NS1r;B. pcDNA3.1(+)-NS1q;C. pcDNA3.1(+)-NS2Ar; D. pcDNA3.1(+)-NS2Aq; E. pcDNA3.1(+)-NS1-2Ar; F. pcDNA3.1(+)-NS1-2Aq 图 1 重组质粒的双酶切结果 Figure 1 The double digestion results of recombinant plasmids |
将双酶切鉴定符合预期结果的重组质粒送Invitrogen公司进行测序,测序结果序列与pMD19-T Simple载体的测序结果相同,表明乙型脑炎强、弱毒株非结构蛋白NS1、NS2A和NS1-2A真核表达质粒构建成功。
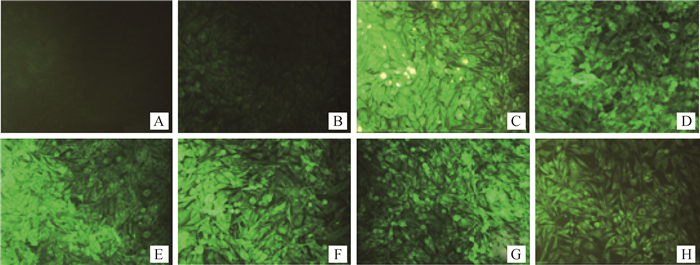
2.2 真核表达质粒在BHK-21细胞中的表达采用脂质体转染法分别将成功构建的6个真核表达质粒转染至BHK-21细胞,分别在转染后24、48和72 h用间接免疫荧光染色法检测真核表达质粒的表达情况,结果在24 h即可检测到特异荧光,可维持到72 h(图 2)。
|
A.阴性对照(24 h);B.pcDNA3.1(+)空质粒转染;C.pcDNA3.1(+)-NS1r转染(24 h);D.pcDNA3.1(+)-NS1q转染(24 h);E. pcDNA3.1(+)-NS2Ar转染(24 h);F. pcDNA3.1(+)-NS2Aq转染(24 h);G. pcDNA3.1(+)-NS1-2Ar转染(24 h);H. pcDNA3.1(+)-NS1-2Ar转染(24 h) A. Control group (24 h); B.pcDNA3.1 (+)-null plasmid transfection; C.pcDNA3.1 (+)-NS1r transfection (24 h); D.pcDNA3.1 (+)-NS1q transfection (24 h); E. pcDNA3.1 (+)-NS2Ar transfection (24 h); F. pcDNA3.1 (+)-NS2Aq transfection (24 h); G. pcDNA3.1 (+)-NS1-2Ar transfection (24 h); H. pcDNA3.1 (+)-NS1-2Ar transfection (24 h) 图 2 间接免疫荧光染色检测构建的6种真核表达质粒在BHK-21细胞中的表达情况 Figure 2 Expression of six constructed eukaryotic expression plasmids in BHK-21 cells by indirect immunofluorescence staining |
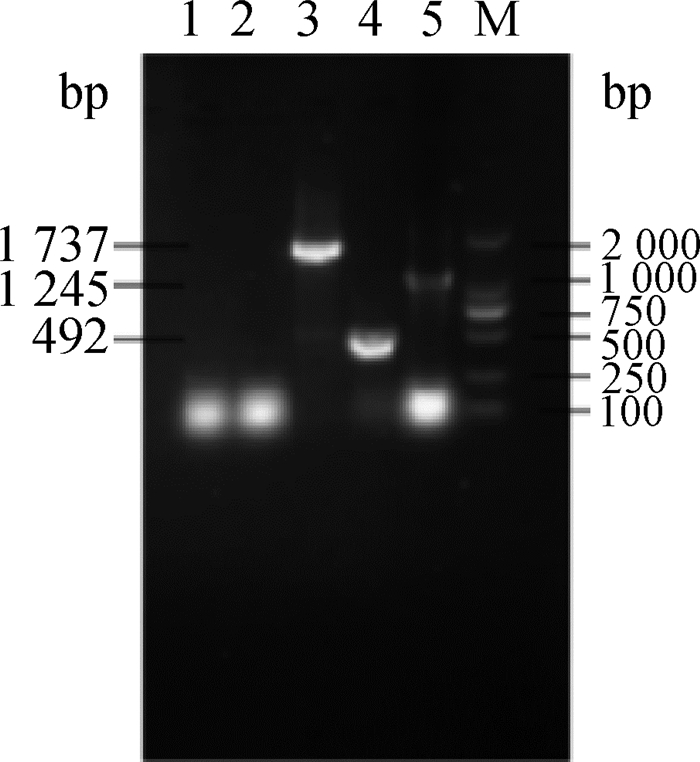
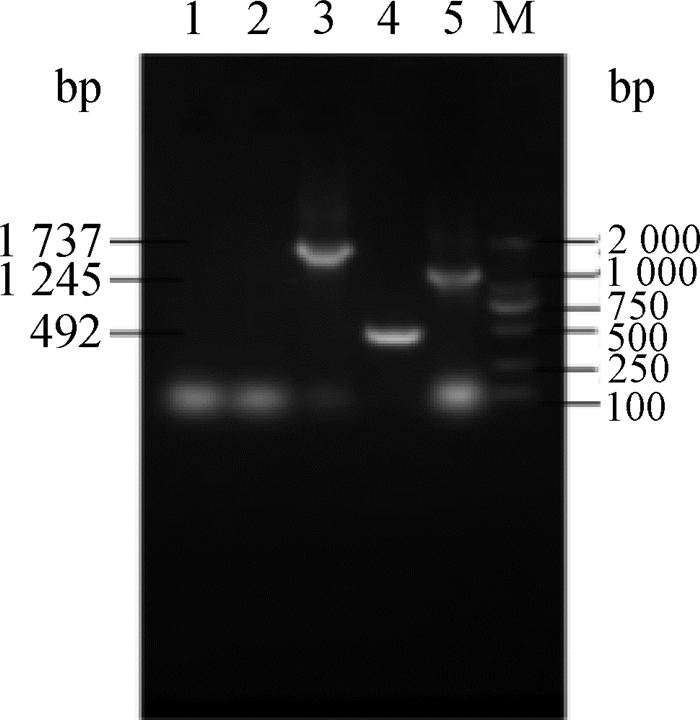
转染至BHK-21细胞后24 h,收集细胞抽提总RNA,进行RT-PCR,电泳检测RT-PCR产物,电泳结果(图 3、图 4)显示扩增出目的条带,且pcDNA3.1(+)转染细胞和对照细胞的RT-PCR结果均为阴性,证实了真核表达质粒在BHK-21细胞中得到表达。
|
1.阴性对照;2.pcDNA3.1(+)转染细胞;3.pcDNA3.1(+)-NS1-NS2Ar转染细胞RT-PCR扩增产物;4.pcDNA3.1(+)-NS2Ar转染细胞RT-PCR扩增产物;5. pcDNA3.1(+)-NS1r转染细胞RT-PCR扩增产物;M. DL2000相对分子质量标准 1.Control group; 2. pcDNA3.1(+)tranfected cells RT-PCR product; 3. pcDNA3.1(+)-NS1-NS2Ar tranfected cells RT-PCR product; 4. pcDNA3.1(+)-NS2Ar tranfected cells RT-PCR product; 5. pcDNA3.1(+)-NS1r tranfected cells RT-PCR product; M. DL2000 marker 图 3 弱毒株转染细胞RT-PCR扩增结果 Figure 3 SA14-14-2 strain RT-PCR results of tranfect cells |
|
1.阴性对照;2.pcDNA3.1(+)转染细胞;3.pcDNA3.1(+)-NS1-NS2Aq转染细胞RT-PCR扩增物;4.pcDNA3.1(+)-NS2Aq转染细胞RT-PCR扩增产物;5. pcDNA3.1(+)-NS1q转染细胞RT-PCR扩增产物;M. DL2000相对分子质量标准 1.Control group; 2. pcDNA3.1(+)tranfected cells RT-PCR product; 3. pcDNA3.1(+)-NS1-NS2Aq tranfected cells RT-PCR product; 4. pcDNA3.1(+)-NS2Aq tranfected cells RT-PCR product; ;5. pcDNA3.1(+)-NS1q tranfected cells RT-PCR product; M. DL2000 marker 图 4 强毒株转染细胞RT-PCR扩增结果 Figure 4 GZ strain RT-PCR results of tranfect cells |
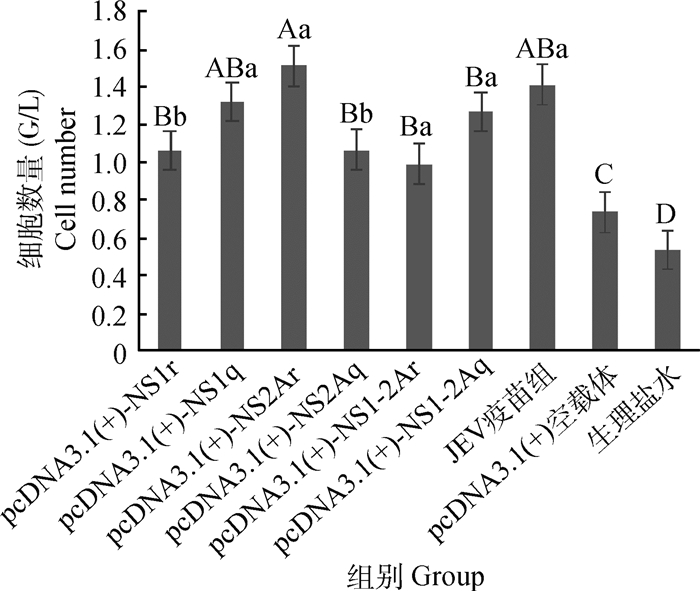
图 5的检测结果显示3个对照组与6个免疫组CD4+细胞的变化情况:与生理盐水组和空载体组相比较,6个免疫组均可以极显著(P<0.01)或显著(P<0.05)增加CD4+细胞的相对数量;与JEV疫苗组相比,6个免疫组除弱毒组NS2A蛋白增加CD4+细胞的数量略高于疫苗组外,其余各组均略低于疫苗组。强、弱毒株非结构蛋白重组真核质粒同组间比较对细胞免疫CD4+细胞的影响:强、弱毒株NS1免疫组和NS1-2A免疫组,均是强毒株非结构蛋白免疫组略高于弱毒株非结构蛋白免疫组,其中强、弱毒株NS1免疫组差异显著(P<0.05);强、弱毒株NS2A免疫组,弱毒株免疫组增加CD4+细胞的数量极显著(P<0.01)高于强毒株免疫组。
|
大写上标表示与相应组比较差异极显著(P<0.01);小写上标表示与相应组比较差异显著(P<0.05) Marked with capital letter superscript means P < 0.01;Marked with lowercase means P < 0.05 图 5 免疫BALB/c小鼠T淋巴细胞亚群CD3+CD4+的变化 Figure 5 The change of CD3+CD4+ cells in immunized BALB/c mice |
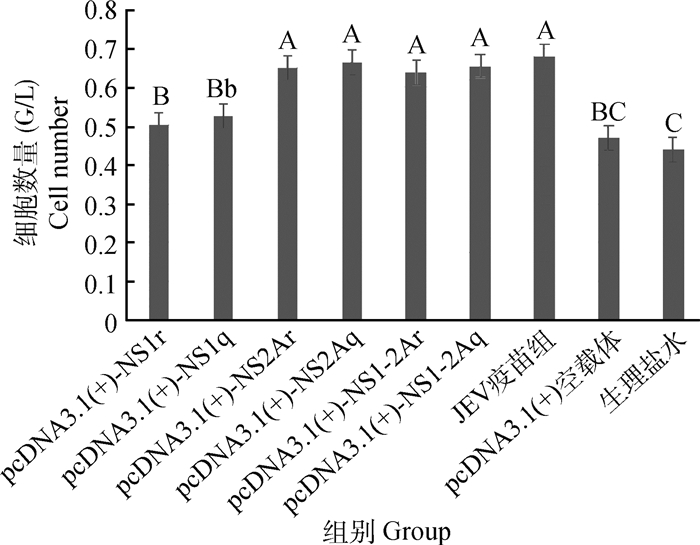
图 6的检测结果显示3个对照组与6个免疫组CD8+细胞的变化情况:与生理盐水组和空载体组相比,6个免疫组均可增加CD8+细胞的数量(显著性见图 6);与JEV疫苗组相比6个免疫组均略低于疫苗组增加CD8+细胞的数量(显著性见图 6)。强、弱毒株非结构蛋白重组真核质粒同组间比较对细胞免疫CD8+的影响:强、弱毒株NS1免疫组、NS2A免疫组和强、弱毒株NS1-2A免疫组,均是强毒株非结构蛋白免疫组略高于弱毒株非结构蛋白免疫组(P>0.05)。
|
大写上标表示与相应组比较差异极显著(P<0.01);小写上标表示与相应组比较差异显著(P<0.05) Marked with capital letter superscript means P < 0.01;Marked with lowercase means P < 0.05 图 6 免疫BALB/c小鼠T淋巴细胞亚群CD3+CD8+的变化 Figure 6 The change of CD3+CD8+ cells in immunized BALB/c mice |
为检测外源基因的表达情况,本试验分别采用脂质体转染法将构建的6种真核表达质粒转染于BHK-21细胞中,并分别提取转染细胞和对照细胞的总RNA,经RT-PCR检测结果显示在24 h分别检测到NS1、NS2A和NS1-2A的特征条带,表明重组质粒已成功转染至BHK-21细胞,通过间接免疫荧光技术检测真核表达质粒表达情况,在转染后36 h构建的6种乙型脑炎病毒强、弱毒株非结构蛋白真核表达质粒呈现出特异荧光,pcDNA3.1(+)空载体组合对照组没有检测到特异性荧光,证明了pcDNA3.1(+)-NS1r、pcDNA3.1(+)-NS2Ar、pcDNA3.1(+)-NS1-2Ar、pcDNA3.1(+)-NS1q、pcDNA3.1(+)-NS2Aq和pcDNA3.1(+)-NS1-2Aq基因在BHK-21细胞中能够表达。
本试验采用间接ELISA方法检测体液免疫水平,结果构建的重组真核表达质粒免疫小鼠后未能诱导机体产生较高水平的体液免疫。据相关文献报道,重组病毒中NS1蛋白的有效表达、外泌及其诱生的保护性免疫,依赖于NS1上有疏水信号序列及下游至少70%NS2A蛋白的协同[14],在没有NS2A蛋白的存在下,NS1蛋白可能不能诱生其保护性免疫机制;NS2A蛋白参与病毒复制复合物的形成,同时在病毒的组装和释放上也起到至关重要的作用[12],国内外尚无报道证明其可以单独诱生机体产生保护性免疫;在无NS2A蛋白存在的情况下,NS1-NS2A连接处无法被切割,则在NS2A蛋白协同下使NS1蛋白诱导机体产生保护性免疫的机制可能无法激活,故联合蛋白无法诱导机体产生较高水平的体液免疫。构建的重组真核表达质粒免疫小鼠后未能诱导机体产生较高水平的体液免疫,其原因可能是表达的蛋白不能够诱导产生抗体,或者是蛋白表达量过低而与抗原结合量不足,导致间接ELISA无法检测出,具体原因还需进一步研究。
T淋巴细胞亚群数量和比例的动态平衡是一个复杂的过程,其调节机制并不十分清楚,而CD4+T和CD8+T淋巴细胞的失调是许多疾病的主要表现特征。CD4+是辅助性T细胞表面的标志分子,一般认为CD4+Th细胞可以分泌IL-2、IL-4、IL-5、IL-10、IFN-γ等细胞因子,可诱导和增强细胞和体液免疫应答;CD8+T细胞是杀伤性T细胞表面的标志分子,包括抑制性T淋巴细胞和杀伤性T淋巴细胞,可以分泌抑制因子,抑制CTL细胞和B淋巴细胞起到负调节作用。两种作用迥异的T淋巴细胞借其相互拮抗作用调节免疫应答过程,以保持免疫功能的平衡。CD3分子能表达于全部T细胞上,是T细胞共同的表面标志。根据CD4和CD8可将T细胞分成两个重要亚群。CD4存在于辅助性T细胞(TH)表面,而CD8主要存在于细胞毒性T细胞(CTL)表面。CD4+/CD8+比例高则机体自身免疫功能相对强,低则相反。本试验结果表明:pcDNA3.1(+)-NS1r、pcDNA3.1(+)-NS2Ar、pcDNA3.1(+)-NS1-2Ar和pcDNA3.1(+)-NS1q、pcDNA3.1(+)-NS2Aq、pcDNA3.1(+)-NS1-2Aq免疫小鼠可以极显著或显著增加CD4+细胞的相对数量;同时CD8+细胞相对数量也有所增加,说明构建的真核表达质粒诱发了机体的细胞免疫。用pcDNA3.1(+)免疫小鼠对其CD4+、CD8+细胞的数量(与空白对照组相比较)有增强作用,这可能是因为pcDNA3.1(+)含有以非甲基化的CpG为核心的免疫刺激序列可以诱导细胞免疫。强、弱毒株非结构蛋白重组真核质粒同组间比较对细胞免疫CD4+的影响为:NS1免疫组和NS1-2A免疫组均是强毒株非结构蛋白免疫组略高于弱毒株非结构蛋白免疫组,其中强、弱毒株NS1免疫组差异显著(P<0.05)。NS2A免疫组弱毒株免疫组增加CD4+细胞的数量略高于强毒株免疫组。强、弱毒株非结构蛋白重组真核质粒同组间比较对细胞免疫CD8+的影响为:NS1免疫组、NS2A免疫组和强、弱毒株NS1-2A免疫组,均是强毒株非结构蛋白免疫组略高于弱毒株非结构蛋白免疫组。关于JEV的结构蛋白原核表达和真核表达的相关研究较多,非结构蛋白中NS1基因的研究已有很多的成果,但除NS1非结构蛋白基因外,其他的非结构蛋白基因研究较少[7, 15-21],这些非结构蛋白的功能对机体的作用有许多机制不清楚,深入了解乙脑病毒非结构蛋白的作用对于乙脑疫苗的研制和乙脑的治疗有重要意义。
4 结论综合分析数据显示,JEV强毒株非结构蛋白所产生的细胞免疫略优于弱毒株非结构蛋白产生的细胞免疫,但差异不明显。
| [1] |
方美玉, 林立辉, 刘建伟.
虫媒传染病[M]. 北京: 军事医学科学出版社, 2005.
FANG M Y, LIN L H, LIU J W. Insect-borne infectious diseases[M]. Beijing: Military Medical Science Press, 2005. (in Chinese) |
| [2] |
黄庆生, 马文煜, 姜绍谆, 等. 乙脑病毒全长cDNA的扩增克隆及体外转录制备感染性RNA的研究[J]. 中国病毒学, 2000, 15(4): 330–335.
HUANG Q S, MA W Y, JIANG S C, et al. Amplification and cloning of full-length JEV cDNA and preparation of infectious RNA by in vitro transcription[J]. Virologica Sinica, 2000, 15(4): 330–335. (in Chinese) |
| [3] |
徐健, 汤德元, 黄涛, 等. 日本乙型脑炎病毒的分离与鉴定[J]. 畜牧与兽医, 2009, 41(12): 10–12.
XU J, TANG D Y, HUANG T, et al. Isolation and identification of Japanese encephalitis virus[J]. Animal Husbandry & Veterinary Medicine, 2009, 41(12): 10–12. (in Chinese) |
| [4] |
徐高原, 王祥, 陈焕春, 等. 乙型脑炎病毒NS1基因重组伪狂犬病毒的构建[J]. 畜牧兽医学报, 2004, 35(2): 192–197.
XU G Y, WANG X, CHEN H C, et al. Construction of recombinant virus strain TK-/gG-/NS1+ recombinized by pseudorabies virus Ea Mutant strain TK-/gG-/LacZ+ and NS1 gene of Japanese encephalitis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2004, 35(2): 192–197. (in Chinese) |
| [5] |
徐健. 乙脑病毒分离株PrM/E和E基因表达载体构建及E基因表达的研究[D]. 贵阳: 贵州大学, 2010.
XU J. Construction of expression vector of PrM/E and E genes and expression of E gene in Japanese encephalitis virus isolate[D]. Guiyang: Guizhou University, 2010. (in Chinese) http://d.wanfangdata.com.cn/Thesis/D215730 |
| [6] |
汤德元, 王凤, 马萍, 等. 乙型脑炎病毒贵州分离株E基因原核表达及其免疫原性的研究[J]. 畜牧兽医学报, 2012, 43(8): 1330–1336.
TANG D Y, WANG F, MA P, et al. The study of prokaryotic expression and immunogenicity of E gene of Japanese encephalitis virus Guizhou isolation strain[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(8): 1330–1336. (in Chinese) |
| [7] |
张亮, 田耕, 石双艳, 等. RT-RCR-RFLP方法鉴别基因Ⅰ型和基因Ⅲ型日本脑炎病毒[J]. 畜牧兽医学报, 2014, 45(9): 1555–1560.
ZHANG L, TIAN G, SHI S Y, et al. Development of a RT-PCR-RFLP assay for differentiation of Japanese encephalitis viras genotype Ⅰ and genotype Ⅲ[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(9): 1555–1560. (in Chinese) |
| [8] | QI W B, HUA R H, YAN L P, et al. Effective inhibition of Japanese encephalitis virus replication by small interfering RNAs targeting the NS5 gene[J]. Virus Res, 2008, 132(1-2): 145–151. DOI: 10.1016/j.virusres.2007.11.014 |
| [9] | LIN Y L, CHEN L K, LIAO C L, et al. DNA immunization with Japanese encephalitis virus nonstructural protein NS1 elicits protective immunity in mice[J]. J Virol, 1998, 72(1): 191–200. |
| [10] | LEE J M, CROOKS A J, STEPHENSON J R. The synthesis and maturation of a non-structural extracellular antigen from tick-borne encephalitis virus and its relationship to the intracellular NS1 protein[J]. J Gen Virol, 1989, 70(Pt 2): 335–343. |
| [11] | MASON P W. Maturation of Japanese encephalitis virus glycoproteins produced by infected mammalian and mosquito cells[J]. Virology, 1989, 169(2): 354–364. DOI: 10.1016/0042-6822(89)90161-X |
| [12] | LINDENBACH B D, RICE C M. Trans-complementation of yellow fever virus NS1 reveals a role in early RNA replication[J]. J Virol, 1997, 71(12): 9608–9617. |
| [13] |
冯瑶, 岳辉喜, 刘洪明, 等. 基因Ⅰ型猪乙型脑炎灭活疫苗免疫原性评价[J]. 畜牧兽医学报, 2017, 48(5): 889–895.
FENG Y, YUE H X, LIU H M, et al. The immunogenicity evaluation of inactivated vaccines of swine Japanese encephalitis virus genetypeⅠ[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5): 889–895. (in Chinese) |
| [14] | FALGOUT B, CHANOCK R, LAI C J. Proper processing of dengue virus nonstructural glycoprotein NS1 requires the N-terminal hydrophobic signal sequence and the downstream nonstructural protein NS2a[J]. J Virol, 1989, 63(5): 1852–1860. |
| [15] |
李自力, 陈焕春, 徐高原, 等. 表达乙脑病毒PrM基因重组伪狂犬病病毒的构建[J]. 畜牧兽医学报, 2007, 38(1): 53–58.
LI Z L, CHEN H C, XU G Y, et al. Construction of recombinant virus strain TK-/gG-/PrM+ recombinized by pseudorabies virus Ea mutant strain TK-/gG-/LacZ+ and PrM gene of Japanese encephalitis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(1): 53–58. (in Chinese) |
| [16] | ENDY T P, NISALAK A. Japanese encephalitis virus:Ecology and epidemiology[J]. Curr Top Microbiol Immunol, 2002, 267: 11–48. |
| [17] |
王晓杜, 赵凡凡, 代兵, 等. 猪日本乙型脑炎病毒DNA复制子载体的构建及外源基因表达分析[J]. 畜牧兽医学报, 2015, 46(1): 111–118.
WANG X D, ZHAO F F, DAI B, et al. Construction of DNA replicon vector of swine Japanese encephalitis virus and application of exogenous gene expression analysis[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(1): 111–118. (in Chinese) |
| [18] | LIU H, CHIOU S S, CHEN W J. Differential binding efficiency between the envelope protein of Japanese encephalitis virus variants and heparan sulfate on the cell surface[J]. J Med Virol, 2004, 72(4): 618–624. DOI: 10.1002/(ISSN)1096-9071 |
| [19] | MIBAYASHI M, MARTÍNEZ-SOBRIDO L, LOO Y M, et al. Inhibition of retinoic acid-inducible gene imediated induction of beta interferon by the NS1 protein of influenza A virus[J]. J Virol, 2007, 81(2): 514–524. DOI: 10.1128/JVI.01265-06 |
| [20] | PARK G S, MORRIS K L, HALLETT R G, et al. Identification of residues critical for the interferon antagonist function of Langat virus NS5 reveals a role for the RNA-dependent RNA polymerase domain[J]. J Virol, 2007, 81(13): 6936–6946. DOI: 10.1128/JVI.02830-06 |
| [21] | CHEN S O, TSAI T H, CHANG T J, et al. Expression of recombinant envelope protein of Japanese encephalitis virus YL strain in Escherichia coli possesses Hemagglutination activity[J]. Virus Genes, 2004, 28(2): 215–221. DOI: 10.1023/B:VIRU.0000016861.78378.9b |



