2. 四川农业大学动物疫病与人类健康四川省重点实验室, 成都 611130;
3. 四川百诺吉科技有限公司, 绵阳 621000
2. Key Laboratory of Animal Diseases and Human Health of Sichuan Province, Sichuan Agricultural University, Chengdu 611130, China;
3. Sichuan Bainuoji Technology Co., Ltd, Mianyang 621000, China
1963年,自噬研究者Christian de Duve首次公开提出“自噬”这一概念,而后自噬这一名词逐渐开始出现在人们的视线中。自噬(autophagy)是细胞普遍的代谢途径之一,也是细胞自我保护机制之一,发生自噬的细胞通过溶酶体降解机制对自身细胞器和外源异物进行包裹、吞噬、降解,将细胞器、蛋白质、病原微生物等大分子物质转化为氨基酸等小分子物质,以实现物质的循环利用和抵抗异物入侵[1]。依据被降解物运送至溶酶体方式的不同,自噬通常分为三种类型:分子伴侣自噬、微自噬、巨自噬[2]。巨自噬发生时可通过透射电镜在细胞内发现双层膜包裹的非细胞器结构,其中常包裹衰老变形的细胞器、蛋白质、外来异物及入侵的病原微生物等,这种双层膜结构被称作“自噬泡”,自噬泡是目前较为认可的自噬发生的金标准[3]。自噬相关基因统称为ATG,以酵母自噬基因的研究为例,目前已有30个左右的酵母基因被证实参与自噬过程。不同的ATG在自噬发生时担负不同的功能,如ATG6主要在自噬泡形成的早期发挥作用[4],ATG1主要是对自噬的发生起激活作用[5],ATG5与ATG12相互结合,形成聚合体[6],促进LC3蛋白脂质化,进而促进自噬。小分子GTP酶家族成员Rab11a被证明在自噬体成熟中具有重要作用,且Rab11a被沉默后将导致胞内PRRSV NSP2和ORF7的表达受到损害[7]。已有研究表明PRRSV能激活细胞自噬,自噬被激活后PRRSV继续阻止自噬体和溶酶体融合以维持自噬发生,并通过该方式利用自噬来增强自身复制[8-9]。就自噬基因而言,Beclin1作为比较重要的自噬基因,其在自噬发生中具有启动意义[10],同时也与病毒增殖关系密切[11]。自噬标记蛋白LC3Ⅱ也是自噬监测的重要指标,LC3Ⅱ蛋白水平的高低与自噬相关基因Beclin1的表达量密切相关。LC3蛋白能裂解成为LC3Ⅱ和LC3Ⅰ,这两者均能在一定程度上反映细胞的自噬水平,但通常认为LC3Ⅱ/内参蛋白更能真实反映自噬情况[12-13]。
近年来,越来越多的研究证明细胞自噬与多种疾病的发生关系密切[14],与病毒复制也有一定关系[15],自噬也越来越受到研究者的重视。值得一提的是,在细胞自噬的研究上,相关蛋白的研究比较多,但对自噬相关基因的研究却较少。Beclin1作为近年自噬研究中的明星分子,其mRNA的转录变化具有重要研究意义。ATG5与ATG12在自噬过程中形成复合物,对细胞自噬过程起正向调控作用,探究ATG5与ATG12基因mRNA的转录规律对了解自噬过程有积极意义。本研究对感染PRRSV SC株前后Marc145细胞Beclin1、ATG5和ATG12的mRNA基因的转录进行测定,探究PRRSV SC株对Marc145细胞自噬相关基因转录的影响及规律、为细胞自噬与病毒增殖相关研究提供参考。
1 材料与方法 1.1 细胞系与病毒Marc145细胞系、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)SC株均由四川农业大学动物疫病与人类健康四川省重点实验室保存。
1.2 试剂及仪器pMD19-T Simple Vector、RNA抽提试剂盒、DNA凝胶回收试剂盒、质粒抽提试剂盒等均购自宝生物工程(大连)有限公司,SYBR Green Premix Ex TaqⅡ、DL2000 DNA Marker等均为天根生化科技(北京)有限公司产品。大肠杆菌DH5α感受态细胞由本实验室自行制备。实时荧光定量仪器CFX-96 touch购自BIO-RAD公司。
1.3 引物设计与合成根据GenBank中登录的Beclin1、ATG5和ATG12基因序列(登录号NC_027908.1等)利用DNAStar软件分析比较,选择保守区域序列,利用引物设计软件Primer Primer5分别设计一对特异性引物,引物序列及预期目的片段长度如表 1。
|
|
表 1 实时荧光定量PCR的引物 Table 1 Primer for real-time PCR |
反应体系采用25 μL,分别对引物、标准质粒、TM值和反应程序进行优化,以荧光值、Ct值、熔解曲线为判定依据,同时设立空白对照,选择最优的反应条件。
1.4.2 标准曲线的绘制以梯度稀释的标准质粒为模板,参照优化后的反应条件进行实时荧光定量PCR,以拷贝数对数为横坐标,Ct值为纵坐标绘制标准曲线。
1.4.3 重复性、稳定性及敏感性试验于不同时间对梯度稀释的标准质粒进行独立的重复试验,共计5次,观察所呈现曲线的组间稳定性和重复性。抽选同一稀释梯度下的标准质粒,设立3个重复,观察所呈现曲线的组内稳定性和重复性。将标准质粒做10倍连续稀释后作为模板,进行常规PCR和实时荧光定量PCR,通过荧光信号和电泳条带判断其敏感性。
1.5 样品准备及荧光图片的采集 1.5.1 孔板的制备5%二氧化碳浓度及37 ℃细胞培养箱中培养Marc145细胞,使用含10%血清浓度的DMEM培养基,吸取细胞悬液于6孔板中,每孔2.5 mL。按相同方法共铺6个6孔板,3个用于试验组等待接毒,3个用作对照(为Marc145细胞)。试验组按0.5 MOI接毒,接毒1 h后弃去孔内液体,每孔加入2.5 mL维持液。重复两次,共计三次重复。
1.5.2 样品的收集Marc145细胞的收集:于传代后的12 h第一次收集细胞,而后每隔12 h收集一次,最后一次收集为传代后的72 h,将所收细胞冻存于超低温冰箱备用。病毒液的收集:于接毒后的12 h第一次收集病毒液,而后每隔12 h收集一次,最后一次收集为接毒后的72 h,将所收病毒液冻存于超低温冰箱备用。
1.5.3 核酸的准备RNA抽提试剂盒抽提试验组和对照组总RNA,经核酸蛋白仪测定浓度,0.1%DEPC水调定RNA浓度一定后反转录为cDNA,冻存于超低温冰箱备用。
1.5.4 自噬相关基因mRNA转录的测定利用本文建立的Beclin1、ATG5及ATG12实时荧光定量检测方法分别对“1.5.3”中试验组和对照组cDNA进行荧光定量检测。
2 结果 2.1 实时荧光定量方法的建立 2.1.1 反应条件的优化优化后的反应条件:反应体系25 μL,其中上、下游引物各1 μL, 质粒标准品2 μL,SYBR Green Premix Ex TaqⅡ12.5 μL,ddH2O补足到25 μL;退火温度均为56 ℃;反应采用的三步法:95 ℃ 30 s,95 ℃ 5 s,56 ℃ 30 s,72 ℃ 30 s,39个循环。
2.1.2 自噬相关基因标准曲线的绘制如图 1显示,标准品与其对应的Ct值线性关系良好,Beclin1、ATG5及ATG12相关系数R2分为0.998、0.998、0.999,斜率Slope分别为-3.485、-3.347、-3.571,y轴截距分别为34.614、33.778、34.357,所建立的标准曲线分别为y=-3.485x+34.614,y=-3.347x+ 33.778,y=-3.571x+34.357。

|
A.Beclin1;B.ATG5;C.ATG12 图 1 自噬相关基因实时荧光定量PCR的标准曲线 Figure 1 The standard curves of the real-time PCR of autophagy-related genes |
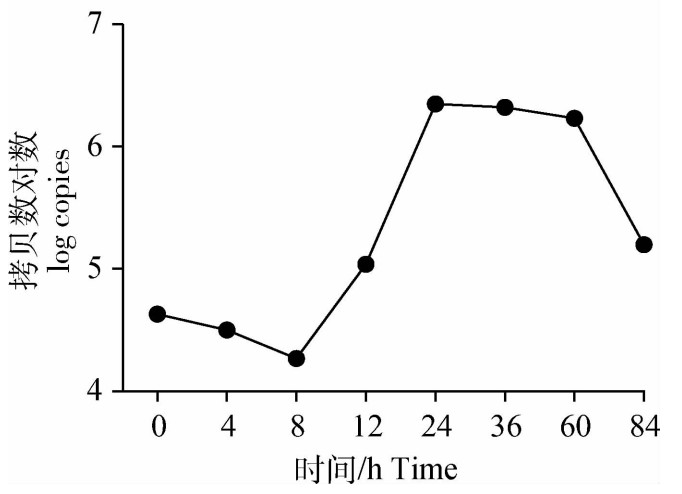
PRRSV SC株荧光定量检测方法由本实验室自行建立[16]。利用所建方法分别对0、4、8、12、24、36、60、84 h的病毒含量进行测定,绘制PRRSV SC株一步生长曲线(图 2):8 h前PRRSV增殖缓慢,8~24 h病毒进入对数增殖期,在24~60 h达到平稳期,60~84 h病毒增殖快速下降。PRRSV感染Marc145细胞后,由于细胞量相对充足,病毒在8~24 h快速增殖,60 h后由于细胞大量病变、营养物质缺乏,病毒增殖速度明显降低。
|
图 2 PRRSV SC株在Marc145细胞中的一步生长曲线 Figure 2 The one-step growth curve of PRRSV SC strain in Marc145 cell |
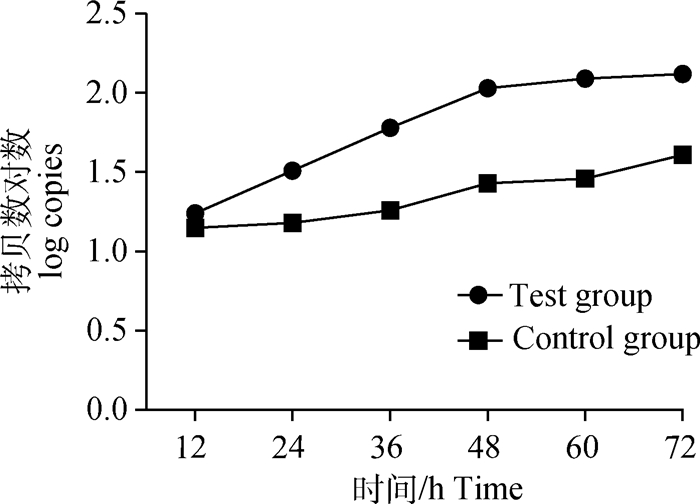
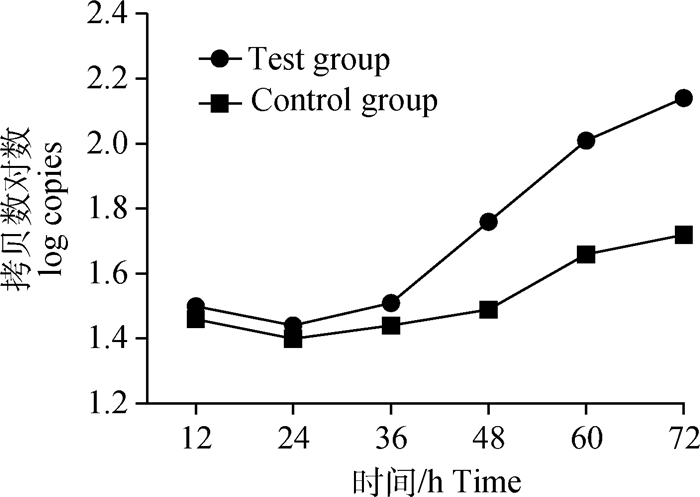
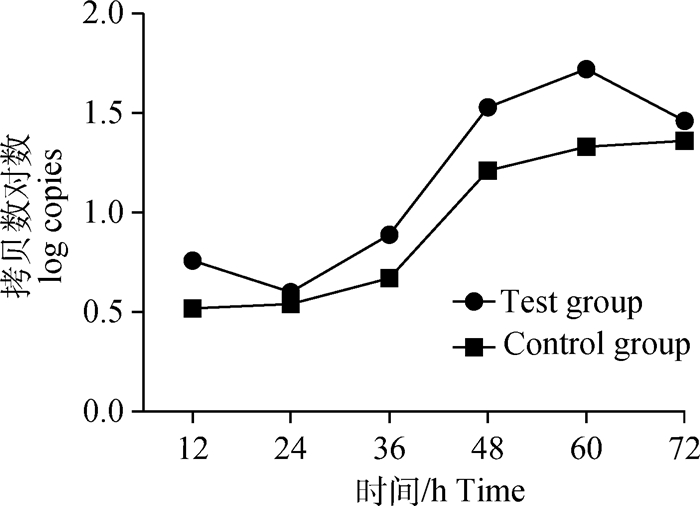
将对照组和试验组各时间点Ct值记录整理,利用所建立方法的标准曲线将Ct值换算为拷贝数,以时间为横坐标,拷贝数对数为纵坐标,作拷贝数对数-时间的线性曲线图,其中拷贝数对应的绝对值为细胞数量。如图 3所示,具有自噬启动作用的Beclin1 mRNA在感染PRRSV SC株前后转录量存在明显差异,感染后PRRSV使Beclin1 mRNA转录量增加,且在12 h时其转录量已明显高于对照组。感染后12~48 h期间Beclin1 mRNA转录量呈直线增加,48 h后其转录量增加缓慢,但仍高于对照组。如图 4所示,试验组和对照组的ATG5 mRNA在36 h前转录差异不大,48 h时试验组转录增多,并在72 h前保持持续增加,对照组从48 h时转录量虽有增加,但增加量较试验组低。图 5显示,试验组与对照组ATG12 mRNA增长趋势差异不大,试验组转录量在60 h时达到峰值,而后开始下降;对照组转录量则从24 h时开始增加,持续增加至72 h。对试验组与对照组的基因转录量进行组间方差分析,结果显示,Beclin1(P=0.005<0.01)差异极显著,ATG5(0.01<P=0.005<0.05)差异显著,ATG12(0.01<P=0.002<0.05)差异显著。
|
图 3 Beclin1 mRNA转录量拷贝数线性曲线图 Figure 3 Linear curve of copy number of Beclin1 mRNA expression |
|
图 4 ATG5 mRNA转录量拷贝数线性曲线图 Figure 4 Linear curve of copy number of ATG5 mRNA expression |
|
图 5 ATG12 mRNA转录量拷贝数线性曲线图 Figure 5 Linear curve of copy number of ATG12 mRNA expression |
自噬相关基因对于自噬的发生及调控至关重要,了解相关基因在通路中的功能作用,对于自噬研究十分必要。Beclin1基因作为细胞自噬的启动基因和调控基因,其在乳腺癌[17-18]等疾病的发生中,常表现为下调,而在胃癌、肝癌疾病过程中,却表现为明显上调。在多种神经系统疾病中,研究人员对Beclin1的检测结果显示其转录量降低[19-20]。Beclin1参与许多疾病过程,也与病毒感染关系密切。已有研究表明PRRSV感染细胞后,Beclin1能通过调节其他ATG蛋白的定位对自噬活性进行调节[21]。但Beclin1在细胞内如何被因子调控,PRRSV的变异对其表达有怎样的影响等此类问题目前并不清楚。ATG5与ATG12在自噬发生过程中常形成复合物,能通过促进LC3蛋白脂质化从而促进细胞自噬,并对细胞抗病毒天然免疫也有积极作用[22]。细胞自噬在一定程度上能增强抵御病毒感染的能力,研究ATG5与ATG12对揭示细胞天然免疫,增强细胞抗病毒能力具有重要意义。
本研究对对照组和试验组的自噬相关基因mRNA进行测定,发现PRRSV感染Marc145细胞后使Beclin1、ATG5、ATG12 mRNA的转录量增加,且三个基因mRNA转录量在较长时间内一直持续在较高水平,与自噬相关蛋白LC3Ⅱ表达量符合[23]。PRRSV在60 h左右达到增殖峰值,而此时刻相关基因的mRNA也处于持续较高转录量的状态,这与陈全刚[24]得出的PRRSV能利用细胞自噬促进自身增殖相符合,也与Rab11a以自噬方式帮助PRRSV结果相一致。对照组细胞在维持36 h左右后相关基因mRNA转录量开始升高,但与试验组相比仍相对较低,推测在维持状态的Marc145细胞在36 h左右已开始发生自噬,在48~72 h时相关基因mRNA转录量稳定在稍高水平,且仍有随时间推移继续升高的趋势,可能是发生自噬后细胞虽能利用自噬物质暂时维持自身代谢活动,但由于环境中营养物质的消耗殆尽发生了广泛的自噬,后期自噬增强逐渐发展为凋亡。PRRSV在24 h时快速增殖,病毒量在24~60 h均处于较高状态,结合自噬基因转录水平可以基本说明PRRSV增殖与细胞自噬在一定程度范围内呈正向作用,即PRRSV能诱导细胞自噬并利用自噬产物帮助自身增殖。
本研究虽发现了Beclin1、ATG5与ATG12 mRNA的转录规律、PRRSV增殖与细胞自噬的相关联系,但病毒增殖与细胞自噬怎样相互作用,病毒的变异对细胞自噬有怎样的影响等问题仍有待研究。
4 结论PRRSV感染Marc145细胞,实时荧光定量方法测得Beclin1、ATG5和ATG12 mRNA在感染后转录量增加;其转录规律与细胞病变、PRRSV增殖规律呈正相关。
| [1] | LEVINE B, YUAN J Y. Autophagy in cell death:An innocent convict?[J]. J Clin Invest, 2005, 115(10): 2679–2788. DOI: 10.1172/JCI26390 |
| [2] | CROTZER V L, BLUM J S. Autophagy and intracellular surveillance:Modulating MHC class Ⅱ antigen presentation with stress[J]. Proc Natl Acad Sci U S A, 2005, 102(22): 7779–7780. DOI: 10.1073/pnas.0503088102 |
| [3] | SWANLUND J M, KREGEL K C, OBERLEY T D. Investigating autophagy:Quantitative morphometric analysis using electron microscopy[J]. Autophagy, 2010, 6(2): 270–277. DOI: 10.4161/auto.6.2.10439 |
| [4] | KLIONSKY D J, CREGG J M, DUNN W A Jr, et al. A unified nomenclature for yeast autophagy-related genes[J]. Dev Cell, 2003, 5(4): 539–545. DOI: 10.1016/S1534-5807(03)00296-X |
| [5] | KAMADA Y, FUNAKOSHI T, SHINTANI T, et al. Tor-mediated induction of autophagy via an Apg1 protein kinase complex[J]. J Cell Biol, 2000, 150(6): 1507–1513. DOI: 10.1083/jcb.150.6.1507 |
| [6] | OHSUMI Y. Molecular dissection of autophagy:Two ubiquitin-like systems[J]. Nat Rev Mol Cell Biol, 2001, 2(3): 211–216. DOI: 10.1038/35056522 |
| [7] | WANG K, LI S F, WORKU T, et al. Rab11a is required for porcine reproductive and respiratory syndrome virus induced autophagy to promote viral replication[J]. Biochem Biophys Res Commun, 2017, 492(2): 236–242. DOI: 10.1016/j.bbrc.2017.08.057 |
| [8] | LIU Q H, QIN Y X, ZHOU L, et al. Autophagy sustains the replication of porcine reproductive and respiratory virus in host cells[J]. Virology, 2012, 429(2): 136–147. DOI: 10.1016/j.virol.2012.03.022 |
| [9] | SUN M X, HUANG L, WANG R, et al. Porcine reproductive and respiratory syndrome virus induces autophagy to promote virus replication[J]. Autophagy, 2012, 8(10): 1434–1447. DOI: 10.4161/auto.21159 |
| [10] | AITA V M, LIANG X H, MURTY V V V S, et al. Cloning and genomic organization of Beclin 1, a candidate tumor suppressor gene on chromosome 17q21[J]. Genomics, 1999, 59(1): 59–65. DOI: 10.1006/geno.1999.5851 |
| [11] | ZHOU A, LI S F, KHAN A, et al. Autophagy postpones apoptotic cell death in PRRSV infection through Bad-Beclin1 interaction[J]. Virulence, 2016, 7(2): 98–109. DOI: 10.1080/21505594.2015.1131381 |
| [12] | KIMURA S, FUJITA N, NODA T, et al. Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452: 1–12. DOI: 10.1016/S0076-6879(08)03601-X |
| [13] | MIZUSHIMA N, YOSHIMORI T. How to interpret LC3 immunoblotting[J]. Autophagy, 2007, 3(6): 542–545. DOI: 10.4161/auto.4600 |
| [14] | MIJALJICA D, PRESCOTT M, DEVENISH R J. Autophagy in disease[J]. Methods Mol Biol, 2010, 648: 79–92. DOI: 10.1007/978-1-60761-756-3 |
| [15] | KURIAKOSE T, KANNEGANTI T D. War on viruses:LC3 recruits GTPases[J]. Cell Host Microbe, 2017, 22(1): 7–9. DOI: 10.1016/j.chom.2017.06.019 |
| [16] |
黄剑波. PRRSV SC株GP5蛋白合成肽抗体的制备及ADE作用研究[D]. 雅安: 四川农业大学, 2016.
HUANG J B. Preparation of GP5 protein synthetic peptide antibody of PRRSV SC strain and the research of ADE[D]. Ya'an: Sichuan Agricultural University, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10626-1017017007.htm |
| [17] | MATHEW R, KARANTZA-WADSWORTH V, WHITE E. Role of autophagy in cancer[J]. Nat Rev Cancer, 2007, 7(12): 961–967. DOI: 10.1038/nrc2254 |
| [18] | WANG T T, CAO Q H, CHEN M Y, et al. Beclin 1 deficiency correlated with lymph node metastasis, predicts a distinct outcome in intrahepatic and extrahepatic cholangiocarcinoma[J]. PLoS One, 2013, 8(11): e80317. DOI: 10.1371/journal.pone.0080317 |
| [19] | NASCIMENTO-FERREIRA I, SANTOS-FERREIRA T, SOUSA-FERREIRA L, et al. Overexpression of the autophagic beclin-1 protein clears mutant ataxin-3 and alleviates Machado-Joseph disease[J]. Brain, 2011, 134(Pt 5): 1400–1415. |
| [20] | KUO S H, TANG G M, MA K, et al. Macroautophagy abnormality in essential tremor[J]. PLoS One, 2012, 7(12): e53040. DOI: 10.1371/journal.pone.0053040 |
| [21] | PUJHARI S, KRYWORUCHKO M, ZAKHARTCHOUK A N, et al. Role of phosphatidylinositol-3-kinase (PI3K) and the mammalian target of rapamycin (mTOR) signalling pathways in porcine reproductive and respiratory syndrome virus (PRRSV) replication[J]. Virus Res, 2014, 194: 138–144. DOI: 10.1016/j.virusres.2014.09.017 |
| [22] |
范许许. 自噬复合体ATG5-ATG12促进Ⅰ型干扰素信号转导对口蹄疫病毒复制的影响[D]. 北京: 中国农业科学院, 2016.
FAN X X. ATG5-ATG12 Conjugate promotes type Ⅰ IFN signal transduction and influences the replication of foot-and-mouth diease virus[D]. Beijing: Chinese Academy of Agricultural Sciences Dissertation, 2016. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-1016174477.htm |
| [23] | LI S F, ZHOU A, WANG J X, et al. Interplay of autophagy and apoptosis during PRRSV infection of Marc145 cell[J]. Infect Genet Evol, 2016, 39: 51–54. DOI: 10.1016/j.meegid.2016.01.011 |
| [24] |
陈全刚. PRRSV感染诱导细胞自噬及内质网应激的机制研究[D]. 武汉: 华中农业大学, 2013.
CHEN Q G. The mechanisms study of cellular autophagy and ER stress induced by PRRSV[D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10504-1013336730.htm |



