中国是玉米生产和消费大国,同时玉米还是中国主要的饲料原料之一。根据《2016/2017年度国内玉米市场展望》[1]分析,2016年玉米产量为21 245万吨,需求增幅达7.9%,部分玉米则用于工业深加工。玉米皮、玉米蛋白粉、玉米胚芽饼以及玉米DDGS(谷物干酒糟及可溶物)等均为玉米深加工副产品。其中,绝大部分的玉米副产品作为饲料资源饲喂给畜禽,因此对饲料品质要求尤为重要。而如何保持共同产品加工水平一致性是对市场饲料产品质量的一个主要关注点,唐博等[2]也论述了市场上相同的商品名称,其营养成分的差异却很大。饲料中粗脂肪含量与加工工艺流程相关[3-4],其脂质水解酸败还受到温度和水分含量的影响[5],也就是说批次对饲料的营养价值影响较大。根据Gamage等[6]研究报道,同样得出批次对饲料样品的营养特性存在一定的影响。
此外,以往大多数试验研究是采用常规方法研究玉米及其副产品的营养价值,其工作量大、用时较长。而傅立叶变换红外光谱技术(FTIR)是一种快速、直接,不破坏生物样本组织内部结构的先进生物分析技术,并且可以提供组织中的化学成分和官能团的数量、组成、结构及分布有关的信息[7-8]。Yu等[8]研究FTIR分析技术证明,植物相似的形态学部分有相似的光谱特征和化学组成,不同的形态学部位呈现出不同的光谱特征。现已有研究表明,可以利用FTIR分子技术来评价饲料质量、检测其化学结构构象,以及有关光谱结构与营养可用性之间关系的研究[9-11]。然而,很少有利用FTIR技术分析脂质营养特性的研究,进而有关玉米及其副产品的脂质研究还未见报道,对于来自同一玉米饲料加工厂的不同批次问题就更少被研究并进行评价。通过研究发现,脂质的品质、营养价值以及动物对其利用情况可能不仅与脂肪含量有关,也与脂质内部的分子结构特征存在一定的相关性。这些脂质内部的分子结构特征包括CH3反对称伸缩、CH2反对称伸缩、CH3对称伸缩、CH2对称伸缩、C=O伸缩和脂质不饱和结构组[12]。
本试验旨在探求不同批次玉米及其副产品营养特性和脂质分子结构的差异及其两者之间是否存在相关关系,进而在分子结构层面对玉米及其副产品的脂质效价进行更深层次地了解,为利用FTIR技术快速、准确测定饲料营养价值提供理论依据。
1 材料与方法 1.1 试验样品采集与测定本次试验采用四分法采集样本。于2016年6-7月在吉林省松原嘉吉生化有限公司采集3批饲料样品(n=1、2、3;i=玉米、玉米皮(喷浆)、玉米胚芽(带壳)、玉米胚芽饼、玉米蛋白粉),共15个样本。一部分样品用粉碎机过1 mm孔筛粉碎并充分混匀,用于常规化学成分分析;另一部分样品粉碎过0.25 mm孔筛,并于东北农业大学化学馆进行光谱分析测定(型号:岛津FTIR-8400S)。
1.2 测定指标及方法 1.2.1 常规化学成分分析测定指标:干物质(DM)、有机物质(OM)、粗蛋白(CP)、中性洗涤纤维(NDF)和粗脂肪(EE)。其中,DM、OM、CP和EE的分析根据AOAC(1990)[13]的程序进行测定,NDF根据Van Soest等[14]的标准过滤方法并结合ANKOM滤袋技术进行测定。
1.2.2 光谱数据的采集及分析光谱分析试验在东北农业大学化学馆实验室进行,利用傅里叶变换红外光谱仪进行光谱测定,收集不同批次的玉米及其副产品的脂质分子光谱。将2 mg干燥的样品与溴化钾在1:100的比例下,混合于玛瑙研钵中,在红外烤灯照射下,研磨成粉末并充分混和均匀后,用红外专用压片机(型号:769YP-15A粉末压片机)压成适当薄片。在饲料样品光谱收集之前,对空气(主要是二氧化碳)进行校正。然后通过光谱管理软件对样品薄片进行光谱扫描并收集中红外波段光谱数据,扫描波段在4 000~400 cm-1,分辨率为4 cm-1,扫描次数为128,每个样品做10个重复。
利用OMNIC 8.2软件对扫描样品后获得的红外光谱进行处理分析,分析相关功能团的数据。通过OMNIC 8.2软件中的傅里叶自去卷积(FSD)[15]和二阶导函数功能(2nd derivative)[16]确定CH3反对称伸缩、CH2反对称伸缩、CH3对称伸缩、CH2对称伸缩的光谱区域及峰高位置。一般测定并记录在脂质光谱特征峰波段内(包括CH拉伸区域(ca. 2 984~ 2 781 cm-1)、不饱和脂质拉伸区域(ca. 3 016~2 971 cm-1)和脂质酯的羰基拉伸区域(ca. 1 826~1 693 cm-1))典型分子结构的峰高、峰面积、峰高比和峰面积比。
1.3 统计分析通过Excel 2007软件进行初步统计处理,采用SAS 9.4软件中的PROC MIXED程序对常规化学成分指标以及光谱分子结构峰值进行数据分析。具体模型为Yijk =u+Fi+Bj+Fi*Bj+eijk,其中,Yijk是对自变量ijk的因变量;u是变量的平均值;Fi是不同样品即玉米及其副产品(i =5;玉米、玉米皮、玉米胚芽(带壳)、玉米胚芽饼和玉米蛋白粉);Bj是不同处理即3个批次(j =1、2、3);Fi*Bj是因子F在水平i和因子B在水平j相互作用的固定效应;eijk是与观察ijk相关的随机误差。Tuley-Karmaer检验用于比较不同样品和批次间的差异,P<0.05表示差异显著,P<0.01表示差异极显著。对于光谱脂质分子结构参数与常规营养成分各指标之间的相关性采用SAS 9.4软件中的PROC CORR模块进行分析。本试验还采用Statistica 8.0软件(StatSoft Inc., Tulsa, OK, USA)对脂质分子结构图谱进行多变量分析,其中包括多层聚类分析(CLA)和主成分分析(PCA)两种分析方法。
2 结果 2.1 不同批次玉米与其副产品的常规化学成分分析由表 1可见,不同批次玉米与其副产品的有机物(OM)、粗蛋白(CP)、中性洗涤纤维(NDF)、粗脂肪(EE)含量之间均差异显著(P<0.05),并且两个因素之间的互作效应显著(P<0.05)。玉米皮的中性洗涤纤维(NDF)含量(57.04%DM、46.89%DM和50.50%DM)明显高于其他饲料样品,其中第一批次含量最高(P<0.05),第三批次的OM含量最低(P<0.05)。玉米蛋白粉的OM和CP含量最高(分别是98.67% DM~99.06% DM和64.18% DM~69.94% DM),而NDF含量最低,其中第二批次的OM和第三批次的CP含量最高,以及第一批次的NDF含量最低。而玉米胚芽(带壳)的脂肪(EE)含量最高(34.57% DM~37.24% DM),其中第一批含量最高。对于脂肪(EE)含量,其中玉米胚芽饼的含量次之(12.24% DM~13.45% DM),玉米蛋白粉的含量最低(0.29% DM~0.65% DM)。
|
|
表 1 不同批次玉米与其副产品的常规化学成分 Table 1 Basic chemical profile in different batches of corn and its by-products |
由表 2可见,玉米与其副产品之间的脂质分子结构光谱区域的特征峰参数(CH3反对称伸缩峰高、CH2反对称伸缩峰高、CH3对称伸缩峰高、CH2对称伸缩峰高、CH伸缩峰总面积、不饱和脂质(ULB)伸缩峰高和峰面积、脂质酯的羰基(LECC)伸缩峰高和峰面积以及它们之间的比值)之间存在显著差异(P<0.05)。对饲料样品不同批次分析,仅LECC峰高值和CH2反对称伸缩/CH2对称伸缩峰高比值之间不存在显著差异(P>0.05)。在CH3反对称伸缩峰高、CH2反对称伸缩峰高、CH3对称伸缩峰高、CH2对称伸缩峰高、CH伸缩峰总面积特征参数中,两因素(批次和样品)之间不存在显著性的互作效应(P>0.05)。从CH3和CH2反对称与对称伸缩、不饱和脂质伸缩和脂质酯的羰基伸缩概况来看,玉米胚芽(带壳)的特征值均显著高于玉米和其他副产品的参数含量(P<0.05),而玉米蛋白粉的ULB特征的峰高和峰面积值均显著低于玉米和其他副产品的数值(P<0.05)。在脂质光谱特征比值方面,玉米胚芽(带壳)的CH3反对称伸缩/CH3对称伸缩峰高比值、不饱和脂质伸缩/CH伸缩的峰面积比值、脂质酯的羰基伸缩/CH伸缩的峰面积比值和不饱和脂质伸缩/脂质酯的羰基峰面积比值最高(P<0.05),然而CH3对称/CH2对称伸缩峰高比值在玉米胚芽的第一批次中最低(P<0.05)。CH3反对称/CH2反对称伸缩峰高比值、CH3反对称/CH3对称伸缩峰高比值以及反对称伸缩/对称伸缩峰面积比值均是玉米籽粒显著低于其他饲料样品(P<0.05)。玉米蛋白粉光谱分子结构中CH3反对称/CH2反对称伸缩峰高比值和反对称伸缩/对称伸缩峰面积比值都显著高于其他饲料样品(P<0.05),而在不饱和脂质伸缩/CH伸缩峰面积比值、不饱和脂质/脂质酯的羰基峰高比值、不饱和脂质/脂质酯的羰基峰面积比值都显著较低(P<0.05)。
|
|
表 2 不同批次玉米及其副产品的脂质光谱参数 Table 2 Lipid spectral profiles in different batches of corn and its by-products |
由表 3可得,脂质的化学成分(EE)与其光谱参数(除了不饱和脂质/脂质酯的羰基伸缩峰高比值)之间均存在显著性相关(P<0.05)。在脂质的光谱参数中,EE与CH3反对称/CH2反对称伸缩峰高比值、CH3对称/CH2对称伸缩峰高比值、CH2反对称/CH2对称伸缩峰高比值之间存在显著负相关(r=-0.40~-0.86,P<0.05),而与其他光谱参数(除不饱和脂质/脂质酯的羰基伸缩峰高比值)间存在显著正相关(r=0.32~0.98,P<0.05)。NDF与反对称伸缩/对称伸缩峰面积比值呈显著性负相关(r=-0.45,P<0.05),与其他脂质参数无相关性(P>0.05)。反对称伸缩/对称伸缩峰面积比值与OM和CP之间有显著性正相关(分别为r=0.48和r=0.68,P<0.05)。CP与CH3反对称/CH2反对称伸缩峰高比值存在高度正相关(r=0.98,P<0.05),而与不饱和脂质伸缩/CH伸缩的峰面积比值、脂质酯的羰基伸缩/CH伸缩的峰面积比值、不饱和脂质/脂质酯的羰基峰高比值、不饱和脂质/脂质酯的羰基伸缩峰面积比值呈显著负相关(r=-0.40~ -0.62,P<0.05)。
|
|
表 3 不同批次玉米及其副产品的脂类光谱结构特征与基本化学成分之间的相关性 Table 3 Correlation between lipid-related structure spectral characteristics and basic chemical profiles in different batches of corn and its by-products |
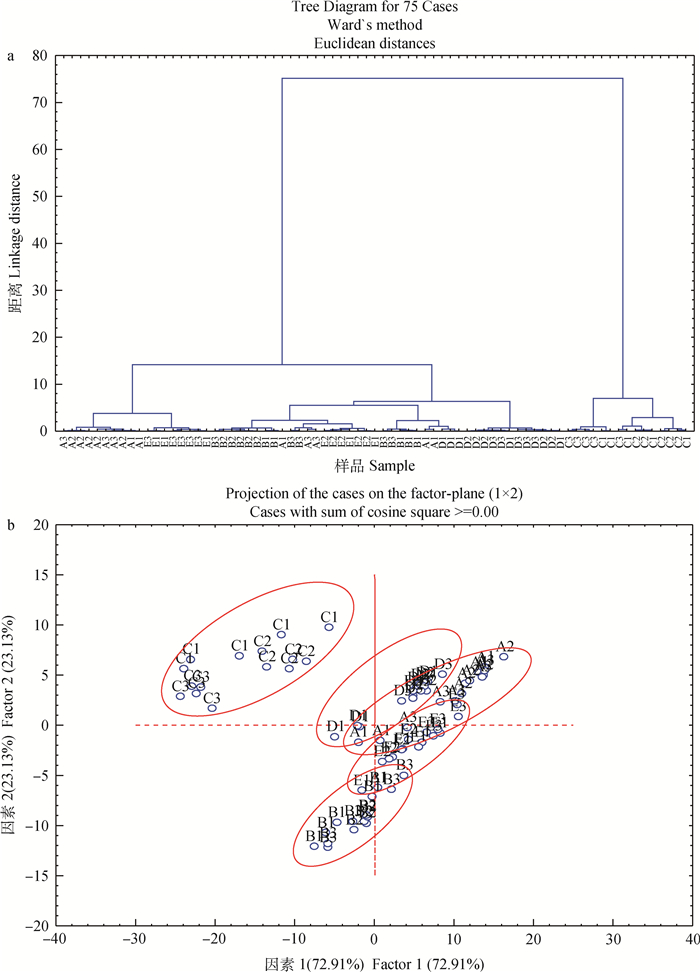
玉米与其副产品的脂质化合物分子结构(ca. 3 016~2 781 cm-1与1 826~1 693 cm-1)的层序聚类分析(CLA)和主成分分析(PCA)结果见图 1~图 3。不同批次间的样本均相互重叠,无法分开。从CH3和CH2反对称与对称伸缩区域(ca. 2 984~2 781 cm-1)概况可知,玉米胚芽(带壳)与其他饲料样品间的树状图在距离20以内可以完全分开(图 1a)。饲料样品(除玉米胚芽外)的主成分(PCA)存在部分互相重叠,但在PCA分析中,玉米胚芽可以完全区分开来(图 1b),这与CLA结果相似。其中PCA分析中的第一和第二主成分分别占总变异数的72.91%和23.13%(图 1b)。在不饱和脂质伸缩相关光谱区域内(ca. 3 016~2 971 cm-1),玉米胚芽(带壳)也可以与其他饲料样品区分开(图 2a),其中的第一和第二主成分分别占总变异数的87.01%和12.80%(图 2b),此外玉米胚芽饼也能完全独立分开(图 2b)。在脂质酯的羰基(C=O)伸缩光谱(ca. 1 826~1 693 cm-1)多变量分析中(图 3),玉米胚芽(带壳)与其他饲料样品可以完全分开(图 3a),PCA分析中的第一和第二主成分分别占总变异数的68.16%和29.73%(图 3b),与CLA结果相似。并且玉米及其副产品在PCA分析中均能完全区分开(图 3b)。这一结果说明玉米胚芽(带壳)与其他样品间的分子结构存在差异,但是其他饲料样品之间在内部分子结构方面也存在一定的相似性,这也进一步支持了表 2中光谱数据的分析结果。
|
a.不同批次的玉米与其副产品CH3和CH2不对称和对称伸缩区域(ca. 2 984~2 781 cm-1,方法为欧氏距离,聚类方法为Ward算法,下同);b. PCA光谱分析不同批次玉米与其副产品中得到其第一主成分和第二主成分的散点图:第一和第二主成分的总方差分别是72.91%和23.13%。A.玉米籽粒;B.喷浆玉米皮;C.玉米胚芽;D.玉米胚芽饼;E.玉米蛋白粉;1.第一批次;2.第二批次;3.第三批次。下同 a. CLA spectral analysis of the CH3 and CH2 asymmetric and symmetric stretching regions (ca. 2 984-2 781 cm-1) obtained from different batches of samples(Distance method is euclidean, Cluster method is Ward's algorithm, the same as below); b. Scatter plot of the 1st principal component vs. the 2nd principal component of PCA analysis of spectrum obtained from different batches of samples: the 1st and 2nd principal components explain 72.91% and 23.13% of the total variance, respectively. A. Corn kernel; B. Corn gluten feed; C. Corn germ with pericarp; D. Corn germ cake; E. Corn gluten meal; 1. The first batch; 2. The second batch; 3. The third batch. The same as below 图 1 多变量分析不同批次玉米及其副产品在CH3和CH2不对称和对称拉伸光谱区域内的脂质分子特征 Figure 1 Multivariate molecular spectral analyses of the CH3 and CH2 asymmetric and symmetric stretching on a molecular basis in different batches of corn and its by-products |

|
a.不同批次的玉米与其副产品不饱和脂质伸缩区域(ca. 3 016~2 971 cm-1);b. PCA光谱分析不同批次玉米与其副产品中得到其第一主成分和第二主成分的散点图:第一和第二主成分的总方差分别是87.01%和12.80% a.CLA spectral analysis of the ULB stretching regions (ca. 3 016-2 971 cm-1) obtained from different batches of samples; b. Scatter plot of the 1st principal component vs. the 2nd principal component of PCA analysis of spectrum obtained from different batches of samples: the 1st and 2nd principal components explain 87.01% and 12.80% of the total variance, respectively 图 2 多变量分析不同批次玉米及其副产品不饱和脂质伸缩光谱区域内的脂质分子特征 Figure 2 Multivariate molecular spectral analyses of the unsaturated lipid bands on a molecular basis in different batches of corn and its by-products |

|
a.不同批次的玉米与其副产品脂质酯的羰基伸缩区域(ca. 1 826~1 693 cm-1);b. PCA光谱分析不同批次玉米与其副产品中得到其第一主成分和第二主成分的散点图:第一和第二主成分的总方差分别是68.16%和29.73% a.CLA spectral analysis of the lipid ester C=O carbonyl regions (ca. 1 826-1 693 cm-1) obtained from different batches of samples; b. Scatter plot of the 1st principal component vs. the 2nd principal component of PCA analysis of spectrum obtained from different batches of samples: the 1st and 2nd principal components explain 68.16% and 29.73% of the total variance, respectively 图 3 多变量分析不同批次玉米及其副产品脂质酯的羰基伸缩光谱区域内的脂质分子特征 Figure 3 Multivariate molecular spectral analyses of the lipid ester C=O carbonyl on a molecular basis in different batches of corn and its by-products |
对于玉米及其副产品营养价值的研究已经取得了一定的成果。例如:在玉米蛋白粉的营养成分及应用的研究中,张锋斌和李维平[17]得出了玉米蛋白粉与玉米籽粒的粗蛋白(65%和8.9%)和脂肪(7%和3.9%)含量,其中玉米蛋白粉的脂肪含量结果与本次试验结果存在差异。但吴春胜等[18]在2004年的研究中也对玉米营养成分进行了分析,得出普通玉米的脂肪含量为4.62%,较高于本次的研究值(3.74% DM~3.85% DM)。在王燕等[19]的研究中得出,玉米皮的中性洗涤纤维含量为50.85%~58.00%,较高于本次试验的第二批玉米皮的含量。在本研究中,第一批玉米胚芽的含脂肪量最高(37.24%),然而较低于钱志娟等[20]在玉米胚芽水酶法提油及蛋白质的回收中指出的玉米胚芽脂肪(54.62%)含量。钱志娟等[20]的研究还指出,玉米胚芽粗蛋白含量为12.36%,这一结果较低于本试验结果。么学博等[21]研究得到玉米胚芽饼的脂肪含量是10.10%,较低于本试验得到的结果;此外,其测得的CP含量较高于本次试验的第一批玉米胚芽饼,但低于第二批和第三批的含量;然而NDF的含量与本试验差异较大。林谦等[22]得到在风干基础上的玉米皮(喷浆)脂肪(EE)含量(分别是1.74%和4.46%)和玉米蛋白粉的脂肪含量(9.31%)均不同于本次研究的结果,导致这种结果的原因可能是不同地区加工工艺流程的不同[3-4]。
3.2 不同批次玉米与其副产品脂质分子结构光谱值本试验研究了CH3和CH2不对称和对称伸缩带、不饱和脂质带(ULB)和脂质羰基酯伸缩带(LECC)的光谱结构,仅发现在CH3不对称(CH3-as),CH2不对称(CH2-as),CH3对称(CH3-s)和CH2对称(CH2-s)分子结构上饲料的品种与批次之间没有互作效应(P>0.05)。据先前报道,仅发现玉米与玉米DDGS之间的脂质光谱功能团存在差异[23],因目前很少报道关于玉米与其副产品脂质结构的分析,故无法进行比较。然而有文献研究[24-26]报道其他样品间的脂质功能团结构存在差异,说明FTIR分析技术可用于检测与脂质相关的分子结构组成变化。
3.3 不同批次玉米与其副产品脂质营养价值与脂质分子结构之间的相关关系脂质分子结构特性(特征峰的峰高、峰面积以及比值)与脂质营养价值密切相关。在金色亚麻籽与棕色亚麻籽脂质相关结构中,Xin和Yu[12]报道了CH3和CH2对称伸缩峰高比值与EE呈负相关(r=-0.53),但与CH3和CH2不对称和对称伸缩带、不饱和脂质带(ULB)和脂质羰基酯伸缩带(LECC)的光谱特征峰的峰高、峰面积呈正相关,这与本试验的结果相关性一致。Xin等[24]在研究中建立了脂质光谱功能团结构与EE之间的回归方程,其拟合度高达0.99,证明了脂质分子光谱结构特征与脂肪含量存在相关关系。尽管有关于脂质功能团特征的报道很少,然而采用FTIR光谱技术对饲料营养价值与蛋白质及碳水化合之间相关性的研究很多,例如,丁雪等[27]试验得出玉米秸秆不同部位的蛋白质营养价值及分子结构存在明显的差异,并且二者存在显著的相关关系。饲料脂质分子结构特性分析还有待大量的试验对其相关性进行验证。
3.4 不同批次玉米与其副产品的脂质光谱结构多变量分析本试验的目的是运用FTIR光谱进行多变量分子分析,快速确定样品的脂质分子结构。聚类分析是一种多变量分析,对红外光谱数据集进行聚类分析,并将聚类分析结果显示为系统树图[28],可以更直观的区别不同饲料光谱结构。本研究中,使用了内平方距离法(Ward)的算法,在脂质区域中进行光谱数据的参数化。主成分分析是一种统计数据还原方法,PCA分析的结果通常以二维关系图的形式表示[29]。在本试验中,不同的样品其光谱分子结构特征(CH3和CH2不对称和对称伸缩带、ULB和LECC光谱结构)存在差异,以及在批次间存在相似的分子结构。Ban和Yu[30]在利用分子光谱技术对反刍家畜系统中营养物质分子结构进行单变量和多变量分析时也得出类似的分析结果,即不同样品存在显著结构差异。在一定程度上,本研究中脂质光谱的多变量分析与单变量分析结果相一致。然而,有报道[26]研究对菜籽油进行干、湿加热,发现在PCA分析中其分子结构存在大量重叠,说明了强度不足以引起脂质结构的热诱导变化。在本试验中,不同批次间饲料样本同样存在大量重叠,说明批次间的差异不足以影响其分子光谱结构。
4 结论综上所述,玉米与其副产品的化学成分差异显著,尤其脂质部分的营养成分(EE)存在明显的不同,不同批次样品间有明显互作效应。利用FTIR分子光谱学研究了玉米与其副产品的脂质光谱分子结构,其中CH2和CH3伸缩带振动强度没有显著互作效应。由CLA和PCA分析得出,在非对称和对称的CH3和CH2区域的原始光谱中产生了部分重叠。但是通过多变量分析发现,玉米胚芽(带壳)与其他饲料样品的脂质分子结构之间存在着显著性差异,并且与常规营养价值存在明显的相关关系,这与饲料间的营养价值密切相关。这种潜在的相关关系可用于饲料分子化学的质量与营养价值判定,然而这还需进一步的研究证明。
| [1] |
王梅. 2016/2017年度国内玉米市场展望[J]. 中国粮食经济, 2017(1): 30–32.
WANG M. 2016/2017 domestic corn market outlook[J]. China Grain Economy, 2017(1): 30–32. (in Chinese) |
| [2] |
唐博, 柳景然, 刘金锐. 玉米及其加工副产品的营养价值分析[J]. 现代畜牧科技, 2017(9): 54.
TANG B, LIU J R, LIU J R. Analysis of nutritional value of maize and its processing byproducts[J]. Modern Animal Husbandry Science & Technology, 2017(9): 54. (in Chinese) |
| [3] |
邓君明, 张曦. 加工工艺对饲料营养价值及动物生产性能的影响[J]. 饲料工业, 2001(9): 10–14.
DENG J M, ZHANG X. The effects of feed processing on feed nutrition and animal performance[J]. Feed Industry, 2001(9): 10–14. (in Chinese) |
| [4] |
柳序, 田科雄, 彭灿阳, 等. 饲料加工工艺对饲料营养成分及动物生产性能的影响[J]. 饲料研究, 2016(22): 52–57.
LIU X, TIAN K X, PENG C Y, et al. Effect of feed processing technology on feed nutrients and animal production performance[J]. Feed Research, 2016(22): 52–57. (in Chinese) |
| [5] |
何健, 周东兵, 周安国, 等. 温度、时间和水分对配合饲料脂质酸败的影响[J]. 粮食与饲料工业, 2001(7): 23–24.
HE J, ZHOU D B, ZHOU A G, et al. The effects of temperature, time and moisture on lipid rancidity in formula feeds[J]. Cereal and Feed Industry, 2001(7): 23–24. (in Chinese) |
| [6] | GAMAGE I H, JONKER A, CHRISTENSEN D A, et al. Metabolic characteristics of proteins and biomolecular spectroscopic profiles in different batches of feedstock (wheat) and their co-products (wheat distillers dried grains with solubles) from the same bioethanol processing plant[J]. J Dairy Sci, 2012, 95(11): 6695–6715. DOI: 10.3168/jds.2012-5685 |
| [7] | WETZEL D L, EILERT A J, PIETRZAK L N, et al. Ultraspatially-resolved synchrotron infrared microspectroscopy of plant tissue in situ[J]. Cell Mol Biol (Noisy-le-grand), 1998, 44(1): 145–168. |
| [8] | YU P Q, MCKINNON J J, CHRISTENSEN C R, et al. Chemical imaging of microstructures of plant tissues within cellular dimension using synchrotron infrared microspectroscopy[J]. J Agric Food Chem, 2003, 51(20): 6062–6067. DOI: 10.1021/jf034654d |
| [9] | YU P Q, NUEZ-ORTÍN W G. Relationship of protein molecular structure to metabolisable proteins in different types of dried distillers grains with solubles:A novel approach[J]. Br J Nutr, 2010, 104(10): 1429–1437. DOI: 10.1017/S0007114510002539 |
| [10] | ZHANG X W, YU P Q. Using ATR-FT/IR molecular spectroscopy to detect effects of blend DDGS inclusion level on the molecular structure spectral and metabolic characteristics of the proteins in hulless barley[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2012, 95: 53–63. DOI: 10.1016/j.saa.2012.04.022 |
| [11] | LI X X, XU W B, YANG J S, et al. Carbohydrate spectroscopic features of bio-oil co-products in relation to rumen degradation kinetics in ruminants[R]. Salt Lake City, UT: JAM, 2016: 227. http://asas.confex.com/asas/jam2016/webprogram/Paper18202.html |
| [12] | XIN H S, YU P Q. Detect changes in lipid-related structure of brown-and yellow-seeded Brassica Carinata seed during rumen fermentation in relation to basic chemical profile using ATR-FT/IR molecular spectroscopy with chemometrics[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2014, 133: 811–817. DOI: 10.1016/j.saa.2014.06.041 |
| [13] | AO AC. Official methods of analysis of the association of official analytical chemists[M]. Washington, DC, USA: AOAC, 1990. |
| [14] | VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. J Dairy Sci, 1991, 74(10): 3583–3597. DOI: 10.3168/jds.S0022-0302(91)78551-2 |
| [15] | KAUPPINEN J K, MOFFATT D J, MANTSCH H H, et al. Fourier self-deconvolution:A method for resolving intrinsically overlapped bands[J]. Appl Spectrosc, 1981, 35(3): 271–276. DOI: 10.1366/0003702814732634 |
| [16] | YU P Q, NIU Z Y, DAMIRAN D. Protein molecular structures and protein fraction profiles of new coproducts from bioethanol production:A novel approach[J]. J Agric Food Chem, 2010, 58(6): 3460–3464. DOI: 10.1021/jf904179m |
| [17] |
张锋斌, 李维平. 玉米蛋白粉的营养成分及应用[J]. 畜牧兽医杂志, 1998, 17(4): 26–28.
ZHANG F B, LI W P. Nutritional composition and application of corn gluten meal[J]. Journal of Animal Science and Veterinary Medicine, 1998, 17(4): 26–28. (in Chinese) |
| [18] |
吴春胜, 贾士芳, 王成己, 等. 高蛋白玉米、高油玉米与普通玉米品质的对比研究[J]. 玉米科学, 2004, 12(1): 57–60.
WU C S, JIA S F, WANG C J, et al. A comparison of quality among high-protein corn, high-oil corn and common corn[J]. Journal of Maize Sciences, 2004, 12(1): 57–60. (in Chinese) |
| [19] |
王燕, 刘骥, 刘晓兰, 等. 不同来源玉米纤维饲料的营养价值评价[J]. 饲料研究, 2016(16): 50–54.
WANG Y, LIU J, LIU X L, et al. Evaluation of nutritional value of corn fiber feed from different sources[J]. Feed Research, 2016(16): 50–54. (in Chinese) |
| [20] |
钱志娟, 王璋, 许时婴, 等. 玉米胚芽水酶法提油及蛋白质的回收[J]. 无锡轻工业大学学报, 2004, 23(5): 58–62.
QIAN Z J, WANG Z, XU S Y, et al. Aqueous enzymatic extraction of corn germ oil and recovering protein[J]. Journal of Wuxi University of Light Industry, 2004, 23(5): 58–62. (in Chinese) |
| [21] |
么学博, 杨红建, 谢春元, 等. 反刍家畜常用饲料蛋白质和氨基酸瘤胃降解特性和小肠消化率评定研究[J]. 动物营养学报, 2007, 19(3): 225–231.
YAO X B, YANG H J, XIE C Y, et al. In situ degradability characteristics of crude protein and amino acids in the rumen and small intestinal digestibility using the mobile nylon bag with ruminant feedstuffs[J]. Chinese Journal of Animal Nutrition, 2007, 19(3): 225–231. (in Chinese) |
| [22] |
林谦, 戴求仲, 蒋桂韬, 等. 玉米及其加工副产品的营养价值评定[J]. 中国饲料, 2013(4): 18–21.
LIN Q, DAI Q Z, JIANG G T, et al. Evaluation of nutritional value of corn by-products[J]. China Feed, 2013(4): 18–21. (in Chinese) |
| [23] | Yu P Q. Study the sensitivity of molecular functional groups to bioethanol processing in lipid biopolymer of co-products using DRIFT molecular spectroscopy[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2011, 82(1): 1–7. DOI: 10.1016/j.saa.2011.05.078 |
| [24] | XIN H S, KHAN N A, FALK K C, et al. Mid-infrared spectral characteristics of lipid molecular structures in Brassica carinata seeds:Relationship to oil content, fatty acid and glucosinolate profiles, polyphenols, and condensed tannins[J]. J Agric Food Chem, 2014, 62(32): 7977–7988. DOI: 10.1021/jf502209x |
| [25] | XIN H S, THEODORIDOU K, YU P Q. Implication of modified molecular structure of lipid through heat-related process to fatty acids supply in Brassica carinata seed[J]. Ind Crops Prod, 2014, 62: 204–211. DOI: 10.1016/j.indcrop.2014.08.025 |
| [26] | ABEYSEKARA S, SAMADI, YU P Q. Response and sensitivity of lipid related molecular structure to wet and dry heating in canola tissue[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2012, 90: 63–71. DOI: 10.1016/j.saa.2011.12.045 |
| [27] |
丁雪, 张幸怡, 郝小燕, 等. 玉米秸秆不同部位的蛋白质营养价值与其分子结构相关关系的研究[J]. 畜牧兽医学报, 2016, 47(8): 1592–1600.
DING X, ZHANG X Y, HAO X Y, et al. Protein molecular structure in relation to protein nutritive values at different sections of corn stover[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(8): 1592–1600. (in Chinese) |
| [28] | LIU B, MCKINNON J J, THACKER P, et al. Molecular structure and metabolic characteristics of the proteins and energy in triticale grains and dried distillers grains with solubles for dairy cattle[J]. J Agric Food Chem, 2012, 60(40): 10064–10074. DOI: 10.1021/jf302382b |
| [29] | YU P Q. Applications of hierarchical cluster analysis (CLA) and principal component analysis (PCA) in feed structure and feed molecular chemistry research, using synchrotron-based Fourier transform infrared (FTIR) microspectroscopy[J]. J Agric Food Chem, 2005, 53(18): 7115–7127. DOI: 10.1021/jf050959b |
| [30] | BAN Y J, YU P Q. Structural and nutritional characterization of macromolecular complexes in new bioenergy feedstock by infrared radiation with advanced molecular spectroscopy and spectral chemometrics[J]. Appl Spectrosc Rev, 2016, 51(10): 822–838. DOI: 10.1080/05704928.2016.1191017 |



