在妊娠初期,孕体发出信号(类固醇激素或蛋白质)传递给母体后,母体随即产生反应以识别孕体的存在。由此母体与孕体建立密切联系,促进孕体进一步发育,这一生理过程叫妊娠识别[1]。奶牛妊娠识别大约发生在授精后第15天,并且接纳孕体的最晚时间必须早于第17天[2],干扰素τ(interferon tau,INF-τ)是反刍动物妊娠识别的关键信号[3]。孕体发育到囊胚期,滋养外胚层开始分泌INF-τ,随着囊胚的延伸,分泌量也不断增加,孕体附着于子宫上皮即着床之前INF-τ含量达到峰值,着床之后其分泌量减退。它作为一种旁分泌因子,可以与子宫内膜细胞的相关受体结合,下调催产素受体表达,破坏PGF2α脉冲释放,使得黄体不被溶解,进而维持孕酮分泌以维持妊娠[4]。但由于该细胞因子在血液中含量极低,因此很难作为早期妊娠诊断的指标[5]。早期妊娠诊断对减少空怀率,提高繁殖效率具有十分重要的意义。目前常用血清或牛奶中孕酮、妊娠相关蛋白和直肠检查进行诊断[6-8],但这些手段均在人工授精后35 d左右才能进行准确诊断。因此探索在一个情期内实现妊娠诊断已经成为国内外研究的热点之一。
除了INF-τ引起孕酮持续分泌是保障早期胚胎存活的重要原因外,国内外研究还发现,营养也是调节子宫生理功能、促进胚胎发展和提高妊娠率的重要因素之一[9-10]。在胚胎着床前,胚胎与母体之间已经建立了营养关系,即母血营养,子宫滋养层可为胚胎提供大量葡萄糖以供其发展[11]。另外在着床前,由母体提供的氨基酸对胚胎的存活也至关重要[12]。研究还发现母体磷脂代谢也与早期妊娠相关[13]。母体代谢通路因妊娠时营养转运而发生改变。但目前关于母体对妊娠早期的系统代谢应答机制研究较少。因此,探索妊娠早期母体体内代谢物或代谢组的变化情况,对回答母体对早期妊娠的应答机制具有重要的科学意义,也可为建立新的早期妊娠诊断方法提供依据。
代谢组学(metabolomics)是一种利用高通量、高灵敏度的现代分析技术研究生物体在被扰动后,生物体液中的小分子代谢物的动态变化,了解机体整体的生理状态的一门新兴学科。目前代谢组学常用的检测技术有GC-MS、LC-MS和NMR,由于LC-MS具有高分辨率和灵敏度的优点,被广泛应用于代谢组学研究。近年来,代谢组学方法已成功应用于奶牛疾病诊断和生理机制研究[14-15]。本试验采用高效液相色谱-四极杆-飞行时间质谱(LC-Q/TOF-MS)代谢组学技术,对人工授精当天和第17天奶牛乳样代谢轮廓进行模式识别,并筛选其差异代谢物。旨在寻找妊娠识别阶段生物标志物,为早期妊娠诊断方法提供新的思路和方法,也可为解答妊娠识别期奶牛应答的机制提供新的视角。
1 材料与方法 1.1 仪器与试剂LC-Q/TOF-MS仪(Agilent, 1290 Infinity LC, 6530 UHD and Accurate-Mass Q-TOF /MS),分离色谱柱为C18色谱柱(Agilent, 100 mm×2.1 mm,1.8 μm)。乙睛(LC/MS级,Merck,Dannstadt,Gennany),甲醇(HPLC级,Merck,Dannstadt,Gennany),甲酸(CNW,Gennany)。其它试剂均为市售分析纯。试验用水为屈臣氏蒸馏水。
1.2 试验动物与分组选择宁夏某大型集约化奶牛场10头2~3胎次体况相近的健康荷斯坦高产奶牛为试验对象,采用PGF2α同期发情后(注射两次,间隔14 d),采集发情当天乳样(A组)和人工授精后第17天乳样(B组),每组每份乳样按组别+阿拉伯数字编号,即A组乳样编号为A1~A10,B组乳样编号为B1~B10。10头奶牛在授精45 d左右均被确诊为成功妊娠,且在此期间无疾病发生。乳样于-80 ℃保存,以备后续分析。
1.3 乳样的预处理乳样常温下解冻后,移液枪精准移取100 μL样本,移至1.5 mL的离心管,采用甲醇沉淀蛋白,其比例为样本:甲醇=1:3,充分涡旋30 s,4 ℃,1 200 r·min-1离心15 min;小心取出离心管,移取200 μL上清液,转入进样小瓶。
1.4 LC-Q/TOF-MS分析 1.4.1 色谱分离条件柱温40 ℃;流速0.35 mL·min-1;流动相组成A:水+0.1%甲酸,B:乙腈+0.1%甲酸;梯度洗脱程序见表 1。进样量为4 μL,自动进样器温度4 ℃,压力范围800 bar。
|
|
表 1 LC-Q/TOF-MS梯度洗脱程序 Table 1 Gradient elution program of LC-Q/TOF-MS |
以氮气作为雾化、锥孔气;飞行管检测模式V型。正离子模式条件:毛细管电压(capillary voltage)4 kV、锥孔电压(sampling cone)35 kV、离子源温度(source temperature)100 ℃;脱溶剂气温度(desolvation temperature)350 ℃、反向锥孔气流(cone gas flow)50 L·h-1、脱溶剂气(desolvation gas flow)600 L·h-1、萃取锥孔(extraction cone)电压4 V。
1.4.2.2 负离子模式毛细管电压(capillary voltage)3.5 kV、锥孔电压(sampling cone)50 kV、离子源温度(source temperature)100 ℃;脱溶剂气温度(desolvation temperature)300 ℃、反向锥孔气流(cone gas flow)50 L·h-1、脱溶剂气(desolvation gas flow)700 L·h-1、萃取锥孔(extraction cone)电压4 V。离子扫描时间(scan time)0.03 s、扫描时间间隔(inter scan time)0.02 s、数据采集:50~1 000 m·z-1。为确保质量的准确性和重复性,应用亮氨酸-脑啡肽作为锁定质量(lock mass),正离子模式下产生[M+H]+离子556.277 1 u。负离子模式下产生[M-H]-离子554.261 5 u。
将所得数据用Mass Profiler软件(Agilent公司)对LC-Q/TOF-MS数据进行预处理,并在EXCEL2007软件中进行后期编辑,将最终结果组织为二维数据矩阵,包括变量(rt_mz,即保留时间_质荷比)、观察量(样本)和峰强度。
1.5 数据分析经过预处理后数据导入到SIMCA-P+软件(V13.0,Umetrics AB,Umea,Sweden)中进行模式识别多变量统计分析,包括主成分分析(principal component analysis,PCA))和正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),PCA和OPLS-DA用来揭示两组乳样代谢轮廓的变化,相应的变量重要性(variable importance in the projection,VIP)通过OPLS-DA模型计算出来。对VIP>1的代谢物数据导入OriginPro 8.0软件,选择非参数检验中的Kruskal-Wallis检验进行差异性分析,分析结果用P值表示,P < 0.05表示差异显著。聚类分析采用Heatmap Illustrator 1.0.3.7软件分析。差异代谢物对分类的识别能力采用SPSS 13.0中的ROC曲线进行分析。
1.6 差异代谢物的鉴定差异代谢物鉴定根据其MS值和在线数据库HMDB (http://www.hmdb.ca/),KEGG (http://www.genome.jp/kegg/),METLIN (http://metlin.scripps.edu/)进行;然后在牛代谢组学数据库(Bovine Metabolome Database, DMDB, http://www.cowmetdb.ca/)中进行比对和校正。
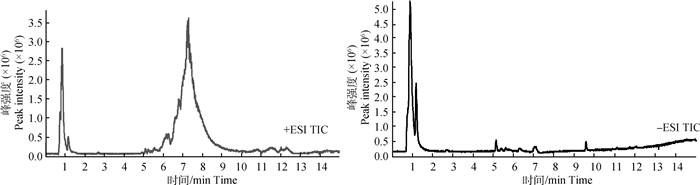
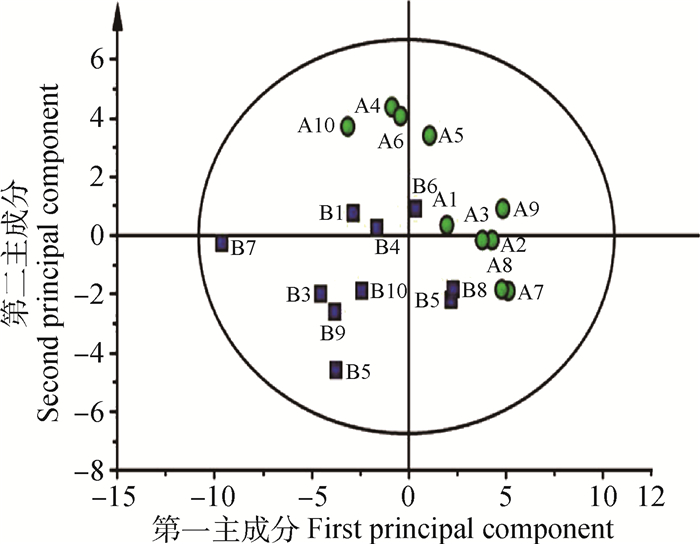
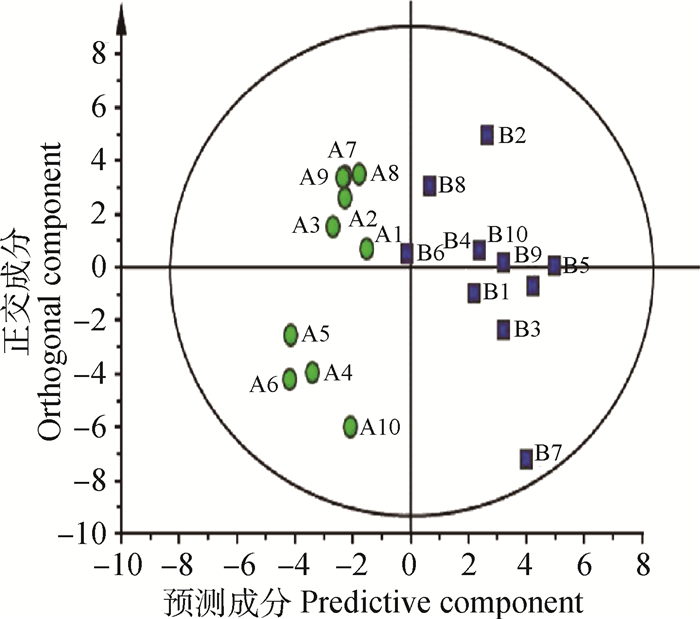
2 结果 2.1 妊娠奶牛乳样代谢轮廓的模式识别两组奶牛乳样代表性正负离子LC-Q/TOF-MS色谱见图 1,包含799个色谱峰,其中正离子模式下有380个色谱峰,负离子模式下有419个色谱峰。首先对色谱峰所获得的数据进行PCA分析,其结果用得分散点图(score plot)来表示,见图 2。得分散点图中每个点代表 1个乳样的所有代谢物(包含正离子和负离子色谱峰),从图 2中可以看出,两组之间有所重叠,但表现出明显的分离趋势。然后采用OPLS-DA对LC-Q/TOF-MS X变量(峰强度)和Y变量(分组信息)之间的相关关系进行分析。OPLS-DA模型的质量采用交叉验证法进行检验,并用交叉验证后得到的R2X、R2Y和Q2(分别代表LC-Q/TOF-MS数据可解释的变量、分组信息可解释的变量和模型的可预测度)对模型有效性进行评判。两组奶牛乳样OPLS-DA得分散点图见图 3,其中R2X为0.49,R2Y为0.828,说明用49% LC-Q/TOF-MS数据能完全反映两组之间的变量差异,而Q2为0.558,高于0.4,说明模型的可预测度较高。因此,由PCA和OPL-DA得分散点图结果可以看出,两组奶牛乳样代谢轮廓存在明显差异。
|
+ESI.正离子,-ESI.负离子 +ESI. Positive ion, -ESI. Negative ion 图 1 奶牛乳样代表性正离子(左)和负离子(右)LC-Q/TOF-MS色谱峰 Figure 1 Typical positive ion peak(left)and negative ion peak of LC-Q/TOF-MS from dairy cow milk |
|
A组.绿色圆圈; B组.蓝色正方形,图 3同 Group A.Green circle; Group B.Blue square.The same as Figure 3 图 2 两组奶牛乳样PCA得分散点图 Figure 2 PCA score scatter plot of milk from 2 groups of dairy cows |
|
图 3 两组奶牛乳样OPLS-DA得分散点图 Figure 3 OPLS-DA score scatter plot of milk from 2 groups of dairy cows |
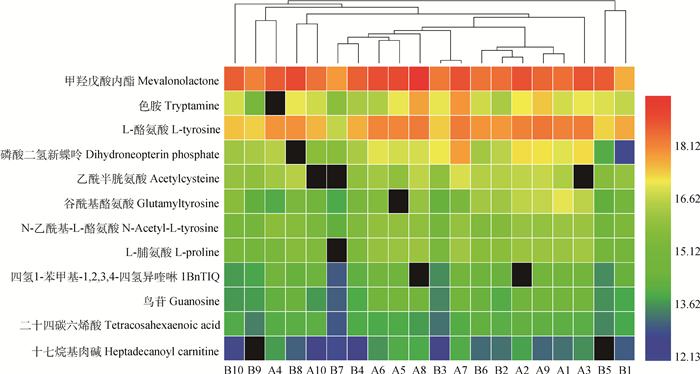
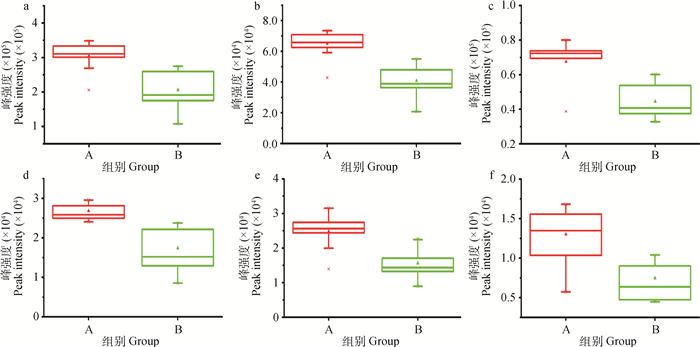
根据OPLS-DA的VIP值,12个代谢物作为候选差异代谢物(VIP>1)进行聚类分析,结果显示,这12个代谢物并不能将两组乳样完全分开(图 4)。因此采用非参数检验中的Kruskal-Wallis检验进一步对12个差异代谢物的差异性进行了验证,结果显示仅有10个代谢物的峰强度在两组乳样中有明显差异(P < 0.05),并且在B组乳样中均有不同程度的降低。这10个差异代谢物MS值、VIP值、P值、牛代谢组学数据库编号(BMDB ID)见表 2。采用ROC曲线进一步考察了这10个差异指标对分类的识别能力,ROC曲线下的面积(AUC)>0.5时,说明具有较好的识别能力,AUC越接近于1,即ROC曲线越靠近左上角,识别效果越好。本试验结果(图 5)显示,在这10个差异代谢物中,6个代谢物AUC面积在0.80以上,P < 0.05,说明这6个代谢物是识别两组奶牛乳样的主要指标。6个代谢物为四氢1-苯甲基-1, 2, 3, 4-四氢异喹啉(1BnTIQ)、N-乙酰基-L-酪氨酸(N-Acetyl-L-tyrosine)、L-酪氨酸(L-Tyrosine)、鸟苷(guanosine)、L-脯氨酸(L-proline)和十七烷基肉碱(heptadecanoyl carnitine)。两分类逻辑回归(binary logistic regression analysis,BLR)结果显示,这6个代谢物能准确识别两组奶牛乳样,识别率为100%。从6个差异代谢物峰强度(含量)的位置与分散情况(图 6)可以看出,6个代谢物含量在两组乳样中均发生了明显变化。而且在10个差异代谢物中,这6个差异代谢物的差异倍数均>其它4个差异代谢物(表 2)。
|
颜色由红变蓝表示代谢物的峰值由高变低,黑色表示峰值为0 The color changes from red to blue indicate the peak of the metabolites from high to low, and black indicate the peak value of 0 图 4 两组乳样代谢物(VIP>1)聚类分析热图 Figure 4 Heat map of cluster analysis for metabolites with VIP>1 between 2 groups |
|
|
表 2 差异代谢物VIP及Kruskal-Wallis检验结果 Table 2 VIP and Kruskal-Wallis test results of differentiated metabolites |

|
AUC.Area under curve 图 5 6个差异代谢物的ROC曲线 Figure 5 ROC curves of 6 differentiated metabolites between 2 groups |
|
a. L-酪氨酸;b. N-乙酰基-L-酪氨酸;c. L-脯氨酸;d.四氢1-苯甲基-1, 2, 3, 4-四氢异喹啉;e.鸟苷;f.十七烷基肉碱 a. L-tyrosine; b. N-Acetyl-L-tyrosine; c. L-proline; d.1BnTIQ; e. Guanosine; f. Heptadecanoyl carnitine 图 6 两组乳样中6个差异代谢物LC-Q/TOF-MS峰强度箱式图 Figure 6 BOX-charts of LC-Q/TOF-MS peak intensity of 6 differentiated metabolites between 2 groups |
L-酪氨酸(L-tyrosine)是必须氨基酸,可以通过血脑屏障而进入脑组织,它既是神经递质多巴胺、去甲肾上腺素和肾上腺素的前体,也是儿茶酚雌激素类、色素和褪黑素的前体[16]。而N-乙酰基-L-酪氨酸(N-Acetyl-L-tyrosine)是生成L-酪氨酸的前体[17-18]。有研究表明,酪氨酸可通过抑制大鼠血清孕酮的生成而终止早期妊娠[17]。本研究结果显示,奶牛乳样中L-酪氨酸和N-乙酰基-L-酪氨酸含量在妊娠识别阶段均显著降低,这一变化可能是由于机体为了保障妊娠的成功建立,应答性的降低了体内酪氨酸的含量。另外酪氨酸在体内可被迅速代谢,叶酸、维生素C和微量元素铜可促进酪氨酸的代谢[19-20]。因此,奶牛在妊娠前饲料中适当降低酪氨酸或N-乙酰基-L-酪氨酸含量,增加叶酸、维生素和铜的含量可能有助于妊娠的成功建立。
现已证明L-脯氨酸(L-proline)对猪和羊孕体的代谢、成长和发展具有非常重要的作用,脯氨酸是合成多胺(腐胺、亚精胺和精胺)的一种重要氨基酸,多胺是胎盘成长和血管生成必不可少的物质,胎盘通过脯氨酸氧化酶、鸟氨酸转氨酶和鸟氨酸脱羧酶将脯氨酸转化为多胺[21]。有研究报道,猪在妊娠20~40 d,脯氨酸氧化酶、鸟氨酸转氨酶和鸟氨酸脱羧酶活性、脯氨酸的转运、多巴胺的合成和多胺的浓度在胎盘组织显著增加[22]。本研究结果显示,人工授精后第17天奶牛乳汁中脯氨酸含量显著下降,可能是由于母体大量脯氨酸通过血液被转运到子宫组织合成多胺,以备胎盘的形成和发展之需,以致乳中脯氨酸的含量明显下降。但上述物质在妊娠奶牛子宫和胎盘组织中是否升高,还有待于进一步验证。
四氢1-苯甲基-1, 2, 3, 4-四氢异喹啉(1BnTIQ)是内源性胺类物质,它可以降低脑组织中多巴胺的含量[23]。大鼠在妊娠期,大量多巴胺被分泌进入垂体门脉,在妊娠20 d时,垂体门脉血浆多巴胺的含量高达20 ng·mL-1[24]。妊娠妇女在怀孕后期羊水多巴胺的含量会显著升高[25],另外伴有妊高症的孕妇血浆中多巴胺的浓度明显高于正常血压的孕妇[26]。但目前关于多巴胺对妊娠的生理机制尚不清楚。本结果显示,人工授精后第17天奶牛乳样中四氢1-苯甲基-1, 2, 3, 4-四氢异喹啉含量明显低于人工授精当天奶牛乳样,推测可能与母体血液和胎盘组织中多巴胺含量升高有关。
鸟苷(guanosine)磷酸化后可生成鸟苷一磷酸(GMP)、环磷酸鸟苷(CGM)和鸟苷二磷酸(GDP)。母体在妊娠初期会产生氧化应激[27],NO-CGMP信号通路上调子宫组织中NO和CGMP含量,雌激素能显著降低子宫组织中NO和CGMP的含量,相反孕酮能显著增加NO和CGMP的含量[28]。在怀孕初期奶牛必须持续分泌孕酮以维持正常妊娠,必然会导致子宫中NO和CGMP的含量较未怀孕前显著升高。本研究结果显示,奶牛乳汁鸟苷含量在妊娠识别阶段显著下降,可能与血液中大量鸟苷被转运到子宫组织生成CGMP有关。
十七烷基肉碱(heptadecanoyl carnitine)是一种酰基肉碱(acylcarnitine),目前研究发现体内酰基肉碱升高可能与脂肪酸β氧化和酮体生成异常有关[29],但另有研究发现健康妊娠妇女血液中总肉碱(包括自由肉碱和酰基肉碱)含量明显低于未怀孕妇女,且从怀孕12周~分娩持续呈现降低趋势[30],但其机制尚不清楚。本研究结果显示,人工授精第17天奶牛乳样中十七烷基肉碱含量明显低于人工授精前当天奶牛乳样,这可能与血液中总肉碱含量下降有关。
4 结论本试验采用具有较高分辨率和灵敏度的LC-Q/TOF-MS代谢组学技术对妊娠识别期奶牛乳样代谢物的变化趋势进行了研究,结合Kruskal-Wallis检验和ROC曲线筛选了6个生物标志物(L-酪氨酸、N-乙酰基-L-酪氨酸、L-脯氨酸、四氢1-苯甲基-1, 2, 3, 4-四氢异喹啉、鸟苷和十七烷基肉碱),这6个生物标志物均与妊娠存在着直接或间接的联系,有望成为奶牛妊娠识别期妊娠诊断的重要生化指标。
| [1] | LONERGAN P, FORDE N. The role of progesterone in maternal recognition of pregnancy in domestic ruminants[C]//GEISERT R D, BAZER F W. Regulation of Implantation and Establishment of Pregnancy in Mammals. Cham: Springer, 2015: 87-104. https: //link. springer. com/chapter/10. 1007%2F978-3-319-15856-3_6 |
| [2] | GARCIA-ISPIERTO I, LÓPEZ-HELGUERA I, SERRANO-PÉREZ B, et al. Progesterone supplementation during the time of pregnancy recognition after artificial insemination improves conception rates in high-producing dairy cows[J]. Theriogenology, 2016, 85(7): 1343–1347. DOI: 10.1016/j.theriogenology.2015.12.021 |
| [3] | SPENCER T E, BAZER F W. Conceptus signals for establishment and maintenance of pregnancy[J]. Reprod Biol Endocrinol, 2004, 2: 49. DOI: 10.1186/1477-7827-2-49 |
| [4] |
程蕾, 王定发, 刘晓华, 等. ISG15和OAS1在奶牛早期妊娠阶段外周血中的表达规律[J]. 畜牧兽医学报, 2015, 46(1): 77–84.
CHENG L, WANG D F, LIU X H, et al. Study on ISG15 and OAS1 transcriptions in peripheral blood of dairy cows during early pregnancy[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(1): 77–84. (in Chinese) |
| [5] | BOTT R C, ASHLEY R L, HENKES L E, et al. Uterine vein infusion of interferon tau (IFNT) extends luteal life span in ewes[J]. Biol Reprod, 2010, 82(4): 725–735. |
| [6] | NAKAO T, SUGIHASHI A, KAWATA K, et al. Milk progesterone levels in cows with normal or prolonged estrous cycles, referenced to an early pregnancy diagnosis[J]. Jpn J Vet Sci, 1983, 45(4): 495–499. |
| [7] | ZOLI A P, GUILBAULT L A, DELAHAUT P, et al. Radioimmunoassay of a bovine pregnancy-associated glycoprotein in serum:its application for pregnancy diagnosis[J]. Biol Reprod, 1992, 46(1): 83–92. |
| [8] | FRICKE P M. Scanning the future-ultrasonography as a reproductive management tool for dairy cattle[J]. J Dairy Sci, 2002, 85(8): 1918–1926. DOI: 10.3168/jds.S0022-0302(02)74268-9 |
| [9] | THATCHER W W, GUZELOGLU A, MATTOS R, et al. Uterine-conceptus interactions and reproductive failure in cattle[J]. Theriogenology, 2001, 56(9): 1435–1450. |
| [10] | BINELLI M, THATCHER W W, MATTOS R, et al. Antiluteolytic strategies to improve fertility in cattle[J]. Theriogenology, 2001, 56(9): 1451–1463. |
| [11] | BAZER F W, WU G Y, JOHNSON G A, et al. Environmental factors affecting pregnancy:endocrine disrupters, nutrients and metabolic pathways[J]. Mol Cell Endocrinol, 2014, 398(1-2): 53–68. |
| [12] | FRANCA M R, DA SILVA M I S, PUGLIESI G, et al. Evidence of endometrial amino acid metabolism and transport modulation by peri-ovulatory endocrine profiles driving uterine receptivity[J]. J Anim Sci Biotechnol, 2017, 8: 54. DOI: 10.1186/s40104-017-0185-1 |
| [13] | BELAZ K R A, TATA A, FRANCA M R, et al. Phospholipid profile and distribution in the receptive oviduct and uterus during early diestrus in cattle[J]. Biol Reprod, 2016, 95(6): 127. |
| [14] |
郭延生, 贾启鹏, 陶金忠. 基于GC-MS策略的奶牛热应激血液代谢组学研究[J]. 畜牧兽医学报, 2015, 46(8): 1356–1362.
GUO Y S, JIA Q P, TAO J Z. Blood metabolomic studies of heat stress cow with GC-MS[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(8): 1356–1362. (in Chinese) |
| [15] |
陶金忠, 郭延生. 奶牛产后血浆1H-NMR代谢组学分析[J]. 畜牧兽医学报, 2016, 47(1): 198–206.
TAO J Z, GUO Y S. Study on the plasma metabolism using 1H-NMR in postpartum cows[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(1): 198–206. (in Chinese) |
| [16] | CHAUBE R, JOY K P. In vitro effects of catecholamines and catecholestrogens on brain tyrosine hydroxylase activity and kinetics in the female catfish Heteropneustes fossilis[J]. J Neuroendocrinol, 2003, 15(3): 273–279. |
| [17] | MAGNUSSON I, EKMAN L, WÅNGDAHL M, et al. N-acetyl-L-tyrosine and N-acetyl-L-cysteine as tyrosine and cysteine precursors during intravenous infusion in humans[J]. Metabolism, 1989, 38(10): 957–961. |
| [18] | IM H A, MEYER P D, STEGINK L D. N-acetyl-L-tyrosine as a tyrosine source during total parenteral nutrition in adult rats[J]. Pediatr Res, 1985, 19(6): 514–518. DOI: 10.1203/00006450-198506000-00002 |
| [19] |
段红, 王乃功. 酪氨酸单用及合并RU486对小鼠生殖功能的影响及作用机理[J]. 药学学报, 1997, 32(8): 583–585.
DUAN H, WANG N G. Effects of tyrosine alone and tyrosine in combination with RU486 on early pregnancy in mice and the mechanism of action[J]. Acta Pharmaceutica Sinica, 1997, 32(8): 583–585. (in Chinese) |
| [20] | WU M C C, SEALOCK R R. Factors concerned in tyrosine metabolism[J]. Arch Biochem Biophys, 1953, 44(2): 312–319. |
| [21] | WU G, BAZER F W, DATTA S, et al. Proline metabolism in the conceptus:implications for fetal growth and development[J]. Amino Acids, 2008, 35(4): 691–702. DOI: 10.1007/s00726-008-0052-7 |
| [22] | WU G Y, BAZER F W, HU J B, et al. Polyamine synthesis from proline in the developing porcine placenta[J]. Biol Reprod, 2005, 72(4): 842–850. |
| [23] | KOTAKE Y. Tetrahydroisoquinoline derivatives as possible Parkinson's disease-inducing substances[J]. Yakugaku Zasshi, 2002, 122(11): 975–982. |
| [24] | BEN-JONATHAN N, OLIVER C, WEINER H J, et al. Dopamine in hypophysial portal plasma of the rat during the estrous cycle and throughout pregnancy[J]. Endocrinology, 1977, 100(2): 452–458. |
| [25] | PELEG D, MUNSICK R A, DIKER D, et al. Distribution of catecholamines between fetal and maternal compartments during human pregnancy with emphasis on L-dopa and dopamine[J]. J Clin Endocrinol Metab, 1986, 62(5): 911–914. |
| [26] | DAVEY D A, MACNAB M F. Plasma adrenaline, noradrenaline and dopamine in pregnancy hypertension[J]. Br J Obstet Gynaecol, 1981, 88(6): 611–618. |
| [27] | ŻELAŹNIEWICZ A, NOWAK J, PAWLOWSKI B. Woman's body symmetry and oxidative stress in the first trimester of pregnancy[J]. Am J Hum Biol, 2015, 27(6): 816–821. |
| [28] | YALLAMPALLI C, BYAM-SMITH M, NELSON S O, et al. Steroid hormones modulate the production of nitric oxide and cGMP in the rat uterus[J]. Endocrinology, 1994, 134(4): 1971–1974. |
| [29] | PIERRE G, MACDONALD A, GRAY G, et al. Prospective treatment in carnitine-acylcarnitine translocase deficiency[J]. J Inherit Metab Dis, 2007, 30(5): 815. |
| [30] | SCHODERBECK M, AUER B, LEGENSTEIN E, et al. Pregnancy-related changes of carnitine and acylcarnitine concentrations of plasma and erythrocytes[J]. J Perinat Med, 1995, 23(6): 477–485. |



