2. 湖南省兽药工程技术研究中心, 长沙 410128;
3. 华中农业大学动物科技学院, 武汉 430070
2. Hunan Engineering Research Center of Veterinary Drug, Changsha 410128, China;
3. College of Animal Science and Technology, Huazhong Agricultural University, Wuhan 430070, China
哺乳动物的卵泡发育是由体内各种生长因子、垂体促性腺激素和类固醇激素共同调节的一个连续而复杂的生理过程[1-2]。在卵泡发育过程中,颗粒细胞分泌抑制素(inhibin, INH)、雌二醇(estradiol, E2)和胰岛素样生长因子(insulin-like growth factor, IGF)等细胞因子,影响卵母细胞成熟和卵泡发育[3-4]。INH是由α和β亚基组成的异二聚体糖蛋白,属于转化生长因子β(transforming growth factor beta,TGFβ)超家族成员之一,通过自分泌或旁分泌的方式调控颗粒细胞增殖、类固醇激素产生及卵母细胞成熟,参与卵泡发育[5-7]。INHβ能诱导体外培养猪颗粒细胞凋亡,甚至在猪的卵泡发育过程中上调卵泡闭锁率[8]。合成的抑制素α(1~32)片段在牛颗粒细胞中能抑制细胞增殖,诱导细胞凋亡[9]。
CpG寡脱氧核苷酸(CpG-ODN)是含有非甲基化胞嘧啶-磷酸-鸟嘌呤基序的短单链合成DNA分子,是一种能诱导或增强各类免疫应答的免疫调节剂[10-12]。研究表明,CpG-ODN具有免疫刺激活性,能诱导Ⅰ型免疫应答,随后激活机体的细胞和体液免疫[13]。激活人体细胞的最佳CpG-ODN基序是5′-GTCGTT-3′,而对小鼠细胞具有活化作用的最佳CpG-ODN基序是5′-GACGTT-3′[14]。Yeh等[15]研究发现,合成的CpG-ODN能有效激活人和小鼠TLR9介导的NF-κB和细胞因子,并产生相应的免疫应激。含CpG-ODN的疫苗可介导细胞增殖,干扰启动子活性和免疫基因的表达,进而产生较强的免疫刺激,显著增加动物体内IgM和抗病毒分子Mx2的含量[16]。
尽管CpG-ODN作为佐剂已表现出提高动物免疫力的能力,但CpG-ODN是否影响哺乳动物卵泡发育尚无报道。已有研究表明,INH可抑制猪颗粒细胞生长发育,主要表现为诱导细胞凋亡,影响类固醇激素生成,进而影响卵泡发育过程[8]。在Geng等[9]研究基础上,本研究设计并合成了对小鼠细胞具有免疫刺激活性的CpG-ODN基序,构建含免疫基序CpG-ODN片段和抑制素α(1~32)片段的重组抑制素质粒pEGISI-CpG-ODN,并转染原代培养的小鼠卵巢颗粒细胞,通过qRT-PCR法检测细胞中死亡受体通路相关基因mRNA表达水平的变化,以探讨CpG-ODN能否拮抗抑制素对颗粒细胞发育的抑制作用,为降低颗粒细胞凋亡和促进卵泡发育提供新思路。
1 材料与方法 1.1 材料 1.1.1 试验动物21~23日龄雌性ICR小鼠购于湖南斯莱克景达实验动物有限公司。
1.1.2 菌种及生化试剂抑制素质粒pEGISI(含绿色荧光蛋白(GFP)、乙肝表面抗原(HBsAg)S基因及抑制素(INH)基因)由曹少先等[17]构建,本实验室保存;T4 DNA连接酶、限制性内切酶Xho Ⅰ、Hind Ⅲ、LiopfectamineTM 2000、Opti-MEM培养基(Thermo scientific,美国);无内毒素质粒提取试剂盒、柱式RNA提取试剂盒(天恩泽,北京);PrimeScriptTM RT reagent Kit、SYBR® Premix Ex TaqTM(TaKaRa,日本);DME/F-12培养基(Hyclone,美国)。
1.2 方法 1.2.1 CpG-ODN片段的设计与合成选择对小鼠细胞具有激活作用的CpG基序:5′-GACGTT-3′,根据设计原则设计具有免疫作用的CpG-ODN片段,由华大基因技术有限公司合成(划线部分为限制性内切酶XhoⅠ和Hind Ⅲ的酶切位点及其保护性碱基)。
正链:5′-CTCGAGCGGCACGTTGACGTTCACG-TTGACGTTCACGTTGACGTTCACGTTGACGTTCCCAAGCTTGGG-3′。
1.2.2 重组抑制素质粒pEGISI-CpG-ODN的构建及鉴定将带有酶切位点的CpG-ODN片段和pEGISI质粒分别用XhoⅠ和HindⅢ限制性内切酶进行双酶切,然后用T4 DNA连接酶于4 ℃连接过夜,连接产物转化到感受态细胞E.coli DH5α中,将冰浴好的混合物放入42 ℃水浴90 s,再冰浴2~3 min,混合物置于700 μL无抗性LB培养基中,37 ℃摇床培养45 min,然后取100 μL均匀地涂布于含有Kana抗生素的LB固体平板上,平板于37 ℃恒温箱中倒置培养过夜。质粒进行单菌落筛选,上游引物:5′-CGCAATGGGCGGTAGGCGTG-3′,下游引物:5′-CCCAAGCTTGGGAACGTCAACGT-3′。用Taq DNA聚合酶进行扩增:94 ℃预变性4 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸10 s,共35个循环。
1.2.3 小鼠卵巢颗粒细胞的分离与培养取21~23日龄雌性ICR小鼠5只,用乙醚麻醉小鼠后,迅速将其颈椎脱臼处死。小鼠腹部用75%的酒精棉球进行擦拭消毒。于无菌环境中迅速取出双侧卵巢,体式显微镜下去除多余的输卵管、脂肪及其它组织。用预热的PBS冲洗卵巢3遍,4号针头刺破卵泡,释放出颗粒细胞及卵母细胞。加入1 mL完全培养基(DME/F-12+15%FBS+1%青链霉素)进行吹打,用40 μm的过滤器过滤细胞悬液,以分离卵母细胞,得到的细胞悬液于1 000 r·min-1离心5 min,弃上清,获得细胞沉淀。颗粒细胞以1×106·mL-1密度铺板于细胞培养瓶中,于37 ℃、5% CO2细胞培养箱中培养。
1.2.4 质粒转染颗粒细胞以2×106·孔-1密度铺板于6孔板中,当细胞融合率达到80%左右进行转染,转染前24 h,更换为无双抗培养基(DME/F-12+15%FBS)。试验分为3组:pEGFP质粒转染组为空载体组,抑制素重组质粒pEGISI转染组为对照组,含CpG-ODN基序的重组抑制素质粒pEGISI-CpG-ODN转染组为试验组,每组设3个重复。用脂质体LipfectamineTM2000进行转染。分别用47和44 μL Opti-MEM培养液稀释DNA(3 μg)和LipofectamineTM 2000(6 μL),室温静置5 min后,将两者混合至体积为100 μL·孔-1,室温静置20 min,呈点滴状添加到6孔板内,5 h后更换细胞培养液,转染48 h收集细胞,进行qRT-PCR检测。
1.2.5 细胞中总RNA的提取及反转录根据柱式RNA提取试剂盒中说明书操作,每孔加入500 μL Trizol溶液提取细胞中的总RNA。通过OD260 nm/OD280 nm的比值和琼脂糖凝胶电泳来分析所提取RNA的质量及完整性。用PrimerScriptTM RT reagent Kit with gDNA Eraser反转录总RNA得到模板cDNA,将cDNA作为模板进行qRT-PCR检测。
1.2.6 qRT-PCR检测相关凋亡基因mRNA的表达用荧光定量PCR仪(ABI Step One)检测死亡因子受体(Fas)/死亡因子Fas配体(FasL)和死亡因子受体(DR4/5)/死亡因子DR4/5配体(TRAIL)通路中相关基因的表达。qRT-PCR反应体系:2×SYBR Premix Ex Taq 5 μL,上下游引物(10 μmol·L-1)各0.2 μL,50×ROX Reference Dye 0.2 μL,cDNA模板1 μL,ddH2O 3.4 μL,总体积10 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。所有操作过程均在冰上完成。以β-actin作为内参基因,并用2-△△CT法分析试验结果。qRT-PCR引物见表 1。
|
|
表 1 qRT-PCR引物序列 Table 1 Primer sequences used for qRT-PCR |
数据以“平均值±标准差”表示。用SPSS 17.0的单因素方差分析法(One-way ANOVA)分析试验数据,** P < 0.01表示差异极显著,*P < 0.05表示差异显著。
2 结果 2.1 重组抑制素质粒pEGISI-CpG-ODN的鉴定 2.1.1 扩增CpG-ODN片段重组抑制素质粒pEGISI-CpG-ODN经单菌落筛选,用普通PCR进行扩增,1.2%琼脂糖凝胶电泳图显示, 在100 bp左右出现目的片段,与扩增CpG-ODN片段的引物大小相符合(图 1)。以pEGISI-CpG-ODN质粒为模板,进行PCR扩增,电泳结果显示, 在100 bp左右出现明显条带(图 1)。
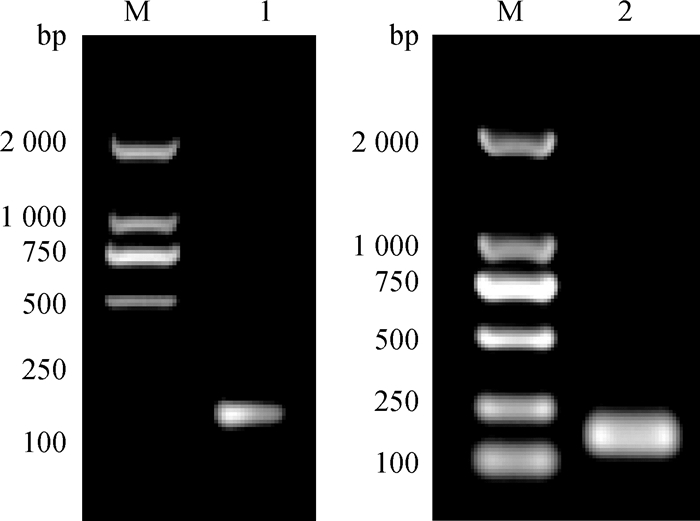
|
M. DL2000 DNA相对分子质量标准;1. pEGISI-CpG-ODN单菌落PCR扩增产物;2. CpG-ODN PCR扩增产物 M.DL2000 DNA marker; 1. PCR amplification product of pEGISI-CpG-ODN single colony; 2. PCR amplification product of CpG-ODN 图 1 PCR扩增结果 Figure 1 The result of PCR amplification |
将pEGISI-CpG-ODN菌落条带正确的单菌落进行扩菌,并用无内毒素质粒提取试剂盒进行质粒小提,质粒送华大基因公司进行测序。测序结果表明,含免疫片段的CpG-ODN核苷酸序列正确插入到pEGISI质粒中,证明重组抑制素质粒pEGISI-CpG-ODN构建成功(图 2)。
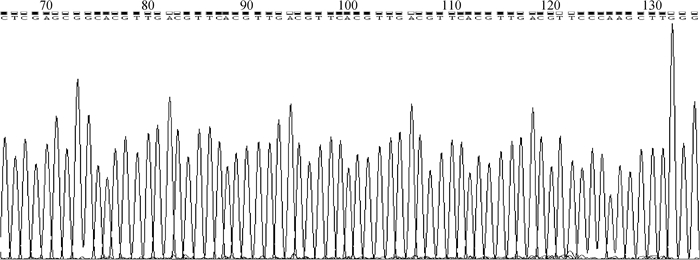
|
图 2 pEGISI-CpG-ODN质粒测序结果 Figure 2 The sequencing result of pEGISI-CpG-ODN plasmid |
3种质粒(pEGFP、pEGISI和pEGISI-CpG-ODN)转染颗粒细胞48 h,荧光显微镜观察各孔细胞中绿色荧光蛋白(EGFP)的荧光强度和转染数目(图 3),各组转染效率为60%左右。

|
A. pEGFP; B. pEGISI; C. pEGISI-CpG-ODN 图 3 荧光显微镜检测质粒在颗粒细胞中的表达情况(10×10) Figure 3 The expression of plasmids in granulosa cells detected by fluorescence microscopy (10×10) |
3种质粒(pEGFP、pEGISI和pEGISI-CpG-ODN)转染颗粒细胞48 h后收集细胞,根据RNA提取试剂盒说明书进行细胞中总RNA的提取,微量紫外可见分光光度计测定OD260 nm/OD280 nm比值均为1.8~2.0。1.2%琼脂糖电泳鉴定RNA的完整性。28 S、18 S和5 S条带清晰可见,表明所提总RNA质量良好,可用于后续研究(图 4)。
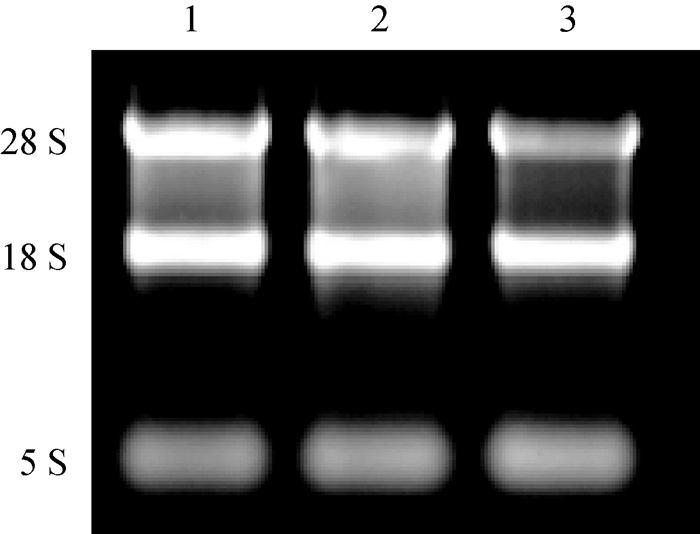
|
1.pEGFP;2. pEGISI;3. pEGISI-CpG-ODN 图 4 小鼠颗粒细胞总RNA琼脂糖凝胶电泳图 Figure 4 Results of the agarose gel electrophoresis of total RNA in mice GCs |
3种质粒(pEGFP、pEGISI和pEGISI-CpG-ODN)转染颗粒细胞48 h后收集细胞,采用qRT-PCR法检测CpG在各组细胞中的表达量。结果表明,与pEGFP组和pEGISI组相比,含CpG-ODN基序的pEGISI-CpG-ODN组中CpG mRNA的表达量极显著升高(P < 0.01)(图 5)。
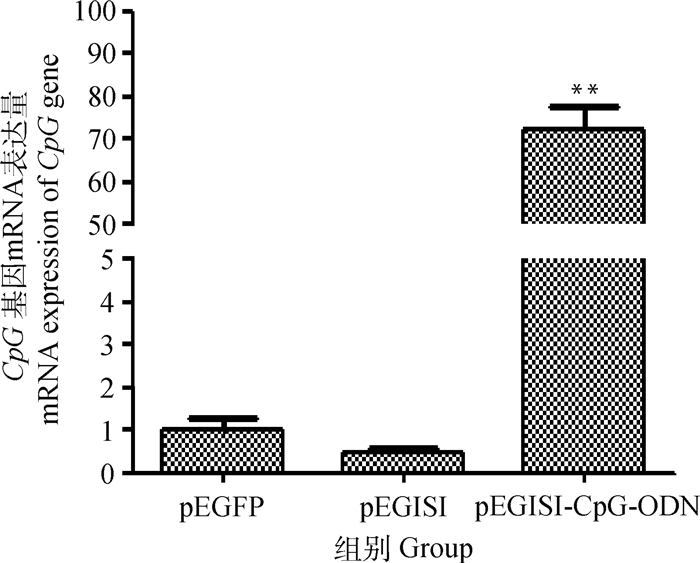
|
组间比较:*. P < 0.05; **. P < 0.01。下同 Comparison among groups:*. P < 0.05; **. P < 0.01.The same as below 图 5 质粒转染颗粒细胞后CpG mRNA的表达 Figure 5 The expression of CpG mRNA in the mouse granulosa cells after plasmid transfection |
3种质粒(pEGFP、pEGISI和pEGISI-CpG-ODN)转染颗粒细胞48 h后收集细胞,用qRT-PCR法检测Fas/FasL通路中关键基因在各组细胞中的含量。结果表明,与pEGFP组相比,pEGISI组中颗粒细胞促凋亡基因Fas的mRNA水平显著上升(P < 0.05),促凋亡基因FasL、Caspase8和Caspase3的mRNA水平极显著上升(P < 0.01);与pEGISI组相比,pEGISI-CpG-ODN组中颗粒细胞促凋亡基因Fas、FasL、Caspase8和Caspase3 mRNA的水平极显著下降(P < 0.01)(图 6A)。

|
图 6 小鼠颗粒细胞转染后凋亡基因mRNA的表达 Figure 6 The mRNA expression levels of apoptotic genes in mouse granulosa cells after transfection plasmid |
3种质粒(pEGFP、pEGISI和pEGISI-CpG-ODN)转染小鼠颗粒细胞48 h后收集细胞,用qRT-PCR法检测DR4/5/TRAIL通路中关键基因在各组细胞中的表达量。研究结果表明,与pEGFP组相比,pEGISI组中颗粒细胞促凋亡基因TRAIL的相对表达量显著降低(P < 0.05);与pEGISI组相比,pEGISI-CpG-ODN组中颗粒细胞促凋亡基因DR4/5、TRAIL的相对表达量极显著降低(P < 0.01)(图 6B)。
3 讨论在雌性动物中,INHα亚基基因主要存在于卵泡颗粒细胞中,其功能是负反馈抑制垂体促卵泡激素(follicle stimulating hormone, FSH)的合成与分泌,拮抗激活素的活化作用,影响卵泡发育[18-19]。用含INHα(1~32)片段的重组质粒(pVAX-asd-IS)免疫小鼠,结果表明,重组抑制素蛋白具有免疫功能,并可在动物体内稳定复制40代[20]。Geng等[9]用过表达INHα(1~32)亚基的融合表达质粒(pEGISI)转染牛颗粒细胞,在48和96 h处均能显著抑制颗粒细胞增殖,细胞凋亡率极显著上升,但48和96 h无显著差异。另有研究表明,用抗INHα亚基抗体处理猪颗粒细胞,24 h后细胞增殖无明显变化,但在处理后48 h能极显著促进细胞增殖[21],表明用外源因子处理颗粒细胞48 h可能是影响细胞生长的最适时间点。
本研究结果表明,用含INHα(1~32)片段的抑制素质粒(pEGISI)转染小鼠颗粒细胞48 h后,细胞中促凋亡基因FasL、Caspase8和Caspase3的表达量极显著高于pEGFP组(P < 0.01),与上述报道一致。据报道,除Fas/FasL死亡受体通路外,肿瘤坏死因子中DR4/5死亡受体与其配体TRAIL结合能也诱导细胞凋亡[22],但其配体TRAIL不直接诱导细胞死亡,而是通过激活Caspase8的活性启动下游凋亡基因的功能,进而诱发细胞凋亡[23]。
目前尚没有关于INHα亚基是否通过影响DR4/5/TRAIL死亡受体通路中基因表达诱导细胞凋亡的报道。本研究表明,pEGISI质粒转染颗粒细胞48 h后,DR4/5和TRAIL基因的表达量较pEGFP组出现降低趋势,可能受颗粒细胞发育阶段不同或种属原因影响,但其具体机制还需深入研究。综上,在颗粒细胞中过表达INHα亚基能增强内源性抑制素对颗粒细胞的抑制作用,引起细胞中死亡受体通路相关基因的表达量显著升高(P < 0.05),进而诱导细胞凋亡。CpG-ODN是近年来发现的一种新型免疫佐剂,可激活先天性免疫反应和适应性免疫反应[24],已在许多动物模型中表现出抗病毒、细菌、寄生虫感染和增强抗肿瘤免疫应答等功效[25-28]。Yu等[29]用脂多糖(LPS)与CpG-ODN结合,发现结合CpG-ODN的LPS能显著降低小鼠B细胞促凋亡基因CASP4、CASP9和Dapk1的表达情况,且上调抗凋亡基因IL-10的表达。另有研究报道,CpG-ODN与药物结合后经腹腔注射治疗脑损伤C57BL/6模型小鼠,能增加抗凋亡基因Bcl-2的水平,并减弱缺血脑组织中Bax和Caspase3的活性[30]。为进一步探讨体外试验中CpG-ODN与抑制素质粒DNA结合是否会对颗粒细胞凋亡产生调节作用,本研究以pEGISI质粒为表达载体,成功构建了含CpG-ODN的重组抑制素质粒pEGISI-CpG-ODN,且qRT-PCR结果表明,pEGISI-CpG-ODN组中CpG mRNA的含量显著高于pEGFP组和pEGISI组(P < 0.01)。同时,本研究通过检测Fas/FasL和DR4/5/TRAIL两条死亡受体通路中关键基因mRNA的表达水平,对重组抑制素质粒pEGISI-CpG-ODN的作用效果进行初步评估。结果显示,pEGISI-CpG-ODN组与pEGISI组相比能极显著下调颗粒细胞中Fas/FasL和DR4/5/TRAIL死亡受体通路中关键基因(Fas、FasL、DR4/5、TRAIL、Caspase8和Caspase3)mRNA的表达水平(P < 0.01)。因此,本研究证实了CpG-ODN与pEGISI质粒融合能降低抑制素对小鼠卵巢颗粒细胞中促凋亡基因mRNA的表达水平,进而抑制细胞凋亡。
4 结论本研究成功构建了含CpG-ODN免疫基序的重组抑制素质粒pEGISI-CpG-ODN,并转染至原代培养的小鼠卵巢颗粒细胞中,表明CpG-ODN能一定程度上减弱外/内源性抑制素对颗粒细胞凋亡的促进作用,下调细胞中促凋亡基因mRNA的表达,进而影响卵泡发育。
| [1] | GILCHRIST R B. Recent insights into oocyte-follicle cell interactions provide opportunities for the development of new approaches to in vitro maturation[J]. Reprod Fertil Dev, 2011, 23(1): 23–31. DOI: 10.1071/RD10225 |
| [2] | KOMATSU K, MASUBUCHI S. Observation of the dynamics of follicular development in the ovary[J]. Reprod Med Biol, 2017, 16(1): 21–27. DOI: 10.1002/rmb2.12010 |
| [3] | MATSUDA F, INOUE N, MANABE N, et al. Follicular growth and atresia in mammalian ovaries:Regulation by survival and death of granulosa cells[J]. J Reprod Dev, 2012, 58(1): 44–50. DOI: 10.1262/jrd.2011-012 |
| [4] | GAO F, ZHANG J, WANG X N, et al. Wt1 functions in ovarian follicle development by regulating granulosa cell differentiation[J]. Hum Mol Genet, 2014, 23(2): 333–341. DOI: 10.1093/hmg/ddt423 |
| [5] | STENVERS K L, FINDLAY J K. Inhibins:From reproductive hormones to tumor suppressors[J]. Trends Endocrinol Metab, 2010, 21(3): 174–180. DOI: 10.1016/j.tem.2009.11.009 |
| [6] | BILEZIKJIAN L M, JUSTICE N J, BLACKLER A N, et al. Cell-type specific modulation of pituitary cells by activin, inhibin and follistatin[J]. Mol Cell Endocrinol, 2012, 359(1-2): 43–52. DOI: 10.1016/j.mce.2012.01.025 |
| [7] | LEI M M, CAI L P, LI H, et al. Transcriptome sequencing analysis of porcine granulosa cells treated with an anti-inhibin antibody[J]. Reprod Biol, 2017, 17(1): 79–88. DOI: 10.1016/j.repbio.2017.01.002 |
| [8] | TU F, PAN Z X, YAO Y, et al. miR-34a targets the inhibin beta B gene, promoting granulosa cell apoptosis in the porcine ovary[J]. Genet Mol Res, 2014, 13(2): 2504–2512. DOI: 10.4238/2014.January.14.6 |
| [9] | GENG L Y, FANG M, YI J M, et al. Effect of overexpression of inhibin α(1-32) fragment on bovine granulosa cell proliferation, apoptosis, steroidogenesis, and development of co-cultured oocytes[J]. Theriogenology, 2008, 70(1): 35–43. DOI: 10.1016/j.theriogenology.2008.02.013 |
| [10] | SCHEIERMANN J, KLINMAN D M. Clinical evaluation of CpG oligonucleotides as adjuvants for vaccines targeting infectious diseases and cancer[J]. Vaccine, 2014, 32(48): 6377–6389. DOI: 10.1016/j.vaccine.2014.06.065 |
| [11] | SUN R, YUE F, QIU L M, et al. The CpG ODNs enriched diets enhance the immuno-protection efficiency and growth rate of Chinese mitten crab, Eriocheir sinensis[J]. Fish Shellfish Immunol, 2013, 35(1): 154–160. DOI: 10.1016/j.fsi.2013.04.015 |
| [12] | URSU R, CARPENTIER A F. Immunotherapeutic approach with oligodeoxynucleotides containing CpG motifs (CpG-ODN) in malignant glioma[C]//YAMANAKA R. Glioma. New York: Springer, 2012: 95-108. https://rd.springer.com/chapter/10.1007/978-1-4614-3146-6_8 |
| [13] | FLAMINIO M J B F, BORGES A S, NYDAM D V, et al. The effect of CpG-ODN on antigen presenting cells of the foal[J]. J Immune Based Ther Vaccines, 2007, 5: 1. DOI: 10.1186/1476-8518-5-1 |
| [14] | HARTMANN G, WEERATNA R D, BALLAS Z K, et al. Delineation of a CpG phosphorothioate oligodeoxynucleotide for activating primate immune responses in vitro and in vivo[J]. J Immunol, 2000, 164(3): 1617–1624. DOI: 10.4049/jimmunol.164.3.1617 |
| [15] | YEH D W, LAI C Y, LIU Y L, et al. CpG-oligodeoxynucleotides developed for grouper toll-like receptor (TLR) 21s effectively activate mouse and human TLR9s mediated immune responses[J]. Sci Rep, 2017, 7(1): 17297. DOI: 10.1038/s41598-017-17609-2 |
| [16] | SU H, LIAO Z W, YUAN G L, et al. A plasmid containing CpG-ODN as vaccine adjuvant against grass carp reovirus in grass carp Ctenopharyngodon idella[J]. Oncotarget, 2017, 8(49): 86576–86591. |
| [17] |
曹少先, 茆达干, 舒邓群, 等. 卵泡抑制素与GFP融合基因疫苗pEGISI的构建及表达[J]. 家畜生态学报, 2007, 28(2): 9–12.
CAO S X, MAO D G, SHU D Q, et al. Construction and expression of inhibin DNA vaccine pEGISI in 293T cell[J]. Acta Ecologiae Animalis Domastici, 2007, 28(2): 9–12. (in Chinese) |
| [18] | MELDI K M, GACONNET G A, MAYO K E. DNA methylation and histone modifications are associated with repression of the inhibin α promoter in the rat corpus luteum[J]. Endocrinology, 2012, 153(10): 4905–4917. DOI: 10.1210/en.2012-1292 |
| [19] | KEMPISTY B, PIOTROWSKA H, RYBSKA M, et al. Expression of INHβA and INHβB proteins in porcine oocytes cultured in vitro is dependent on the follicle size[J]. Zygote, 2015, 23(2): 205–211. DOI: 10.1017/S0967199413000439 |
| [20] | HAN L, ZHEN Y H, LIANG A X, et al. Oral vaccination with inhibin DNA delivered using attenuated Salmonella choleraesuis for improving reproductive traits in mice[J]. J Basic Microbiol, 2014, 54(9): 962–968. DOI: 10.1002/jobm.v54.9 |
| [21] | CAI L P, SUN A D, LI H, et al. Molecular mechanisms of enhancing porcine granulosa cell proliferation and function by treatment in vitro with anti-inhibin alpha subunit antibody[J]. Reprod Biol Endocrinol, 2015, 13: 26. DOI: 10.1186/s12958-015-0022-3 |
| [22] | FOSSATI S, GHISO J, ROSTAGNO A. TRAIL death receptors DR4 and DR5 mediate cerebral microvascular endothelial cell apoptosis induced by oligomeric Alzheimer's Aβ[J]. Cell Death Dis, 2012, 3(6): e321. DOI: 10.1038/cddis.2012.55 |
| [23] | VAN RAAM B J, LACINA T, LINDEMANN R K, et al. Secretory stressors induce intracellular death receptor accumulation to control apoptosis[J]. Cell Death Dis, 2017, 8(10): e3069. DOI: 10.1038/cddis.2017.466 |
| [24] | SANJAYA A, ELDER J R, SHAH D H. Identification of new CpG oligodeoxynucleotide motifs that induce expression of interleukin-1β and nitric oxide in avian macrophages[J]. Vet Immunol Immunopathol, 2017, 192: 1–7. DOI: 10.1016/j.vetimm.2017.08.005 |
| [25] | YUAN F, CHU Y, QI L H, et al. Immunoprotection induced by CpG-ODN/Poly(I:C) combined with recombinant gp90 protein in chickens against reticuloendotheliosis virus infection[J]. Antiviral Res, 2017, 147: 1–10. DOI: 10.1016/j.antiviral.2017.04.019 |
| [26] | STACEY K J, BLACKWELL J M. Immunostimulatory DNA as an adjuvant in vaccination against Leishmania major[J]. Infect Immun, 1999, 67(8): 3719–3726. |
| [27] | MOLDOVEANU Z, LOVE-HOMAN L, HUANG W Q, et al. CpG DNA, a novel immune enhancer for systemic and mucosal immunization with influenza virus[J]. Vaccine, 1998, 16(11-12): 1216–1224. DOI: 10.1016/S0264-410X(98)80122-9 |
| [28] | ZHANG W D, AN M, XI J C, et al. Targeting CpG adjuvant to lymph node via dextran conjugate enhances antitumor immunotherapy[J]. Bioconjug Chem, 2017, 28(7): 1993–2000. DOI: 10.1021/acs.bioconjchem.7b00313 |
| [29] | YU X Q, WANG Y H, LIN J, et al. Lipopolysaccharides-induced suppression of innate-like B cell apoptosis is enhanced by CpG oligodeoxynucleotide and requires toll-like receptors 2 and 4[J]. PLoS One, 2016, 11(11): e0165862. DOI: 10.1371/journal.pone.0165862 |
| [30] | LU C, HA T Z, WANG X H, et al. The TLR9 ligand, CpG-ODN, induces protection against cerebral ischemia/reperfusion injury via activation of PI3K/Akt signaling[J]. J Am Heart Assoc, 2014, 3(2): e000629. DOI: 10.1161/JAHA.113.000629 |



