2. 内蒙古自治区综合疾病预防控制中心, 呼和浩特 010030
2. Inner Mongolia Center for Disease Comprehensive Control and Prevention, Hohhot 010030, China
肌钙蛋白(troponin, Tn)是横纹肌上的结构蛋白,位于肌原纤维的细丝中[1],同时也是与心肌和骨骼肌收缩相关的调节蛋白。肌钙蛋白主要由肌钙蛋白C(troponin C,TnC)、肌钙蛋白Ⅰ(troponin Ⅰ,TnI)和肌钙蛋白T(troponin T,TnT)3种不同的亚型组成。其中肌钙蛋白C(Tnc)是肌钙蛋白的钙离子结合组分[2]。研究表明,肌钙蛋白C对应有两种蛋白异构型,即慢肌和心肌肌钙蛋白C(cardiac and slow skeletal troponin C, cTnC)和快肌肌钙蛋白[3]。两种肌钙蛋白异构型由两种不同的基因编码,其中,cTnC是由TNNC1基因编码,可以在骨骼肌和心肌中特定表达;快肌肌钙蛋白C是由TNNC2基因编码,能在骨骼肌中进行表达[4]。在脊椎动物中两种亚型的肌钙蛋白的区别在于:TNNC2被钙离子激活于N-末端的低亲和力钙离子结合位点Ⅰ和Ⅱ,而TNNC1仅结合在低亲和力的钙离子结合位点Ⅱ[5]。
肌球蛋白轻链2(myosin light chain 2,MYL-2)是肌球蛋白轻链家族中的一员,为调节性轻链,对肌纤维的活性有调控作用[6],进而影响肌球蛋白重链上ATP酶的活性,使肌纤维的类型发生转化[7-8],影响肌肉的生长。研究者们对该基因及其蛋白的表达研究主要集中在心肌组织中。研究发现,MYL-2的突变和过量表达可导致人的心肌增生[9-10],慢性心脏病患者的MYL-2表达量显著低于正常人,而严重心脏病患者该基因的表达量显著低于慢性心脏病患者[11]。成年人心肌中MYL-2的磷酸化可引起心肌扩张[12],并与心肌扭曲等多种心脏疾病有关[13]。从而认为该基因主要对心肌细胞的正常维系有重要作用。另有研究发现,MYL-2基因在成熟的小鼠骨骼肌中表达,而在体外培养的C2C12成肌细胞分化过程中不表达[14-15]。将小鼠心肌和骨骼肌中该基因敲除后,小鼠在胚胎期或初生期的生长出现严重异常,甚至有致命性的表现[16-17]。MYL-2在小鼠Ⅱ型肌纤维完整性的维持、细胞结构、细胞粘着、细胞迁移和分裂过程中起着重要作用[18]。因此认为,MYL-2可能在哺乳动物心肌和骨骼肌的生长和发育过程中发挥重要的功能。
显然TNCC1和MYL-2基因在慢肌和心肌的发育中起到了关键作用。马作为运动性较强的动物,肌肉的发育尤为关键,尤其蒙古马作为耐力性能较强的马种, 慢肌的作用显得更为重要。但到目前为止,对以上两种基因的研究主要集中在人和小鼠中,在家畜上的研究非常少,尤其在马上还未见报道。
经过长期的自然选择和人工选育,赋予了马很多运动潜质,在全球700多个马种[19]中即有速度型马种也有耐力型马种。蒙古马毋庸置疑是世界上长距离连续奔跑耐力最强的马种[20],这种特质可能是在13世纪行军打仗、长途跋涉过程中形成的。虽然具有较好的遗传潜质,但蒙古马在赛前还是需要合理的训练才能取得优异的成绩。说明训练对蒙古马耐力的形成有重要的作用。近些年运动马的研究多集中于纯血马[21]。对马匹速度的形成和相关基因的调控机制已越来越清晰。但对马匹耐力形成的分子机制知之甚少,只见在阿拉伯马上有相关的研究[22]。尤其对蒙古马超强耐力特性形成的分子机制的研究更不多见。本实验室前期进行了蒙古马高负荷运动训练前后的转录组差异表达分析[23]。本试验试图通过蒙古马长期高负荷运动训练模拟耐力训练,比较运动前后与肌肉发育相关的基因在不同水平上的表达变化。试图为今后马的耐力训练提供科学的参考数据。
1 材料与方法 1.1 试验材料试剂耗材:TRIzol试剂、RNA反转录试剂盒(TaKaRa)、SYBR Premix Ex TaqⅡ定量试剂盒(TaKaRa)、BCA蛋白浓度测定试剂盒(Cwbiotech公司)、兔多克隆GAPDH抗体(Abcam)、兔单克隆MYL-2抗体(Abcam)、兔多克隆TNNC1抗体(Abcam)、羊抗兔IgG-HRP(Jackson公司)、羊抗鼠IgG-HRP(Jackson公司)。
仪器设备:实时荧光定量PCR仪(Agilent Technologies Stratagene Mx3000P)、酶标仪(Thermo NANODROP 2000c)、WB转膜仪(J-MAX,ST-2)。
1.2 马匹训练与肌肉样品采集选择3匹5岁雌性蒙古马作为试验动物,在长期高负荷运动训练前,将马匹保定并注射局部麻醉剂,从臀中肌采取试验所需肌肉样品(30 g),肌肉组织离体后,迅速用蒸馏水反复冲洗并剪成黄豆颗粒大小的块状,立即放入液氮预冷的无RNase Ep-pendorf管中。投入液氮冷冻,带回实验室后转移至-80 ℃冰箱中保存,用于后续试验。
待休息1周后开始为期4个月的高负荷运动训练,试验用马的运动在一个直径为30 m,周长约100 m的圆形调教圈中进行。为避免高负荷运动训练对马造成损伤,运动方案将4个月按照天数分为3个阶段,每阶段又分为若干周期,循序渐进地加强运动强度,让马慢慢适应逐渐增强的负荷。
第一阶段(第1~15天):该阶段持续15 d,每5 d为1个周期,起始运动距离为8 km,每个周期中前4 d每日运动距离以2 km递增,即第二天10 km,第三天12 km,第四天14 km,第五天休息,下一周期起始距离回到8 km,如此循环。将奔跑速度控制在20 s每圈,即大约每100 m用时20 s。此阶段内主要目的是进行体能适应性强度运动,使肌腱、韧带和骨骼得到强化,帮助马匹适应后面高强度运动时的压力。
第二阶段(第16~108天):该阶段持续92 d,也是高负荷运动训练方案的主体部分。每4 d为1个周期,起始距离为15 km,每个周期中前3 d每日运动距离以5 km递增,即第二天20 km,第三天25 km,第四天休息。如此循环,将速度控制在18~20 s每圈,即每100米用时18~20 s。此阶段运动程序是为了使肌肉有氧适应性最大化,距离逐步增加,并及时下降回归,让训练马匹得到休息。使肌肉、心和肺等器官能够适应递增的高强度运动。
第三阶段(第109~122天):在运动期最后的两周里,要尽可能延长运动时间和距离,运动起始距离为20 km,每日以10 km递增,即第二天30 km,第三天40 km,第四天50 km,第五、六天休息,同时提高日粮中精饲料比例。将速度控制在15 s左右每圈,即每100 m用时15 s。
该阶段结束后,静养3 d,在清晨空腹安静状态下将马匹保定,注射局部麻醉剂,从臀中肌采取试验所需肌肉样品30 g,方法同“1.2”。
1.3 试验步骤与方法 1.3.1 RNA提取提取每匹马长期高负荷运动训练前后骨骼肌总RNA,步骤按常规TRIzol提取法完成。
1.3.2 将提取的总RNA反转录合成cDNA首先去除基因组DNA,在冰上将反应混合液(5×gDNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,总RNA 10 μL,用RNase Free dH2O补至20 μL)混匀,然后42 ℃反应2 min,4℃保存。其次进行反转录反应,在冰上配制反应混合液(去除基因组DNA混合液10 μL,PrimeScript RT Enzyme Mix 1 1 μL,RT Primer Mix 1 μL,5×PrimeScript Buffer 2 4 μL,RNase Free dH2O 4 μL),轻柔混匀后立即进行反转录反应:37 ℃反应15 min;85℃反应5 s;温度降到4 ℃终止反应,-80 ℃保存。
1.3.3 PCR引物设计以GAPDH为内参基因,MYL-2和TNNC1为目的基因,用Primer Premier 3.0软件设计引物,并且通过NCBI中的Blsat功能检测各引物的特异性。并由上海生物工程有限公司合成(引物序列见表 1)。
|
|
表 1 GAPDH、MYL-2和TNNC1基因扩增引物序列 Table 1 The primers for amplifying GAPDH, MYL-2 and TNNC1 genes |
实时荧光定量PCR反应在Agilent Technologies Stratagene Mx3000P实时荧光定量PCR仪上完成。具体方法参照SYBR® Rremix Ex TaqTMⅡ(Perfect Real Time)试剂盒流程进行。扩增体系(20 μL):SYBR® Rremix ExTaqTMⅡ(Perfect Real Time)10 μL,PCR Forward Primer(20 μmol·L-1)0.8 μL,PCR Reverse Primer(20 μmol·L-1)0.8 μL,ROX Reference DyeⅡ0.4 μL,cDNA模板2 μL,ddH2O 6 μL。反应条件:反应40个循环(95 ℃变性1 min,60 ℃退火30 s,72 ℃延伸1 min),最后72 ℃延伸5 min。
1.3.5 Western blot分析首先按常规方法提取每匹马在长期高负荷运动训练前后骨骼肌中总蛋白。采用BCA法对提取的蛋白浓度进行测定。然后通过蛋白变性、凝胶电泳、转膜、封闭、一抗孵育、二抗孵育、成像及灰度分析一系列步骤对目的蛋白的表达量进行定量。
1.3.6 数据处理和分析本研究以GAPDH基因为内参基因,采用2-△△Ct定量分析方法对运动训练前后蒙古马骨骼肌中MYL-2和TNNC1基因的表达量进行比较分析,目的基因的相对表达量=2-△△Ct;△Ct=(运动前目的基因的Ct值-运动前GAPDH的Ct值);△Ct=(运动后目的基因的Ct值-运动后GAPDH的Ct值)。试验进行3个重复,从而减少外界以及人为操作因素对试验的影响。将得到的数据采用SAS9.0软件进行单因素方差分析和显著性检验。
2 结果 2.1 蒙古马肌肉样品总RNA的质量检测将提取的总RNA采用1%的琼脂糖凝胶电泳进行检测。结果显示,28S和18S条带清晰,亮度较好(图略),表明RNA完整性较好。采用酶标仪分别测定提取的RNA在260 nm和280 nm光密度下的纯度和浓度。检测结果显示,样品总RNA的OD260 nm/OD280 nm值均为1.8~2.0,说明提取的RNA样品纯度较好。结合检测结果判定,提取的总RNA可以用于后续试验。
2.2 蒙古马肌肉样品BCA法蛋白定量结果提取的蒙古马肌肉样品的蛋白浓度为3.5~6.1 μg·μL-1,定量标准曲线线性回归方程公式为y=0.997 8x+0.121 7,R2=0.989 8(y为蛋白浓度,x为OD值,R为相关系数)。标准曲线(图 1)比较理想,预示测定的蛋白浓度数据可信,可用于后续的试验。
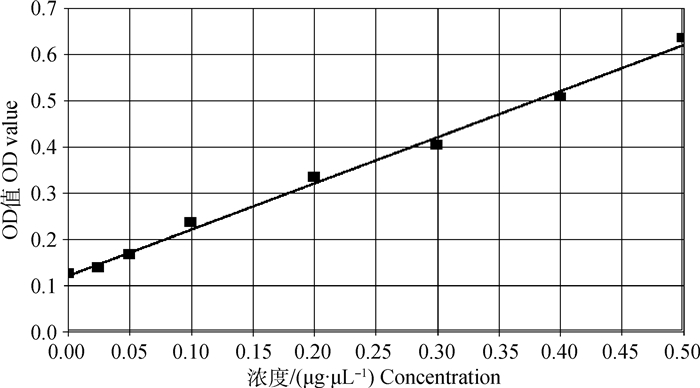
|
图 1 提取蛋白标准曲线 Figure 1 Protein standard curve |
本试验以GAPDH基因作为内参基因,采用2-△△Ct定量分析法对MYL-2和TNNC1基因在长期高负荷运动训练前后蒙古马骨骼肌中的表达量进行分析。试验结果显示,经长期高负荷运动训练后蒙古马骨骼肌中MYL-2和TNNC1基因的表达量极显著高于训练前(P < 0.01)。说明运动训练对该基因的表达量有明显的促进作用,从而对蒙古马的运动性能产生影响,结果如图 2所示。
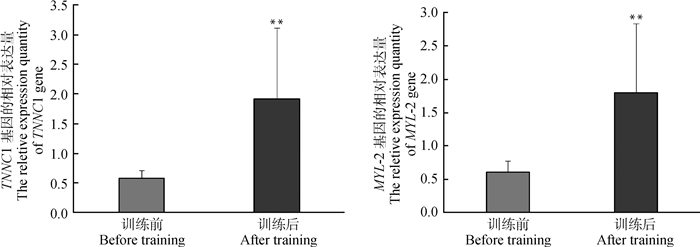
|
**表示差异极显著(P < 0.01)。图 3同 ** represent the extremely significant difference(P < 0.01).The same as Figure 3 图 2 运动训练前后蒙古马骨骼肌中MYL-2和TNNC1基因mRNA相对表达量 Figure 2 Relative expression quantity of MYL-2 and TNNC1 genes in Mongolian horses skeletal muscle before and after high loading exercise |
本试验以GAPDH为内参,采用Western blot技术对蒙古马高负荷运动训练前后骨骼肌中MYL-2和TNNC1基因在翻译水平的表达进行检测。图 3a显示,在蒙古马长期高负荷运动训练前后的肌肉组织中MYL-2和TNNC1蛋白均有表达,但在高负荷运动训练前后表达水平不同。使用Gel Image ststem ver.4.00软件对图像进行灰度分析,结果显示(图 3b),MYL-2和TNNC1蛋白在高负荷运动训练后在蛋白水平的表达量均高于高负荷运动训练前,且MYL-2蛋白在高负荷运动训练后的蛋白表达量较高负荷运动训练前有了极显著的增加(P < 0.01),而TNNC1蛋白在高负荷运动训练后蛋白表达量的增加相比高负荷运动训练前并未达到显著水平(P>0.05)。
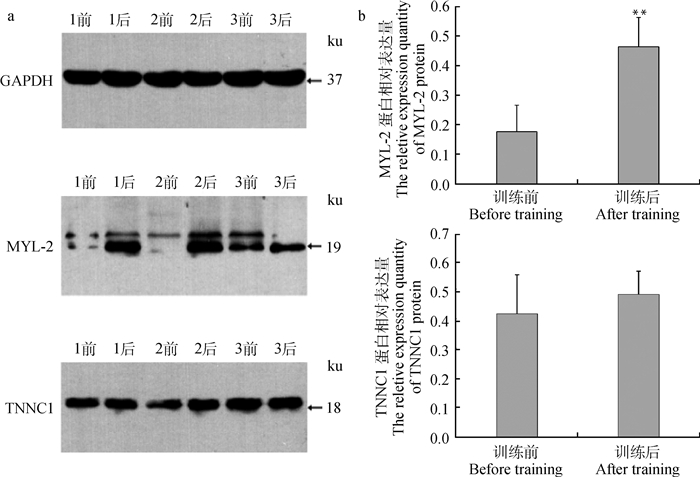
|
a.Western blot检测MYL-2和TNNC1的蛋白表达:1前和1后为一号马运动前后肌肉样品;2前和2后为二号马运动前后肌肉样品;3前和3后为三号马运动前后肌肉样品。b.MYL-2和TNNC1蛋白表达的灰度分析 a.The expression of MYL-2 and TNNC1 proteins detected by Western blot: The number represent the sample number before and after exercise. b.The gray value analysis of MYL-2 and TNNC1 proteins expression 图 3 蒙古马高负荷运动训练前后骨骼肌中MYL-2和TNNC1的蛋白表达 Figure 3 Expression of MYL-2 and TNNC1 proteins in skeletal muscle before and after high loading exercise in Mongolia horses |
本试验首先对蒙古马长期高负荷运动前后肌肉发育相关基因进行了转录水平的表达差异性分析。结果显示,经过高负荷运动后蒙古马肌肉组织中TNNC1和MYL-2基因的表达量发生上调,极显著高于高负荷运动前(P < 0.01)。其次,为了进一步研究高负荷运动对蒙古马肌肉发育相关基因在mRNA水平和蛋白质水平上的表达是否一致,采用免疫印迹方法对这两个基因进行了检测。结果显示,在高负荷运动后MYL-2和TNNC1在蛋白水平的表达量均高于高负荷运动前,且MYL-2在高负荷运动后的表达量较高负荷运动前有了明显的上调,差异极显著(P < 0.01),这与本试验的荧光定量结果完全一致。而TNNC1在高负荷运动后蛋白表达量相比高负荷运动前也有一定的上调趋势,但未达到显著水平(P>0.05),这与本试验荧光定量的结果趋势一样。
在其他研究中,通过对100头猪肉样品及肉质性状的数据处理,发现基因TNNC1与猪肉的肉质性状密切相关。随后进一步验证了TNNC1基因在猪背最长肌中的表达量与肉质性状的相关性,发现TNNC1基因的表达量与滴水损失、pH24 h、肉色等肉质性状相关[24]。对山羊的TNNC1基因研究发现,该基因在非肌肉组织中,如肝和脑,其表达量很低,甚至没有表达。因而,无论是在非肌肉组织中没有表达或是表达量极低,都印证TNNC1基因表达的独特性,即在心中和慢肌纤维含量高的肌肉中高表达,而在其他组织中都是低表达甚至是不表达。此外,TNNC1及MyHC基因以及肌纤维类型之间存在着紧密的共表达规律[25]。研究证明,体外培养成肌细胞时,在成肌细胞呈指数增长的时候,绿头鸭TNNC1基因的表达量相对减少,而在肌纤维形成和成熟时,该基因的表达量较高[26]。在细胞增长的快速阶段主要是Desmin基因表达,但在营养耗尽,或是说在细胞增长的平台期,主要表达Mckand和TNNC1基因。因而TNNC1基因与肌肉生长有一定的关系[27-28]。赵启南等[29]通过对训练前后蒙古马肌肉转录组的测定也发现,TNNC1基因为高表达基因。荧光定量PCR分析表明,天府肉羊TNNC1基因在心肌、慢骨骼肌(比目鱼肌)高表达,极显著高于在快肌骨骼肌和其他内脏组织中的表达[30]。研究显示,TnC与TnT、TnI结合成肌钙蛋白复合物(Tn), 肌钙蛋白复合物(Tn)再与原肌球蛋白(Tm)一起构成Tm-Tn复合体,调节肌肉收缩与舒张的力量和速度。Tm-Tn复合体位于横纹肌的细肌丝和心肌细胞的细肌丝上。Tm-Tn复合体对肌肉收缩的调节作用需要在Ca2+的诱导下进行。钙从肌质网(sarcoplasmic reticulum)释放出来,与肌钙蛋白结合而使其结构发生改变,于是被抑制的肌动蛋白和肌球蛋白相互作用,致使肌肉发生收缩。如果钙被去除,肌钙蛋白恢复原来状态,肌肉便发生松弛,这就是肌肉收缩的一个循环过程[14, 31-36]。
而本研究发现,在蒙古马长期高负荷运动前后的臀中肌中TNNC1基因均有所表达。并且通过为期4个月的高负荷运动后表达量明显提高,呈现了极显著差异(P < 0.01)。由此可推断,通过高负荷运动可能促进了蒙古马肌肉的有效发育,甚至改变了快肌和慢肌的比例,从而有效提高蒙古马骨骼肌中TNNC1基因的表达量。TNNC1基因虽在蒙古马高负荷运动前后mRNA水平上有显著差异,但在蛋白水平上的结果为差异不显著(P>0.05),总结原因为两方面:一方面可能与蛋白表达的延滞性有关;另一方面,基因的表达是DNA-RNA-蛋白,期间有转录水平的调控、转录后的调控以及翻译后调控等多种调控机制影响着该基因的表达,也有可能在mRNA到蛋白的翻译过程中由于非编码RNA等的相应调控作用导致在蛋白水平上的表达不显著。
吴华俊等[37]的研究结果显示,在松墨天牛成虫身体的各个部位中MYL-2表达量不尽相同,其中松墨天牛成虫足部MYL-2的表达量最高,这是由于足部是动物运动的主要器官,因此足部富含肌肉蛋白。头部、触角和胸部MYL-2的表达量次之,这与动物在觅食和求偶等活动中离不开运动有密切相关。而在腹部MYL-2的表达量极低,这正是因为腹部为松墨天牛成虫的整体部分,不参与运动功能,因此MYL-2表达量低。近年来发现,MYL-2可能在肌肉肥大过程中执行作用。经检测,MYL-2在成熟肌肉中表达,而在培养的鼠C2C12成肌细胞分化过程中不表达[38-39]。在鼠非肌肉成纤维细胞中,MYL-2对Ⅱ型肌纤维完整性的维持起着重要的作用,进而对细胞的结构、细胞粘着、迁移和分裂起着关键的作用[18]。说明MYL-2对Ⅱ型肌纤维的活性有调节作用。同样地,将小鼠的心肌和骨骼肌中该基因敲除后,发现小鼠在胚胎期或初生期出现严重的反常,甚至有致命性的表现[14]。
本试验中,长期高负荷运动后蒙古马臀中肌中MYL-2基因及其蛋白水平的表达都有显著的提高,这与先前的研究基本一致,运动增强的肌肉中该基因表达量明显增高。因此,高负荷运动能够有效提高蒙古马肌肉组织中MYL-2基因的表达量,从而促进肌肉的发育,提高其耐力性能。
4 结论本研究结果表明,MYL-2和TNNC1基因与蒙古马的耐力性能存在着密切的关系,更全面地了解到先前筛选的与肌肉结构发育相关的基因在蒙古马长期高负荷运动前后的变化及调控。为下一步对蒙古马进行系统的训练和探讨耐力基因的作用机理奠定了基础。
| [1] | JIN J P, ZHANG Z, BAUTISTA J A. Isoform diversity, regulation, and functional adaptation of troponin and calponin[J]. Crit Rev Eukaryot Gene Expr, 2008, 18(2): 93–124. DOI: 10.1615/CritRevEukarGeneExpr.v18.i2 |
| [2] | KRETSINGER R H, WASSERMAN R H. Structure and evolution of calcium-modulated protein[J]. Crit Rev Biochem, 1980, 8(2): 119–174. DOI: 10.3109/10409238009105467 |
| [3] | SCHREIER T, KEDES L, GAHLMANN R. Cloning, structural analysis, and expression of the human slow twitch skeletal muscle/cardiac troponin C gene[J]. J Biol Chem, 1990, 265(34): 21247–21253. |
| [4] | SASSE S, BRAND N J, KYPRIANOU P, et al. Troponin Ⅰ gene expression during human cardiac development and in end-stage heart failure[J]. Circ Res, 1993, 72(5): 932–938. DOI: 10.1161/01.RES.72.5.932 |
| [5] | O'CONNELL B, BLAZEV R, STEPHENSON G M M. Electrophoretic and functional identification of two troponin C isoforms in toad skeletal muscle fibers[J]. Am J Physiol Cell Physiol, 2006, 290(2): C515–C523. DOI: 10.1152/ajpcell.00307.2005 |
| [6] | ZHANG S Z, XU Y, XIE H Q, et al. The possible role of myosin light chain in myoblast proliferation[J]. Biol Res, 2009, 42(1): 121–132. |
| [7] | GEEVES M A, FEDOROV R, MANSTEIN D J. Molecular mechanism of actomyosin-based motility[J]. Cell Mol Life Sci, 2005, 62(13): 1462–1477. DOI: 10.1007/s00018-005-5015-5 |
| [8] | VICENTE-MANZANARES M, MA X F, ADELSTEIN R S, et al. Non-muscle myosin Ⅱ takes centre stage in cell adhesion and migration[J]. Nat Rev Mol Cell Biol, 2009, 10(11): 778–790. DOI: 10.1038/nrm2786 |
| [9] | WETERMAN M A J, BARTH P G, VAN SPAENDONCK-ZWARTS K Y, et al. Recessive MYL2 mutations cause infantile type Ⅰ muscle fibre disease and cardiomyopathy[J]. Brain, 2013, 136(Pt 1): 282–293. |
| [10] | GÓMEZ J, REGUERO J R, MORÍS C, et al. Mutation analysis of the main hypertrophic cardiomyopathy genes using multiplex amplification and semiconductor next-generation sequencing[J]. Circ J, 2014, 78(12): 2963–2971. DOI: 10.1253/circj.CJ-14-0628 |
| [11] | LI Y H, WU G, TANG Q Z, et al. Slow cardiac myosin regulatory light chain 2(MYL2) was down-expressed in chronic heart failure patients[J]. Clin Cardiol, 2011, 34(1): 30–34. DOI: 10.1002/clc.20832 |
| [12] | HUANG W R, LIANG J S, YUAN C C, et al. Novel familial dilated cardiomyopathy mutation in MYL2 affects the structure and function of myosin regulatory light chain[J]. FEBS J, 2015, 282(12): 2379–2393. DOI: 10.1111/febs.2015.282.issue-12 |
| [13] | SHEIKH F, LYON R C, CHEN J. Functions of myosin light chain-2(MYL2) in cardiac muscle and disease[J]. Gene, 2015, 569(1): 14–20. DOI: 10.1016/j.gene.2015.06.027 |
| [14] | CHEN J, KUBALAK S W, MINAMISAWA S, et al. Selective requirement of myosin light chain 2v in embryonic heart function[J]. J Biol Chem, 1998, 273(2): 1252–1256. DOI: 10.1074/jbc.273.2.1252 |
| [15] | WANG Y C, SZCZESNA-CORDARY D, CRAIG R, et al. Fast skeletal muscle regulatory light chain is required for fast and slow skeletal muscle development[J]. FASEB J, 2007, 21(9): 2205–2214. DOI: 10.1096/fj.06-7538com |
| [16] | CIAPANNA E, TABOGA M. Bayesian analysis of coefficient instability in dynamic regressions[R]. Bank of Italy Temi di Discussione (Working Paper) No. 836. Banca D'Italia, 2011. |
| [17] |
李宁.
动物遗传学[M]. 3版. 北京: 中国农业出版社, 2011: 88.
LI N. Animal genetics[M]. 3rd ed. Beijing: China Agricultural University Press, 2011: 88. (in Chinese) |
| [18] | PARK I, HAN C, JIN S, et al. Myosin regulatory light chains are required to maintain the stability of myosin Ⅱ and cellular integrity[J]. Biochem J, 2011, 434(1): 171–180. |
| [19] | PETERSEN J L, MICKELSON J R, COTHRAN E G, et al. Genetic diversity in the modern horse illustrated from genome-wide SNP data[J]. PLoS One, 2013, 8(1): e54997. DOI: 10.1371/journal.pone.0054997 |
| [20] |
杨丽华. 蒙古马运动相关候选基因的分子鉴定[D]. 呼和浩特: 内蒙古农业大学, 2013.
YANG L H. Molecular identification of candidate genes for locomotion in Mongolian horses[D]. Hohhot: Inner Mongolia Agricultural University, 2013. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10129-1013248447.htm |
| [21] | GU J J, ORR N, PARK S D, et al. A genome scan for positive selection in thoroughbred horses[J]. PLoS One, 2009, 4(6): e5767. DOI: 10.1371/journal.pone.0005767 |
| [22] | ROPKA-MOLIK K, STEFANIUK-SZMUKIER K, ZUKOWSKI K, et al. Exercise-induced modification of the skeletal muscle transcriptome in Arabian horses[J]. Physiol Genom, 2017, 49(6): 318–326. DOI: 10.1152/physiolgenomics.00130.2016 |
| [23] |
赵启南, 芒来, 白东义, 等. 蒙古马高负荷运动训练前后转录组差异表达分析[J]. 畜牧兽医学报, 2017, 48(6): 1007–1016.
ZHAO Q N, MANG L, BAI D Y, et al. Mongolian horses transcriptome differential expression analysis before and after a high load exercise training[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(6): 1007–1016. (in Chinese) |
| [24] | PIERZCHALA M, HOEKMAN A J W, URBANSKI P, et al. Validation of biomarkers for loin meat quality (M. longissimus) of pigs[J]. J Anim Breed Genet, 2014, 131(4): 258–270. DOI: 10.1111/jbg.2014.131.issue-4 |
| [25] | SCHIAFFINO S, REGGIANI C. Fiber types in mammalian skeletal muscles[J]. Physiol Rev, 2011, 91(4): 1447–1531. DOI: 10.1152/physrev.00031.2010 |
| [26] | LIU H H, LI L, CHEN X, et al. Characterization of in vitro cultured myoblasts isolated from duck (Anas platyrhynchos) embryo[J]. Cytotechnology, 2011, 63(4): 399–406. DOI: 10.1007/s10616-011-9356-7 |
| [27] | BUCHER E A, MAISONPIERRE P C, KONIECZNY S F, et al. Expression of the troponin complex genes:Transcriptional coactivation during myoblast differentiation and independent control in heart and skeletal muscles[J]. Mol Cell Boil, 1988, 8(10): 4134–4142. DOI: 10.1128/MCB.8.10.4134 |
| [28] | PARMACEK M S, BENGUR A R, VORA A J, et al. The structure and regulation of expression of the murine fast skeletal troponin C gene.Identification of a developmentally regulated, muscle-specific transcriptional enhancer[J]. J Biol Chem, 1990, 265(26): 15970–15976. |
| [29] |
赵启南, 芒来, 白东义, 等. 蒙古马高负荷运动训练前后miRNA差异表达分析[J]. 中国农业大学学报, 2018, 23(3): 61–68.
ZHAO Q N, MANG L, BAI D Y, et al. miRNA analysis of Mongolian horses before and after high-load training[J]. Journal of China Agricultural University, 2018, 23(3): 61–68. (in Chinese) |
| [30] | CHEN H, WANG D, XU G, et al. Cloning, structural analysis and expression of cardiac troponin C (TNNC1) gene in goat[J]. Afr J Biotechnol, 2012, 11(16): 3903–3910. |
| [31] | SOLARO R J, RARICK H M. Troponin and tropomyosin:Proteins that switch on and tune in the activity of cardiac myofilaments[J]. Circ Res, 1998, 83(5): 471–480. DOI: 10.1161/01.RES.83.5.471 |
| [32] | ABBOTT M B, GAPONENKO V, ABUSAMHADNEH E, et al. Regulatory domain conformational exchange and linker region flexibility in cardiac troponin C bound to cardiac troponin Ⅰ[J]. J Biol Chem, 2000, 275(27): 20610–20617. DOI: 10.1074/jbc.M909252199 |
| [33] | YE Y M, SHEALY S, LEE H W, et al. A grafting approach to obtain site-specific metal-binding properties of EF-hand proteins[J]. Protein Eng, 2003, 16(6): 429–434. DOI: 10.1093/protein/gzg051 |
| [34] | BLUMENSCHEIN T M A, STONE D B, FLETTERICK R J, et al. Calcium-dependent changes in the flexibility of the regulatory domain of troponin C in the troponin complex[J]. J Biol Chem, 2005, 280(23): 21924–21932. DOI: 10.1074/jbc.M500574200 |
| [35] | HOOPER S L, THUMA J B. Invertebrate muscles:Muscle specific genes and proteins[J]. Physiol Rev, 2005, 85(3): 1001–1060. DOI: 10.1152/physrev.00019.2004 |
| [36] | MORITA H, SEIDMAN J, SEIDMAN C E. Genetic causes of human heart failure[J]. Clin Invest, 2005, 115(3): 518–526. DOI: 10.1172/JCI24351 |
| [37] |
吴华俊, 蔡紫玲, 罗淋淋, 等. 松墨天牛肌球蛋白轻链2基因的鉴定及表达模式[J]. 华北农学报, 2015, 30(3): 25–30.
WU H J, CAI Z L, LUO L L, et al. Characterization and expression pattern of myosin light chain 2 gene from Monochamus alternatus[J]. Acta Agriculturae Boreali-Sinica, 2015, 30(3): 25–30. DOI: 10.7668/hbnxb.2015.03.005 (in Chinese) |
| [38] | SUTHERLAND C J, ESSER K A, ELSOM V L, et al. Identification of a program of contractile protein gene expression initiated upon skeletal muscle differentiation[J]. Dev Dyn, 1993, 196(1): 25–36. DOI: 10.1002/aja.1001960104 |
| [39] |
张素珍, 解慧琪, 徐永, 等. 肌球蛋白轻链在肌肉再生中作用的体外实验研究[J]. 中国修复重建外科杂志, 2008, 22(6): 753–758.
ZHANG S Z, XIE H Q, XU Y, et al. An experimental study of the role of myosin light chain in myogenesis in vitro[J]. Chinese Journal of Reparative and Reconstructive Surgery, 2008, 22(6): 753–758. (in Chinese) |



