生活水平的提高和消费观念的改变使高品质的羊肉受到了更多的青睐。肌内脂肪含量(intramuscular fat,IMF)是决定羊肉品质的关键因素之一,其高低直接影响肉的嫩度、多汁性和风味[1]。由于生长速度与肉质间存在一定的负相关,肉羊生产中常用的提高瘦肉率及饲料转化率的方法,例如营养调控、遗传选择等手段均可能导致IMF含量下降。IMF含量受到了遗传、营养、环境等多种因素的共同影响[2-3]。如何在不影响生长速度的前提下,提高羊肉的IMF含量已成为肉羊生产中亟待解决的问题之一。
肌内脂肪细胞由肌内前体脂肪细胞分化而来,研究肌内前体脂肪细胞的分化对理解肉羊成熟肌内脂肪细胞的生成及IMF的沉积有重要意义。相对于猪、牛等家畜,国内外关于绵、山羊肌内脂肪发育调控的研究起步较晚。刘建华和师涛等[4-5]克隆了UCP2 cDNA全长序列,就其时空表达特异性进行了研究,并证明了miR-132-3p与UCP2 3′-UTR特异结合抑制其表达,促进绵羊前体脂肪细胞的分化。杜琛等[6-7]以绒山羊肌内脂肪细胞为试验材料,探讨了绒山羊PPARγ基因在肌内脂肪细胞增殖和分化过程中的功能。同时,该课题组还进行了转录组高通量测序,筛选出与脂肪沉积相关的基因。郑竹清等[8]对涉及山羊肌内脂肪细胞分化的lncRNA进行了序列、结构与功能的分析。栾兆进等[9]研究了FAM134B、PPARγ、FAS和HSL等基因在发育过程中的组织表达规律及其与IMF含量的关系。
AMPK(AMP-activated protein kinase)是细胞调节能量代谢最重要的酶之一,参与了糖、脂肪及蛋白质的代谢过程。研究表明,敲除小鼠骨骼肌中的AMPK会导致严重的脂肪沉积和对胰岛素的抵抗(insulin resistance)[10-11],而激活3T3-L1细胞中AMPK可抑制成脂关键基因C/EBPβ、PPARγ和C/EBPα等的表达[12-13]。Wnt属于分泌型糖蛋白,在胚胎的早期发育、成体的组织稳态维持、干细胞自我更新、细胞命运决定、细胞分裂以及肿瘤发生发展等过程中起关键作用[14]。模式动物中的研究已证明,Wnt/β-catenin信号通路可通过抑制PPARγ和C/EBPα表达抑制脂肪细胞的形成[15-16],而其是否参与了羔羊肌内脂肪前体细胞的分化尚不清楚。
本试验以羔羊背最长肌中分离的前体细胞为研究对象,研究了AMPK活性对其成脂分化的影响,并初步探讨了潜在机制。
1 材料与方法 1.1 试验材料 1.1.1 试验动物3日龄小尾寒羊羔羊来自山西农业大学肉羊养殖基地。本次试验所涉及的动物饲养管理及取样过程严格遵循《山西农业大学实验动物伦理委员会章程》中的相关规定。
1.1.2 主要试剂DMEM低糖培养液(SH30021.01)购自于Hyclone公司;双抗(青链霉素)(10378016)与胎牛血清(10091155)购自于Gibco公司;Ⅱ型胶原酶(C6885)、胰岛素(I5500)、地塞米松(D4902)和3-异丁基-1-甲基黄嘌呤(IBMX)(I7018)购自于美国Sigma公司;AICAR(AB120358)和Compound C(AB120843)购于美国Abcam公司;胰蛋白酶(S01412)和油红O染液(S01058)购自于中国索莱宝公司。PrimeScript® RT Master Mix(R047A)与SYBR® Premix Ex TaqTM II65(R820A)购于日本TaKaRa公司。
1.2 试验方法 1.2.1 羔羊肌内前体脂肪细胞的分离3日龄羔羊经75%酒精消毒后放血处死。取倒数第二、三肋骨间背最长肌,经含100 U双抗的PBS清洗3次后移入超净工作台。使用灭菌的剪刀和镊子剔除可见的血块及结缔组织,小心分离肌束膜,置于50 mL离心管中,加入含Ⅱ型胶原酶(2 mg·mL-1)的消化缓存溶液,37 ℃水浴摇床(250 r·min-1)振荡消化1 h。消化结束后,加入等体积的消化终止液(DMEM +10%FBS),700×g离心10 min,弃上清。用2 mL完全培养基(DMEM +10% FBS+100 U·mL-1青链霉素)重悬细胞,依次通过100和40 μm细胞筛,进行过滤。滤液500×g离心5 min,弃上清并在沉淀中加入含10%胎牛血清的DMEM完全培养基悬浮细胞。细胞经计数后(2.5×105)接种于培养皿中,置于培养箱培养。
1.2.2 肌内前体脂肪细胞的培养和成脂分化细胞培养1.5 h后,弃培养液,并用新鲜培养液清洗贴壁细胞2次,继续培养。细胞长至80%~90%丰度时,用0.25%胰蛋白酶消化并传代培养。传代过程中,每2 d换1次完全培养液,直至细胞丰度达到80%后,重复上述操作。为减小试验误差,分化试验均使用2~4代的细胞完成。成脂分化时,细胞按3×103个·cm-2密度接种于12孔板中,待细胞长满后进行诱导分化。分化培养液:DMEM/低糖+10%FBS+1%双抗+ 5 μg·mL-1胰岛素+1 μmol·L-1地塞米松+0.5 mmol·L-1 IBMX,2 d换液1次。4 d后,分化培养液换为DMEM/低糖+10% FBS+1%双抗+5 μg·mL-1的胰岛素,每2 d换液1次,分化至第12天。
1.2.3 Real-time PCR检测总RNA的提取参照Trizol® Reagent试剂盒说明进行。提取后的总RNA用1%琼脂糖凝胶电泳检测其完整性,并用Nanodrop ND-1000进行浓度与完整性检测,OD260nm/OD280nm=1.9~2.0者用于后续试验。RNA经DNA酶处理后,取1 μg进行cDNA反转录,并进行qRT-PCR分析。扩增程序:95 ℃预变性20 s;95 ℃变性20 s,60℃退火及延伸20 s,36个循环。结果根据2-ΔΔCT法计算,18S为内参基因。引物信息见表 1。
|
|
表 1 引物序列 Table 1 Primer sequences for Real-time PCR |
Western blot分析采用本实验室前期建立的方法完成[17]。具体操作:吸出培养液,并用预冷PBS洗1次,加入100 μL预冷裂解液(20 mmol·L-1 Tris-HCl,2% SDS,1% Triton X-100,5.0 mmol·L-1 EDTA,5.0 mmol·L-1 EGTA,1 mmol·L-1 DTT,100 mmol·L-1NaF,2 mmol·L-1钒酸钠,0.5 mmol·L-1苯基甲基磺酰氟),匀浆后离心(12 000 r·min-1,4 ℃,15 min)。取上清液,并加入等体积的2倍上样缓冲液(150 mmol·L-1 Tris-HCl,20%甘油,2 mmol·L-1巯基乙醇,0.004%溴酚蓝),经煮沸后备用。蛋白经SDS-PAGE分离后(Bio-Rad Mini-RPOTEAN,美国)转膜于硝基纤维素膜(NC,100 V,1 h)。经5%脱脂奶粉封闭1 h后,加入一抗(1:1 000),4℃过夜。NC膜经PBST洗膜3次后,加入荧光二抗(1:10 000),室温孵育60 min,用Odyssey远红外扫描系统进行分析。β-actin作为内参,目的蛋白的相对表达量=目的蛋白含量/β-actin蛋白含量。
相关抗体信息:PPARγ多克隆抗体(sc-7196)、ap2多克隆抗体(sc-18661)、C/EBPα多克隆抗体(sc-9314)购于美国Santa Cruz公司;ACC多克隆抗体(3662)、p-ACC多克隆抗体(3661)、AMPK多克隆抗体(2532)、p-AMPK单克隆抗体(2535)、β-catenin(8480)单克隆抗体、β-actin抗体(4970)购于美国Cell signaling technology公司;GSK3β多克隆抗体(bs-0023M)、p-GSK3β多克隆抗体(bs-2066R)购于中国博奥森公司。Goat anti-Rabbit IgG(926-32211)荧光二抗、Donkey anti-Goat IgG(926-32214)荧光二抗和Goat anti-Mouse IgG(926-68070)荧光二抗购于美国LICOR公司。
1.2.5 油红O染色细胞分化第12天移去上层培养液,用预冷PBS漂洗3次,并用10%的甲醛室温固定10 min。随后,细胞用自来水充分漂洗3次,加入60%的异丙醇浸洗。待培养皿完全干燥后,用油红O染液室温染色10 min,自来水冲洗,光学倒置显微镜下进行拍照。
1.2.6 统计分析数据以“平均值±标准差”表示,并采用Graphpad Prism 7.0进行单因素方差分析,采用Duncan法进行多重比较。P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果 2.1 羔羊骨骼肌肌内前体脂肪细胞的诱导分化如图 1所示,分离的羔羊背最长肌肌内前体脂肪细胞在成脂诱导的第4天开始出现脂滴,但数量较少(图 1A)。诱导第8天,脂滴明显增多(图 1B),诱导第12天,细胞几乎完全分化,成熟脂滴充满整个细胞(图 1C)。
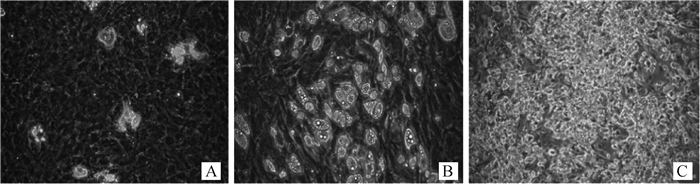
|
A.分化4天;B.分化8天;C.分化12天 The morphology of preadipocytes at different induction times: A. 4 d; B. 8 d; C. 12 d 图 1 羔羊肌内前体脂肪细胞的成脂诱导分化(200×) Figure 1 Adipogenic differentiation of sheep intramuscular preadipocytes (200×) |
分别使用不同浓度的AMPK激活剂AICAR(0.1、0.25、0.5 mmol·L-1)与抑制剂Compound C(0.5、1、2 μmol·L-1)对羔羊前体脂肪细胞进行处理,24 h后取样进行Western blot和灰度值分析。如图 2所示,0.1 mmol·L-1的AICAR可极显著增加p-AMPK(P=0.004)与p-ACC(P=0.007)的含量(图 2A),激活AMPK。其中,0.25 mmol·L-1的激活效果最好。同时,0.5 μmol·L-1的Compound C也极显著降低p-AMPK(P=0.002)与p-ACC(P=0.003)的含量(图 2B)。AMPK的活性受特定位点磷酸化的修饰,其活性形式是p-AMPK。此外,p-ACC是AMPK的唯一下游靶点,p-ACC与p-AMPK的增加均说明了AMPK被激活。本试验采用的AICAR与Compound C的浓度分别为0.25 mmol·L-1与0.5 μmol·L-1。
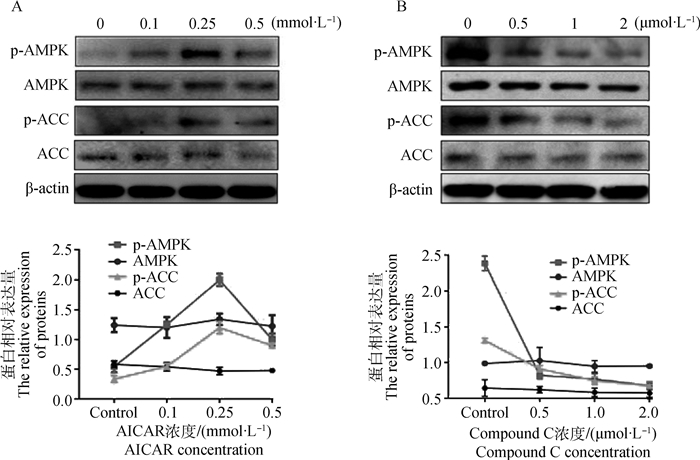
|
A.添加不同浓度AICAR后p-AMPK、AMPK、p-ACC及ACC表达的Western blot检测;B.添加不同浓度Compound C后p-AMPK、AMPK、p-ACC及ACC表达的Western blot检测 A.p-AMPK, AMPK, p-ACC and ACC expressions after adding different concentrations of AICAR; B. p-AMPK, AMPK, p-ACC and ACC expressions after adding different concentrations of Compound C 图 2 不同浓度AICAR与Compound C对AMPK活性的影响 Figure 2 The effects of different concentrations of AICAR and Compound C on AMPK activity |
细胞接受处理(AICAR或Compound C)48 h后取样进行成脂关键基因mRNA及蛋白表达分析。如图 3B所示,与对照组相比,AICAR处理可极显著降低PPARγ、C/EBPα和aP2(P<0.01)等关键基因的mRNA表达,而Compound C处理组中的相应mRNA水平均极显著升高(P<0.01,图 3B)。上述关键基因的蛋白水平的变化与mRNA的变化趋势一致(图 3A,P<0.01)。细胞处理12 d后采用油红O染色衡量最终分化效果。结果显示(图 3C),AICAR处理组的油红着色明显少于对照组,而Compound C处理后的油滴明显多于对照组。
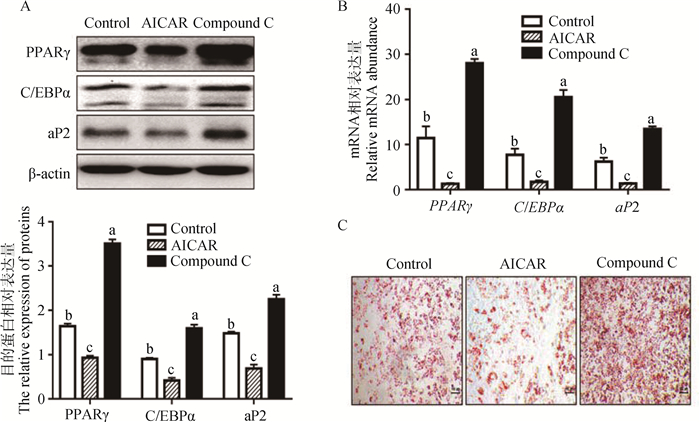
|
A.不同处理组中PPARγ、C/EBPα和aP2蛋白的相对表达量;B.不同处理组中PPARγ、C/EBPα和aP2关键基因的mRNA表达量;C.分化12天后不同处理组油红O染色结果(100×)。不同字母表示差异极显著(P < 0.01)。下同 A. Relative protein contents of PPARγ, C/EBPα and aP2 in different groups; B.Relative mRNA expressions of PPARγ, C/EBPα and aP2 in different groups; C. Oil-red-O staining of sheep intramuscular preadipocytes in different groups after 12 d differentiation(100×). The different letters indicate extremely significant difference(P < 0.01). The same as below 图 3 AMPK活性对绵羊肌内脂肪前体细胞成脂分化的影响 Figure 3 The effect of AMPK activity on sheep intramuscular preadipocytes differentiation |
本试验采用LiCl和IWR-1分别激活和抑制Wnt/β-catenin信号通路。如图 4A所示,细胞接受LiCl处理12 h后明显增加了β-catenin的蛋白含量,其中浓度为25 mmol·L-1时的效果最好。添加25 mmol·L-1的LiCl后,Wnt/β-catenin信号通路的下游基因C-MYC的mRNA表达极显著上升(图 4B,P<0.01),Cyclin D1的mRNA表达显著上升(图 4B,P<0.05)。IWR-1剂量依赖性的抑制了β-catenin蛋白含量(图 4C),0.5 μmol·L-1的添加量明显地减少β-catenin的表达。如图 4D所示,添加0.5 μmol·L-1的IWR-1可显著降低C-MYC(P<0.05)与Cyclin D1(P<0.05)的mRNA水平。
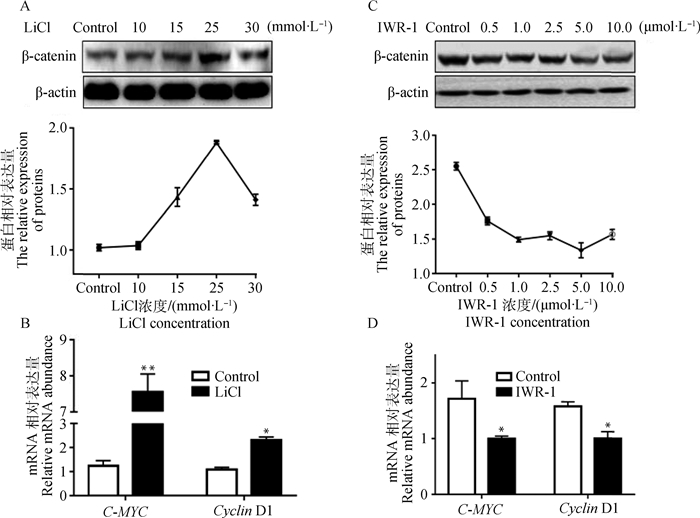
|
A.不同浓度的LiCl处理后细胞中β-catenin蛋白水平;B. 25 mmol·L-1 LiCl处理细胞后,C-MYC与Cyclin D1的mRNA表达;C.不同IWR-1浓度处理后细胞中β-catenin的蛋白相对表达量;D. 0.5 μmol·L-1 IWR-1处理细胞后,C-MYC与Cyclin D1的mRNA表达。*. P < 0.05;**. P < 0.01,下同 A.β-catenin protein contents after cells were treated with different concentrations of LiCl; B. The mRNA expressions of C-MYC and Cyclin D1 after cells were treated with 25 mmol·L-1 LiCl; C. β-catenin protein contents after cells were treated with different concentrations of IWR-1;D. The mRNA expressions of C-MYC and Cyclin D1 after cells were treated with 0.5 μmol·L-1 IWR-1.*. P < 0.05;**. P < 0.01, the same as below 图 4 LiCl与IWR-1对Wnt/β-catenin通路的影响 Figure 4 The effect of LiCl and IWR-1 addition on Wnt/β-catenin signaling pathway activity |
前体脂肪细胞成脂诱导分化的同时,加入LiCl或IWR-1,48 h后提取mRNA及蛋白进行荧光定量和Western blot分析。如图 5A和5B显示,与对照组相比,LiCl可极显著降低PPARγ和C/EBPα mRNA表达(P<0.01),同时显著减少aP2的mRNA表达(P<0.05)。添加IWR-1后,上述关键基因的mRNA水平呈显著上升(P<0.05)。Western blot结果显示,LiCl(图 5C)极显著降低PPARγ、C/EBPα和aP2的蛋白水平(P<0.01),而IWR-1(图 5D)极显著提高上述蛋白的含量(P<0.01)。此外,油红O染色结果显示,LiCl处理组脂滴明显少于对照组,而IWR-1添加后明显增加了脂滴的数量。

|
A、B.添加LiCl与IWR-1后成脂关键基因(包括PPARγ、C/EBPα和aP2)的mRNA相对表达量;C、D.不同处理组PPARγ、C/EBPα和aP2的蛋白表达量;E.细胞分化12天后油红O染色结果(100×) A, B. PPARγ, C/EBPα and aP2 gene expressions after cells were treated with LiCl and IWR-1; C, D. PPARγ, C/EBPα and aP2 protein contents after cells were treated with LiCl and IWR-1. E. Oil-red-O staining in different groups when cells were differentiated for 12 d (100×) 图 5 Wnt/β-catenin信号通路对绵羊肌内前体脂肪细胞分化的影响 Figure 5 The effect of Wnt/β-catenin signaling pathway on sheep intramuscular preadipocytes differentiation |
如图 6A所示,AICAR与Compound C处理细胞后(48 h),并未显著影响β-catenin的mRNA表达。Western blot结果显示,AICAR处理细胞后极显著增加了β-catenin的蛋白含量(P < 0.01),而Compound C极显著降低了β-catenin蛋白表达(图 6B,P<0.01)。

|
A.β-catenin mRNA相对表达量;B. β-catenin蛋白含量 A. β-catenin mRNA abundance in different groups; B. β-catenin protein contents in different groups 图 6 AMPK对β-catenin含量的影响 Figure 6 The effect of AMPK on β-catenin protein contents |
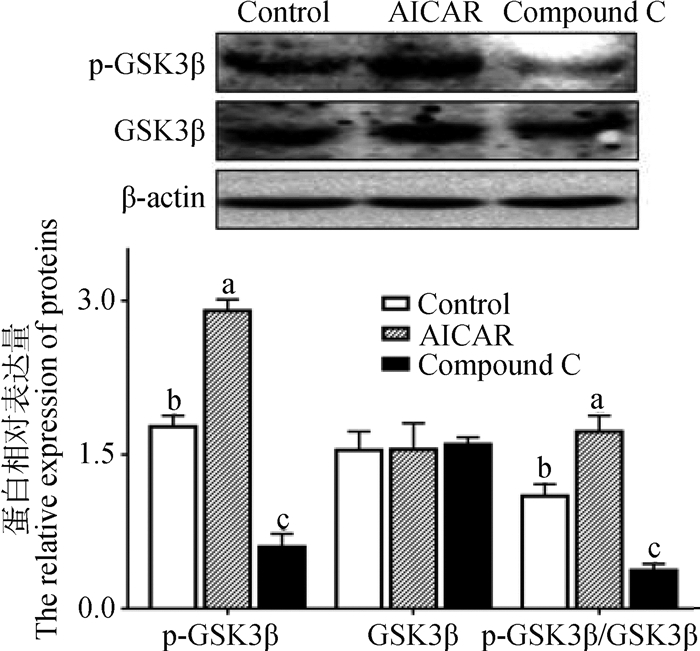
如图 7所示,不同处理组间GSK3β蛋白含量未见显著差异。与对照组相比,AICAR处理组的p-GSK3β蛋白含量极显著增加(P<0.01),而Compound C处理组的p-GSK3β含量极显著降低(P<0.01)。p-GSK3β/GSK3β的变化趋势与p-GSK3β一致。
|
图 7 AMPK对GSK3β活性的影响 Figure 7 The effect of AMPK on GSK3β activity |
IMF含量的高低影响了包括羊肉在内的肉类多汁性、嫩度、风味和适口性,其含量的高低受脂肪的合成能力与脂肪细胞数量的影响。动物肌内脂肪细胞由间充质干细胞分化而来[18],其分化过程受一系列关键基因及调控网络决定[19-20],数量一般在动物出生前或是生长早期就已确定。在家畜发育过程中,间充质干细胞首先定向决定成脂肪前体细胞,进而在特定基因及信号通路的共同决定下分化成脂肪细胞。破译脂肪前体细胞向脂肪细胞分化的机制将为提高羊肉IMF含量提供参考。
根据来源,家畜脂肪组织可分为皮下脂肪、内脏脂肪、肌内脂肪及肌间脂肪4类[21]。当前,国内外有关家畜脂肪前体细胞分化研究中使用的原代细胞(ADSCs)大多来源于皮下与内脏脂肪组织中[22],由于不同来源的脂肪前体细胞分化调节机制可能存在差异[23],肌内脂肪前体细胞无疑是研究IMF分化的最好模型。肌内脂肪细胞主要分布于骨骼肌肌束膜上[24],本试验直接分离了3日龄羔羊背最长肌肌束膜的原代细胞,成脂诱导结果表明,分离的细胞可以形成成熟的脂肪油滴,是肌内脂肪前体细胞。结果可为理解绵羊IMF形成提供更直接的证据。
AMPK是保守的异源三聚体蛋白质激酶,包括α、β和γ 3种亚基。AMPK通过感受细胞能量水平变化来维持细胞ATP生成和消耗的平衡,其活性主要受细胞AMP/ATP比例的调节。AMPK激活将引起代谢相关的关键酶活性与表达水平发生改变,影响细胞能量代谢。AMPK在调控细胞生长和增殖、建立和稳定细胞极性、调节动物寿命、调控生理节律等方面也起着重要作用[25-28],这些研究大多集中于AMPK和能量代谢方面的关系,而AMPK在脂肪细胞分化过程中的作用及机制研究较少。
AICAR与Compound C是常用的AMPK激活剂和抑制剂,其中AICAR已通过FDA应用于临床。本研究首先筛选了羔羊肌内前体脂肪细胞AICAR与Compound C的最佳浓度,发现,0.25 mmol·L-1的AICAR可有效激活AMPK,而0.5 μmol·L-1的Compound C足以抑制AMPK活性。在改变羔羊肌内前体脂肪细胞AMPK活性的基础上,笔者分析成脂关键基因的表达,Real-time PCR和Western blot结果均证明,AMPK的活性与PPARγ、C/EBPα和aP2等基因的mRNA及蛋白表达均相关。油红O染色的结果进一步揭示了AMPK活性与羔羊肌内前体脂肪细胞分化的相关性。Yang等[29]以小鼠3T3-L1细胞为研究对象,发现白藜芦醇可通过激活AMPK抑制其成脂能力。Figarola和Rahbar[30]的研究发现,抗肿瘤药物COH-SR4亦可通过活化AMPK抑制3T3-L1的分化。LKB1(liver kinase B1)是AMPK的上游激酶。对LKB1基因敲除的小鼠研究表明,AMPK活性降低的同时导致了白色脂肪细胞分化的增加[31]。以上研究结果均以小鼠极其鼠源的细胞系展开,本研究结果可为理解羔羊肉中AMPK活性与肌内前体脂肪细胞分化的关系提供必要的研究基础。
LiCl是Wnt/β-catenin信号通路的激活剂。经LiCl处理的猪脂肪间充质干细胞(AMSCs)稳定了细胞质的β-catenin,进而抑制了猪AMSCs的成脂分化[32]。IWR-1是一种新的抑制Wnt信号通路的小分子复合物,主要通过稳定Axin而降解β-catenin。本试验中,经LiCl(25 mmol·L-1)与IWR-1(0.5 μmol·L-1)处理的羔羊肌内前体脂肪细胞中Wnt信号重要的靶基因Cyclin D1和C-MYC的表达显著降低,表明二者可显著改变羔羊肌内前体脂肪细胞中Wnt/β-catenin信号通路的活性。试验结果发现,羔羊肌内前体脂肪细胞中Wnt/β-catenin信号通路活性与PPARγ、C/EBPα和aP2等基因的mRNA及蛋白表达存在负相关,揭示了其与细胞成脂分化的关系。
β-catenin是经典Wnt信号通路的信号转导因子。当细胞外无Wnt蛋白时,胞质中的β-catenin会被由Axin、APC、GSK3β和CK1等蛋白组成的降解复合体磷酸化并降解,从而保持胞内较低的β-catenin,关闭基因表达。当细胞外有Wnt蛋白时,降解复合体的活性降低,从而抑制β-catenin的降解,提高胞内游离β-catenin蛋白水平,启动靶基因的表达[33]。本研究结果表明,羔羊肌内前体脂肪细胞中AMPK活性的变化未改变β-catenin的mRNA表达,但却改变了其蛋白的含量,表明AMPK对β-catenin调控不是通过影响转录,而可能是通过改变β-catenin的胞内稳定性实现的。Horike等[34]的研究表明,小鼠中AMPK活性的激活导致了GSK3β的磷酸化增加,从而抑制了GSK3β的活性。GSK3β的活性受磷酸化话水平的调控,p-GSK3β含量多,则代表GSK3β的活性强。同时,p-GSK3β是β-catenin稳定性公认的调控因子。鉴于GSK3β对细胞内β-catenin稳定性的作用,我们分析了羔羊肌内前体脂肪细胞在AMPK活性改变时的GSK3β活性变化。结果表明,AMPK的活性与p-GSK3β含量呈正相关,说明AMPK可通过GSK3β的活性影响胞内β-catenin稳定性,进而影响细胞的成脂分化。
本研究建立的AMPK与肌内前体脂肪细胞分化的关系可为肉羊生产中调控IMF含量提供理论依据。AMPK的活性受摄入能量水平的影响,而一些生物活性物质亦可以改变AMPK的活性[35]。如能在肌内脂肪细胞形成的过程中有效的改变羔羊体内AMPK活性,将为实现IMF含量的提高及肉品质的提升提供新的途径。
4 结论羔羊背最长肌中AMPK的活性与成脂分化能力呈负相关。Wnt/β-catenin信号通路激活会抑制脂肪细胞形成,而其活性被抑制则起促进作用。AMPK通过改变GSK3β活性影响细胞内β-catenin稳定性,实现对羔羊肌内前体脂肪细胞分化的调控。
| [1] | WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality:A review[J]. Meat Sci, 2008, 78(4): 343–358. DOI: 10.1016/j.meatsci.2007.07.019 |
| [2] |
郑程莉, 徐刚毅, 汪代华. 羊肉肌内脂肪及影响因素的研究进展[C]//中国畜牧兽医学会养羊学分会全国养羊生产与学术研讨会. 银川: 中国畜牧兽医学会养羊学分会, 2010: 71-73.
ZHENG C L, XU G Y, WANG D H. Research progress on intramuscular fat and influencing factors of mutton[C]//Proceedings of the National Sheep Production and Academic Conference. Yinchuan: Animal husbandry and Veterinary Association of China, 2010: 71-73. (in Chinese) |
| [3] | WATKINS P J, FRANK D, SINGH T K, et al. Sheepmeat flavor and the effect of different feeding systems:A review[J]. J Agric Food Chem, 2013, 61(15): 3561–3579. DOI: 10.1021/jf303768e |
| [4] |
刘建华, 乔利英, 郭云雁, 等. 绵羊UCP2基因的克隆及其在脂肪组织中的季节性差异表达[J]. 畜牧兽医学报, 2015, 46(7): 1114–1121.
LIU J H, QIAO L Y, GUO Y Y, et al. Cloning of ovine UCP2 gene and its seasonally differential expression in adipose tissues[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(7): 1114–1121. (in Chinese) |
| [5] |
师涛, 闫晓茹, 潘洋洋, 等. miR-132-3p靶向UCP2调节绵羊前体脂肪细胞分化的研究[J]. 畜牧兽医学报, 2017, 48(11): 2059–2067.
SHI T, YAN X R, PAN Y Y, et al. Study on the regulation of miR-132-3p in ovine preadipocyte differentiation by targeting UCP2[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(11): 2059–2067. (in Chinese) |
| [6] |
杜琛, 李金泉, 陈秀娟. 白绒山羊PPARγ基因RNA干扰慢病毒载体的构建及对肌内脂肪细胞增殖分化的影响[J]. 畜牧兽医学报, 2016, 47(4): 671–678.
DU C, LI J Q, CHEN X J. Construction of lentiviral RNAi vector of PPARγ gene in cashmere goat and its effect on proliferation and differentiation of intramuscular adipocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 671–678. (in Chinese) |
| [7] |
杜琛, 付绍印, 高鸿雁, 等. 绒山羊肌内脂肪细胞成熟前后比较转录组分析[J]. 畜牧兽医学报, 2014, 45(5): 714–721.
DU C, FU S Y, GAO H Y, et al. Transcriptome analysis of intramuscular preadipocytes and matureadipocyte in cashmere goats[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(5): 714–721. (in Chinese) |
| [8] |
郑竹清, 杜琛, 付绍印, 等. 山羊肌内脂肪细胞lncRNA鉴别及特征分析[J]. 畜牧兽医学报, 2014, 45(12): 1924–1931.
ZHENG Z Q, DU C, FU S Y, et al. Identification and characterization analysis of long Non-coding RNA from RNA-seq data of intramuscular adipocytes in goats[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(12): 1924–1931. (in Chinese) |
| [9] |
栾兆进, 刘开东, 贺建宁, 等. 绵羊FAM134B、PPARγ、HSL和FAS基因表达量及与肌内脂肪含量的关系[J]. 畜牧兽医学报, 2016, 47(12): 2379–2389.
LUAN Z J, LIU K D, HE J N, et al. The FAM134B, PPARγ, HSL and FAS gene expression patterns and their association with intramuscular fat content in sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(12): 2379–2389. (in Chinese) |
| [10] | ZHANG W Y, ZHANG X L, WANG H, et al. AMP-activated protein kinase α1 protects against diet-induced insulin resistance and obesity[J]. Diabetes, 2013, 61(12): 3114–3125. |
| [11] | VILLENA J A, VIOLLET B, ANDREELLI F, et al. Induced adiposity and adipocyte hypertrophy in mice lacking the AMP-activated protein kinase-α2 subunit[J]. Diabetes, 2004, 53(9): 2242–2249. DOI: 10.2337/diabetes.53.9.2242 |
| [12] | HABINOWSKI S A, WITTERS L A. The effects of AICAR on adipocyte differentiation of 3T3-L1 cells[J]. Biochem Biophys Res Commun, 2001, 286(5): 852–856. DOI: 10.1006/bbrc.2001.5484 |
| [13] | BIJLAND S, MANCINI S J, SALT I P. Role of AMP-activated protein kinase in adipose tissue metabolism and inflammation[J]. Clin Sci, 2013, 124(8): 491–507. DOI: 10.1042/CS20120536 |
| [14] | ZHAN T, RINDTORFF N, BOUTROS M. Wnt signaling in cancer[J]. Oncogene, 2017, 36(11): 1461–1473. DOI: 10.1038/onc.2016.304 |
| [15] | OKAMURA M, KUDO H, WAKABAYASHI K I, et al. COUP-TFⅡ acts downstream of Wnt/β-catenin signal to silence PPARγ gene expression and repress adipogenesis[J]. Proc Natl Acad Sci U S A, 2009, 106(14): 5819–5824. DOI: 10.1073/pnas.0901676106 |
| [16] | XU Z, YU S T, HSU C H, et al. The orphan nuclear receptor chicken ovalbumin upstream promoter-transcription factor Ⅱ is a critical regulator of adipogenesis[J]. Proc Natl Acad Sci U S A, 2008, 105(7): 2421–2426. DOI: 10.1073/pnas.0707082105 |
| [17] | ZHAO J X, LI Q, ZHANG R X, et al. Effect of dietary grape pomace on growth performance, meat quality and antioxidant activity in ram lambs[J]. Anim Feed Sci Technol, 2018, 236: 76–85. DOI: 10.1016/j.anifeedsci.2017.12.004 |
| [18] | PARK A, KIM W K, BAE K H. Distinction of white, beige and brown adipocytes derived from mesenchymal stem cells[J]. World J Stem Cells, 2014, 6(1): 33–42. DOI: 10.4252/wjsc.v6.i1.33 |
| [19] | DESAI M, BEALL M, ROSS M G. Developmental origins of obesity:Programmed adipogenesis[J]. Curr Diab Rep, 2013, 13(1): 27–33. DOI: 10.1007/s11892-012-0344-x |
| [20] | TANG Q Q, LANE M D. Adipogenesis:from stem cell to adipocyte[J]. Annu Rev Biochem, 2012, 81: 715–736. DOI: 10.1146/annurev-biochem-052110-115718 |
| [21] | HAUSMAN G J, BASU U, DU M, et al. Intermuscular and intramuscular adipose tissues:Bad vs. good adipose tissues[J]. Adipocyte, 2014, 3(4): 242–255. DOI: 10.4161/adip.28546 |
| [22] | GENTILE P, ORLANDI A, SCIOLI M G, et al. Concise review:Adipose-derived stromal vascular fraction cells and platelet-rich plasma:Basic and clinical implications for tissue engineering therapies in regenerative surgery[J]. Stem Cells Trans Med, 2012, 1(3): 230–236. DOI: 10.5966/sctm.2011-0054 |
| [23] | HAUSMAN G J, POULOS S P, PRINGLE T D, et al. The influence of thiazolidinediones on adipogenesis in vitro and in vivo:Potential modifiers of intramuscular adipose tissue deposition in meat animals[J]. J Anim Sci, 2008, 86(S14): E236–E243. |
| [24] | NISHIMURA T. The role of intramuscular connective tissue in meat texture[J]. Anim Sci J, 2010, 81(1): 21–27. DOI: 10.1111/asj.2010.81.issue-1 |
| [25] | MIHAYLOVA M M, SHAW R J. The AMPK signalling pathway coordinates cell growth, autophagy and metabolism[J]. Nat Cell Biol, 2011, 13(9): 1016–1023. DOI: 10.1038/ncb2329 |
| [26] | CARLING D, THORNTON C, WOODS A, et al. AMP-activated protein kinase:new regulation, new roles?[J]. Biochem J, 2012, 445(1): 11–27. DOI: 10.1042/BJ20120546 |
| [27] | JEON S M, CHANDEL N S, HAY N. AMPK regulates NADPH homeostasis to promote tumour cell survival during energy stress[J]. Nature, 2012, 485(7400): 661–665. DOI: 10.1038/nature11066 |
| [28] | NAKANO A, TAKASHIMA S. LKB1 and AMP-activated protein kinase:Regulators of cell polarity[J]. Genes Cells, 2012, 17(9): 737–747. DOI: 10.1111/j.1365-2443.2012.01629.x |
| [29] | YANG Y Y, YANG X D, XU B, et al. Chemical constituents of Morus alba L. and their inhibitory effect on 3T3-L1 preadipocyte proliferation and differentiation[J]. Fitoterapia, 2014, 98: 222–227. |
| [30] | FIGAROLA J L, RAHBAR S. Small-molecule COH-SR4 inhibits adipocyte differentiation via AMPK activation[J]. Int J Mol Med, 2013, 31(5): 1166–1176. DOI: 10.3892/ijmm.2013.1313 |
| [31] | ZHANG W C, WANG Q L, SONG P, et al. Liver kinase B1 is required for white adipose tissue growth and differentiation[J]. Diabetes, 2013, 62(7): 2347–2358. DOI: 10.2337/db12-1229 |
| [32] | LI H X, LUO X, LIU R X, et al. Roles of Wnt/β-catenin signaling in adipogenic differentiation potential of adipose-derived mesenchymal stem cells[J]. Mol Cell Endocrinol, 2008, 291(1-2): 116–124. DOI: 10.1016/j.mce.2008.05.005 |
| [33] |
苏尚, 吴畏. Wnt/β-catenin信号通路对靶基因转录的调控[J]. 中国科学:生命科学, 2014, 44(10): 1029–1042.
SU S, WU W. Regulation of target gene transcription by Wnt/β-catenin signaling[J]. Scientia Sinica Vitae, 2014, 44(10): 1029–1042. (in Chinese) |
| [34] | HORIKE N, SAKODA H, KUSHIYAMA A, et al. AMP-activated protein kinase activation increases phosphorylation of glycogen synthase kinase 3β and thereby reduces cAMP-responsive element transcriptional activity and phosphoenolpyruvate carboxykinase C gene expression in the liver[J]. J Biol Chem, 2008, 283(49): 33902–33910. DOI: 10.1074/jbc.M802537200 |
| [35] | LANZI C R, PERDICARO D, BOTTINI R, et al. Grape pomace extract, rich in polyphenols, stimulate the emergence of brown-like cells in white adipose tissue in spontaneously hypertensive rats and in 3T3-L1 adipocytes[J]. Free Radic Biol Med, 2017, 108(S1): S83. |



