2. 山东省动物生物工程与疾病防治重点实验室, 泰安 271018;
3. 山东省畜禽疫病防制工程技术研究中心, 泰安 271018
2. Shandong Provincial Key Laboratory of Animal Biotechnology and Disease Control and Prevention, Tai'an 271018, China;
3. Shandong Provincial Engineering Technology Research Center of Animal Disease Control and Prevention, Tai'an 271018, China
马立克病(Marek’s disease, MD)以及禽网状内皮组织增生病(reticuloendotheliosis, RE)是危害鸡群重要的肿瘤病,给养禽业造成极大的危害。MD是由马立克病病毒(Marek’s disease virus,MDV)引起以感染鸡肝、肾等内脏器官的肿瘤以及T淋巴细胞的大量增生为主要特征的一种高度传染性疾病,对未经疫苗免疫的鸡群可造成极高的死亡率[1-2]。MD是目前唯一能用疫苗免疫的家禽肿瘤病,疫苗的使用有效预防了MD的暴发。随着疫苗的使用,病毒毒力呈现增强的趋势,由弱毒株、强毒株、超强毒株逐渐演变为特超强毒株[3-4],MD疫苗也由最初的HPRS-16/att、火鸡疱疹病毒(herpesvirus of turkeys, HVT)疫苗发展到由血清Ⅰ型MDV传代致弱毒力的CVI988/Rispens疫苗[5-7]。近年来,国内外鸡群MD频发,CVI988/Rispens疫苗已经不能提供完全的免疫保护[8-10]。Witter等[11]利用细胞传代致弱MDV毒力的方法制备了近10株MD疫苗候选株,其免疫保护效果均没有CVI988/Rispens好。
GX0101是从国内免疫CVI988/Rispens疫苗发生MD肿瘤的鸡群分离的MDV超强毒株[12]。利用细菌人工染色体(bacterial artificial chromosome, BAC)技术,笔者实验室构建了GX0101的感染性克隆bac-GX0101[13-14],基于Red E/T同源重组技术,敲除bac-GX0101的meq基因构建了MDV SC9-1[15]。SC9-1对鸡完全丧失致病性,不再诱发接种鸡产生肿瘤,无论是SPF鸡还是海兰褐鸡SC9-1均能诱导比商品化疫苗CVI988/Rispens更好的免疫保护效果。
RE是由禽网状内皮组织增生病病毒(reticuloendotheliosis virus, REV)引起的禽类病理综合征,表现为从亚临床感染到明显的生长迟缓、免疫抑制和肿瘤等不同的临床和病理变化。研究表明,REV能引起接种鸡早期严重的免疫抑制,可持续性地抑制鸡对灭活疫苗的抗体反应[16]。近年来,大量的研究显示国内鸡群普遍存在REV流行,严重危害养禽业的健康发展,对于REV的免疫防控越来越引起人们的重视[17]。
本研究以前期构建的血清Ⅰ型MDV meq基因缺失株SC9-1为载体,利用同源重组技术将REV env基因插入SC9-1的meq基因位点,构建重组MDV,并对重组MDV的生物学特性进行了初步研究,为其他重组MDV的构建提供思路,也为REV的免疫防控奠定基础。
1 材料与方法 1.1 材料 1.1.1 主要试剂和仪器大肠杆菌(Escherichia coli)DH5α和DH10B由本实验室保存。DMEM、Opti-MEM、转染试剂LipfactamineTM2000及真核表达载体pcDNA3.1购自Invitrogen公司。Red/ET重组系统Counter-Selection BAC Modification Kit购自德国Gene Bridge公司。FITC标记的抗鼠IgG二抗购自Sigma公司。plasmid Maxi kit购自QIAGEN公司。MDV 1型毒株pp38基因特异性的单克隆抗体H19、REV env基因特异性的单克隆抗体11B118均为本实验室保存。
1.1.2 SPF鸡和MDV毒株9~10日龄SPF鸡胚和SPF鸡均购自济南斯帕法斯家禽有限公司,MDV SC9-1株[15]、MDV rMd5株[18]以及REV SNV株[19]均由本实验室保存。H9禽流感、新城疫二联灭活苗购自青岛易邦生物工程有限公司(批号:161880701)。
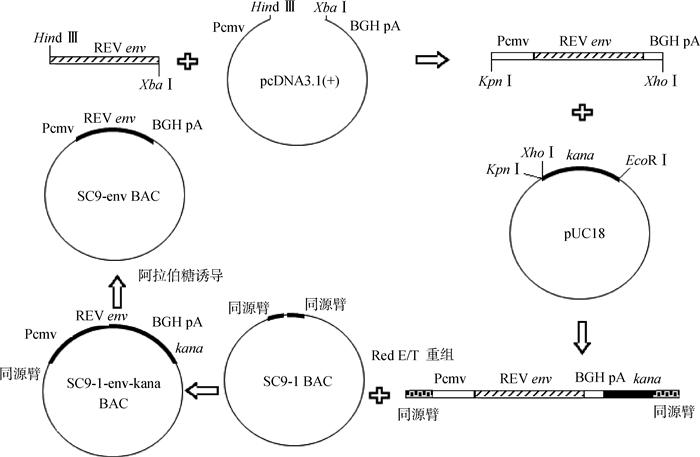
1.2 方法 1.2.1 REV env基因真核表达质粒的构建及鉴定构建策略见图 1。按常规方法提取REV SNV株的感染性克隆DNA作为模板,利用Env-F/R引物扩增env基因(表 1),回收的PCR产物与真核表达载体pcDNA3.1 (+)质粒共同用Hind Ⅲ与Xba Ⅰ双酶切后进行连接,提取重组质粒进行酶切鉴定,鉴定的阳性克隆命名为pcDNA-env(图 1)。使用QIAGEN plasmid Midi kit试剂盒提取并纯化质粒pcDNA-env,按照转染试剂LipfectamineTM2000的说明书将pcDNA-env转染进CEF中。转染后放置在37 ℃,5%CO2培养箱中培养,72 h后,吸出孔中的细胞培养液,倒掉,用预冷的丙酮:乙醇(体积比3:2)固定液固定10 min,用PBS清洗1次,加入0.5 mL(1:100稀释)REV单抗11B118,放置在37 ℃生化恒温箱中反应1 h,用PBS清洗3次,将水分甩干,加入0.5 mL FITC标记的抗鼠IgG荧光抗体,放置在37 ℃生化恒温箱反应1 h,用PBS洗3次,在倒置荧光显微镜下观察。
|
图 1 SC9-env BAC构建过程示意图 Figure 1 Construction of SC9-env BAC |
|
|
表 1 PCR扩增引物表 Table 1 Primers for PCR amplification |
以质粒pKD13为模板,Kana-F/R引物(表 1)经PCR扩增卡那霉素抗性基因(kanamycin resistance gene, kanr),回收PCR产物,经KpnⅠ、EcoRⅠ双酶切后,克隆进pUC18载体,构建pUC18-kana重组质粒。以pcDNA-env质粒为模板,Biao-F/R引物(表 1)经PCR扩增REV env基因的完整真核表达盒,回收PCR产物,经KpnⅠ、XhoⅠ双酶切后,克隆进pUC18-kana载体,构建pUC18-env-kana重组质粒。按照上述方法鉴定pUC18-env-kana重组质粒中REV env基因在CEF细胞中的真核表达。
1.2.3 将REV env基因表达盒以及kana抗性基因插入MDV SC9-1基因组meq基因位点以pUC18-env-kana重组质粒为模板,Recombine-F/R引物(表 1)经PCR扩增包含meq基因插入位点前后50 bp序列同源臂的REV env基因表达盒以及kana抗性基因,利用同源重组技术插入MDV SC9-1基因组meq基因位点[20]。PCR产物用DpnⅠ酶消化1 h,在2 000 V/100 Ω/25 μF的条件下,利用电转化仪将PCR产物转化进已含有SC9-1-BAC的大肠杆菌EL250中,转化后的菌涂于含有卡那霉素抗性的LB平板中。16 h后挑取单菌落利用JC-F/R引物经PCR鉴定REV env基因表达盒以及kana抗性基因是否插入MDV SC9-1基因组meq基因位点。鉴定阳性菌落,用0.1%的阿拉伯糖诱导表达flp重组酶,通过位点特异性重组将kanr去除,命名为SC9-env BAC(图 1)。
1.2.4 SC9-env重组病毒的拯救以及在CEF细胞上的增殖利用QIAGEN plasmid Midi kit试剂盒提取并纯化质粒SC9-env BAC。以LipfectamineTM2000进行转染,转染后4~6 d,待出现病毒蚀斑后,分别以MDV单抗H19以及REV单抗11B118进行间接免疫荧光鉴定。收获阳性重组病毒,用0.25%胰酶消化含有重组病毒的细胞,用冻存液重悬细胞后将其冻存于液氮中,重组病毒命名为SC9-env。为了比较SC9-1与SC9-env在CEF细胞上的复制能力,将SC9-1与SC9-env按100 PFU·孔-1的剂量分别接种长满单层CEF细胞的6孔板中,放置在含有5%CO2、37 ℃的细胞培养箱内培养。分别在接种后0、24、48、72、96、120、144 h计算MDV蚀斑数。绘制MDV的生长曲线,比较SC9-1与SC9-env在CEF细胞上复制水平的差异。
1.2.5 重组病毒SC9-env对SPF鸡的致病性将75只1日龄SPF鸡随机分为3组(每组25只),分别饲养在正压过滤空气的消毒隔离罩内,饲料、饮用水均经过高压灭菌后分别饲喂。第1、2组鸡分别以2 000 PFU·只-1的剂量腹腔接种SC9-env、SC9-1,第3组鸡作为空白对照组。分别在接种MDV后7、14、21、28 d称量各组鸡的体重,评价SC9-1、SC9-env对SPF鸡生长性能的影响。接种后每天观察各组鸡的临床症状并记录鸡的死亡数。试验期间,对各组死亡鸡进行剖检,并取有病变的脏器做石蜡切片,HE染色后进行病理组织学观察,判定是否由MDV引起的死亡。在接种MDV 90 d后,所有存活鸡均采用CO2安乐死并剖检,观察记录鸡的病变。
1.2.6 重组病毒SC9-env对SPF鸡的免疫保护为了比较SC9-env对SPF鸡感染vv MDV rMd5的免疫保护效果。将100只1日龄SPF鸡,随机分为4组(每组25只),第1、2组鸡分别以2 000 PFU·只-1的剂量腹腔接种SC9-env、SC9-1,第3、4组分别作为攻毒对照组、空白对照组。免疫5 d后,第1、2、3组分别以1 000 PFU·只-1的剂量腹腔接种vv MDV rMd5。攻毒后每天观察各组鸡的临床症状并记录鸡的死亡数。饲养90 d后,所有存活鸡均采用CO2安乐死并剖检观察其病变。选取病变的组织、脏器,并且每组随机选取3只分别取其心、肾、肝做石蜡切片,HE染色,进行病理组织学观察。疫苗免疫保护效力由保护指数(protective index, PI)来评价,免疫组PI计算方法:
| $ {\rm{PI}} = \frac{{攻毒对照组{\rm{MD}}发病率{\rm{ - }}免疫组{\rm{MD}}发病率}}{{攻毒对照组{\rm{MD}}发病率}} \times 100。$ |
为了比较SC9-env对SPF鸡感染REV SNV的免疫保护效果。将100只1日龄SPF鸡,按照上述试验方式进行分组、免疫。免疫14 d后,第1、2、3组分别以2 000 TCID50·只-1的剂量腹腔接种REV SNV。SNV接种后14 d,各组鸡均免疫NDV、AIV H9灭活苗。分别在接种SNV后7、14、21、28 d称量各组鸡的体重,攻毒后每天观察各组鸡的临床症状并记录鸡的死亡数。饲养70 d后,所有存活鸡均采用CO2安乐死并剖检观察其病变。
2 结果 2.1 REV env基因的真核表达重组质粒的鉴定利用PCR扩增长1 782 bp的REV env基因,克隆进pcDNA3.1 (+)载体,构建的重组质粒pcDNA-env转染CEF细胞,以REV单抗11B118进行IFA鉴定,发出亮绿色荧光。将pcDNA-env的env基因表达盒与卡那霉素抗性基因串联克隆进pUC18载体,构建重组质粒pUC18-env-kana。将pUC18-env-kana质粒转染CEF细胞,以REV单抗11B118进行IFA鉴定,发出亮绿色荧光(图 2A,黑白图中未能体现,下同);pUC18-kana质粒转染CEF细胞以及空白CEF细胞以REV单抗11B118进行IFA鉴定,均没有发出亮绿色荧光(图 2B、C);证实pUC18-env-kana质粒在CEF细胞能够表达REV env基因。

|
A. pUC18-env-kana质粒转染CEF细胞;B. pUC18-kana质粒转染CEF细胞;C.空白CEF细胞 A. CEF cells transfected by pUC18-env-kana plasmid; B. CEF cells transfected by pUC18-kana plasmid; C. Blank CEF cells 图 2 REV env基因的真核表达重组质粒的IFA鉴定(200 ×) Figure 2 IFA identification of REV env expressed by the recombinant eukaryotic plasmid (200 ×) |
利用同源重组技术将REV env基因表达盒插入SC9-1基因组的meq基因位点,构建了SC9-env BAC,转染CEF细胞7 d后出现典型的MDV蚀斑(图 3A),以MDV单抗H19、REV单抗11B118进行IFA鉴定,蚀斑均能发出亮绿色荧光(图 3C、D),重组MDV命名为SC9-env;而SC9-1蚀斑仅能与MDV单抗H19发生反应,发出亮绿色荧光(图 3E、F);空白CEF细胞没有亮绿色荧光(图 3G、H)。结果表明,SC9-env能够表达REV env蛋白。

|
A. MDV SC9-env形成的蚀斑;B.空白CEF细胞;C. SC9-env蚀斑H19单抗IFA鉴定;D. SC9-env蚀斑11B118单抗IFA鉴定;E. SC9-1蚀斑H19单抗IFA鉴定;F. SC9-1蚀斑11B118单抗IFA鉴定;G.空白CEF细胞H19单抗IFA鉴定;H.空白CEF细胞11B118单抗IFA鉴定 A. Plaque formed by MDV SC9-env; B. Blank CEF cells; C. IFA analysis of SC9-env plaque by H19 monoclonal antibody; D. IFA analysis of SC9-env plaque by 11B118 monoclonal antibody; E. IFA analysis of SC9-1 plaque by H19 monoclonal antibody; F. IFA analysis of SC9-1 plaque by 11B118 monoclonal antibody; G. IFA analysis of blank CEF cells by H19 monoclonal antibody; H. IFA analysis of blank CEF cells by 11B118 monoclonal antibody 图 3 重组MDV SC9-env的拯救及IFA鉴定(100×) Figure 3 Rescue and IFA identification of recombinant MDV SC9-env (100×) |
将SC9-env与SC9-1分别感染CEF细胞进行病毒复制动态测定,结果显示:在病毒感染后的24、48、72、96、120、144 h,SC9-env可在CEF细胞良好的复制,与SC9-1相比,SC9-env在CEF细胞的复制减慢,但是差异不显著(图 4)。

|
图 4 SC9-env在CEF细胞上的复制曲线 Figure 4 Replication kinetics of SC9-env in CEF cells |
SC9-env接种组鸡个体大小均一,生长良好,没有MD特有的临床症状,体重与SC9-1组以及空白对照组鸡相比差异不显著(表 2)。整个试验期间,SC9-env接种组鸡没有出现鸡只死亡,存活率100%,剖检所有鸡,均没有发现MDV引起的肿瘤。SC9-1组与空白对照组鸡同样没有出现鸡死亡以及MDV诱发的肿瘤(表 3)。结果表明,SC9-env对SPF鸡没有明显的致病性以及致肿瘤性,对接种鸡的体重没有显著影响。
|
|
表 2 重组MDV SC9-env对SPF鸡体重的影响(x±s) Table 2 Effects of recombinant MDV SC9-env on body weight of SPF chickens (x±s) |
SC9-env对SPF鸡感染vv MDV rMd5的免疫保护效果。与空白对照组相比,rMd5攻毒对照组鸡群个体明显偏小,大小不均,鸡出现明显的瘫痪症状,攻毒后2周鸡陆续出现死亡(图 5)。SC9-env免疫攻毒组、SC9-1免疫攻毒组鸡长势正常,没有出现MD临床症状。试验期间,SC9-env免疫攻毒组有2只鸡死亡,SC9-1免疫攻毒组有1只鸡死亡,剖检,均没有发现肉眼可见的肿瘤结节,心、肝组织病理切片可见少量淋巴细胞浸润(图 6A、B、E、F);rMd5攻毒对照组有23只鸡死亡,其中6只鸡出现肉眼可见的肿瘤结节,心、肝组织病理切片可见肿瘤淋巴细胞浸润,心肌细胞被肿瘤细胞取代(图 6C、G)。rMd5攻毒后90 d剖检所有存活鸡,空白对照组、SC9-env免疫攻毒组以及SC9-1免疫攻毒组鸡正常,没有出现肉眼可见的肿瘤结节;rMd5攻毒对照组有1只鸡肝出现明显的肿瘤结节。基于攻毒对照组vv MDV rMd5引起感染鸡的病变率,SC9-env对SPF鸡能够提供92%的免疫保护,SC9-1对SPF鸡能够提供96%的免疫保护(表 3,图 5)。
|
|
表 3 SC9-env对SPF鸡的致病性及免疫保护效果 Table 3 Pathogenicity and immune protective efficacy of SC9-env on SPF chickens |

|
图 5 疫苗免疫后接种MDV rMd5各组鸡的生存曲线 Figure 5 Survival curves of chickens challenged with MDV rMd5 after immunization |

|
图 6 心、肝病理组织切片图(HE,205×) Figure 6 Pathologic section of heart and liver (HE, 205×) |
SC9-env对SPF鸡感染REV SNV的免疫保护效果。整个试验周期,各组鸡均没有出现死亡,剖检均没有发现肉眼所见的肿瘤结节。与空白对照组相比,除SC9-env+SNV组攻毒后7 d外,各SNV攻毒组体重均显著降低(P < 0.05)(表 4)。SC9-env免疫攻毒组鸡的体重在7、14、21、28 d均显著高于SNV攻毒组以及SC9-1免疫攻毒组(P < 0.05)。SC9-env免疫攻毒组鸡的NDV、AIV H9抗体水平均显著高于SNV攻毒组以及SC9-1免疫攻毒组(P < 0.05)(图 7)。
|
|
表 4 SC9-env接种对感染REV SNV鸡体重的影响(x±s) Table 4 Effects of SC9-env on body weight of SPF chickens challenged with REV SNV (x±s) |

|
同一字母表示数据差异不显著(P>0.05);不同字母表示数据差异显著(P<0.05) The same letters indicate the differences of the data were not significant (P>0.05), the different letters indicate the differences of the data were significant (P < 0.05) 图 7 接种REV SNV各组鸡AIV H9、NDV抗体水平 Figure 7 The antibody levels induced by AIV H9 and NDV inactivated vaccines in chickens challenged with REV SNV |
MDV分为Ⅰ、Ⅱ、Ⅲ三个血清型,其中血清Ⅰ型为致病型,近年来MDV毒力不断增强[21]。Lee等[22-23]利用黏粒系统构建了MDV Md5的meq基因缺失株rMd5Δmeq,比MD商品疫苗CVI988/Rispens具有更好的免疫保护效果。本实验室利用BAC技术构建的MDV meq基因缺失株SC9-1,不但对鸡群的免疫保护效果优于CVI988/Rispens,而且具有良好的生物安全性。MDV载体疫苗具有抗母源抗体干扰、免疫持续期长等优点,一直是人们研究的热点。以血清Ⅲ型MD疫苗HVT作为载体,构建的重组MDV能够稳定地表达NDV、AIV、IBDV等外源病毒基因,并且对鸡群ND、AI、IBD以及MD具有一定的免疫保护[24-26]。随着MDV超强毒株、特超强毒株的出现,HVT疫苗对鸡群MD已经不能提供理想的免疫保护。以血清Ⅰ型MDV CVI988/Rispens、814株构建的重组MDV对鸡群ND、IB、IBD以及MD均具有良好的免疫保护[27-29]。
前期的研究已经证实我国鸡群普遍存在REV的感染,虽然REV感染鸡群的致死率较低,但是REV引起的免疫抑制较强,尤其可显著抑制对NDV、AIV灭活疫苗免疫后的抗体反应,继发的细菌感染更是增加了对养禽业的危害[17]。迄今为止,国内外尚没有用于预防REV感染的疫苗,研究发现构建的REV gp90基因真核表达质粒及其蛋白对于预防鸡群REV的感染均具有良好的免疫效果[30-31]。基于本实验室构建的免疫效果比CVI988/Rispens更好的MD疫苗候选株SC9-1,利用Red E/T同源重组技术将REV env基因表达盒插入SC9-1基因组的meq基因位点,构建了重组MDV SC9-env。利用REV单抗11B118作为一抗经IFA鉴定,SC9-env在CEF细胞稳定的表达REV的env蛋白,表明SC9-1的meq位点能够插入外源基因并且稳定表达。病毒在CEF细胞的增殖试验显示SC9-env与SC9-1在细胞上的复制水平相似,表明REV env基因的插入没有显著影响重组MDV的复制。1日龄SPF鸡接种SC9-env,鸡群没有死亡以及肿瘤的发生,体重与空白对照组相比差异不显著,表明SC9-env对SPF鸡没有明显的致病性。动物免疫保护试验结果表明SC9-1对感染MDV rMd5的SPF鸡提供96%的免疫保护;SC9-env提供92%的免疫保护,差异不显著,证实SC9-env对于MDV rMd5能够提供良好的免疫保护。本实验室前期研究表明SC9-1对于MDV rMd5提供92%~100%的免疫保护,而CVI988/Rispens提供60%~70%的免疫保护。虽然试验不是同时进行,但是SC9-1的免疫效果相似,因此可以推测SC9-env能够提供比CVI988/Rispens更好的免疫效果,然而这一推测尚需要试验验证。相比空白对照组鸡,感染REV SNV的SPF鸡呈现较强的免疫抑制,鸡的体重以及免疫AIV、NDV灭活苗诱导的抗体水平均显著下降,而SC9-env免疫组鸡的体重以及免疫AIV、NDV灭活苗诱导的抗体水平均显著高于SNV攻毒组,证实SC9-env能够降低SNV感染SPF鸡引起的体重减轻以及灭活苗抗体水平的下降。
总之,MDV疫苗候选株SC9-1作为病毒载体能够稳定表达外源基因,构建的重组MDV SC9-env对SPF鸡没有明显的致病性,对SPF鸡感染MDV、REV均具有良好的免疫保护效果。然而,SC9-env作为免疫防控REV感染的重组MDV载体疫苗,其生物安全性尤其是转基因生物安全评价尚需进一步全面系统研究。SC9-env作为疫苗候选株不同免疫方式、不同免疫剂量以及对不同靶动物(海兰褐、海兰白等品系鸡)的免疫效力,同样需要大规模的田间试验进行比较分析。
4 结论利用同源重组技术构建的表达禽网状内皮组织增生病病毒env基因的重组马立克病毒SC9-env能够稳定复制,对感染马立克病毒、禽网状内皮组织增生病病毒的SPF鸡具有良好的免疫保护效果,为鸡群马立克病、禽网状内皮组织增生病的免疫防控奠定基础。
| [1] | CHURCHILL A E, BIGGS P M. Agent of Marek's disease in tissue culture[J]. Nature, 1967, 215(5100): 528–530. DOI: 10.1038/215528a0 |
| [2] | SAIF Y M, FADLY A M, GLISSON J R, et al. Diseases of poultry[M]. 12th ed. Ames: Black-Well, 2008: 452-514. |
| [3] | WITTER R L. Characteristics of Marek's disease viruses isolated from vaccinated commercial chicken flocks:Association of viral pathotype with lymphoma frequency[J]. Avian Dis, 1983, 27(1): 113–132. DOI: 10.2307/1590377 |
| [4] | WITTER R L, CALNEK B W, BUSCAGLIA C, et al. Classification of Marek's disease viruses according to pathotype:Philosophy and methodology[J]. Avian Pathol, 2005, 34(2): 75–90. DOI: 10.1080/03079450500059255 |
| [5] | CHURCHILL A E, CHUBB R C, BAXENDALE W. The attenuation, with loss of oncogenicity, of the herpes-type virus of Marek's disease (Strain HPRS-16) on passage in cell culture[J]. J Gen Virol, 1969, 4(4): 557–564. DOI: 10.1099/0022-1317-4-4-557 |
| [6] | WITTER R L, NAZERIAN K, PURCHASE H G, et al. Isolation from turkeys of a cell-associated herpesvirus antigenically related to Marek's disease virus[J]. Am J Vet Res, 1970, 31(3): 525–538. |
| [7] | WITTER R L. Safety and comparative efficacy of the CVI988/Rispens vaccine strain[C]//Proceedings of the 4th International Symposium on Marek's Disease, 19th World's Poultry Congress. Netherlands: World`s Poultry Science Association, 1992: 315-319. |
| [8] | CUI N, SU S, SUN P, et al. Isolation and pathogenic analysis of virulent Marek's disease virus field strain in China[J]. Poult Sci, 2016, 95(7): 1521–1528. DOI: 10.3382/ps/pew073 |
| [9] | YU Z H, TENG M, LUO J, et al. Molecular characteristics and evolutionary analysis of field Marek's disease virus prevalent in vaccinated chicken flocks in recent years in China[J]. Virus Genes, 2013, 47(2): 282–291. DOI: 10.1007/s11262-013-0942-y |
| [10] | ZHANG Y P, LI Z J, BAO K Y, et al. Pathogenic characteristics of Marek's disease virus field strains prevalent in China and the effectiveness of existing vaccines against them[J]. Vet Microbiol, 2015, 177(1-2): 62–68. DOI: 10.1016/j.vetmic.2014.12.020 |
| [11] | WITTER R L, KREAGER K S. Serotype 1 viruses modified by backpassage or insertional mutagenesis:Approaching the threshold of vaccine efficacy in Marek's disease[J]. Avian Dis, 2004, 48(4): 768–782. DOI: 10.1637/7203-050304R |
| [12] | ZHANG Z, CUI Z Z. Isolation of recombinant field strains of Marek's disease virus integrated with reticuloendotheliosis virus genome fragments[J]. Sci China Ser C Life Sci, 2005, 48(1): 81–88. DOI: 10.1360/03yc0270 |
| [13] | SUN A J, LAWRENCE P, ZHAO Y G, et al. A BAC clone of MDV strain GX0101 with REV-LTR integration retained its pathogenicity[J]. Chin Sci Bull, 2009, 54(15): 2641–2647. |
| [14] | SU S, CUI N, CUI Z Z, et al. Complete genome sequence of a recombinant Marek's disease virus field strain with one reticuloendotheliosis virus long terminal repeat insert[J]. J Virol, 2012, 86(24): 13818–13819. DOI: 10.1128/JVI.02583-12 |
| [15] | SU S, CUI N, ZHOU Y, et al. A recombinant field strain of Marek's disease (MD) virus with reticuloendotheliosis virus long terminal repeat insert lacking the meq gene as a vaccine against MD[J]. Vaccine, 2015, 33(5): 596–603. DOI: 10.1016/j.vaccine.2014.12.057 |
| [16] | SUN S H, CUI Z Z, QU L X. Maternal antibody protected chicks from growth retardation and immunosuppression induced by early reticuloendotheliosis virus infection[J]. Agric Sci China, 2007, 6(6): 762–768. DOI: 10.1016/S1671-2927(07)60110-2 |
| [17] | YANG Y L, ZHAO J, MA Z J, et al. Serological survey of Reticuloendotheliosis virus infection in chickens in China in 2005 to 2015[J]. Poult Sci, 2017, 96(11): 3893–3895. DOI: 10.3382/ps/pex209 |
| [18] | REDDY S M, LUPIANI B, GIMENO I M, et al. Rescue of a pathogenic Marek's disease virus with overlapping cosmid DNAs:Use of a pp38 mutant to validate the technology for the study of gene function[J]. Proc Natl Acad Sci USA, 2002, 99(10): 7054–7059. DOI: 10.1073/pnas.092152699 |
| [19] |
吉荣, 崔治中, 王锡乐, 等. 分子克隆化禽网状内皮组织增生症病毒传染性及其前病毒全基因组序列研究[J]. 病毒学报, 2005, 21(6): 448–455.
JI R, CUI Z Z, WANG X L, et al. Study of the infectivity of the molecular cloned reticuloendotheliosis virus and its genome[J]. Chinese Journal of Virology, 2005, 21(6): 448–455. (in Chinese) |
| [20] | JAROSINSKI K W, OSTERRIEDER N, NAIR V K, et al. Attenuation of Marek's disease virus by deletion of open reading frame RLORF4 but not RLORF5a[J]. J Virol, 2005, 79(18): 11647–11659. DOI: 10.1128/JVI.79.18.11647-11659.2005 |
| [21] | SCHAT K A, NAIR V. Marek's disease[M]//SWAYNE D E, GLISSON J R, MCDOUGALD L R, et al. Diseases of Poultry. 13th ed. Ames: Black-Well, 2013: 407-467. |
| [22] | LEE L F, KREAGER K S, ARANGO J, et al. Comparative evaluation of vaccine efficacy of recombinant Marek's disease virus vaccine lacking Meq oncogene in commercial chickens[J]. Vaccine, 2010, 28(5): 1294–1299. DOI: 10.1016/j.vaccine.2009.11.022 |
| [23] | LEE L F, HEIDARI M, ZHANG H M, et al. Cell culture attenuation eliminates rMd5ΔMeq-induced bursal and thymic atrophy and renders the mutant virus as an effective and safe vaccine against Marek's disease[J]. Vaccine, 2012, 30(34): 5151–5158. DOI: 10.1016/j.vaccine.2012.05.043 |
| [24] | PALYA V, KISS I, TATÁR-KIS T, et al. Advancement in vaccination against Newcastle disease:Recombinant HVT NDV provides high clinical protection and reduces challenge virus shedding with the absence of vaccine reactions[J]. Avian Dis, 2012, 56(2): 282–287. DOI: 10.1637/9935-091511-Reg.1 |
| [25] | KAPCZYNSKI D R, DORSEY K, CHRZASTEK K, et al. Vaccine protection of turkeys against H5N1 highly pathogenic avian influenza virus with a recombinant turkey herpesvirus expressing the hemagglutinin gene of avian influenza[J]. Avian Dis, 2016, 60(2): 413–417. DOI: 10.1637/11267-090115-Reg |
| [26] | ISHIHARA Y, ESAKI M, SAITOH S, et al. Combination of two Marek's disease virus vectors shows effective vaccination against Marek's disease, infectious bursal disease, and Newcastle disease[J]. Avian Dis, 2016, 60(2): 473–479. DOI: 10.1637/11359-122615-RegR |
| [27] | ZHANG X R, WU Y T, HUANG Y Z, et al. Protection conferred by a recombinant Marek's disease virus that expresses the spike protein from infectious bronchitis virus in specific pathogen-free chicken[J]. Virol J, 2012, 9: 85. DOI: 10.1186/1743-422X-9-85 |
| [28] | SAKAGUCHI M, NAKAMURA H, SONODA K, et al. Protection of chickens with or without maternal antibodies against both Marek's and Newcastle diseases by one-time vaccination with recombinant vaccine of Marek's disease virus type 1[J]. Vaccine, 1998, 16(5): 472–479. DOI: 10.1016/S0264-410X(97)80001-1 |
| [29] | LI K, LIU Y Z, ZHANG Y P, et al. Protective efficacy of a novel recombinant Marek's disease virus vector vaccine against infectious bursal disease in chickens with or without maternal antibodies[J]. Vet Immunol Immunopathol, 2017, 186: 55–59. DOI: 10.1016/j.vetimm.2017.02.003 |
| [30] | YUAN F, CHU Y, QI L H, et al. Immunoprotection induced by CpG-ODN/Poly(I:C) combined with recombinant gp90 protein in chickens against reticuloendotheliosis virus infection[J]. Antiviral Res, 2017, 147: 1–10. DOI: 10.1016/j.antiviral.2017.04.019 |
| [31] | LI K, GAO L, GAO H L, et al. Protection of chickens against reticuloendotheliosis virus infection by DNA vaccination[J]. Vet Microbiol, 2013, 166(1-2): 59–67. DOI: 10.1016/j.vetmic.2013.04.031 |



