2. 甘肃农业大学动物科技学院, 兰州 730050
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730050, China
在高寒牧区,牦牛产毛是其除产肉、产奶外又一重要经济性状。由于白毛便于染色,因此它的经济价值高于其他毛色的毛。毛色既是牦牛品种的标志,亦是决定牦牛毛绒经济价值的关键。因而在牦牛育种中毛色选育具有重要意义。目前,牦牛毛色形成的分子机制鲜有报道,通常大多数牦牛全身被毛呈黑色或夹有少量棕黑色纤维,其中大通牦牛是被毛黑褐色,是以野牦牛为父本,当地家牦牛为母本培育出的肉用型新品种。而天祝白牦牛因其被毛洁白如雪的外貌特征,被誉为“白珍珠”,是世界上稀有的珍贵牦牛遗传资源。
动物的毛色是研究表型遗传机制的理想模型[1]。家养动物的毛色作为一种可见性状,被广泛用于品种鉴定。在哺乳动物中,动物的毛色取决于真黑素(黑/棕色)和褐黑素(黄/红)的数量及比例,该开关位点受到由Agouti和Extension基因座分别编码的鼠灰色基因(Agouti signaling protein gene,ASIP)和黑素皮质素受体1(melanocortin 1 receptor,MC1R)调控。黑色素生成过程中MC1R/ASIP/α-MSH信号通路发挥重要的作用[2]。已有研究表明,MC1R被视为影响黑色素合成的主控基因之一[3]。细胞膜上MC1R与天然配体激动剂促黑素细胞激素(α-MSH)结合后,活化的G蛋白会激活膜上的腺苷酸环化酶系统,经过一系列反应激活酪氨酸酶(TYR),催化真黑素形成[4]。而ASIP能够竞争性结合至MC1R,导致真黑色素合成减少,促进褐黑色素生成。此外,小眼畸形相关转录因子(MITF)通过与酪氨酸酶启动子区域结合而调控TYR的表达,TYR表达上调进而真黑素合成增加[5]。所以,在研究黑色素生成过程中,MC1R基因对毛色生成起到重要的调控作用。
虽然在多种动物中对MC1R基因展开了广泛而深入研究[6-7],但对于MC1R是否直接参与影响牦牛毛色及黑色素合成的调控机制却鲜有报道。因此本试验以大通牦牛(黑褐色)和天祝白牦牛(白色)为研究对象,首先通过染色初步确定黑色素细胞和黑色素的分布情况,其次通过qRT-PCR分析MC1R基因在两种毛色牦牛皮肤中的差异表达,最后在细胞水平上探讨MC1R与其它毛色相关基因(Agouti、MITF、TYR)和黑色素生成的关系,初步阐明牦牛黑色素沉积的内在调控机理,为牦牛毛色研究提供理论依据。
1 材料与方法 1.1 材料 1.1.1 shRNA MC1R干扰载体的构建将4个靶向MC1R基因不同mRNA部位的shRNA序列克隆到shRNA载体上,构建成pAV-4in1shRNA-GFP载体,该表达载体上连有绿色荧光报告蛋白(green fluorescent protein,GFP),可根据绿色荧光信号强弱判断转染效果,shRNA重组干扰载体、阴性对照载体均由山东维真(Vigenebio)生物技术有限公司构建。小鼠黑色素瘤(B16)细胞购自中国科学院上海细胞库。
1.1.2 组织样采集分别挑选年龄相近的大通牦牛和天祝白牦牛各6头,剪掉背部左侧被毛并刮净表皮,用手术刀分离2 cm×5 cm皮肤组织块,剔除皮下结缔组织和脂肪,生理盐水冲洗干净后放入液氮保存。
1.2 主要试剂与仪器 1.2.1 主要试剂甲苯胺蓝(Solarbio,中国),TRIzol、转染试剂(Invirtrogen,美国),SYBR Premix Ex TaqⅡ、PrimeScriptTM RT-PCR Kit(TaKaRa),冰冻切片组织包埋剂(Sakura,美国),RIPA蛋白裂解液、BCA蛋白定量试剂盒、10×Tris-Glycine-SDS电泳缓冲液(Beyotime,中国)
1.2.2 主要仪器超速冷冻离心机、NanoDrop 2000(Thermo,德国),Real-time PCR扩增仪(Bio-Rad,美国),DYY-6C型平板电泳槽(六一仪器厂),凝胶成像系统(Tanon 2500)、冰冻切片机、普通光学显微镜、倒置荧光显微镜、CO2细胞培养箱HF90(Heal force)(Leica,德国)。
1.3 冰冻切片制作及甲苯胺蓝染色 1.3.1 冰冻切片的制作从液氮中取出新鲜组织,用手术刀修剪成1.5 cm×0.5 cm×0.5 cm的组织块,置于冰冻切片包埋盒中,加入包埋剂,-20 ℃冰箱冷冻过夜后,进行切片,镜检。
1.3.2 甲苯胺蓝染色皮肤组织冰冻块纵向进行6 μm连续切片,60 ℃烤片1.5 h;二甲苯透明,梯度酒精(浓度从大~小)复水,蒸馏水洗,0.5%甲苯胺蓝溶液染色,蒸馏水洗,梯度酒精(浓度从小~大)脱水,二甲苯透明,中性树脂胶封片,镜检。
1.4 qRT-PCR检测基因mRNA相对表达量 1.4.1 总RNA提取和反转录TRIzol法分别提取皮肤组织样和B16细胞总RNA,NanoDrop 2000超微量分光光度计测定其浓度及纯度,选择A260 nm/A280 nm为1.8~2.0的RNA样品, 经1%琼脂糖凝胶电泳检测其完整性,选择完整性好的RNA, 将其浓度调整为500 ng·μL-1,按照反转录试剂盒操作说明,以Oligo(dT)18为引物,采用两步法合成第一链cDNA, -20 ℃冰箱保存。
1.4.2 引物设计与合成根据NCBI数据库中提供的牛β-actin(登录号:NM_173979.3)和MC1R(登录号:NM_174108.2);小鼠β-actin(登录号:NM_007393.5),Agouti(登录号:NM_007427.3),MITF(登录号:NM_001113198.1),MC1R(登录号:NM_008559.2)、TYR(登录号:NM_011661.5)基因mRNA序列,利用Primer Premier 5.0设计引物,然后用NCBI中的BLAST检测引物特异性,引物由苏州泓迅生物科技有限公司合成(表 1)。
|
|
表 1 荧光定量PCR引物序列 Table 1 Primer sequences used for real-time PCR |
反应体系为25 μL:SYBR Premix Ex Taq Ⅱ 12.5 μL,上、下游引物各1 μL,cDNA 1 μL,加水补足至25 μL。每个样品设计3个重复。反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环。以β-actin为内参基因,通过2-ΔΔCt法计算各目的基因的相对表达量。
1.5 MC1R基因在小鼠黑色素瘤(B16)细胞上的功能验证 1.5.1 shRNA序列设计根据GenBank数据库中小鼠MC1R基因序列信息,设计与合成对目的基因具有特异性的shRNA。双链shRNA设计在靶基因mRNA起始密码下游120~180 bp至翻译终止密码上游50~100 bp查找AA序列,并记录每个AA 3′端连续相邻19个核苷酸作为shRNA候选靶位点。其中AA(N19)TT是最理想的序列,若靶mRNA中无此序列,亦可选用NA(N21)。在shRNA合成时,有义链3′端需用dTdT代替。最后将候选shRNA序列在GenBank与目的靶基因进行BLAST检索,与非同源基因具有3个或3个以上碱基相同的序列均可选用。
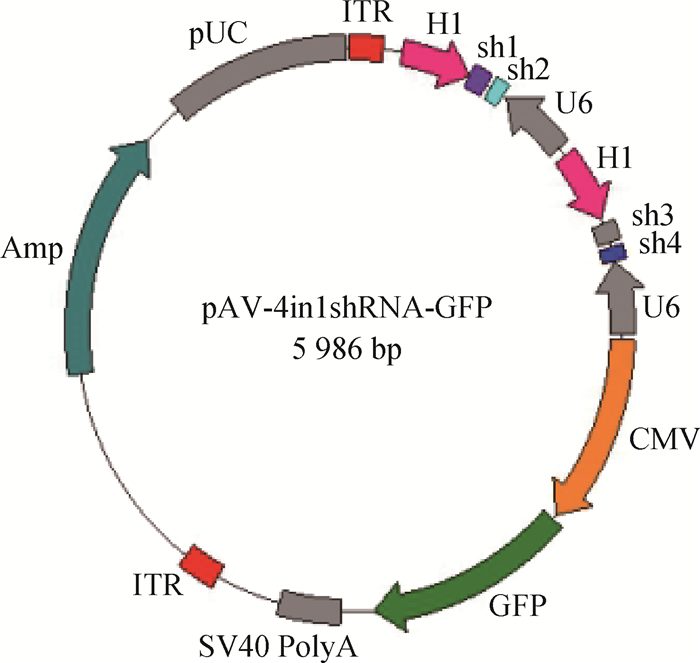
Mock-shRNA即阴性对照的shRNA,与选中的shRNA序列有相同碱基长度,但与靶基因无明显同源性。防止特异性shRNA与靶细胞中的其他基因有同源性,将特异性shRNA的序列打乱,再次进行BLAST比对。shRNA重组质粒载体由山东维真(Vigenebio)生物技术有限公司设计合成(表 2、图 1)。
|
|
表 2 shRNA干扰片段序列 Table 2 Parameters of the short hairpin RNA(shRNA) |
|
图 1 pAV-4in1shRNA-GFP载体结构示意图 Figure 1 Schematic diagram of pAV-4in1shRNA-GFP vector |
将B16细胞培养于6孔板中,设置试验组、阴性对照组和空白组。当细胞密度达到50%~60%时,即接种24 h内,添加脂质体和载体的混合物。通过荧光显微镜和普通光学显微镜在不同时间点观察转染效果。
1.5.3 细胞蛋白提取和Western blot检测RIPA蛋白裂解液提取转染36 h后细胞总蛋白,采用常规Western blot方法,对MC1R蛋白表达情况进行检测,并用Quantity one软件进行蛋白灰度值分析。β-actin作为内参,目的蛋白与内参蛋白比对,进行半定量分析。
1.5.4 黑色素含量测定收集转染后各组B16细胞,PBS冲洗2~3次后,0.2 mol·L-1 NaOH溶解细胞,用酶标仪在475 nm波长进行测值,每个样品重复5次。用乌贼墨标准品作标准曲线[8]。
1.6 数据分析应用SPSS 19.0软件进行单因素方差分析和Duncan法多重比较。所有数据均以“平均值±标准误”表示。P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 皮肤组织形态学观察大通牦牛与天祝白牦牛皮肤组织冰冻切片能观察到完整的皮肤结构(图 2A,2D)。进一步放大发现,牦牛表皮角质层较薄,真皮层较厚(图 2B,2E),同时观察到完整的毛囊、毛球等毛干结构,与常见的哺乳动物皮肤组织结构大体相似(图 2C,2F)。通过甲苯胺蓝染色可知,大通牦牛和天祝白牦牛的皮肤中均有黑色素颗粒的分布,但含量却存在差异(图 3a,3d)。大通牦牛和天祝白牦牛表皮和真皮均分布着大量黑色素细胞,黑色素颗粒大量存在于大通牦牛皮肤的表皮层中,而天祝白牦牛只在皮肤表皮基底层检测到少量黑色素颗粒(图 3b,3e)。大通牦牛毛根、外根鞘、毛髓质有大量的黑色素颗粒存在,毛乳头黑素色含量较少,而天祝白牦牛只在毛根处检测到少量黑色素颗粒(图 3c,3f)。

|
A~C.大通牦牛;D~F.天祝白牦牛。A、D.皮肤组织(100×);B、E.表皮层和真皮层(200×);C、F.毛干(100×)。1.表皮;2.真皮;3.毛球;4.毛囊 A-C.Datong yak; D-F. Tianzhu white yak. A, D. Skin tissue(100×); B, E. Epidermis and dermis(200×); C, F. Hair shaft(100×). 1. Epidermis; 2. Dermis; 3. Hair bulb; 4. Hair follicle 图 2 不同毛色牦牛皮肤组织冰冻切片 Figure 2 The frozen sections without staining in different colors yak skin tissue |

|
a~c.大通牦牛;d~f.天祝白牦牛。a、d.皮肤组织的黑色素分布(100×);b、e.皮肤组织表皮和真皮层黑色素及黑色素细胞的分布(200×);c、f.皮肤组织毛干黑色素及黑色素细胞的分布(200×)。5.毛乳头;6.黑色素;7.黑色素细胞 a-c. Datong yak; d-f. Tianzhu white yak. a, d. Distribution of melanin in skin tissue(100×); b, e. Distribution of melanin and melanocytes in epidermis and dermis of skin tissue(200×); c, f. Distribution of melanin and melanocytes in hair dry of skin tissue(200×). 5. Hair papilla; 6. Melanin; 7. Melanocytes 图 3 不同毛色牦牛皮肤组织甲苯胺蓝染色 Figure 3 Toluidine blue staining of skin of yak with different coat colors |
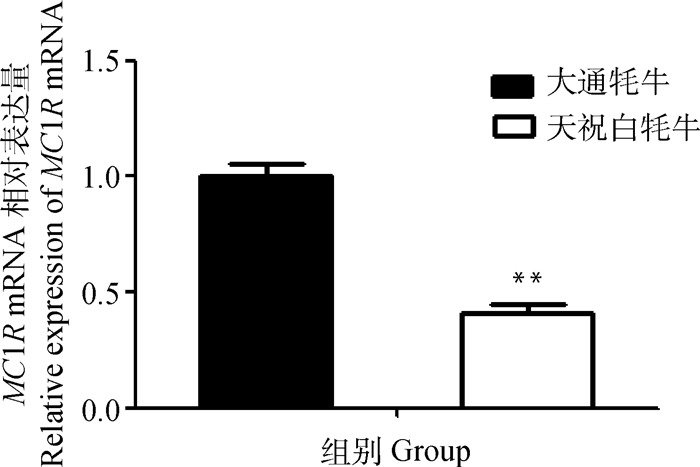
分别以大通牦牛与天祝白牦牛皮肤组织总RNA反转录cDNA为模板,经qRT-PCR分析可知,大通牦牛皮肤中MC1R基因的表达量极显著高于天祝白牦牛(P < 0.01)(图 4)。
|
**代表组间差异极显著(P < 0.01)。下同 ** mean very significantly differences between the groups (P < 0.01).The same as below 图 4 不同毛色牦牛MC1R mRNA差异表达 Figure 4 Differential expression of MC1R mRNA in yak with different coat colors |
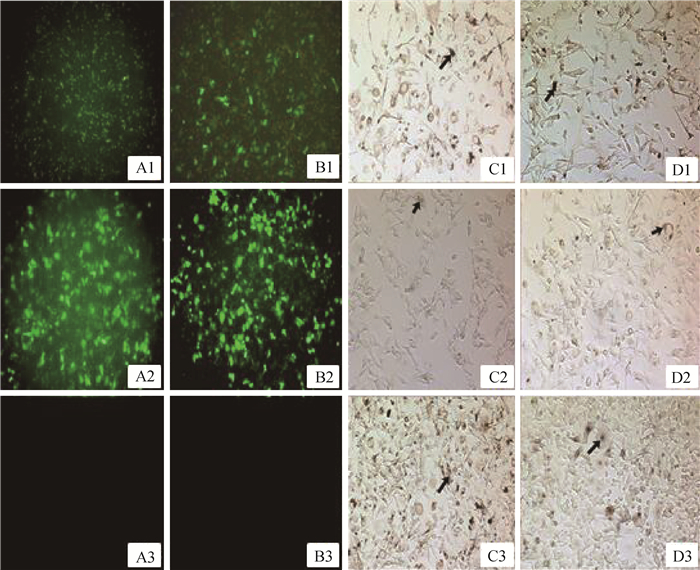
观察12和48 h后转染效率可知,与空白对照(图 5A3、B3)相比,转染12和48 h后,试验组(MC1R干扰载体)和阴性对照组(空载体)均具有较强的荧光信号(图 5A1~A2,B1~B2)。光学显微镜观察细胞形态结构可知,转染12和48 h后,细胞没有结构形态的变化,并能在视野中观察到黑色素的分布(图 5C1~C3,D1~D3),表明转染成功。
|
A1~A3.转染12 h荧光显微镜下观察到的细胞;B1~B3.转染48 h荧光显微镜下观察到的细胞;C1~C3.光学显微镜与A1~A3相同视野的对照;D1~D3.光学显微镜与B1~B3相同视野的对照。A1、B1、C1、D1.阴性对照;A2、B2、C2、D2.试验组;A3、B3、C3、D3.空白对照。↑.黑色素 A1-A3. The cells observed by fluorescence microscope 12 h after transfection; B1-B3. The cells observed by fluorescence microscope 48 h after transfection; C1-C3. The control of the same view of ordinary light microscope as A1-A3;D1-D3.The control of the same view observed by ordinary light microscope as B1-B3. A1, B1, C1, D1. Negative control; A2, B2, C2, D2. The treatment group; A3, B3, C3, D3. Blank control.↑.Melanin 图 5 B16细胞的转染效率(100×) Figure 5 The transfection efficiency in B16 cells(100×) |
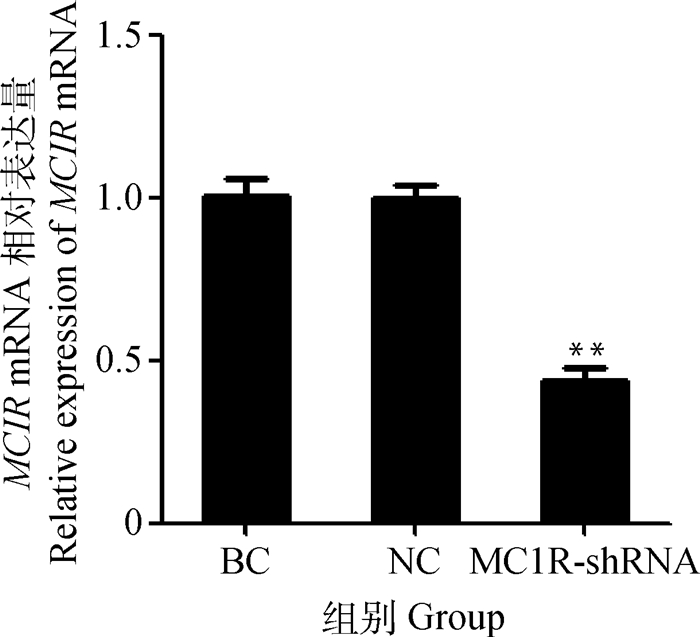
qRT-PCR检测结果显示,与对照组相比,干扰效果明显(图 6)。Western blot结果表明,与对照组相比,试验组MC1R蛋白的表达量极显著降低。综上可知,在MC1R基因转录和翻译水平上,试验组均极显著低于空白及阴性对照组(P < 0.01)(图 7),说明MC1R基因干扰成功。
|
BC.未作转染的空白对照组;NC.转染空载体的阴性对照组;MC1R-shRNA.转染MC1R干扰载体的试验组。*代表组间差异显著(P < 0.05),**代表组间差异极显著(P < 0.01)。下同 BC. Blank control group without transfection; NC. Negative control group transfected with empty vector; MC1R-shRNA. The treatment group transfected with MC1R interference vector. * mean significant differences among the groups (P < 0.05), ** mean very significantly differences among the groups (P < 0.01).The same as below 图 6 转染后MC1R mRNA的差异表达 Figure 6 Differential expression of MC1R mRNA after transfection |
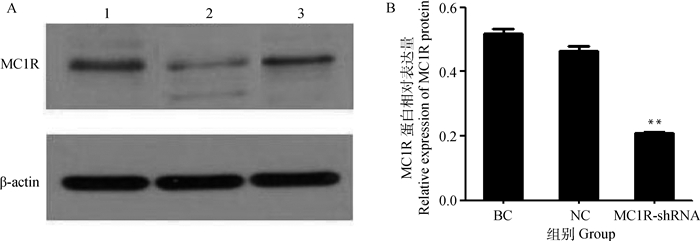
|
1. BC; 2. MC1R-shRNA; 3. NC 图 7 转染后MC1R蛋白的差异表达(A)和灰度值分析(B) Figure 7 Differential expression level (A) and the gray value(B) of MC1R protein after transfection |
由图 8可知,干扰MC1R基因后,TYR基因表达水平极显著下调(P < 0.01);MITF表达水平显著下调(P < 0.05);而Agouti基因没有显著变化。空白组与阴性对照组相比,只有MITF基因出现显著性差异(P < 0.05)。
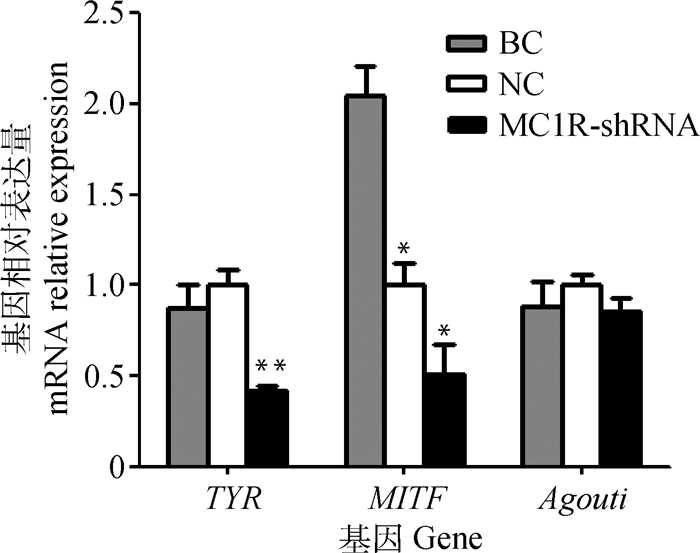
|
图 8 MC1R基因沉默后B16细胞各基因的表达 Figure 8 Expression of genes in B16 cells after MC1R gene silencing |
转染后,对各个时间点的细胞进行黑色素含量测定,结果显示,整个转染期间试验组黑色素浓度均处在较低水平,在24和36 h时浓度最低,与空白和阴性对照组相比差异极显著(P < 0.01);在12、48和60 h浓度较低,与空白和阴性对照组相比差异显著(P < 0.05)。各时间点的空白组与阴性对照组均差异不显著(P > 0.05)(图 9)。
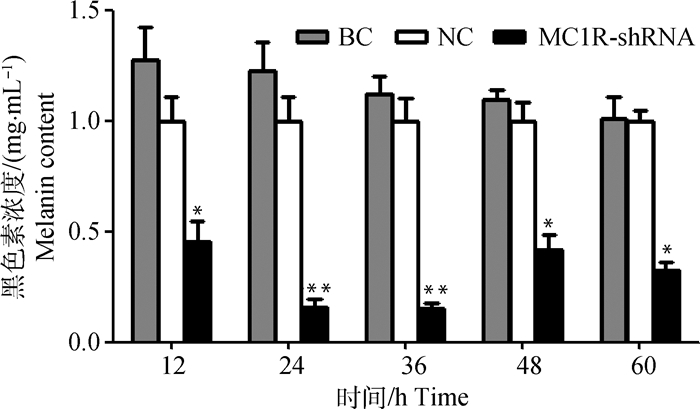
|
图 9 不同时间点黑色素浓度测定 Figure 9 Detection of melanin content at different time points |
甲苯胺蓝是一种碱性染料,可将皮肤组织中存在的大量角化细胞和角化蛋白着色,因此本试验采用甲苯胺蓝染色后发现,大通牦牛和天祝白牦牛皮肤黑色素细胞均分布在表皮基底部和毛囊外根鞘部,这与文献报道一致[9]。黑色素细胞是黑色素的生产者,产生的黑色素从黑色素细胞树枝突沿途分送给角质形成细胞。有研究者根据黑色素细胞分布部位将其分为3类:第1类分布在表皮,它们只有少量黑色素沉积;第2类分布于毛囊外根鞘中,细胞形态较小,没有黑色素分泌,但能够增殖分化;第3类分布于毛球部,形态较大并且可分泌大量黑色素,但不能增生分化[10-11]。而不同部位黑色素细胞产生的黑色素颗粒有着不同的功能,可能是由于调控机理或是传导运输机理不同导致的[12]。有研究证明,哺乳动物毛发着色主要来源于毛球部毛母质细胞间成熟黑色素细胞合成的色素[13],而与毛囊所在皮肤组织中黑色素细胞的数量以及成熟度无关[14]。皮肤的颜色决定于表皮细胞内黑色素的多少,而不决定与黑色素细胞的数目[15]。本研究发现,大通牦牛和天祝白牦牛均具有完整的皮肤结构,且大通牦牛的毛囊周围和表皮基底层存在大量黑色素,而天祝白牦牛只在表皮层检测到少量黑色素。推测其与牦牛毛色差异相关。
3.2 MC1R的表达差异MC1R基因作为控制毛色的重要候选基因之一,在黑色素合成过程中起着重要的调控作用[16]。通过对6种毛色獭兔皮肤中MC1R基因表达量检测发现,黑色表达量最高,黄色獭兔表达量最低[17]。秦珂等[18]通过检测陆川猪等8个猪种MC1R基因的基因型,证实了中外猪种间在毛色遗传上的分子差异。不同毛色绵羊皮肤组织均正常表达MC1R基因,但其表达水平存在差异,全黑绵羊皮肤中MC1R mRNA和蛋白的表达量显著高于其它3种毛色绵羊[19]。本研究发现,MC1R在大通牦牛皮肤组织中的表达量极显著高于天祝白牦牛(P < 0.01),与前人在其他物种上研究结果一致,可见MC1R基因对色素形成和沉积起着重要作用,因此选择MC1R基因作为后续研究对象。
3.3 MC1R的功能初步研究小鼠黑色素瘤细胞(B16)是源自C57小鼠的一种皮肤癌细胞,常被用作研究肿瘤发生机制和抗肿瘤药物的试验模型。B16细胞因其在体外培养也具备合成黑色素颗粒的能力[20-21],也被用来筛选促黑剂尝试治疗白癜风或白化病。本试验中,笔者在体外构建特异性干扰MC1R的shRNA重组质粒载体,重点研究MC1R是否参与黑色素生成。使用RNAi技术研究基因功能,为治疗基因相关疾病提供了一个有效的途径[22],孙笑尉等[23]通过将MC1R siRNA瞬时转染羊驼黑色素细胞后发现,黑色素生成量有明显的变化,推测MC1R与皮肤黑素细胞的黑色素生成有着密切的关系。贾秀华[24]在体外构建干扰TYR的质粒载体,通过抑制酪氨酸酶的活性进而降低黑色素的合成。窦克军和孙春宝[25]在研究中发现,siRNA沉默MC1R基因能下调TYR基因的表达,影响多巴的合成,进而黑色素生成减少。有研究表明,在MC1R功能丧失或MC1R受到与其拮抗的ASIP抑制时,TYR不能被激活而保持较低活性,导致真黑色素含量降低,出现棕色或红色等较浅的毛色性状[13]。本研究在细胞水平利用特异性shRNA抑制MC1R基因的表达后,发现MITF基因在空白组和阴性对照组表达量差异显著,可能是由于转染试剂对细胞破坏导致的。而抑制MC1R显著降低了TYR基因的表达和黑色素的合成。其原因可能是MC1R作为调控黑色素的形成过程中的关键靶基因,直接影响黑色素的合成。也可能是MC1R通过调控下游TYR基因的表达,进一步调控黑色素的合成。本试验结果表明,MC1R参与调控黑色素合成,但具体的分子机制还有待后续研究。
4 结论本研究表明,大通牦牛与天祝白牦牛皮肤中的黑色素颗粒可能是导致牦牛毛色差异的原因。细胞水平上验证发现,MC1R通过调控下游TYR的活性影响B16细胞的黑色素合成,推测大通牦牛皮肤黑色素高度沉积可能与MC1R、TYR的表达量有关。本试验为牦牛黑色素合成的分子机制提供一定的理论依据。
| [1] | HUBBARD J K, UY J A C, HAUBER M E, et al. Vertebrate pigmentation:From underlying genes to adaptive function[J]. Trends Genet, 2010, 26(5): 231–239. DOI: 10.1016/j.tig.2010.02.002 |
| [2] | RODRIGUES A R, ALMEIDA H, GOUVEIA A M. Intracellular signaling mechanisms of the melanocortin receptors:Current state of the art[J]. Cell Mol Life Sci, 2015, 72(7): 1331–1345. DOI: 10.1007/s00018-014-1800-3 |
| [3] | HADDADEEN C, LAI C, CHO S Y, et al. Variants of the melanocortin-1 receptor:Do they matter clinically?[J]. Exp Dermatol, 2015, 24(1): 5–9. DOI: 10.1111/exd.2015.24.issue-1 |
| [4] |
张俊珍, 董常生, 范瑞文, 等. 哺乳动物毛色形成研究进展[J]. 动物医学进展, 2006, 27(S1): 65–68.
ZHANG J Z, DONG C S, FAN R W, et al. Advance in pigment melanin of mammalian[J]. Progress in Veterinary Medicine, 2006, 27(S1): 65–68. (in Chinese) |
| [5] | STEINGRÍMSSON E, COPELAND N G, JENKINS N A. Melanocytes and the Microphthalmia transcription factor network[J]. Annu Rev Genet, 2004, 38: 365–411. DOI: 10.1146/annurev.genet.38.072902.092717 |
| [6] |
任玉红, 杨刚, 范瑞文, 等. 黑素皮质素受体1(MC1R)在不同毛色羊驼皮肤组织中的表达与定位研究[J]. 畜牧兽医学报, 2012, 43(7): 1049–1055.
REN Y H, YANG G, FAN R W, et al. Expression and immunolocalization of melanocortin receptor 1(MC1R) in Alpaca skin with different coat color[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(7): 1049–1055. (in Chinese) |
| [7] |
李洪涛, 曾献存, 张文祥, 等. 哈萨克绵羊MC1R和ASIP基因多态性及表达量与被毛颜色表型相关性的研究[J]. 畜牧兽医学报, 2013, 44(3): 366–375.
LI H T, ZENG X C, ZHANG W X, et al. Analysis of the relationship between polymorphism/mRNA expression levels of MC1R and ASIP and coat color phenotype in Kazakh sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(3): 366–375. (in Chinese) |
| [8] | DONG Y J, WANG H D, CAO J, et al. Nitric oxide enhances melanogenesis of alpaca skin melanocytes in vitro by activating the MITF phosphorylation[J]. Mol Cell Biochem, 2011, 352(1-2): 255–260. DOI: 10.1007/s11010-011-0761-1 |
| [9] |
高泽成, 吴晓云, 梁春年, 等. 两种毛色牦牛皮肤黑色素组织学分析[J]. 四川农业大学学报, 2017, 35(1): 110–115.
GAO Z C, WU X Y, LIANG C N, et al. Melanin histologic analysis of yak skin in two different colors[J]. Journal of Sichuan Agricultural University, 2017, 35(1): 110–115. (in Chinese) |
| [10] |
赵彦斌, 孙兆增, 胡仲明, 等. 黑线仓鼠及其白化突变系毛囊中黑色素细胞的组织学分析[J]. 中国比较医学杂志, 2010, 20(10): 1–2.
ZHAO Y B, SUN Z Z, HU Z M, et al. Histochemical study on the distribution of melanocytes in hair folicle of the Cricetulus barabensis and the albino mutant[J]. Chinese Journal of Comparative Medicine, 2010, 20(10): 1–2. DOI: 10.3969/j.issn.1671.7856.2010.10.001 (in Chinese) |
| [11] | NISHIMURA E K. Melanocyte stem cells:A melanocyte reservoir in hair follicles for hair and skin pigmentation[J]. Pigment Cell Melanoma Res, 2011, 24(3): 401–410. DOI: 10.1111/j.1755-148X.2011.00855.x |
| [12] | COMMO S, GAILLARD O, BERNARD B A. Human hair greying is linked to a specific depletion of hair follicle melanocytes affecting both the bulb and the outer root sheath[J]. Br J Dermatol, 2004, 150(3): 435–443. DOI: 10.1046/j.1365-2133.2004.05787.x |
| [13] |
李鹏飞, 董常生, 杜海燕, 等. 黑色素皮质素受体1(MC1R)基因与哺乳动物毛色[J]. 畜牧兽医杂志, 2006, 25(1): 21–22.
LI P F, DONG C S, DU H Y, et al. Melanocortin receptor 1(MC1R) and the hair color of mammalian[J]. Journal of Animal Science and Veterinary Medicine, 2006, 25(1): 21–22. (in Chinese) |
| [14] | SLOMINSKI A, TOBIN D J, SHIBAHARA S, et al. Melanin pigmentation in mammalian skin and its hormonal regulation[J]. Physiol Rev, 2004, 84(4): 1155–1228. DOI: 10.1152/physrev.00044.2003 |
| [15] | TOBIN D J, BYSTRYN J C. Different populations of melanocytes are present in hair follicles and epidermis[J]. Pigment Cell Res, 1996, 9(6): 304–310. DOI: 10.1111/pcr.1996.9.issue-6 |
| [16] |
封竣淇, 徐伟, 黄兰, 等. MC1R基因的研究进展[J]. 中国畜牧兽医, 2017, 44(4): 1141–1148.
FENG J Q, XU W, HUANG L, et al. Research advances on MC1R gene[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(4): 1141–1148. (in Chinese) |
| [17] |
杨翠军, 葛剑, 陈赛娟, 等. 6品系彩色獭兔MC1r和agouti基因mRNA表达量与毛色相关性[J]. 中国兽医学报, 2016, 36(8): 1429–1434, 1439.
YANG C J, GE J, CHEN S J, et al. Relationship between mRNA expression level of MC1r and agouti genes with coat color in 6 strains of color Rex rabbit[J]. Chinese Journal of Veterinary Science, 2016, 36(8): 1429–1434, 1439. (in Chinese) |
| [18] |
秦珂, 黄翔, 曾检华, 等. 陆川猪MC1R和KIT基因型鉴定[J]. 中国畜牧兽医, 2017, 44(3): 773–781.
QIN K, HUANG X, ZENG J H, et al. Characterization of MC1R and KIT genotypes in Luchuan pig population[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(3): 773–781. (in Chinese) |
| [19] |
王海东, 李亚楠, 陈天直, 等. 不同毛色绵羊皮肤中MC1R的差异表达及定位[J]. 基因组学与应用生物学, 2016, 35(10): 2614–2620.
WANG H D, LI Y N, CHEN T Z, et al. Differential expression and localization analysis of MC1R in sheep skins with different coat color[J]. Genomics and Applied Biology, 2016, 35(10): 2614–2620. (in Chinese) |
| [20] | TAIRA J, TSUCHIDA E, UEHARA M, et al. The leaf extract of Mallotus japonicus and its major active constituent, rutin, suppressed on melanin production in murine B16F1 melanoma[J]. Asian Pac J Trop Biomed, 2015, 5(10): 819–823. DOI: 10.1016/j.apjtb.2015.05.017 |
| [21] | NINOMIYA K, MATSUMOTO T, CHAIPECH S, et al. Simultaneous quantitative analysis of 12 methoxyflavones with melanogenesis inhibitory activity from the rhizomes of Kaempferia parviflora[J]. J Nat Med, 2016, 70(2): 179–189. DOI: 10.1007/s11418-015-0955-z |
| [22] | GRIMM D, STREETZ K L, JOPLING C L, et al. Fatality in mice due to oversaturation of cellular microRNA/short hairpin RNA pathways[J]. Nature, 2006, 441(7092): 537–541. DOI: 10.1038/nature04791 |
| [23] |
孙笑尉, 张雪莲, 庞全海, 等. RNAi对羊驼黑色素细胞中MC1R表达量及黑色素合成的影响[J]. 畜牧兽医学报, 2015, 46(7): 1163–1168.
SUN X W, ZHANG X L, PANG Q H, et al. Effect of RNAi on MC1R expression and melanin synthesis in the melanocytes of alpaca[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(7): 1163–1168. (in Chinese) |
| [24] |
贾秀华. 酪氨酸酶siRNA有效抑制小鼠酪氨酸酶基因表达的初步研究[D]. 广州: 中山大学, 2008.
JIA X H. The pilot study of tyrosinase siRNA effectively suppresses tyrosinase gene expression in mice[D]. Guangzhou: Sun Yat-sen University, 2008. (in Chinese) http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y1295034 |
| [25] |
窦克军, 孙春宝. siRNA抑制A375细胞中黑色素形成[J]. 细胞生物学杂志, 2007, 29(4): 617–622.
DOU K J, SUN C B. Suppression of melanin formation of A375 cells by small interfering RNA[J]. Chinese Journal of Cell Biology, 2007, 29(4): 617–622. (in Chinese) |



