牦牛(Bos grunniens)是中国青藏高原及其毗邻地区不可替代的重要畜种,是当地人民赖以生存的生产资料和生活资料。然而,与普通牛相比,牦牛产肉性能和泌乳性能都低下[1]。家畜育种是提高家畜生产性能的重要措施,但由于牦牛繁殖率低、世代间隔长[2]、产区育种基础设施差、农牧民育种意识淡薄,淘汰劣质母牦牛的措施难以被农牧民接受,因此,采用传统育种手段开展牦牛育种工作难度大。超数排卵与胚胎移植(Multiple ovulation and embryo transfer, MOET)是以遗传性能优秀的母畜作为胚胎移植的供体,将其胚胎移植给生产性能低的母畜(受体),繁殖出优秀的后代。目前,MOET已成为绵羊、奶牛、肉牛育种的重要技术手段,使遗传进展速度提高30%~76%[3]。如果将这项技术应用于牦牛育种,可以实现在不大量淘汰劣质母牦牛的条件下达到良种繁育的目的,有望成为容易被农牧民接受的行之有效的牦牛育种技术。
胚胎超低温冷冻保存使胚胎移植不受时间和地域的限制,是开展高效胚胎移植的关键技术环节。目前,哺乳动物卵母细胞和胚胎的冷冻保存主要有传统慢速冷冻(Conventional slow freezing)和玻璃化冷冻(Vitrification)两种方法。后者具有操作简便、冷冻损伤小、成功率高等优点而被广为采用[4-5]。然而,即便在胚胎冷冻保存技术研究最深入、应用最普遍、冷冻胚胎移植妊娠率最高的畜种——普通牛,玻璃化冷冻胚胎的移植成功率一般也比鲜胚移植低10%以上[6-7]。虽然玻璃化冷冻影响胚胎发育的分子机制尚不完全清楚,但许多研究证明,玻璃化冷冻影响细胞增殖、细胞周期、细胞凋亡、发育、生物合成、呼吸以及应激相关的基因表达,从而影响胚胎的后续发育能力[4-5]。目前,牦牛的胚胎移植尚处于起步阶段[8-9],卵母细胞和胚胎的冷冻保存是开展高效、商业化牦牛胚胎移植亟待解决的关键理论和技术。在牦牛卵母细胞冷冻保存方面开展过一些初步研究[10-12],但玻璃化冷冻对牦牛胚胎的基因表达谱的影响还没有深入研究。因此,本研究首次从转录组水平研究玻璃化冷冻对牦牛囊胚基因表达的影响,为探讨牦牛囊胚冷冻损伤机制及完善冷冻方法提供理论依据。
1 材料与方法 1.1 牦牛囊胚的生产在屠宰场采集的牦牛卵巢,从直径为2~8 mm的卵泡中,抽取牦牛卵丘-卵母细胞复合体(COC),然后参照X. Xiao等[13]的方法开展牦牛卵母细胞体外成熟(IVM)。IVM液为含5 μg·mL-1 FSH、50 IU·mL-1 LH、1 μg·mL-1 17β-雌二醇和10% (v/v)胎牛血清(FCS)的TCM199,在38.6 ℃、5%CO2、饱和湿度的CO2培养箱中成熟培养24 h。参照石仙等[14]方法,用Vitrolife(瑞典)体外胚胎生产系列试剂进行牦牛精子体外获能、体外受精(IVF)及胚胎的体外培养(IVC)。
1.2 牦牛囊胚的玻璃化冷冻与样品处理IVF第6天收集囊胚,采用Kitazato公司的玻璃化冷冻试剂盒(VT101)、解冻试剂盒(VT102),按照使用说明书上的步骤进行牦牛囊胚玻璃化冷冻与解冻。将解冻复苏良好的3枚牦牛冻融囊胚混合获得冻融囊胚组,将3枚发育良好的未进行冷冻处理的牦牛囊胚混合获得新鲜囊胚组。分别将两组囊胚在等渗、无钙镁离子的PBS溶液中清洗2~3遍,去除残留血清和培养液。洗涤后,将囊胚分别移入含有细胞裂解液和RNase Inhibitor的两个采集管中,在-80 ℃超低温冰箱保存。
1.3 Smart-seq2与转录组高通量测序采用RNeasy Micro Kit提取新鲜囊胚和冻融囊胚样本的总RNA,然后由安诺优达基因科技(北京)有限公司(Anoroad)使用Smart-Seq2方法[15-16]进行反转录:用反转录酶、含公共序列的Oligo-dT引物和TSO引物合成第一链cDNA;用ISPCR引物PCR扩增合成第二链cDNA。扩增产物经纯化后,分别采用Qubit 2.0荧光仪(Life Technologies, USA)检测cDNA浓度和Agilent 2100生物分析仪(Agilent Technologies, USA)检测cDNA片段分布和质量情况。检测合格的两组样本各取20 ng扩增产物cDNA作为起始原料进行文库构建。用Bioruptor超声破碎仪(Diagenode Inc, USA)进行样本cDNA片段化,获得长度约为200 bp的cDNA片段。cDNA片段经末端修复、3′端加碱基A、测序接头拼接等各步反应后进行PCR扩增,用Beckman Ampure XP磁珠对PCR产物进行纯化。最后用2%琼脂糖凝胶分离出300~500 bp的DNA片段,回收目的片段,再溶于EB缓冲液中,即为最终的文库。制备的文库用Agilent 2100生物分析仪(Agilent Technologies, USA)和ABI Step One Plus适时PCR系统质检合格后,在HiSeq 2500测序平台(Illumina, USA)用双末端测序法进行高通量测序。
1.4 测序结果与数据分析对HiSeqTM2500测序所得的原始测序序列(Raw Reads)进行过滤,去除低质量序列和测序接头序列,得到干净数据序列(Clean Reads)。采用TopHat v2.0.12软件,将过滤后获得的Clean Reads与牦牛参考基因组(BosGru_v2.0)[17]进行比对。根据RPKM法(Reads per kb per million reads)[18]计算基因表达水平。采用DEGseq法[19],以|log2(冻胚/鲜胚)|≥1和Q < 0.05作为阈值界定牦牛新鲜囊胚文库和冻融囊胚文库之间的差异表达基因(Differentially expressed gene, DEG)。将DEGs向Gene Ontology(GO)数据库(http://www.geneontology.org/)各个条目进行映射,以P < 0.05为筛选条件,满足条件的GO条目即为在DEGs中显著富集的GO条目(GO term)。通过与KEGG (Kyoto encyclopedia of genes and genomes)数据库进行比对,对基因涉及的信号通路进行分析。
2 结果 2.1 转录组测序数据分析对HiSeqTM2500测序所得的Raw reads进行数据过滤后,得到新鲜囊胚文库和冻融囊胚文库的Clean Reads分别为48 455 410条和49 607 452条。将Clean Reads比对到牦牛的参考基因组,新鲜囊胚和冻融囊胚两个文库中分别有85.65%和80.67% Clean Reads序列唯一比对到基因组(表 1)。新鲜囊胚和冻融囊胚分别检测到9 827个和13 567个转录本。
|
|
表 1 测序和比对结果概述 Table 1 A summary of RNA-seq and mapping results |
以|log2(冻胚/鲜胚)|≥1和Q < 0.05作为筛选DEGs的阈值,共筛选得到两个文库之间有11 174个DEGs,其中在冻融囊胚上调7 037个,下调4 137个(图 1)。表 2列出差异倍数最大的前10个上调基因和前10个下调基因。此外,与冷冻损伤相关的多数已知基因如氧化应激(热休克蛋白家族成员(HSP)、超氧化物歧化酶1(SOD1))、细胞凋亡(BCL2家族成员、死亡受体)、细胞周期(Cyclin B、组蛋白家族成员、聚合酶)的表达都发生显著变化(表 3)。
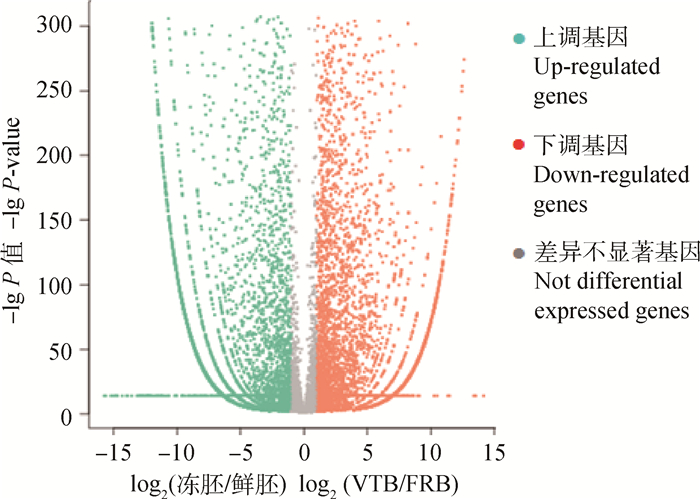
|
图 1 牦牛冻融囊胚和新鲜囊胚差异表达基因火山图 Figure 1 The volcano plot of DEGs of vitrified-thawed vs. fresh yak blastocysts |
|
|
表 2 差异倍数最大的前10个上调基因和前10个下调基因(Q值< 0.05) Table 2 Top 10 up-regulated and top 10 down-regulated DEGs (Q value < 0.05) with the greatest fold changes |
|
|
表 3 冷冻机制相关的部分重要基因在胚胎玻璃化冷冻前后的表达情况 Table 3 Expressions of some important genes related to freezing mechanism pre-and post-vitrification |
将测序得到的DEGs与GO数据库进行比对后,参考GO数据库序列注释测序基因。经GO注释分类后发现,牦牛新鲜囊胚和冻融囊胚共中有10 538个DEGs显著富集(P < 0.05)到479条GO terms上,其中生物过程(Biological process, BP)358条、细胞组成(Cellular component, CC)39条和分子功能(Molecular function, MF)82条。在BP分类中,细胞表面受体信号通路(Cell surface receptor signaling pathway cellular process)、刺激反应(Response to stimulus)和信号转导(Signal transduction)等GO terms富集水平最高;在MF分类中,信号受体活性(Signaling receptor activity)、跨膜信号受体活性(Transmembrane signaling receptor activity)和信号传感器活性(Signal transducer activity)等GO terms富集水平最高;在CC分类中,膜内特性(Intrinsic to membrane)、细胞外周(Cell periphery)和膜完整性(Integral to membrane)等GO terms富集水平最高(表 4)。
|
|
表 4 差异表达基因前10富集的GO分类条目 Table 4 Top 10 enrichment terms of GO categories of DEGs |
对11 174个DEGs进行KEGG通路分析,结果显示,DEGs被富集到真核生物的核糖体合成(Ribosome biogenesis in eukaryotes)、剪接体(Spliceosome)和神经活性配体-受体互作(Neuroactive ligand-receptor interaction)等318条通路上,其中有8条显著富集通路(表 5)。
|
|
表 5 差异表达基因显著富集的KEGG通路 Table 5 The significantly enriched KEGG pathways in the DEGs |
胚胎移植是家畜育种的重要手段,而胚胎冷冻保存是胚胎移植的一个重要技术环节。在胚胎冷冻方法中,尽管玻璃化冷冻法具有操作简便、成功率高等优点,是目前各种家畜胚胎冷冻保存的主要方法[4-5],但是,玻璃化冷冻胚胎移植后的妊娠率一般还是比鲜胚移植低10%以上[6-7],然而其分子机制并没有被完全揭示。牦牛的胚胎移植处于起步阶段,目前尚未见牦牛胚胎冷冻保存的研究报道[8-9, 20]。因此,本研究利用Smart-Seq2方法[15-16]分别对冷冻前后牦牛囊胚微量RNA进行反转录,构建文库并进行高通量测序研究。该技术能充分保持mRNA原有种类的复杂性,保证了扩增样本的测序数据具有和原始未扩增富集样本的测序数据的一致性[15]。
在牦牛新鲜囊胚和冻融囊胚中分别检测到9 827个和13 567个转录本,即低温应激导致冻融胚中新增3 740个转录本,其中多数与冷冻诱导的细胞凋亡、氧化应激、热休克和癌变等通路有关。例如,谷氧还蛋白(GLRX1)作为机体内重要的抗氧化防御体系,对消除体内氧化应激产生活性氧(Reactive oxygen species, ROS)引起的氧化应激损伤具有重要的作用[21]。富含半胱氨酸蛋白1(CRIP1)作为肿瘤分子标志物,在多种肿瘤疾病中表达失调[22],原肌球蛋白4(TPM4)也在肿瘤中表达[23]。高剂量的钙结合蛋白S100A14可诱导细胞凋亡[24]。当然,其中还有一些基因的功能有待进一步研究与完善。本研究还发现牦牛囊胚在玻璃化冷冻前后共有11 174个DEGs,其中冷冻后上调7 037个,下调4 137个(图 1)。在已有的研究报道中,皆没有把本研究发现的前10个上调DEGs和前10个下调DEGs(表 2)与胚胎冷冻应激联系起来,但经过深入分析,发现这些基因在冷冻前后的表达变化似乎都与冷冻应激存在相关性。例如,在前10个上调DEGs中,原肌球蛋白1(TPM1)为肿瘤抑制蛋白,具有诱导细胞凋亡的作用[25]。半乳凝(集)素(LGALS3)能抑制胃癌细胞的衰老,从而加速胃癌的进程[26],而Galectin 1则能诱导细胞凋亡[27]。CLDN6通过抑制细胞增殖和诱导细胞凋亡,从而发挥抑制机体生长的作用[28]。组织蛋白酶L(Cathepsin L)与早期胚胎的细胞分裂活动有关[29]。在前10个下调DEGs中,亮氨酸二十同源(LEUTX)是胚胎基因组激活(Embryo genome activation, EGA)的候选基因,在EGA中发挥核心作用[30]。CD274分子(CD274)表达量低的小鼠细胞不仅容易发生癌变,而且表现出癌干细胞系(CSC)的一些特征,包括醛脱氢酶(LDHA)活性高、ROS产量降低、细胞处于休眠状态等[31]。组织缺氧诱导可以通过降低SLC2A2溶质载体家族2成员2(SLC2A2)的表达而影响细胞功能[32]。F-BAR蛋白和一氧化氮合酶运输介导物(NOSTRIN)参与FGF信号转导和血管的发育[33]。冷冻前后胚胎转录组的这些显著差异提示牦牛胚胎的玻璃化冷冻技术有待进一步完善。
冷冻应激相关的已知基因在牦牛冷冻前后的表达差异基本与前人在其它物种的研究结果一致(表 3)。硫氧还蛋白互作蛋白(TXNIP),通过抑制硫氧还蛋白系统的功能而发挥介导氧化应激、抑制细胞增殖及诱导细胞凋亡等作用[34],细胞周期蛋白依赖性激酶(CDK2)则调节细胞周期的启动和进程[35]。因此,本研究发现在冻融囊胚中,TXNIP表达显著上调及CDK2表达显著下调,说明冷冻对囊胚的存活有不利影响。与C. Monzo等[4]在人卵母细胞和N. Wang等[16]在牛卵母细胞玻璃化冷冻的结果类似,在玻璃化冻融牦牛囊胚中,与细胞周期相关的一些基因如APC15[36]和SYCE2[37]等基因的表达显著下调。促进细胞凋亡的BAX基因的表达显著上调,而抗细胞凋亡的BCL2基因的表达显著下调,这些基因的表达变化可能导致冻融囊胚细胞凋亡加快,发育能力降低。耐冷性强的杂交稻和栽培稻通过提高剑叶的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性以及抗氧化剂抗坏血酸(AsA)、谷胱甘肽(GSH)含量,有效地降低了ROS水平,减轻了低温对生物膜的伤害[38]。本研究发现在牦牛冻融囊胚中,谷胱甘肽过氧化物酶4(GPX4)、谷胱甘肽二硫化还原酶(GSR)和CAT等基因的表达量显著提高,可能也是胚胎对温度胁迫(玻璃化冷冻与解冻)的响应。热休克蛋白家族成员70(Heat shock proteins 70, HSP70)在正常细胞中水平较低,在低温应激状态下可明显升高,具有保护机体和细胞的功能[39],因此,本研究中发现在牦牛冻融囊胚中HSPA8、HSPA5和HSPA9等HSP70家族成员中的基因表达上调,可能也是胚胎对温度的响应机制。
牦牛新鲜囊胚和冻融囊胚共中有10 538个DEGs显著富集到479条GO terms上,其中生物过程(BP)358条、细胞组成(CC)39条和分子功能(MF)82条。在BP分类中,细胞表面受体信号通路、刺激反应和信号转导等GO terms最为显著富集;在MF分类中,信号受体活性、跨膜信号受体活性和信号传感器活性等GO terms最为显著富集;在CC分类中,膜内特性、细胞外周和膜完整性等GO terms最为显著富集(表 4)。这与郑杰等[20]用同样方法在犏牛上开展研究获得的结果相似,说明玻璃化冷冻对牦牛胚胎细胞膜的结构和功能的不良影响可能是导致冻融囊胚发育能力降低的主要原因。KEGG通路分析结果显示,
11 174个DEGs被富集到真核生物的核糖体合成、剪接体和神经活性配体-受体互作等318条通路上,其中有8条显著富集通路(表 5)。该结果也与郑杰等[20]在犏牛上的研究结果基本一致,推测牦牛囊胚可能主要通过真核生物的核糖体合成、剪接体和神经活性配体-受体互作等代谢通路对玻璃化冷冻与解冻作出响应。
4 结论本研究利用RNA-seq技术对玻璃化冷冻前后的牦牛囊胚进行了比较分析,发现牦牛新鲜囊胚与玻璃化冻融囊胚之间有11 174个差异表达基因,显著富集到479条GO terms和8条代谢通路。这些结果为玻璃化冷冻对胚胎发育能力的影响机制提供了分子生物学证据,同时,也为进一步完善牦牛囊胚玻璃化冷冻与解冻技术提供了理论依据。
| [1] | WIENER G, HAN J L, LONG R J. The yak[M]. Bangkok: RAP Publication, 2003. |
| [2] | ZI X D. Reproduction in female yaks (Bos grunniens) and opportunities for improvement[J]. Theriogenology, 2003, 59(5-6): 1303–1312. DOI: 10.1016/S0093-691X(02)01172-X |
| [3] | GRANLEESE T, CLARK S A, SWAN A A, et al. Increased genetic gains in sheep, beef and dairy breeding programs from using female reproductive technologies combined with optimal contribution selection and genomic breeding values[J]. Genet Sel Evol, 2015, 47: 70. DOI: 10.1186/s12711-015-0151-3 |
| [4] | MONZO C, HAOUZI D, ROMAN K, et al. Slow freezing and vitrification differentially modify the gene expression profile of human metaphase Ⅱ oocytes[J]. Hum Reprod, 2012, 27(7): 2160–2168. DOI: 10.1093/humrep/des153 |
| [5] | MOUSSA M, SHU J, ZHANG X H, et al. Cryopreservation of mammalian oocytes and embryos: Current problems and future perspectives[J]. Sci China Life Sci, 2014, 57(9): 903–914. DOI: 10.1007/s11427-014-4689-z |
| [6] | HASLER J F. Factors affecting frozen and fresh embryo transfer pregnancy rates in cattle[J]. Theriogenology, 2001, 56(9): 1401–1415. DOI: 10.1016/S0093-691X(01)00643-4 |
| [7] | SPELL A R, BEAL W E, CORAH L R, et al. Evaluating recipient and embryo factors that affect pregnancy rates of embryo transfer in beef cattle[J]. Theriogenology, 2001, 56(2): 287–297. DOI: 10.1016/S0093-691X(01)00563-5 |
| [8] | YU S J, JU X H, WANG L B, et al. Successful embryo transfer in Tianzhu white yak using standard protocol[J]. Sci China C Life Sci, 2007, 50(5): 655–659. DOI: 10.1007/s11427-007-0062-9 |
| [9] |
孙永刚, 徐惊涛, 才让东智, 等. 体外受精生产犏牛胚胎与移植试验研究[J]. 畜牧兽医学报, 2013, 44(5): 719–726.
SUN Y G, XU J T, CAIRANG D Z, et al. The study on cattle×yak in vitro fertilization and embryo transfer[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(5): 719–726. (in Chinese) |
| [10] | NIU H R, ZI X D, XIAO X, et al. Developmental competence of frozen-thawed yak (Bos grunniens) oocytes followed by in vitro maturation and fertilization[J]. Cryobiology, 2014, 68(1): 152–154. DOI: 10.1016/j.cryobiol.2014.01.012 |
| [11] | NIU H R, ZI X D, XIAO X, et al. Cloning of cDNAs for H1F0, TOP1, CLTA and CDK1 and the effects of cryopreservation on the expression of their mRNA transcripts in yak (Bos grunniens) oocytes[J]. Cryobiology, 2014, 69(1): 55–60. DOI: 10.1016/j.cryobiol.2014.05.002 |
| [12] | CHEN P, PAN Y, CUI Y, et al. Insulin-like growth factor I enhances the developmental competence of yak embryos by modulating aquaporin 3[J]. Reprod Domest Anim, 2017, 52(5): 825–835. DOI: 10.1111/rda.2017.52.issue-5 |
| [13] | XIAO X, ZI X D, NIU H R, et al. Effect of addition of FSH, LH and proteasome inhibitor MG132 to in vitro maturation medium on the developmental competence of yak (Bos grunniens) oocytes[J]. Reprod Biol Endocrinol, 2014, 12: 30. DOI: 10.1186/1477-7827-12-30 |
| [14] |
石仙, 熊显荣, 兰道亮, 等. 糖对牦牛卵母细胞体外成熟及其发育能力的影响[J]. 中国畜牧兽医, 2017, 44(1): 155–160.
SHI X, XIONG X R, LAN D L, et al. Effect of sugar on in vitro maturation and developmental competence of yak oocytes[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(1): 155–160. (in Chinese) |
| [15] | PICELLI S, BJÖRKLUND A K, FARIDANI O R, et al. Smart-seq2 for sensitive full-length transcriptome profiling in single cells[J]. Nat Methods, 2013, 10(11): 1096–1098. DOI: 10.1038/nmeth.2639 |
| [16] | WANG N, LI C Y, ZHU H B, et al. Effect of vitrification on the mRNA transcriptome of bovine oocytes[J]. Reprod Domest Anim, 2017, 52(4): 531–541. DOI: 10.1111/rda.2017.52.issue-4 |
| [17] | QIU Q, ZHANG G J, MA T, et al. The yak genome and adaptation to life at high altitude[J]. Nat Genet, 2012, 44(8): 946–949. DOI: 10.1038/ng.2343 |
| [18] | WANGER G P, KIN K, LYNCH V J. Measurement of mRNA abundance using RNA-seq data: RPKM measure is inconsistent among samples[J]. Theory Biosci, 2012, 131(4): 281–285. DOI: 10.1007/s12064-012-0162-3 |
| [19] | WANG L, FENG Z, WANG X, et al. DEGseq: an R package for identifying differentially expressed genes from RNA-seq data[J]. Bioinformatics, 2010, 26(1): 136–138. DOI: 10.1093/bioinformatics/btp612 |
| [20] |
郑杰, 蒲思颖, 杨远潇, 等. 基于高通量测序的犏牛囊胚玻璃化冷冻损伤机制研究[J]. 畜牧兽医学报, 2017, 48(10): 1871–1881.
ZHENG J, PU S Y, YANG Y X, et al. Exploring mechanism for vitrification damage of the cross-bred blastocysts of the yak via high-throughput sequencing[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(10): 1871–1881. (in Chinese) |
| [21] | HOLMGREN A. Antioxidant function of thioredoxin and glutaredoxin systems[J]. Antioxid Redox Signal, 2000, 2(4): 811–820. DOI: 10.1089/ars.2000.2.4-811 |
| [22] | KLEIN A, OLENDROWITZ C, SCHMUTZLER R, et al. Identification of brain-and bone-specific breast cancer metastasis genes[J]. Cancer Lett, 2009, 276(2): 212–220. DOI: 10.1016/j.canlet.2008.11.017 |
| [23] | JIN Q E, CHEN H Y, LUO A P, et al. S100A14 Stimulates cell proliferation and induces cell apoptosis at different concentrations via receptor for advanced glycation end products (RAGE)[J]. PLoS One, 2011, 6(4): e19375. DOI: 10.1371/journal.pone.0019375 |
| [24] | KABBAGE M, TRIMECHE M, BEN NASR H, et al. Tropomyosin-4 correlates with higher SBR grades and tubular differentiation in infiltrating ductal breast carcinomas: An immunohistochemical and proteomics-based study[J]. Tumour Biol, 2013, 34(6): 3593–3602. DOI: 10.1007/s13277-013-0939-0 |
| [25] | WANG J, GUAN J, LU Z, et al. Clinical and tumor significance of tropomyosin-1 expression levels in renal cell carcinoma[J]. Oncol Rep, 2015, 33(3): 1326–1334. DOI: 10.3892/or.2015.3733 |
| [26] | KIM S J, LEE H W, GU KANG H, et al. Ablation of galectin-3 induces p27KIP1-dependent premature senescence without oncogenic stress[J]. Cell Death Differ, 2014, 21(11): 1769–1779. DOI: 10.1038/cdd.2014.88 |
| [27] | JOUVE N, DESPOIX N, ESPELI M, et al. The involvement of CD146 and its novel ligand Galectin-1 in apoptotic regulation of endothelial cells[J]. J Biol Chem, 2013, 288(4): 2571–2579. DOI: 10.1074/jbc.M112.418848 |
| [28] | GUO Y X, XU X M, LIU Z J, et al. Apoptosis signal-regulating kinase 1 is associated with the effect of claudin-6 in breast cancer[J]. Diagn Pathol, 2012, 7: 111. DOI: 10.1186/1746-1596-7-111 |
| [29] | MORIN V, SANCHEZ-RUBIO A, AZE A, et al. The protease degrading sperm histones post-fertilization in sea urchin eggs is a nuclear cathepsin L that is further required for embryo development[J]. PLoS One, 2012, 7(11): e46850. DOI: 10.1371/journal.pone.0046850 |
| [30] | JOUHILAHTI E M, MADISSOON E, VESTERLUND L, et al. The human PRD-like homeobox gene LEUTX has a central role in embryo genome activation[J]. Development, 2016, 143(19): 3459–3469. DOI: 10.1242/dev.134510 |
| [31] | TAMAI K, NAKAMURA M, MIZUMA M, et al. Suppressive expression of CD274 increases tumorigenesis and cancer stem cell phenotypes in cholangiocarcinoma[J]. Cancer Sci, 2014, 105(6): 667–674. DOI: 10.1111/cas.12406 |
| [32] | SATO Y, INOUE M, YOSHIZAWA T, et al. Moderate hypoxia induces β-cell dysfunction with HIF-1-independent gene expression changes[J]. PLoS One, 2014, 9(12): e114868. DOI: 10.1371/journal.pone.0114868 |
| [33] | KOVACEVIC I, HU J, SIEHOFF-ICKING A, et al. The F-BAR protein NOSTRIN participates in FGF signal transduction and vascular development[J]. EMBO J, 2012, 31(15): 3309–3322. DOI: 10.1038/emboj.2012.176 |
| [34] | SPINDEL O N, WORLD C, BERK B C. Thioredoxin interacting protein: Redox dependent and independent regulatory mechanisms[J]. Antioxid Redox Signal, 2012, 16(6): 587–596. DOI: 10.1089/ars.2011.4137 |
| [35] | HAN S H, CHUNG J H, KIM J, et al. New role of human ribosomal protein S3: Regulation of cell cycle via phosphorylation by cyclin-dependent kinase 2[J]. Oncol Lett, 2017, 13(5): 3681–3687. DOI: 10.3892/ol.2017.5906 |
| [36] | KOTANI S, TUGENDREICH S, FUJⅡ M, et al. PKA and MPF-activated polo-like kinase regulate anaphase-promoting complex activity and mitosis progression[J]. Mol Cell, 1998, 1(3): 371–380. |
| [37] | BOLCUN-FILAS E, COSTA Y, SPEED R, et al. SYCE2 is required for synaptonemal complex assembly, double strand break repair, and homologous recombination[J]. J Cell Biol, 2007, 176(6): 741–747. DOI: 10.1083/jcb.200610027 |
| [38] |
王国骄, 王嘉宇, 马殿荣, 等. 不同耐冷性杂草稻和栽培稻抗氧化系统对冷水胁迫的响应[J]. 中国农业科学, 2015, 48(8): 1660–1668.
WANG G J, WANG J Y, MA D R, et al. Responses of antioxidant system to cold water stress in weedy and cultivated rice with different chilling sensitivity[J]. Scientia Agricultura Sinica, 2015, 48(8): 1660–1668. (in Chinese) |
| [39] | ŠTĚTINAT, KOŠTǍLV, KORBELOVÁJ. The role of inducible Hsp70, and other heat shock proteins, in adaptive complex of cold tolerance of the fruit fly (Drosophila melanogaster)[J]. PLoS One, 2015, 10(6): e0128976. |



