2. 中国农业科学院 兰州畜牧与兽药研究所甘肃省新兽药工程重点实验室, 兰州 730050;
3. 中国农业科学院 兰州畜牧与兽药研究所甘肃省中兽药工程技术研究中心, 兰州 730050
2. Key Laboratory of New Veterinary Medicine Engineering in Gansu Province, Lanzhou Institute of Husbandry and Pharmaceutical Sciences, CAAS, Lanzhou 730050, China;
3. Veterinary Medicine Engineering Technology Research Center Gansu Province, Lanzhou Institute of Husbandry and Pharmaceutical Sciences, CAAS, Lanzhou 730050, China
归芪益母汤,出自《牛经备要医方》。由黄芪、益母草和当归组成。功效为补气生血、活血化瘀。主治劳倦内伤、气血双虚等证。可用于牛劳役过重、产后血虚和产后瘫痪等。中兽医药的不断推广和应用,使其加减后,功效主治更广,如治疗奶牛产后气虚血瘀证、胎衣不下、奶牛不孕症、同期发情和羊/奶牛产后瘫痪等疾病。中兽药具有抗菌、消炎和提高动物体自身免疫等作用,同时具有疗效好、低毒、环保等特点,已成为人们研究的重点。随着网络药理学的发展,可对中药/方剂进行多成分-多靶点-多途径分析,研究其作用机制。近年来,人医上许多学者利用网络药理学探索中药治疗胸痹、消渴病[1-2]、神经退行性疾病、心律失常、冠心病、类风湿关节炎、心肌缺血、肝癌等的作用机制,取得了一定的成果。这种研究方法不仅能分析中药对所研究疾病的作用,而且能发现中药可能还对其他疾病有效,继而深入研究,达到老药新用的目的。该研究方法的整体性和系统性与中(兽)医的整体观念相吻合,具有一定的应用前景。但在兽医领域仍少有人应用,本研究利用中药系统药理学分析平台(TCMSP)对归芪益母汤多成分、多靶点、多途径网络图进行系统分析,以期揭示归芪益母汤治疗牛气血两虚证的作用机制,并寻找出新的临床应用方向。
1 材料与方法 1.1 归芪益母汤活性化合物-靶点网络图的构建本研究是根据中药系统药理学分析平台(http://lsp.nwu.edu.cn/tcmsp.php)检索归芪益母汤全方,黄芪、益母草和当归所有化学成分。根据口服利用度(OB)和类药性(DL)将所有单味药的化合物进行筛选,其阈值分别是OB≥50,DL≥0.18[3],筛选出的化合物具有较好的活性。将筛选出的化合物-靶点通过Cytoscape3.5.0构建归芪益母汤化合物-靶点网络图,探究归芪益母汤治疗疾病的作用机制。
1.2 归芪益母汤作用于牛蛋白-蛋白互相作用(PPI)网络图的构建为了探究靶点蛋白在牛系统水平上的作用,将归芪益母汤相关靶点基因上传至在线STRING 10.5软件(https://string-db.org/),构建由导入基因所表达产物组成的PPI网络,以了解归芪益母汤治疗牛气血两虚证的关键靶点。
1.3 归芪益母汤-牛靶点基因的GO富集及KEGG信号-靶点网络图的构建为了深入了解从归芪益母汤筛出化合物的靶点蛋白在基因功能和信号通路中的作用,采用DAVID数据库对PPI网络中的蛋白质基因进行GO功能富集分析和KEGG通路富集分析,通过软件对KEGG通路富集分析中筛选出的信号通路构建靶点-通路网络,从基因功能和信号通路层次分析归芪益母汤治疗牛气血两虚证的作用机制。
2 结果 2.1 化合物的筛选利用中药系统药理学分析平台从263个化合物中筛选出30个符合条件的化合物,但并非所有化合物都有活性,为此,根据化合物对应靶点的有无再次筛选,筛选出27个化合物,去除单味药之间的重复共24个活性化合物。利用Cytoscape3.5.0软件将24个化合物和对应靶点的关系构建网络图,结果见图 1,在化合物-靶点网络图中,共发现273个节点(包括24个化合物节点和249个靶点节点)和134条边。根据网络的拓扑学性质筛选度(度,英文对应degree,节点的度为节点连接的边的总数,一个节点的节度越大就意味着这个节点的度中心性越高,该节点在网络中就越重要)[4]较大的节点进行分析,这些连接化合物或靶点较多的节点在整个网络中起到枢纽的作用,可能是关键的化合物或者靶点。该网络图中,平均每个化合物有平均靶点数是5.6个,每个靶点平均与10个化合物相互作用,同时归芪益母汤中也存在一个化合物与多靶点之间的相互作用,这体现了归芪益母汤多成分与多靶点之间共同作用的机制,亦符合中药复方治疗疾病的特点。从化合物的角度,有62.5%的化合物作用靶点>10个,其中靶点>20个的化合物有12个,靶点>40个的化合物有3个。其中益母草和黄芪中的槲皮素(quercetin)的连接度最高,能与154个靶点相互作用,然后是山奈酚(kaempferol)等。统计靶点>20的化合物,见表 1。从靶点的角度来看,连接化合物>10个靶点有7个,连接化合物>20个靶点有0个。其中前列腺素合成酶G/H-2连接了20个化合物,占到了总化合物的83.3%,其次是前列腺素合成酶G/H-1,连接了15个化合物,其他连接化合物>10的靶点统计,见表 2。
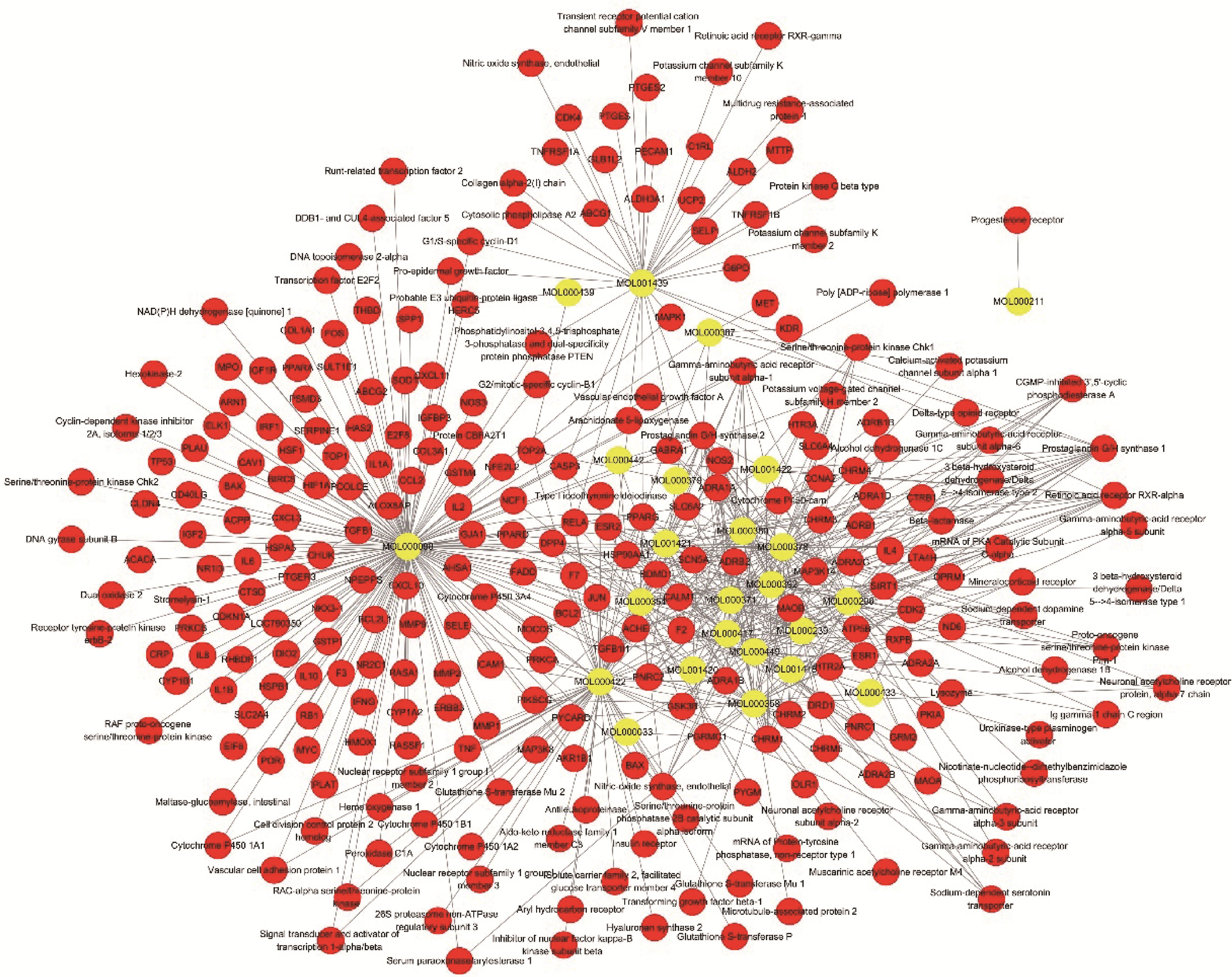
|
图 1 归芪益母汤的复合靶点网络(黄色代表化合物,红色代表靶点) Figure 1 Compound-target network of Gui Qi Yimu decoction (Yellow for the compound and red for the target) |
|
|
表 1 度>10的化合物的拓扑性质 Table 1 Topological properties of compounds with degree > 10 |
|
|
表 2 度>10的靶点拓扑 Table 2 Target topology with degree > 10 |
为了更好地理解归芪益母汤作用于牛病的作用机制,基于PPI关系,利用STRING软件构建了归芪益母汤靶点的PPI网络(图 2)。打分值>0.9,结果PPI网络包括了182个蛋白节点,238条相互关系。根据节点的“Degree”绘制出了前20个关键蛋白质节点的条形图(图 3),其中TNF、IL8、HSP90-AA1、MAPK1、F3、ENSBTAG00000014921、PSMD3、TP53等出现频率较高,在治疗牛气血两虚证中起到关键作用。
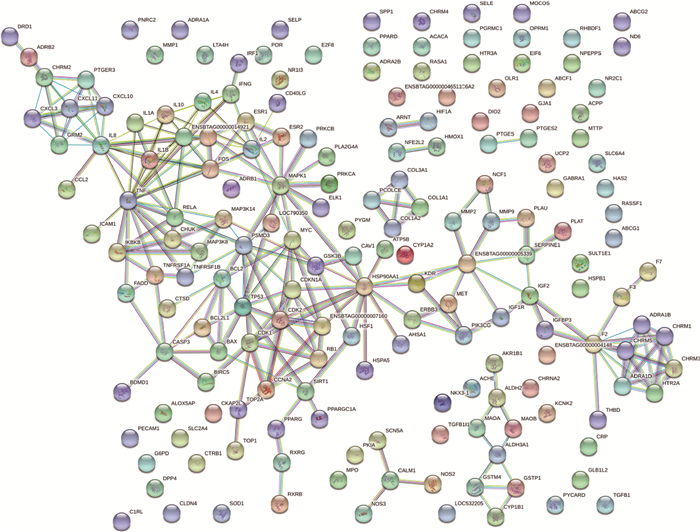
|
图 2 归芪益母汤相关靶点的PPI网络 Figure 2 PPI network of Gui Qi Yimu decoction related targets |
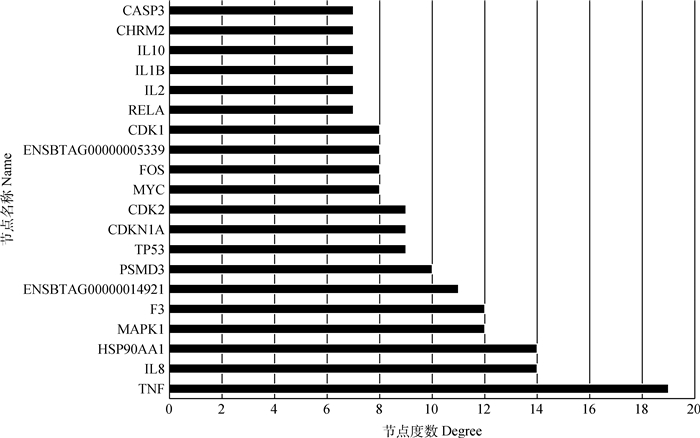
|
图 3 PPI网络的中心节点 Figure 3 Hub nodes from PPI network |
本研究利用DAVID数据库对归芪益母汤PPI靶点的蛋白进行GO富集与KEGG通路富集分析。在GO富集分析中,确定了29条GO条目(伪发现率 < 0.01),其中细胞组成条目1个,涉及extracellular space(细胞外间隙);分子功能条目1个,涉及amine receptor activity(胺受体活动);生物过程条目27个,涉及response to wounding (损伤应答)、regulation of cell proliferation (细胞增殖调控)、negative regulation of cell proliferation (细胞增殖的负调控)、positive regulation of macromolecule metabolic process (大分子代谢过程的调控)、inflammatory response (炎症反应)、cell migration (细胞移行)等(表 3)。如表 4所示,在通路分析中,得到11条信号通路(伪发现率 < 0.01),具体是pathways in cancer(癌症通路)、apoptosis(细胞凋亡)、T cell receptor signaling pathway(T细胞受体信号通路)、prostate cancer(前列腺癌)、MAPK signaling pathway(MAPK信号转导途径)等信号通路(表 4), 靶点-通路网络图如图 4所示。
|
|
表 3 PPI网络中的基因GO富集结果列表(FDR < 0.01) Table 3 List of GO enrichment results to genes in PPI network (FDR < 0.01) |
|
|
表 4 PPI网络中基因通路富集结果列表(FDR < 0.01) Table 4 List of pathway enrichment results to genes in PPI network (FDR < 0.01) |
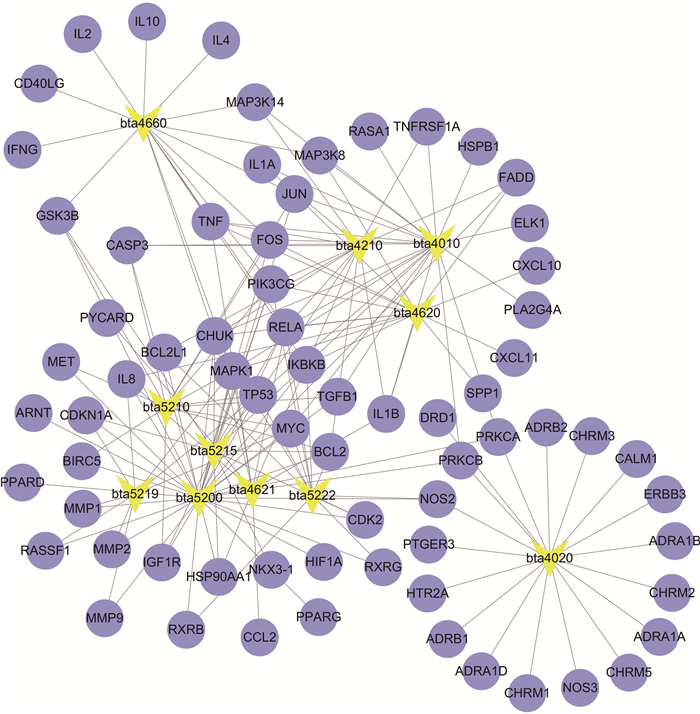
|
图 4 靶点-通路网络(黄色表示通路,紫色表示靶点) Figure 4 Target-pathway network (Yellow for pathway and purple for target) |
归芪益母汤具有补气生血之功效,主治过力劳伤,气血俱虚及产后血虚血滞之证。原方记载治“牛无力疲倦多眠”“牛行路太多,或日夜负重,以致气血俱虚,其症疲倦多眠。宜归芪益母汤主之”。但在临床上,凡过力劳伤所致的气血俱虚,产后气血虚弱,子宫、阴道垂脱等证,均可酌情应用。然而其作用机制尚不明了,故本研究采用TCMSP中药系统药理学分析平台,研究了归芪益母汤3味中药的有效成分,配伍机制,同时构建了化合物-靶点网络,靶点-通路网络,分析了化合物-靶点、靶点-通路相互之间的作用关系,明确了归芪益母汤“多成分-多靶点-多途径”的治疗机制及信号通路表达途径。
3.1归芪益母汤组方中主要是通过黄芪、益母草中的槲皮素、山奈酚、芒柄花黄素、花生四烯酸、异鼠李素等化合物发挥作用,而组方中当归主要是以β-谷固醇和豆甾醇发挥作用的。其中槲皮素能显著抑制促癌剂的作用[5],抑制离体恶性细胞的生长[6],槲皮素还具有扩张冠状动脉、降低毛细血管的通透性和脆性的活性[7];山奈酚主要具有抗动脉粥样硬化[8]、抑制癌细胞增殖[9]和炎症保护作用[10];芒柄花黄素主要针对膀胱癌[11]、肺癌[12]、直肠癌[13]等多种癌症有明显的诱导细胞凋亡的作用;花生四烯酸是前列腺素的重要合成前体,具有广泛的生物活性,对细胞内磷酯酶[14]、蛋白激酶[15]起着调节作用,并直接影响着钙信号转导通道[16],并且具有兴奋子宫的作用[17];异鼠李素具有抑制脂质过氧化反应[18]、扩张冠状动脉[19]、内皮保护[20]、抗血栓[21]、抗血小板凝集[21]、降压[22]和舒张血管[23-24]等多种药理作用;当归中β-谷固醇和豆甾醇是天然抗氧化体系,具有明显的降血脂[25]和抗氧化作用[24-27]。综上,归芪益母汤主要是通过多种化合物的多靶点多作用通路共同实现治疗目的,如通过花生四烯酸调节钙信号转导通道,兴奋子宫,引起子宫收缩,治疗母牛产后胎衣不下;通过槲皮素、异鼠李素等舒张血管、抗血栓、抗血小板凝集和抗氧化作用治疗产后气虚血瘀证。且多种化合物具有明显的抗癌作用,对应了膀胱癌、肺癌、大肠癌等多个疾病通路,对以后的药理作用研究提供了方向。
3.2根据分析表明其化合物-靶点的关键靶点是前列腺素合成酶G/H-2、前列腺素合成酶G/H-1、视黄酸受体RXR-α、热休克蛋白HSP90、核受体共激活剂2等。有学者研究表明,前列腺素合成酶G/H-2是生成前列腺素E2的两种关键合成酶[28-29],而前列腺素E2[30]参与体内发热、炎症[31]、疼痛感知和细胞生长[32]等的调节; 前列腺素合成酶G/H-1主要在多数组织与血小板中表达, 并且涉及前列腺素与血栓素的合成, 前列腺素与血栓素对维持某些细胞功能起作用[33-34];视黄酸受体RXR-α作为一个有着中心作用的核受体,能够在细胞的不同发育阶段进行不同程度的表达,对细胞的生长、增殖、分化等诸多生理过程都起着非常重要的调控作用[16, 27],并且RXR-α功能的异常与某些癌症[35]的发生也存在一定的联系;热休克蛋白[36]是生物受到环境中物理、化学、生物、精神等刺激时发生应激反应而合成的蛋白质。HSP90作为HSPs中的一个重要家族,主要作用是与一系列激素受体和激酶结合,参与信号转导及功能的调节[37-39]。
3.3将归芪益母汤作用于牛的靶点进行PPI映射且构建网络,分析结果表明,归芪益母汤作用于牛的关键靶点是TNF、IL8、HSP90AA1、MAPK1等,尤其TNF的作用程度大于其他靶点,TNF不仅对肿瘤细胞有毒性作用,还可以引起血管扩张,促进细胞增殖和分化,促进T细胞MHCⅠ类抗原表达,增强IL-2依赖的胸腺细胞、T细胞增殖能力,促进IL-2、CSF和IFN-γ等淋巴因子产生,增强有丝分裂原或外来抗原刺激B细胞的增殖和Ig分泌。
3.4GO富集分析和KEGG通路注释分析结果可知, 归芪益母汤主要活性成分的靶点是通过细胞增殖、信号转导在细胞内外不同部位发生蛋白结合、酶反应等分子反应。具体包括:T细胞受体、细胞凋亡、钙离子、Toll样受体等信号通路,前列腺素合成酶G/H-2、前列腺素合成酶G/H-1、视黄酸受体RXR-α、热休克蛋白HSP90、核受体共激活剂2等细胞分化和炎性物质,小细胞肺癌、大肠癌、膀胱癌等疾病通路。综上,归芪益母汤是通过信号转导-内分泌-炎症反应和细胞凋亡来发挥作用的。
分析结果表明,归芪益母汤通过多种通路,多个靶点发挥作用,上述分析的结果与治疗牛气血两虚证的药理作用吻合,且具有抗癌抗肿瘤的靶点与通路,可以为以后的深入研究提供参考和方向。且多靶点、多通路的作用方式符合中药方剂的治疗理念,但古方的配伍比例是否准确,改变比例是否可以改变药效等仍需继续研究讨论。
4 结论通过基于网络药理学方法构建了归芪益母汤治疗牛气血两虚证的化合物-靶点-通路网络模型,分析结果发现归芪益母汤可以通过细胞增殖、信号转导、酶反应等生物过程调控胎衣不下,产后血虚等牛气血两虚证。
| [1] |
马伟, 温东, 赵锐, 等. 基于网络药理学对黄芪六一汤治疗2型糖尿病机制预测研究[J]. 中国药物与临床, 2017, 17(10): 1417–1419.
MA W, WEN D, ZHAO R, et al. Mechanism of Astragalus Liuyi decoction in treating type 2 diabetes mellitus based on network pharmacology[J]. Chinese Remedies & Clinics, 2017, 17(10): 1417–1419. (in Chinese) |
| [2] |
杨振中.抗2型糖尿病中药药效物质发现方法及网络药理学研究[D].杭州: 浙江大学, 2014.
YANG Z Z. Studies on active constituents recognition approaches and the network pharmacology of traditional Chinese medicine for type 2 diabetes[D]. Hangzhou: Zhejiang University, 2014. (in Chinese) |
| [3] |
吴嘉瑞, 金燕萍, 王凯欢, 等. 基于网络药理学的"金银花-连翘"药对作用机制分析[J]. 中国实验方剂学杂志, 2017(5): 179–183.
WU J R, JIN Y P, WANG K H, et al. Analysis on the mechanism of action of "Honeysuckle-Forsythia suspensa" medicine based on network pharmacology[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017(5): 179–183. (in Chinese) |
| [4] |
汪小帆, 李翔, 陈关荣.
网络科学导论[M]. 北京: 高等教育出版社, 2012.
WANG X F, LI X, CHEN G R. Network science:an introduction[M]. Beijing: Higher Education Press, 2012. (in Chinese) |
| [5] |
孟德胜, 汪仕良. 槲皮素的抗癌作用[J]. 中草药, 2001, 32(2): 186–188.
MENG D S, WANG S L. Antitumor effect of quercetin[J]. Chinese Traditional and Herbal Drugs, 2001, 32(2): 186–188. DOI: 10.3321/j.issn:0253-2670.2001.02.045 (in Chinese) |
| [6] |
耿威, 仉慧颖, 李林, 等. 槲皮素对胃癌细胞增殖及侵袭的调控作用及机制[J]. 中国老年学杂志, 2018(1): 34–36.
GENG W, ZHANG H Y, LI L, et al. Effect and mechanism of quercetin on proliferation and invasion of gastric cancer cells[J]. Chinese Journal of Gerontology, 2018(1): 34–36. DOI: 10.3969/j.issn.1005-9202.2018.01.012 (in Chinese) |
| [7] |
林蓉, 刘俊田, 李旭, 等. 槲皮素对血管内皮细胞损伤的保护作用[J]. 中国循环杂志, 2000, 15(5): 304–305.
LIN R, LIU J T, LI X, et al. Protection of vascular endothelial cells from hydrogen peroxide-induced injury by quercetin[J]. Chinese Circulation Journal, 2000, 15(5): 304–305. DOI: 10.3321/j.issn:1000-3614.2000.05.027 (in Chinese) |
| [8] |
孔令希.山奈酚抗动脉粥样硬化作用机理探讨及其药代动力学研究[D].重庆: 重庆医科大学, 2014.
KONG L X. Antiatherosclerotic mechanism of kaempferol and its pharmacokinetics[D]. Chongqing: Chongqing Medical University, 2014. (in Chinese) |
| [9] |
陈卓, 刘胜楠, 吴克俭, 等. 不同剂量山奈酚对胰腺癌细胞株PANC-1增殖、凋亡的影响及机制探讨[J]. 山东医药, 2018(3): 27–30.
CHEN Z, LIU S N, WU K J, et al. Effects of different doses of kaempferol on proliferation and apoptosis of pancreatic cancer PANC-1 cells[J]. Shandong Medical Journal, 2018(3): 27–30. DOI: 10.3969/j.issn.1002-266X.2018.03.007 (in Chinese) |
| [10] |
周运江, 王虎, 李丽, 等. 山柰酚对脂多糖诱导的肥大细胞炎症反应的抑制作用[J]. 药学学报, 2015, 50(6): 702–707.
ZHOU Y J, WANG H, LI L, et al. Inhibitory effect of kaempferol on inflammatory response of lipopolysaccharide-stimulated human mast cells[J]. Acta Pharmaceutica Sinica, 2015, 50(6): 702–707. (in Chinese) |
| [11] |
柳青, 梁梅花, 张幸, 等. 芒柄花黄素对人膀胱癌细胞T739增殖、凋亡的影响及机制探讨[J]. 中国医药导报, 2017, 14(25): 4–7.
LIU Q, LIANG M H, ZHANG X, et al. Effects of formononetin on proliferation and apoptosis of human bladder cancer cells T739 and its mechanism[J]. China Medical Herald, 2017, 14(25): 4–7. (in Chinese) |
| [12] |
李涛. 芒柄花黄素对人肺癌细胞A549增殖与凋亡的影响及其机制[J]. 华夏医学, 2015, 28(1): 28–31.
LI T. Effects and mechanism of formononetin on the proliferation and apoptosis of human lung cancer cells A549[J]. Acta Medicinae Sinica, 2015, 28(1): 28–31. (in Chinese) |
| [13] |
李通, 黎欣, 高枫, 等. 芒柄花黄素对结直肠癌细胞增殖、凋亡的影响及机制探讨[J]. 山东医药, 2016, 56(10): 1–3.
LI T, LI X, GAO F, et al. Effects of formononetin on proliferation and apoptosis of colorectal cancer cells and its mechanism[J]. Shandong Medical Journal, 2016, 56(10): 1–3. DOI: 10.3969/j.issn.1002-266X.2016.10.001 (in Chinese) |
| [14] | MEVES H. Modulation of ion channels by arachidonic acid[J]. Progress Neurobiol, 1994, 43(2): 175–186. |
| [15] | PADMA M, DAS U N. Effect of cis-unsaturated fatty acids on the activity of protein kinases and protein phosphorylation in macrophage tumor (AK-5) cells in vitro[J]. Prostaglandins Leukot Essent Fatty Acids, 1999, 60(1): 55–63. DOI: 10.1054/plef.1998.0008 |
| [16] | SEWTER C P, BLOWS F, VIDAL-PUIG A, et al. Regional differences in the response of human pre-adipocytes to PPARγ and RXRα agonists[J]. Diabetes, 2002, 51(3): 718–723. DOI: 10.2337/diabetes.51.3.718 |
| [17] |
吕虹. 分娩发动、促进阵缩与花生四烯酸级联[J]. 国际妇产科学杂志, 1988(3): 176–177.
LV H. Childbirth, promotion of atrophy and arachidonic acid cascade[J]. Journal of International Obstetrics and Gynecology, 1988(3): 176–177. (in Chinese) |
| [18] |
刘瑞, 孟芳, 白怀, 等. 异鼠李素及橙皮甙抑制HDL氧化修饰作用的研究[J]. 四川大学学报:医学版, 2007, 38(6): 961–964.
LIU R, MENG F, BAI H, et al. Inhibitory effect of isorhamnetin and hesperidin on the oxidation of high-density lipoproteins (HDL) induced by Cu2+[J]. Journal of Sichuan University:Medical Science Edition, 2007, 38(6): 961–964. (in Chinese) |
| [19] | IBARRA M, PÉREZ-VIZCAÍNO F, COGOLLUDO A, et al. Cardiovascular effects of isorhamnetin and quercetin in isolated rat and porcine vascular smooth muscle and isolated rat atria[J]. Planta Med, 2002, 68(4): 307–310. DOI: 10.1055/s-2002-26752 |
| [20] | HÄMÄLÄINEN M, NIEMINEN R, VUORELA P, et al. The Anti-inflammatory effects of flavonoids[J]. Mediat Inflam, 2007, 10: 10. |
| [21] | HUBBARD G P, WOLFFRAM S, DE VOS R, et al. Ingestion of onion soup high in quercetin inhibits platelet aggregation and essential components of the collagen-stimulated platelet activation pathway in man:a pilot study[J]. Br J Nutr, 2006, 96(3): 482–488. |
| [22] | ZHU F, HUANG B, HU C Y, et al. Effects of total flavonoids of Hippophae rhamnoides L. on intracellular free calcium in cultured vascular smooth muscle cells of spontaneously hypertensive rats and Wistar-Kyoto rats[J]. Chin J Integr Med, 2005, 11(4): 287–292. DOI: 10.1007/BF02835791 |
| [23] | PÉREZ-VIZCAÍNO F, IBARRA M, COGOLLUDO A L, et al. Endothelium-independent vasodilator effects of the flavonoid quercetin and its methylated metabolites in rat conductance and resistance arteries[J]. J Pharmacol Exp Therap, 2002, 302(1): 66–72. DOI: 10.1124/jpet.302.1.66 |
| [24] | SANCHEZ M, LODI F, VERA R, et al. Quercetin and isorhamnetin prevent endothelial dysfunction, superoxide production, and overexpression of p47phox induced by angiotensin Ⅱ in rat aorta[J]. J Nutr, 2007, 137(4): 910–915. DOI: 10.1093/jn/137.4.910 |
| [25] |
周海玥, 汤威, 姜婧, 等. β-谷甾醇与豆甾醇对非酒精性脂肪肝作用的体外研究[J]. 营养学报, 2016, 38(5): 456–461.
ZHOU H Y, TANG W, JIANG J, et al. Effects of β-sitosterol and stigmasterol on non-alcoholic fatty liver disease in vitro[J]. Acta Nutrimenta Sinica, 2016, 38(5): 456–461. (in Chinese) |
| [26] |
左玉.某些天然抗氧化剂在复杂体系中抗氧化作用的研究[D].郑州: 河南工业大学, 2007.
ZUO Y.Study on the Antioxidant effect of some Natural antioxidants in complex Systems[D].Zhengzhou: Henan University of Technology, 2007.(in Chinese) |
| [27] | GAO Y Y, JIN L, PENG H, et al. Xanthophylls increased HDLC level and nuclear factor PPARγ, RXRγ and RARα expression in hens and chicks[J]. J Anim Physiol Anim Nutr, 2018, 102(1). |
| [28] | KENNEDY I, COLEMAN R A, HUMPHREY P P, et al. Studies on the characterization of prostanoid receptors[J]. Adv Prostaglandin Thromboxane Leukot Res, 1983, 11: 327–332. |
| [29] |
樊凤娇.奶牛输卵管上皮细胞前列腺素E2和F2α对其合成酶mRNA表达的反馈调控作用研究[D].呼和浩特: 内蒙古农业大学, 2012.
FAN F J.The Feedback regulation of prostaglandin E2 and F2α on the expression of synthetase mRNA in oviductal epithelial cells[D].Hohhot: Inner Mongolia Agricultural University, 2012.(in Chinese) |
| [30] | PARK J Y, PILLINGER M H, ABRAMSON S B. Prostaglandin E2 synthesis and secretion:the role of PGE2 synthases[J]. Clin Immunol, 2006, 119(3): 229–240. DOI: 10.1016/j.clim.2006.01.016 |
| [31] | BERENBAUM F. Proinflammatory cytokines, prostaglandins, and the chondrocyte:mechanisms of intracellular activation[J]. Joint Bone Spine Revue Du Rhumat, 2000, 67(6): 561–564. DOI: 10.1016/S1297-319X(00)00212-8 |
| [32] | SMITH W L. The eicosanoids and their biochemical mechanisms of action[J]. Biochem J, 1989, 259(2): 315–324. DOI: 10.1042/bj2590315 |
| [33] | FUNK C D, FUNK L B, KENNEDY M E, et al. Human platelet/erythroleukemia cell prostaglandin G/H synthase:cDNA cloning, expression, and gene chromosomal assignment[J]. FASEB J, 1991, 5(9): 2304–2312. DOI: 10.1096/fasebj.5.9.1907252 |
| [34] | VANE J R. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs[J]. Nat New Biol, 1971, 231(25): 232–235. DOI: 10.1038/newbio231232a0 |
| [35] | KIM M S, SWEENEY T R, SHIGENAGA J K, et al. Tumor necrosis factor and interleukin 1 decrease RXRα, PPARα, PPARγ, LXRα, and the coactivators SRC-1, PGC-1α, and PGC-1β in liver cells[J]. Metabolism, 2007, 56(2): 267–279. DOI: 10.1016/j.metabol.2006.10.007 |
| [36] |
谢永新, 史延, 黄利华, 等. 急性冷、热应激对肉鸡肝脏和心脏组织中HSPs表达的影响[J]. 中国家禽, 2018(1): 7–11.
XIE Y X, SHI Y, HUANG L H, et al. Effects of acute heat/cold stress on the expression of HSPs in liver and heart of broiler[J]. China Poultry, 2018(1): 7–11. (in Chinese) |
| [37] | KOVACS J J, MURPHY P J M, GAILLARD S, et al. HDAC6 regulates Hsp90 Acetylation and chaperone-dependent activation of glucocorticoid receptor[J]. Mol Cell, 2005, 18(5): 601–607. DOI: 10.1016/j.molcel.2005.04.021 |
| [38] | WHITESELL L, LINDQUIST S L. HSP90 and the chaperoning of cancer[J]. Nat Rev Cancer, 2005, 5(10): 761–772. DOI: 10.1038/nrc1716 |
| [39] | QUEITSCH C, SANGSTER T A, LINDQUIST S. Hsp90 as a capacitor of phenotypic variation[J]. Nature, 2002, 417(6889): 618–624. DOI: 10.1038/nature749 |



