氟是自然界普遍存在的一种化学元素,具有强氧化性,适量的氟有利于机体的健康,但过量氟亦可导致氟中毒[1]。氟中毒主要是以危害骨骼和牙齿等骨相组织,但近年来随着众多学者对氟致非骨相系统深入的研究发现氟对心、肝、肾、脑、睾丸等具有广泛的损伤作用[2-6]。肾作为机体的主要排泄器官,进入机体约85%的氟要通过肾随尿液排出,而且肾中肾小球和肾小管对氟有滤过及重吸收作用,故肾成为氟中毒最容易受损的靶器官之一[2-3, 7]。关于氟中毒肾损伤的机制主要包括肾组织脂质过氧化,诱导细胞凋亡,自由基损害等[8-10]。众多的研究发现氟中毒导致肾损伤的机制与肾细胞凋亡密切相关。杨小蓉等[11]研究发现,高氟使大鼠肾细胞内Ca2+储留,钙超载可激活calpain,进一步激发内质网通路,去除对Caspase的抑制作用,使Caspase-3表达增加导致肾细胞凋亡加速。张颖等[12]研究报道氟中毒大鼠肾小管上皮细胞的凋亡主要是通过刺激Wnt通路中Wnt4、β-catenin的过表达和E-cadherin低表达而介导发生。
然而钙作为氟中毒的拮抗剂在氟骨症的防治研究中早有报道,且得到了极大的应用。有报道称钙营养不良能加重氟的肾毒性,这种观点可以从实验研究和流行病学观察中得到证实[2, 5, 13]。吴秋云等[13]通过染氟加钙的方法发现适量的钙可拮抗氟致大鼠睾丸组织的损害作用;笔者的前期研究也发现适当剂量的钙可以在组织学及血液学指标方面减轻氟对肾的毒性作用,但过量的钙反而加剧肾结构的损伤与功能的改变[2]。那么钙对氟致肾的损伤分子机制及多大剂量的钙能有效缓解氟对肾的毒性仍不清楚。因此,本研究拟观察氟中毒大鼠添加不同水平的钙后肾组织细胞中内质网凋亡相关通路中相关基因及蛋白的表达变化,揭示氟致肾细胞凋亡过程中的分子机制及不同水平钙对其缓解的作用,为在生产实践中正确使用高钙日粮防治氟中毒提供理论依据。
1 材料与方法 1.1 实验动物分组处理选用120只雄性SD大鼠(购自山西医科大学实验动物中心),适应1周后随机分为5组,对照组C(常规饲料)、高氟组F(常规饲料,含150 mg·kg-1 F-)、高氟低钙组L(常规饲料,含150 mg·kg-1 F-+0.5% CaCO3)、高氟中钙组M (常规饲料,含150 mg·kg-1 F-+1% CaCO3)和高氟高钙组H (常规饲料,含150 mg·kg-1 F-+2% CaCO3),试验期间所有大鼠均自由采食和自由饮水,试验环境控制在12 h光照和12 h黑暗,温度控制在23~25 ℃,湿度控制在50%~60%范围内,定期为实验大鼠更换垫料,保证良好的饲养环境,在试验期120 d时随机选出6只大鼠并采取肾组织,一部分放入10%中性甲醛固定,一部分放入液氮后于-82 ℃冰箱低温保存备用。
1.2 主要试剂及实验仪器氟化钠(NaF,AR)购自天津市化学试剂三厂;Trizol、Prime Script RT reagent Kit with gDNA Eraser、Two Step SYBR RT-PCR Kit和DNA Marker均购自TaKaRa;DEPC购自Sigma公司;β-actin、Caspase-12、JNK、Bax、Bcl-2蛋白抗体(均来源于家兔)和辣根过氧化物酶标记的Goat Anti-Rabbit IgG均购自北京博奥森生物技术有限公司。Mx3000实时荧光定量PCR仪(美国Stratagene公司);D-3752高速冷冻离心机(Sigma公司);BX51型生物显微镜(日本OLYMPUS);DL-CJ-1ND医用型超净工作台(北京哈东联公司);FluorChem Q荧光成像系统(美国Alpha);凝胶成像系统(美国BioRad公司)
1.3 试验方法 1.3.1 组织病理学观测及免疫组织化学检测肾组织用中性甲醛固定后,修整组织块,用流水冲洗12 h,梯度乙醇和二甲苯依次脱水,将组织浸蜡、包埋、切片(厚度为5 μm)、HE染色,用生物显微镜观察肾组织的病理变化。免疫组织化学检测是将切片常规脱蜡至水,30% H2O2灭活内源性酶,热修复抗原,5% BSA封闭,加适当稀释的Bcl-2和Bax抗体4 ℃过夜,再加Goat Anti-Rabbit IgG,然后用SABC和DAB显色试剂显色,最后用苏木素轻度复染2 min。脱水,透明,封片,用BX51型生物显微镜采集图片。
1.3.2 Real-time PCR反应 1.3.2.1 总RNA的提取、cDNA的合成及质量鉴定利用TRIZOL试剂提取肾中的总RNA,通过Nano-drop-2000测定其浓度及A260 nm/A280 nm,按照Prime Script RT reagent Kit with gDNA Eraser说明书对RNA进行反转录,置于-82 ℃超低温冰箱保存备用。
1.3.2.2 荧光定量RT-PCR引物设计与合成由美国国立生物信息技术中心(NCBI)和Primer 5.0软件设计大鼠Caspase-3、Caspase-9、Caspase-12、IRE1、TRAF2、ASK1、JNK基因的引物,同时以β-肌动蛋白(β-actin,GenBank登录号NM-031144.2)为内参基因检测和比较各RNA样品的完整性及其反转录效率之间的差别,引物序列及大小见表 1。引物由宝生物工程(大连)有限公司合成。
|
|
表 1 试验中所用到的引物序列 Table 1 Primer sequences used in the present study |
将采集的经免疫组织化学染色的图片在同一条件下运用生物显微镜采集各个试验组图像10张,应用专业图像分析软件进行平均光密度分析,之后用Prism 5统计软件对免疫组化和荧光定量PCR数据进行处理分析,进行差异性显著的分析。
1.3.4 Western blot检测肾凋亡相关蛋白肾组织加入蛋白裂解液裂解,收集蛋白样品后测定蛋白样品的浓度。蛋白样品加入适量的上样缓冲液,混匀后加热到100 ℃变性10 min,冷却到室温后待上样,将样品加入到SDS-PAGE加样空内以恒压80 V进行电泳,至分离胶后电压调整为恒压100 V,该过程在冰浴条件下进行。电泳后转到聚偏二氟乙烯(PVDF)膜上,采用恒压35 V转膜2 h,封闭2 h后,用β-actin、Caspase-12和JNK抗体4 ℃孵育过夜,然后加入对应的辣根过氧化物酶标记的Goat Anti-Rabbit IgG孵育2 h,最后采用ECL试剂来检测蛋白表达。
1.3.5 数据统计结果采用GraphPad Prism 5统计软件的One-way analysis of variance (ANOVA)方法进行分析,数据使用平均值±标准差(x±s)表示,组间比较使用LSD进行显著性检验,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 不同钙水平对氟致大鼠肾组织结构损伤的影响图 1为试验120 d各组大鼠肾组织病理学结果:从C组(对照组)可见肾组织结构形态正常,肾小体分布均匀,肾小囊腔间隙均匀,肾小管上皮细胞排列整齐,管腔圆滑。F组(高氟组)肾小球肿胀,肾球囊间隙变宽,近曲小管上皮细胞肿胀并出现空泡变性。L组(高氟低钙组)肾组织形态并未出现明显异常变化,肾小体分布均匀,肾小管上皮细胞排列整齐,M组(高氟中钙组)和H组(高氟高钙组)肾组织可见明显的损伤,肾球囊间隙不均匀。但M组损伤程度较F组有所减轻;在H组, 肾小体分布不均,肾小管模糊不清,肾小管上皮细胞聚集在一起,损伤程度较F组更加严重。
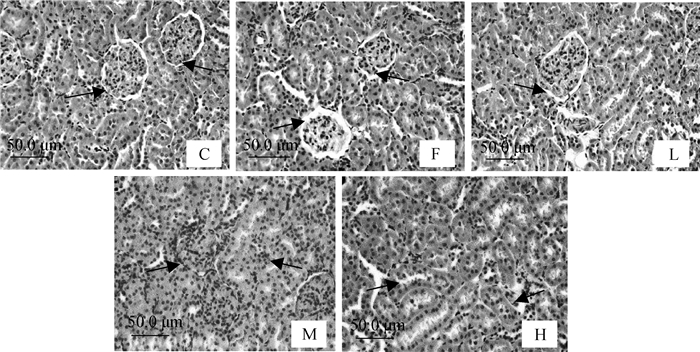
|
C.对照组;F.高氟组(饲料含150 mg·kg-1 F-);L.高氟低钙组(饲料含150 mg·kg-1 F-+0.5% CaCO3);M.高氟中钙组(饲料含150 mg·kg-1 F-+1% CaCO3);H.高氟高钙组(饲料含150 mg·kg-1 F-+2% CaCO3);以下图表分组情况均同此处。箭头标注为肾球囊间隙的变化 C. Control group; F. High fluoride group (feed containing 150 mg·kg-1 F-); L. High fluoride and low calcium group (feed containing 150 mg·kg-1 F-& 0.5% CaCO3); M. High fluoride and medium calcium group (feed containing 150 mg·kg-1 F-& 1% CaCO3); H. High fluoride and high calcium group (feed containing 150 mg·kg-1 F-& 2% CaCO3); The grouping of following charts are in the same way as here. The arrows represent changes in the capsule of glomerulus clearance 图 1 大鼠肾超微结构观察 Figure 1 Ultrastructure observation of kidney in rat |
从图 2可以看出,在试验120 d时,氟中毒大鼠肾内质网凋亡通路中IRE1、ASK1、TRAF2基因mRNA表达水平较对照组显著降低(P < 0.05,P < 0.01或P < 0.001),而JNK、Caspase-12、Caspase-3基因表达量则极显著升高(P < 0.01或P < 0.001)。与F组相比较,L、M和H三组在肾内质网凋亡通路中TRAF2、ASK1基因mRNA表达量显著升高(P < 0.05或P < 0.01),IRE1基因mRNA表达量仅在M组极显著升高(P < 0.01);而Caspase-12、Caspase-3(H组除外)基因mRNA表达量显著降低(P < 0.05或P < 0.01);JNK基因mRNA表达量在H组显著降低(P < 0.05),在M和L组表达量没有显著变化。在120 d的试验中,Caspase-9基因mRNA表达量各试验组中均无显著性变化(P>0.05)。

|
与F组相比较, *.P < 0.05, **.P < 0.01, ***.P < 0.001 Compared with group F, *.P < 0.05, **.P < 0.01, ***.P < 0.001 图 2 不同钙水平对氟致大鼠肾内质网应激相关基因表达水平(n=6, x±s) Figure 2 Different calcium level of fluoride induced rat kidney injury endoplasmic reticulum stress related gene expression level (n=6, x±s) |
图 3为试验120 d大鼠肾组织Bax蛋白免疫组化表达的结果,从图中可以看出,与C组相比,F组Bax阳性染色较多;与F组相比,L、M和H组的Bax阳性细胞数相对较少,L组较M和H组的Bax阳性细胞数相对较少。说明氟可以使得Bax蛋白在肾组织中表达升高,而低剂量的钙有显著抑制氟引起Bax在肾中的高表达作用。
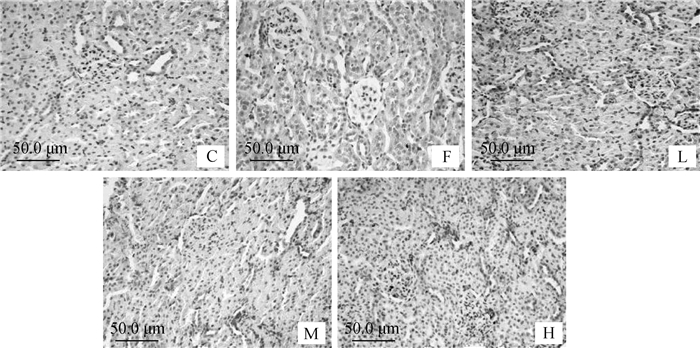
|
图 3 大鼠肾组织免疫组化Bax蛋白表达 Figure 3 The expression of Bax protein in kidney of rats |
试验120 d大鼠肾组织Bcl-2蛋白免疫组化结果见图 4。可以看出,与C组相比,F组Bcl-2的阳性细胞明显减少;但与F组相比,L、M和H组的Bcl-2阳性染色细胞数有所增多,且随着钙剂量的增加而减少。说明氟可以降低Bcl-2蛋白在肾组织中表达,而低剂量的钙对氟引发的Bcl-2在肾中的表达下降有较好的缓解作用。
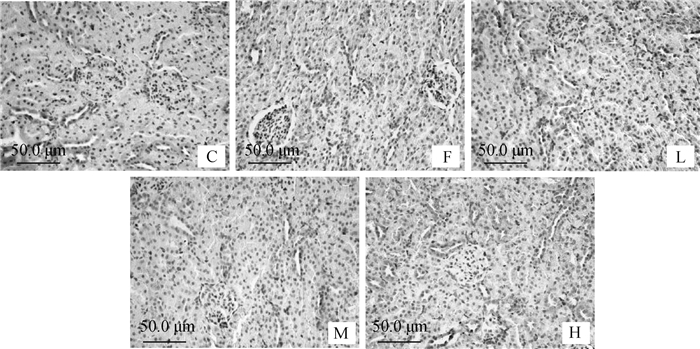
|
图 4 大鼠肾组织免疫组化Bcl-2蛋白表达 Figure 4 The expression of Bcl-2 protein in kidney of rats |
由图 5可知,与C组相比,F组Bax/Bcl-2蛋白表达量极显著升高(P < 0.01);L和M组中Bax/Bcl-2蛋白表达量较F组中均显著降低(P < 0.05或P < 0.01),而H组无显著差异。
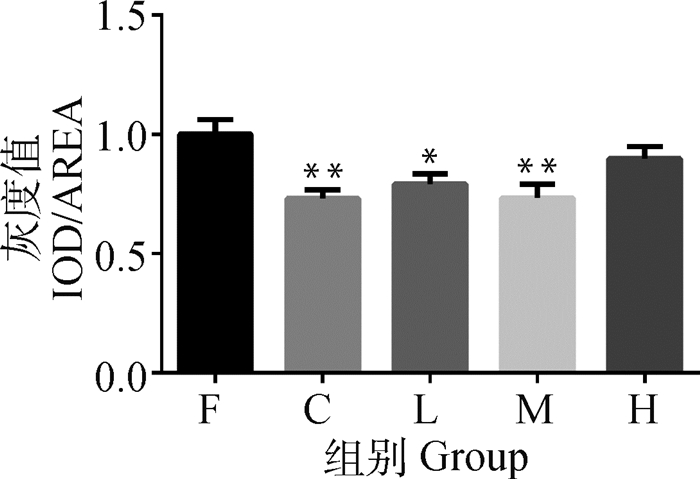
|
与F组相比较, *.P < 0.05, **.P < 0.01 Compared with group F, *.P < 0.05, **.P < 0.01 图 5 大鼠肾中蛋白Bax/Bcl-2的比值(n=10, x±s) Figure 5 The ratio of Bax/Bcl-2 protein in kidney of rats (n=10, x±s) |
免疫印迹测定试验120 d时Caspase-12和JNK蛋白表达水平见图 6,可以看出,与对C相比,F组Caspase-12和JNK蛋白表达显著升高(P < 0.05或P < 0.01);与F组相比,L和M组Caspase-12及JNK蛋白表达降低且差异显著(P < 0.05或P < 0.01),而H组差异不显著。表明氟可以激活JNK通路及Caspase-12通路中的蛋白表达,而低、中剂量的钙可显著抑制氟诱导这两种蛋白的过量表达。
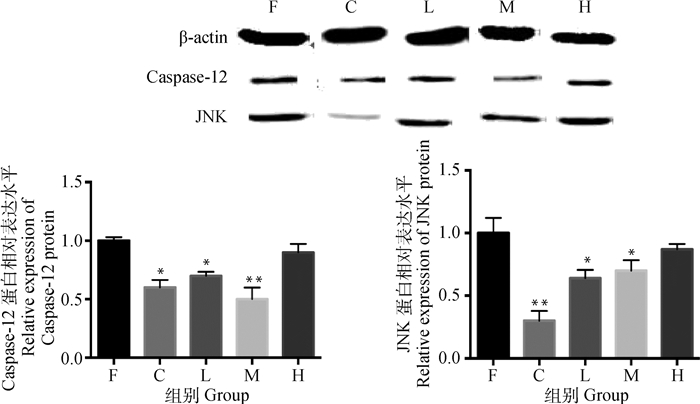
|
与F组相比较, *.P < 0.05, **.P < 0.01 Compared with group F, *.P < 0.05, **.P < 0.01 图 6 120日龄各组大鼠肾免疫印迹杂交条带(n=5, x±s) Figure 6 Western blotting band of the kidney in rat of each group at 120 d (n=5, x±s) |
氟中毒是全世界广泛存在的一种人畜共患性的地方病,主要临床症状是氟斑牙和氟骨症。但近年来众多的学者从流行病学调查和实验动物的研究发现高氟不但对硬组织造成损伤,还可导致全身软组织器官发生损伤[1, 14-15]。肾作为机体氟主要的代谢和排泄器官,长期处于高氟环境的刺激下,更加容易导致组织受损。张颖等[12]研究发现随着氟摄入量的增加,大鼠骨氟、尿氟显著升高,肾小管上皮细胞肿胀明显加重,导致肾功能受损。本课题的前期研究[2]也发现高氟导致大鼠肾各种代谢产物及血液中的肌酐、尿素氮、LDH、SDH、ALP含量发生改变,而中、低剂量钙可以不同程度地减轻肾功能损伤和形态的改变,对肾组织具有一定程度的保护作用。所以,研究氟导致肾组织细胞凋亡的途径及抑制氟的细胞毒性作用成为减缓氟中毒的关键。
生物学上拮抗氟的毒性作用的研究较多,但由于钙本身的使用范围较广,毒副作用较低成为人们研究的热点之一。据徐辉等[16]的研究显示,氟中毒后肾细胞内游离钙离子浓度发生巨大的变化,本课题组前期的研究也显示细胞钙稳态与钙缺乏有着非常密切的联系,而细胞内钙离子浓度的变化会直接激发细胞内质网应激导致细胞的损伤,严重时可导致细胞发生死亡[17]。低钙对机体整体的危害不仅仅表现在神经、内分泌中,在亚细胞水平来看内质网更为敏感[18]。蛋白的折叠、分子伴侣的功能维持都需要内质网腔保持高水平的Ca2+。破坏内质网Ca2+稳态的因素可诱发内质网应激,内质网应激可引起Ca2+从内质网腔释出进入细胞质,促使Ca2+进入细胞核和线粒体,进而促进ROS的生成诱导凋亡[19]。因此,从内质网应激通路研究外源性补充钙对缓解氟的毒性研究具有重要的现实意义。
3.2 内质网应激凋亡相关通路内质网应激是针对外界不利因素的保护性应答反应, 有报道称内质网应激与多种肾毒物引发的肾损伤机制密切相关[20-21]。内质网应激可以触发以未折叠蛋白反应为核心的相关信号通路应答发生变化。在长期或严重的应激下,内质网应激介导的凋亡信号通路主要有以下3条[22-24]:①JNK(c-jun N-terminal kinases)信号通路;②Caspase-12信号通路,③CHOP (CAAT/enhancer-binding protein-homologous protein)信号通路,其中IRE1介导的JNK信号通路和Caspase-12信号通路是我们关注的重点。第1条凋亡通路是在高氟的长期刺激下,活化的IRE1与TRAF2 (TNF receptor associated factor 2)相互聚集,激活凋亡信号调节激酶1(ASK1)而形成IRE1/TRAF2/ASK1三聚体而激活JNK,JNK磷酸化后可以抑制抗凋亡蛋白Bcl-2和激活BAX的表达,诱导细胞凋亡[25-26]。第2条凋亡通路是位于内质网外膜的Caspase-12通过多种途径激活Caspase-12凋亡通路,促进细胞凋亡。有大量的研究报道活化的Caspase-12在无细胞色素C的参与下能激活下游的Caspase-9和Caspase-3, 导致细胞凋亡[19, 27]。
3.2.1 氟中毒及不同水平钙对内质网应激凋亡JNK信号通路的影响本研究发现,与对照组相比较,高氟使IRE1、TRAF2、ASK1基因表达显著降低,而JNK基因及蛋白的表达量均显著升高。这正是由于高氟长期刺激导致内质网持续应激使得活化的IRE1与TRAF2相互作用激活ASK1形成IRE1/TRAF2/ASK1三聚体而激活JNK,导致游离的IRE1、TRAF2、ASK1表达量降低。但在高氟补钙后IRE1、TRAF2、ASK1基因的表达量较F组均有升高,在M组中差异均显著;而JNK基因的表达量有下降趋势,只有在高氟高钙组中差异显著,但JNK蛋白的表达量在L和M组均显著下降。Liu等[14]和张亚楼等[28]分别研究发现氟化钠可通过IRE1途径导致Wistar大鼠甲状腺细胞和人成骨细胞发生内质网应激而凋亡,其中IRE1蛋白表达显著升高。闫婷等[29]用25 mg·(kg·d)-1氟化钠给大鼠灌胃,7周后检测睾丸组织中IRE1及JNK mRNA水平及蛋白的表达量,结果发现睾丸组织中IRE1及JNK的基因及蛋白表达量均显著高于对照组,以上这些研究报道均证实了高氟可以通过IRE1介导JNK通路导致细胞凋亡,与本研究的结果相一致。孙景春等[30]用低钙日粮大鼠氟中毒肾损伤的研究指出,低钙营养可通过内质网应激进一步加剧氟对肾的损伤作用,这也印证了本研究中补充低剂量钙可以缓解氟对肾通过内质网应激的作用机制。
Bcl-2、Bax是细胞内刺激途径中Bcl-2家族成员。Bcl-2具有抑制凋亡作用,Bax具有促进凋亡作用[9, 31]。有研究报道,外界持续的刺激不仅可以活化JNK通路,同时JNK可促进抗凋亡基因Bcl-2和促凋亡基因Bax的磷酸化,激活细胞内Bax的表达,同时抑制Bcl-2的表达[19, 32]。氟中毒大鼠肾组织中Bcl-2的表达量随NaF浓度的增加而逐渐降低,而Bax基因的表达量则显著升高[9]。向程窈等[7]报道不同浓度的氟均可诱导大鼠肾小管上皮细胞凋亡,随着氟浓度增加,凋亡细胞增多; 肾小管上皮细胞Bcl-2表达随氟剂量增加而逐渐下降,Bax表达则逐渐增加。本研究通过免疫组织化学染色发现,在肾组织中高氟组肾小管上皮细胞的细胞质中Bax阳性细胞的染色较多,Bcl-2阳性染色则较少,Bax/Bcl-2的比值显著升高,这与其他学者的研究报道相一致[31, 33]。Yang等[33]和Cao等[31]分别用不同剂量的氟化钠处理成骨细胞和鲤鱼肾的研究发现,氟中毒可使MC3T3-E1成骨细胞和鲤鱼肾中Bax/Bcl-2的比率显著升高。表明凋亡相关因子Bax、Bcl-2可能均参与了大鼠慢性氟中毒时肾损伤的发生发展过程。在氟中毒后添加中、低剂量的钙对氟引起的Bcl-2表达下降和Bax的表达升高有很好的抑制作用,这一结果也与笔者的前期研究用低、中剂量的钙能缓解肾氟中毒的研究相吻合[2],同时提示低、中剂量的钙可以通过抑制氟对肾Bcl-2家族成员的蛋白表达的影响缓解氟的肾毒性作用。
3.2.2 氟中毒及不同水平钙对内质网应激凋亡Caspase-12信号通路的影响有大量研究表明细胞凋亡是由多因子复杂的相互作用诱导产生凋亡信号,当信号传递至内质网外膜上Caspase-12信号时就会引起内质网应激而发生级联反应,导致细胞凋亡[27, 34]。本研究结果显示,F组中Caspase-12和Caspase-3 mRNA的表达量均显著高于C组,用Western blot检测了Caspase-12蛋白的表达与基因相一致;与F组相比,L和M组Caspase-12和Caspase-3基因的表达量显著降低;Caspase-12蛋白的表达L和M组显著低于F组。这与Zhang等[27]研究报道高氟对SD大鼠的神经细胞Caspase-12、Caspase-9和Caspase-3的表达量显著升高相一致。不同氟剂量诱导大鼠肾细胞凋亡中发现,高氟可使得肾细胞Caspase-8、Caspase-9、Caspase-3的表达量均显著升高导致肾细胞发生凋亡[34]。不同水平钙对氟诱导脑细胞损伤的研究中指出,高氟可使Bcl-2表达显著下降,而Caspase-12显著升高,高钙(日粮中含7%)可以使得氟对脑细胞的毒性作用明显减缓,降低Caspase-12的表达量,同时增加Bcl-2的表达[5]。提示高氟不仅可以通过JNK信号通路引发内质网应激,也可以通过Caspase-12通路导致肾发生损伤;同时,补充中剂量的钙可以有效缓解高氟诱导的内质网应激。
4 结论氟中毒可以使大鼠肾组织细胞中内质网凋亡通路中JNK通路和Caspase-12通路中的JNK、Caspase-12、Caspase-3、IRE1、TRAF2、ASK1基因及JNK、Caspase-12、Bax及Bcl-2蛋白表达发生显著变化,引起肾细胞内质网应激导致细胞凋亡加速。在饮食中添加低、中剂量的钙可通过抑制氟诱导肾组织细胞内质网应激中JNK信号通路和Caspase-12信号通路有效缓解氟的肾毒性作用。
| [1] | DAIWILE A P, SIVANESAN S, TARALE P, et al. Role of fluoride induced histone trimethylation in development of skeletal fluorosis[J]. Environ Toxicol Pharmacol, 2018, 57: 159–165. DOI: 10.1016/j.etap.2017.12.015 |
| [2] |
霍梅俊, 王金明, 姚冰芬, 等. 不同水平钙对氟中毒大鼠肾脏功能损伤的影响[J]. 畜牧兽医学报, 2012, 43(9): 1483–1490.
HUO M J, WANG J M, YAO B F, et al. Effects of different Ca levels on functional injury of kidneys induced by fluoride in rat[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(9): 1483–1490. (in Chinese) |
| [3] | IANO F G, FERREIRA M C, QUAGGIO G B, et al. Effects of chronic fluoride intake on the antioxidant systems of the liver and kidney in rats[J]. J Fluorine Chem, 2014, 168: 212–217. DOI: 10.1016/j.jfluchem.2014.09.029 |
| [4] | NIU R Y, CHEN H J, MANTHARI R K, et al. Effects of fluoride on synapse morphology and myelin damage in mouse hippocampus[J]. Chemosphere, 2018, 194: 628–633. DOI: 10.1016/j.chemosphere.2017.12.027 |
| [5] | SUN Y, KE L L, ZHENG X R, et al. Effects of different levels of calcium intake on brain cell apoptosis in fluorosis rat offspring and its molecular mechanism[J]. Biol Trace Elem Res, 2017, 176(2): 355–366. DOI: 10.1007/s12011-016-0850-9 |
| [6] | ZHANG J H, LI Z H, QIE M L, et al. Sodium fluoride and sulfur dioxide affected male reproduction by disturbing blood-testis barrier in mice[J]. Food Chem Toxicol, 2016, 94: 103–111. DOI: 10.1016/j.fct.2016.05.017 |
| [7] |
向程窈, 于燕妮, 陈荣, 等. Beclin-1、Bcl-2、Bax在慢性氟中毒大鼠肾脏中表达[J]. 中国公共卫生, 2016, 32(6): 798–802.
XIANG C Y, YU Y N, CHEN R, et al. Expression and clinical significance of Beclin-1, Bcl-2, and Bax in renal cells of rats with exprimental fluorosis[J]. Chinese Journal of Public Health, 2016, 32(6): 798–802. (in Chinese) |
| [8] |
余日安, 夏涛, 王爱国, 等. 氟中毒对大鼠肾脏脂质过氧化、细胞坏死、凋亡及增殖周期的影响[J]. 环境与健康杂志, 2001, 18(6): 336–338.
YU R A, XIA T, WANG A G, et al. Study on the effects of fluorosis on rat renal oxidative stress, necrosis, apoptosis and proliferation[J]. Journal of Environment and Health, 2001, 18(6): 336–338. DOI: 10.3969/j.issn.1001-5914.2001.06.005 (in Chinese) |
| [9] |
孔德亮, 徐爱静, 李娟, 等. 氟化钠通过调控Bcl-2和Bax基因的表达诱导大鼠肾脏细胞凋亡机制的研究[J]. 临床和实验医学杂志, 2017, 16(17): 1676–1679.
KONG D L, XU A J, LI J, et al. The mechanism study of sodium fluoride induced renal apoptosis by regulating the expression of Bcl-2 and Bax gene in rat kidney[J]. Journal of Clinical and Experimental Medicine, 2017, 16(17): 1676–1679. DOI: 10.3969/j.issn.1671-4695.2017.17.004 (in Chinese) |
| [10] |
王世英, 陈宝平, 杨素霞, 等. 氟中毒大鼠肾脏损害发生机制研究及转化生长因子表达意义[J]. 中国地方病防治杂志, 2017, 32(7): 754.
WANG S Y, CHEN B P, YANG S X, et al. The mechanism of renal damage and the transformation growth factor in rats with fluorosis and their significance[J]. Chinese Journal of Control of Endemic Disenaces, 2017, 32(7): 754. (in Chinese) |
| [11] |
杨小蓉, 于燕妮, 万雯, 等. Calpain-1、caspase-3表达在氟致肾细胞凋亡中作用[J]. 中国公共卫生, 2015, 31(11): 1412–1416.
YANG X R, YU Y N, WAN W, et al. Asscociation of calpain-1 and caspase-3 protein and mRNA expressions with apoptosis of renal cells in rats with chronic fluorosis[J]. Chinese Journal of Public Health, 2015, 31(11): 1412–1416. DOI: 10.11847/zgggws2015-31-11-14 (in Chinese) |
| [12] |
张颖, 于燕妮, 范彬. Wnt信号通路在氟中毒肾脏中表达及其意义[J]. 中国公共卫生, 2015, 31(5): 590–593.
ZHANG Y, YU Y N, FAN B. Expressions of protein and mRNA relevant to Wnt/β-catenin signaling pathway in rats with experimental fluorosis[J]. Chinese Journal of Public Health, 2015, 31(5): 590–593. (in Chinese) |
| [13] |
吴秋云, 许爱芹, 杨向东, 等. 钙拮抗氟对大鼠睾丸组织的氧化损伤作用[J]. 环境与职业医学, 2014, 31(1): 52–54.
WU Q Y, XU A Q, YANG X D, et al. Antagonistic effect of calcium against fluorosis induced oxidative stress in rat testis[J]. Journal of Environmental & Occupational Medicine, 2014, 31(1): 52–54. (in Chinese) |
| [14] | LIU H L, HOU C C, ZENG Q, et al. Role of endoplasmic reticulum stress-induced apoptosis in rat thyroid toxicity caused by excess fluoride and/or iodide[J]. Environ Toxicol Pharmacol, 2016, 46: 277–285. DOI: 10.1016/j.etap.2016.08.007 |
| [15] | ZHOU Y J, ZHANG H L, HE J L, et al. Effects of sodium fluoride on reproductive function in female rats[J]. Food Chem Toxicol, 2013, 56: 297–303. DOI: 10.1016/j.fct.2013.02.026 |
| [16] |
徐辉, 井玲, 李广生, 等. 过量氟对肾细胞内游离钙及钙泵的影响[J]. 中国地方病学杂志, 2006, 25(4): 379–381.
XU H, JING L, LI G S, et al. Effect of overdosal fluoride on the intracellular ion calcium and Ca2+-ATPase of renal cell[J]. Chinese Journal of Endemiology, 2006, 25(4): 379–381. DOI: 10.3760/cma.j.issn.1000-4955.2006.04.008 (in Chinese) |
| [17] | SUN Z L, NIU R Y, SU K, et al. Effects of sodium fluoride on hyperactivation and Ca2+ signaling pathway in sperm from mice:an in vivo study[J]. Arch Toxicol, 2010, 84(5): 353–361. DOI: 10.1007/s00204-009-0508-x |
| [18] |
刘俊, 何娅妮. 内质网应激在肾脏疾病进展中的作用[J]. 生理科学进展, 2010, 41(6): 439–442.
LIU J, HE Y N. The role of endoplasmic reticulum stress in the pregression of kidney disease[J]. Progress in Physiological Sciences, 2010, 41(6): 439–442. (in Chinese) |
| [19] |
刘杰, 朱凯, 杨定平. 内质网应激在急性肾损伤中的研究进展[J]. 临床肾脏病杂志, 2017, 17(9): 516–520.
LIU J, ZHU K, YANG D P. The research progress of endoplasmic reticulum stress in acute renal injury[J]. Journal of Clinical Nephrology, 2017, 17(9): 516–520. DOI: 10.3969/j.issn.1671-2390.2017.09.001 (in Chinese) |
| [20] | NIU Q, CHEN J W, XIA T, et al. Excessive ER stress and the resulting autophagic flux dysfunction contribute to fluoride-induced neurotoxicity[J]. Environ Pollut, 2018, 233: 889–899. DOI: 10.1016/j.envpol.2017.09.015 |
| [21] | KUO C Y, LIN C H, HSU T. VHL inactivation in precancerous kidney cells induces an inflammatory response via ER stress-activated IRE1α signaling[J]. Cancer Res, 2017, 77(13): 3406–3416. DOI: 10.1158/0008-5472.CAN-16-3196 |
| [22] | DENG H D, KUANG P, CUI H M, et al. Sodium fluoride (NaF) induces the splenic apoptosis via endoplasmic reticulum (ER) stress pathway in vivo and in vitro[J]. Aging, 2016, 8(12): 3552–3567. DOI: 10.18632/aging.v8i12 |
| [23] | ITO M, NAKAGAWA H, OKADA T, et al. ER-stress caused by accumulated intracistanal granules activates autophagy through a different signal pathway from unfolded protein response in exocrine pancreas cells of rats exposed to fluoride[J]. Arch Toxicol, 2009, 83(2): 151–159. DOI: 10.1007/s00204-008-0341-7 |
| [24] |
张杰, 荣小龙, 李建民, 等. 通络保肾复方对糖尿病大鼠肾脏内质网应激介导的凋亡信号通路JNK、Caspase-12的影响[J]. 中华中医药杂志, 2017, 32(11): 5109–5112.
ZHANG J, RONG X L, LI J M, et al. Effects of Tongluo Baoshen formula on apoptosis signaling pathways JNK, Caspase-12 mediated by endoplasmic reticulum stress[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(11): 5109–5112. (in Chinese) |
| [25] | CHEN S Q, WANG Y Q, YANG Y B, et al. Psoralen inhibited apoptosis of osteoporotic osteoblasts by modulating IRE1-ASK1-JNK pathway[J]. BioMed Res Int, 2017, 2017: 3524307. |
| [26] | ZHANG J X, LIANG Y, LIN Y B, et al. IRE1α-TRAF2-ASK1 pathway is involved in CSTMP-induced apoptosis and ER stress in human non-small cell lung cancer A549 cells[J]. Biomed Pharmacother, 2016, 82: 281–289. DOI: 10.1016/j.biopha.2016.04.050 |
| [27] | ZHANG H, LI H Z, LIU X Q, et al. Effect of caspase-9 inhibition on endoplasmic reticulum stress induced cortical neuronal injury in rats[J]. Int J Clin Exp Med, 2013, 6(7): 546–551. |
| [28] |
张亚楼, 孙小娜, 冯树梅, 等. 过量氟引起成骨细胞内质网应激信号通路的基因差异表达[J]. 重庆医学, 2014, 43(33): 4425–4427.
ZHANG Y L, SUN X N, FENG S M, et al. Genes differentially expression of endoplasmic reticulum stress signaling pathway caused by excess fluoride in osteoblasts[J]. Chongqing Medicine, 2014, 43(33): 4425–4427. DOI: 10.3969/j.issn.1671-8348.2014.33.003 (in Chinese) |
| [29] |
闫婷, 黄辉, 冯得敏, 等. IRE1通路在染氟雄性大鼠生殖损伤中的作用[J]. 郑州大学学报:医学版, 2017, 52(4): 403–407.
YAN T, HUANG H, FENG D M, et al. Role of IRE1 pathway in fluoride-exposed male rat reproductive system injury[J]. Journal of Zhengzhou University:Medical Sciences, 2017, 52(4): 403–407. (in Chinese) |
| [30] |
孙景春, 王春艳, 徐辉, 等. 内质网应激在氟中毒大鼠肾损害中的作用[J]. 吉林大学学报:医学版, 2009, 35(6): 992–995.
SUN J C, WANG C Y, XU H, et al. Effect of endoplasmic reticulum stress in renal injury of fluorosis rats[J]. Journal of Jilin University:Medicine Edition, 2009, 35(6): 992–995. (in Chinese) |
| [31] | CAO J L, CHEN J J, XIE L T, et al. Protective properties of sesamin against fluoride-induced oxidative stress and apoptosis in kidney of carp (Cyprinus carpio) Via JNK Signaling pathway[J]. Aquat Toxicol, 2015, 167: 180–190. DOI: 10.1016/j.aquatox.2015.08.004 |
| [32] | TONG Q, WU L, JIANG T, et al. Inhibition of endoplasmic reticulum stress-activated IRE1α-TRAF2-caspase-12 apoptotic pathway is involved in the neuroprotective effects of telmisartan in the rotenone rat model of Parkinson's disease[J]. Eur J Pharmacol, 2016, 776: 106–115. DOI: 10.1016/j.ejphar.2016.02.042 |
| [33] | YANG S Y, WANG Z, FARQUHARSON C, et al. Sodium fluoride induces apoptosis and alters bcl-2 family protein expression in MC3T3-E1 osteoblastic cells[J]. Biochem Biophys Res Commun, 2011, 410(4): 910–915. DOI: 10.1016/j.bbrc.2011.06.094 |
| [34] |
高继萍, 宋国华, 刘茂林, 等. 氟诱导大鼠肾脏细胞凋亡与Caspase蛋白表达关系的研究[J]. 卫生研究, 2014, 43(1): 96–100.
GAO J P, SONG G H, LIU M L, et al. Study on the relationship between renal apoptosis andexpression of Caspase protein in fluoride induced rat[J]. Journal of Hygiene Research, 2014, 43(1): 96–100. (in Chinese) |



