2. 军事医学科学院微生物流行病研究所, 北京 100071;
3. 新疆生产建设兵团畜牧兽医工作总站, 乌鲁木齐 830063
2. Beijing Institute of Microbiology and Epidemiology, The Academy of Military Medical Sciences, Beijing 100071, China;
3. The General Station of Animal Husbandry and Veterinary Medicine of Xinjiang Production and Construction Corps, Urumqi 830063, China
奶牛乳房炎在畜牧、兽医、食品卫生等领域一直受到人们的广泛关注,是影响奶牛业发展及其经济效益的常见病和多发病,其病原种类繁多,目前公认的最常见的主要致病菌有金黄色葡萄球菌、链球菌和大肠杆菌。目前国外对肠球菌性乳房炎时有报道,而国内很少有肠球菌引起奶牛乳房炎的研究报道,主要是以肠球菌在内的多种病原菌的混合感染为主,尽管其危害不及由主要病原菌引起的奶牛乳房炎,但其能引起牛奶质量的下降和奶牛乳腺的损伤。肠球菌性乳房炎不仅给养殖业造成了严重的经济损失,同时也给公共卫生安全和人类健康等带来了诸多问题[1-3]。自2002年我国新疆北部地区的羔羊在春季发生的急性死亡传染病中分离到β溶血的粪肠球菌和屎肠球菌以来[4],肠球菌性乳腺炎也引起了足够的重视。在临床上由于长期、大量使用广谱抗菌药物,致使其临床耐药菌株不断出现,并导致其耐药机制和耐药特点不断发生变化。因此,迫切需要研发新型药物,以控制耐药性病原菌引起的感染。而噬菌体作为一种特异性感染细菌的病毒,其对宿主菌具有高度的特异性和高效性,且对动植物基本没有副作用,减少了随之带来的耐药性问题。因此,越来越多的研究者开始重新探索应用噬菌体防治细菌病的道路。近年来噬菌体治疗的临床应用逐渐增多,并取得了较好的效果,S. K. Wall等[5]用噬菌体鸡尾酒法明显降低出栏猪的盲肠和回肠沙门菌浓度;张哲[6]分离的四株粪肠球菌噬菌体为噬菌体疗法应用于耐药性肠球菌的感染提供了依据;B. Biswas等[7]和宫鹏娟等[8]均利用耐万古霉素屎肠球菌噬菌体成功治疗了小鼠菌血症等。基于奶牛乳房炎防治研究的现状,笔者以奶牛乳房炎源肠球菌为宿主菌,分离筛选裂解性噬菌体,研究其生物学特性,为噬菌体作为一种生物制剂用于治疗奶牛乳房细菌性感染提供资源。
1 材料与方法 1.1 材料 1.1.1 菌株和样品采集4株屎肠球菌 (编号1~4),6株粪肠球菌 (编号5~10),4株金黄色葡萄球菌,4株大肠杆菌,2株沙门菌均为石河子大学动物传染病实验室分离鉴定所得的奶牛乳房炎源菌株,粪样采自石河子周边5个奶牛场。
1.1.2 主要试剂及培养基PEG8000(天津市光复精细化工研究所);DNaseⅠ、RNaseA、Mung Bean Nuclease、病毒核酸提取试剂盒 (TaKaRa);核酸Marker D15000(TIANGEN);SM缓冲液、PBS缓冲液、液体LB培养基、半固体LB培养基、固体LB培养基,均由石河子大学动物科技学院传染病实验室常规配制;19种抗菌药物纸片购自杭州微生物试剂有限公司。
1.2 方法 1.2.1 宿主菌的准备将10株肠球菌分别接种于液体LB培养基中,于37 ℃、180 r·min-1摇床中过夜培养,置4 ℃保存。
1.2.2 噬菌体的富集与分离参考文献方法[9]将采自石河子周边5个奶牛场的粪样过滤液静置于4 ℃冰箱过夜。将所得滤液、10株肠球菌的菌悬液以及液体LB培养基混匀于锥形瓶中,37 ℃摇床培养24 h,将培养液于4 ℃、10 000 r·min-1离心10 min,取上清液与肠球菌菌液混匀后采用双层平板法培养,观察结果。
1.2.3 噬菌体的纯化与保存如出现噬菌斑则用灭菌牙签挑取单个噬菌斑接种于其相应的宿主菌中,于LB液体培养基37 ℃振荡培养8 h,将培养液离心后取上清,将稀释的上清液与宿主菌混匀后采用双层平板法培养,如此重复三次以上,直至形成形状和大小均一的噬菌斑,即可得到较纯的噬菌体。将噬菌体与50%甘油等体积混匀后放于-80 ℃冻存、备用。
1.2.4 噬菌体的浓缩及电镜观察噬菌体浓缩液的制备参照《分子克隆实验指南》第三版中λ噬菌体颗粒提取方法[10]进行。取噬菌体浓缩液经2%的磷钨酸负染后用透射电子显微镜观察噬菌体形态[11]。
1.2.5 噬菌体核酸类型的鉴定参考文献方法[12]利用病毒基因组提取试剂盒对纯化的噬菌体浓缩液进行基因组提取,操作严格按照说明书进行。分别用DNase Ⅰ(20 U·μg-1),RNase A (5 U·μg-1) 和Mung Bean Nuclease (20 U·μg-1) 对提取的噬菌体基因组在37 ℃水浴锅中消化2 h,取消化产物进行琼脂糖凝胶核酸电泳检测。
1.2.6 噬菌体全基因组测序将噬菌体的基因组处理为约290 bp的测序文库,利用Life technologies公司的Ion Torrent测序仪PGM完成,利用Newbler 2.9软件对基因组进行拼接处理。该部分的测序内容由北京军事医学科学院微生物学流行病学研究所完成。
1.2.7 噬菌体的生物学特性将分离纯化的裂解性屎肠球菌噬菌体进行裂解谱、最佳感染复数 (MOI)、一步生长曲线、热稳定性、pH稳定性的研究。
1.2.7.1 噬菌体裂解谱的测定取纯化后的噬菌体原液100 μL,分别加入到10株肠球菌、4株金黄色葡萄球菌、4株大肠杆菌、2株沙门菌菌悬液 (50 μL) 中,采用双层平板法培养,观察结果。
1.2.7.2 噬菌体的最佳感染复数 (multiplicity of infection, MOI)按照感染复数分别为0.001、0.01、0.1、1、10、100的比例将噬菌体液和宿主菌液混合、静置、离心,沉淀分别用液体LB重悬,使不同比例的培养体系总体积一致。振荡培养5 h。利用双层平板法对噬菌体增殖液进行滴度测定,每组做三个重复,获得最高滴度的噬菌体∕细菌比例即为MOI。
1.2.7.3 一步生长曲线测定将培养至对数生长期的宿主菌与噬菌体按照最佳MOI的比例混匀、静置、离心,将所得沉淀重悬于3 mL的液体LB中,置于37 ℃、180 r·min-1摇床中振荡培养,同时开始计时取样,在0时刻和此后每隔5、10、20 min (各取6次) 取样,测定噬菌体的滴度,从而绘制出噬菌体感染宿主菌的一步生长曲线。
1.2.7.4 热稳定性测定将已知滴度的噬菌体液等体积分装若干,分别在40、50、60、70 ℃水浴锅中培养3 h,于0、20、40、60、80、100、120、140、160、180 min分别取样,倒板。通过观察噬菌斑的形成情况,可得出在不同温度下、不同时间噬菌体的滴度,并绘制曲线,即可得噬菌体对热的稳定性。
1.2.7.5 pH稳定性测试将等体积的噬菌体分别加到不同pH (pH=2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0) 的PBS缓冲液中,在37 ℃水浴中孵育2 h,釆用双层平板法测定其滴度,绘制曲线,观察不同pH处理后噬菌体生长情况,即噬菌体pH稳定性。
2 结果 2.1 噬菌体的分离、纯化从奶牛粪样中分离到一株裂解性屎肠球菌噬菌体,对其进行三次以上纯化,得到噬菌斑透亮、大小均一、形态一致、无晕环且边缘整齐的纯化噬菌体 (图 1)。将该分离株命名为vB_EfaM_XJ3。

|
图 1 双层平板法纯化噬菌体 Figure 1 Purified phage by double-layer plate method |
纯化的噬菌体浓缩液经负染后,在透射电子显微镜下观察其形态,如图 2,噬菌体vB_EfaM_XJ3其头部呈廿面体,头部长约53.15 nm,尾长约14.42 nm×199.62 nm。根据2011年国际病毒分类委员会第9次报告提出的噬菌体分类与命名标准,该噬菌体符合有尾噬菌体目 (Caudovirales),肌尾噬菌体 (Myoviridae) 的特征[13]。

|
图 2 噬菌体vB_EfaM_XJ3的电镜照片 Figure 2 Electron micrograph of phage vB_EfaM_XJ3 |
噬菌体vB_EfaM_XJ3的核酸经DNase Ⅰ、RNase A和Mung Bean Nuclease消化处理后,其消化产物进行琼脂糖凝胶核酸电泳结果表明 (图 3),vB_EfaM_XJ3核酸能被DNase Ⅰ消化,但不能被RNase A消化,说明此核酸为DNA;同时不能被Mung Bean Nuclease消化,说明为双链;因此证明vB_EfaM_XJ3基因组为双链DNA。
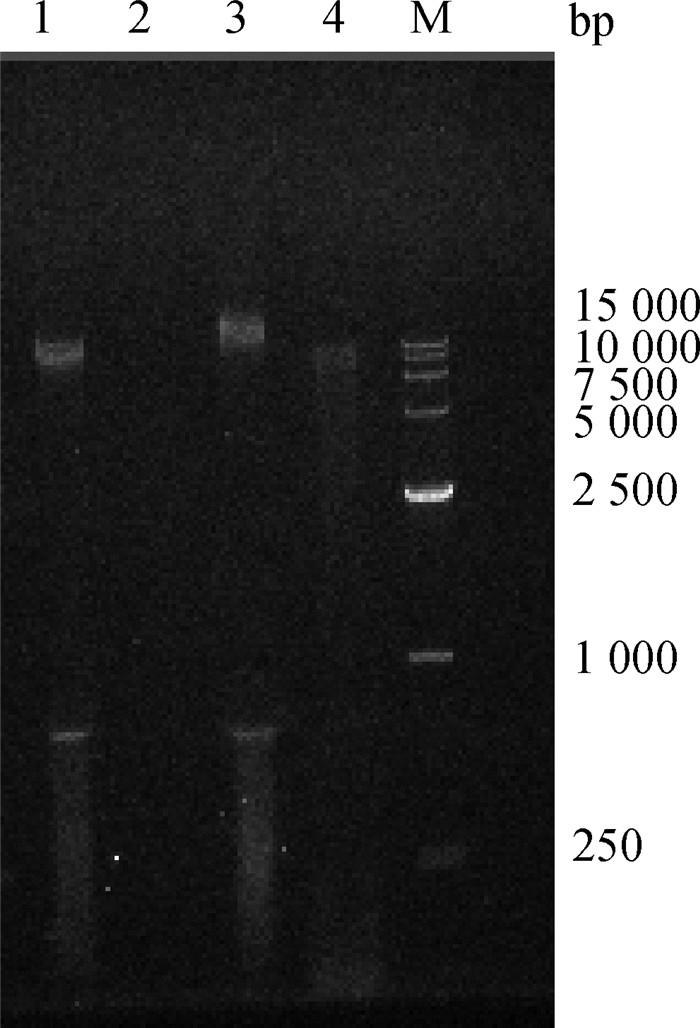
|
M.D15000相对分子质量标准;1.vB_EfaM_XJ3核酸;2.DNaseⅠ;3.RNase A;4. Mung Bean Nuclease M. D15000 DNA molecular weight marker; 1. Nucleic acid of vB_EfaM_XJ3; 2. DNaseⅠ enzyme; 3. RNase A enzyme; 4. Mung Bean Nuclease enzyme 图 3 噬菌体vB_EfaM_XJ3核酸类型 Figure 3 Nucleic acid type of phage vB_EfaM_XJ3 |
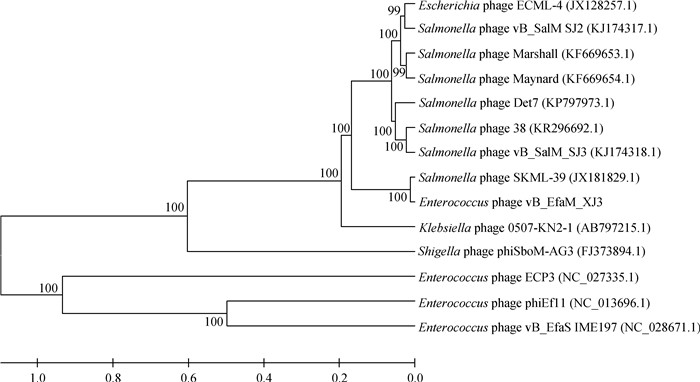
噬菌体vB_EfaM_XJ3的测序结果显示,其完整基因组由157 189个核苷酸组成,G+C含量为50.27%。与NCBI上已公布的亲缘噬菌体的全基因组进行比对,得知vB_EfaM_XJ3与沙门菌噬菌体SKML-39相似性高达98%。且在进化树中与沙门菌噬菌体SKML-39在同一支上,而与屎肠球菌噬菌体亲缘性较远 (图 4),说明vB_EfaM_XJ3在核苷酸序列方面确实与沙门菌噬菌体相似性较高,且是肌尾科噬菌体。
|
进化树利用MEGA 5.2软件中的Constract/Test UPGMA Tree法构建;分支上的数字是在1 000次重复后获得的置信值。比例尺对应于每0.2个核苷酸 The tree was constructed with the MEGA 5.2 program using Constract/Test UPGMA Tree. Numbers at the branches are bootstrap confidence values obtained after 1 000 replicates. The scale bar corresponds to 0.2 substitution per nucleotide position 图 4 噬菌体vB_EfaM_XJ3系统发育分析 Figure 4 Phylogenetic analysis of phage vB_EfaM_XJ3 |
通过裂解谱的测定得知此噬菌体目前只能裂解其宿主菌 (3号屎肠球菌),而对其余9株肠球菌、4株金黄色葡萄球菌、4株大肠杆菌和2株沙门菌均无裂解能力,见表 1。
|
|
表 1 噬菌体vB_EfaM_XJ3对多株临床分离菌株的灵敏度 Table 1 The sensitivity of phage vB_EfaM_XJ3 to many strains of clinical isolates |
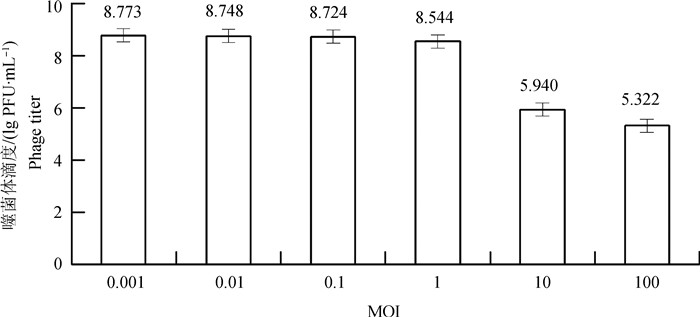
试验结果 (图 5) 表明vB_EfaM_XJ3的最佳MOI为0.001,此时产生的子代噬菌体数量最多。在后续的生物学特性中均以最佳MOI扩增以实现回收率最大。
|
图 5 噬菌体vB_EfaM_XJ3的最佳MOI测定 Figure 5 Determination of optimal multiplicity of infection for phage vB_EfaM_XJ3 |
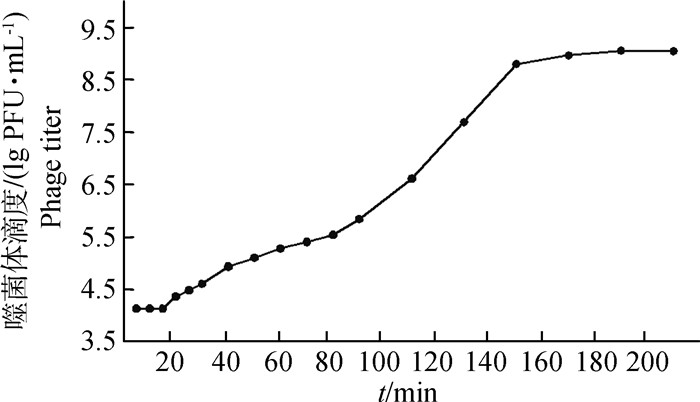
从结果 (图 6) 可以看出vB_EfaM_XJ3感染宿主15 min内,噬菌体的量基本没有增加,这段时间被称为噬菌体的潜伏期,感染后15~190 min噬菌体的量急剧增加,这段时间称为噬菌体的爆发期,之后噬菌体的数量基本保持平衡。本试验测得的vB_EfaM_XJ3感染宿主菌的潜伏期是15 min,爆发期是175 min,裂解量约为84,表明此噬菌体具有较强的裂解能力,可选为临床用噬菌体生物制剂的备选对象。
|
图 6 噬菌体vB_EfaM_XJ3的一步生长曲线 Figure 6 One-step growth curve of phage vB_EfaM_XJ3 |
vB_EfaM_XJ3对温度的耐受结果 (图 7) 表明,随着温度升高、处理时间延长,噬菌体的存活率逐渐降低。室温至50 ℃时,噬菌体基本可以保持其原活性;温度高于60 ℃时,滴度开始下降但不明显,60 ℃作用1.5 h时滴度下降三个数量级;70 ℃作用40 min噬菌体全部失活。
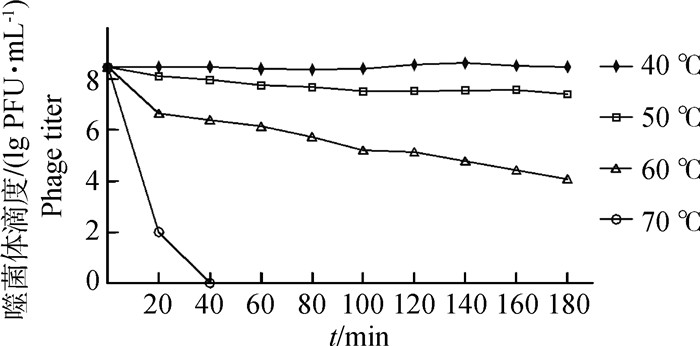
|
图 7 噬菌体vB_EfaM_XJ3的热稳定性测定 Figure 7 Determination of thermal stability of phage vB_EfaM_XJ3 |
从结果 (图 8) 可以看出噬菌体vB_EfaM_XJ3经不同的pH处理2 h后,pH为2.0时噬菌体失活,而pH在5.0至11.0之间时酸碱度对噬菌体的影响不大,且当pH为7.0时噬菌体活性最好。此结果表明该噬菌体具有很强的酸碱耐受性。
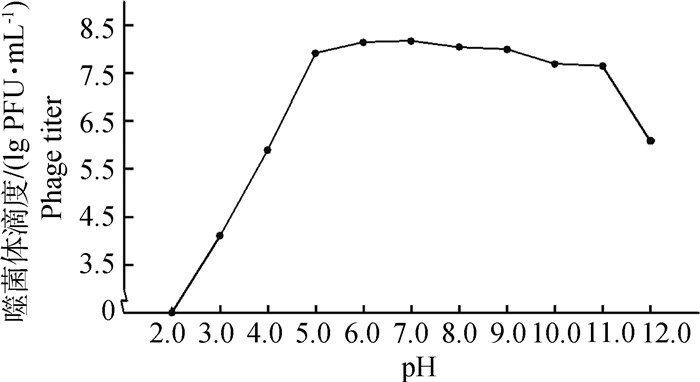
|
图 8 噬菌体vB_EfaM_XJ3的pH稳定性测定 Figure 8 Determination of pH stability of phage vB_EfaM_XJ3 |
在噬菌体的分离、纯化与计数中,噬菌斑试验和双层平板培养法被认为是既基本又经典的方法,本试验噬菌体的分离、纯化同样采用此方法。依据包红朵等[14]和E. Bueno等[15]对其分离出的噬菌体进行命名,本试验分离纯化的屎肠球菌噬菌体暂时命名为vB_EfaM_XJ3,其中vB表示viruses bacteriophage (病毒噬菌体);Efa表示Enterococcus faecium(屎肠球菌);M表示Myoviridae(肌尾噬菌体科)。《国际病毒分类委员会第8次报告》[16]与《国际病毒分类委员会第9次报告》[17]中均将噬菌体按核酸类型及单双链分为4个“群”,“群”是噬菌体分类的第一个级阶,而dsDNA病毒群最为常见,种类最多,本试验分离得到的噬菌体也不例外。
该噬菌体通过全基因组测序及序列比对和进化树分析得知其与肌尾噬菌体科的沙门菌噬菌体SKML-39十分相似,基因序列相似性高达98%,但通过裂解谱试验得知其目前不裂解沙门菌、金黄色葡萄球菌和大肠杆菌,只能裂解其宿主菌屎肠球菌,属特异性较强的噬菌体。其特性与H. Anany等[18]分离的志贺菌噬菌体ΦSboM-AG3特性相似。志贺菌噬菌体ΦSboM-AG3的功能蛋白与沙门菌噬菌体ViI相近,但其却是志贺菌噬菌体,只能裂解志贺菌而不能裂解沙门菌。对于此株噬菌体的功能蛋白分析以及其是否能裂解其他屎肠球菌或沙门菌需要在后期的试验中进行验证。目前此株屎肠球菌噬菌体只能裂解其宿主菌,在后续的试验中可以尝试通过其裂解酶的原核表达拓宽裂解范围。
本试验分离得到的噬菌体vB_EfaM_XJ3属于有尾噬菌体目肌尾噬菌体科的裂解性dsDNA噬菌体,基因组全长为157.189 kb,GC含量为50.27%,目前此噬菌体只能裂解其宿主菌屎肠球菌,能耐受50 ℃左右的高温且在pH 5.0~11.0时vB_EfaM_XJ3的活性基本没有明显的变化,繁殖迅速,对环境的适应能力强。与张文惠等[19]和邢少贞等[20]报道的裂解性粪肠球菌噬菌体相比,vB_EfaM_XJ3的潜伏期短、裂解期长,裂解量高。这株基因序列与沙门菌噬菌体极为相似的裂解性屎肠球菌噬菌体,为肠球菌性奶牛乳房炎的防治和治疗提供了一种新的解决途径,同时也为沙门菌和屎肠球菌抑菌剂的应用奠定了基础。
4 结论分离鉴定出一株裂解性肌尾科屎肠球菌噬菌体vB_EfaM_XJ3,可裂解其宿主菌;最佳感染复数0.001,潜伏期15 min,爆发期175 min,裂解量约84;能耐受50 ℃左右高温,在pH 5.0~11.0范围内效价稳定。
| [1] |
阚威. 奶牛乳房炎链球菌和肠球菌的分离鉴定及毒力基因的检测[D]. 兰州: 甘肃农业大学, 2014.
KAN W. Isolation, characerization and virulence gene analysis of Streptococcus and Enterococcus collected from bovine mastitis[D]. Lanzhou: Gansu Agricultural University, 2014. (in Chinese) |
| [2] |
董翔宸. 奶牛乳房炎肠球菌ESP基因真核重组质粒的构建与表达[D]. 兰州: 甘肃农业大学, 2015.
DONG X C. Construction and expression of eukaryotic vector of ESP gene from bovine Enterococcus[D]. Lanzhou: Gansu Agricultural University, 2015. (in Chinese) |
| [3] | KLIMIENĖ I, RUŽAUSKAS M, ŠPAKAUSKAS V, et al. Prevalence of gram positive bacteria in cow mastitis and their susceptibility to beta-lactam antibiotics[J]. Vet Med Zoot, 2011, 56(78): 65–72. |
| [4] |
齐亚银, 剡根强, 王静梅, 等. 致羔羊脑炎型粪肠球菌的分离及鉴定[J]. 石河子大学学报:自然科学版, 2005, 23(2) :200–202.
QI Y Y, YAN G Q, WANG J M, et al. Isolation and identification of Enterococcus faecalis in lambs with meningitis[J]. Journal of Shihezi University (Natural Science), 2005, 23(2): 200–202. (in Chinese) |
| [5] | WALL S K, ZHANG J, ROSTAGNO M H, et al. Phage therapy to reduce preprocessing Salmonella infections in market-weight swine[J]. Appl Environ Microbiol, 2010, 76(1): 48–53. DOI: 10.1128/AEM.00785-09 |
| [6] |
张哲. 两株裂解性粪肠球菌噬菌体的分离鉴定及生物学特性分析[D]. 长春: 吉林大学, 2015.
ZHANG Z. Isolation and biological characteristic of two lytic Enteroocus bacteriophages active against Enterococcus faecalis[D]. Changchun: Jilin University, 2015. (in Chinese) |
| [7] | BISWAS B, ADHYA S, WASHART P, et al. Bacteriophage therapy rescues mice bacteremic from a clinical isolate of vancomycin-resistant Enterococcus faecium[J]. Infect Immun, 2002, 70(1): 204–210. DOI: 10.1128/IAI.70.1.204-210.2002 |
| [8] |
宫鹏娟, 张蕾, 夏翡翡, 等. 屎肠球菌噬菌体m5的分离鉴定及其对小鼠菌血症的治疗研究[J]. 中国兽医学报, 2016, 36(5) :746–749.
GONG P J, ZHANG L, XIA F F, et al. Bacteriophage m5 therapy rescues mice bacteremic from a clinical isolate of vancomycin-resistant Enterococcus faecium[J]. Chinese Journal of Veterinary Science, 2016, 36(5): 746–749. (in Chinese) |
| [9] | JAMALLUDEEN N, JOHNSON R P, FRIENDSHIP R, et al. Isolation and characterization of nine bacteriophages that lyse O149 enterotoxigenic Escherichia coli[J]. Vet Microbiol, 2007, 124: 47–57. DOI: 10.1016/j.vetmic.2007.03.028 |
| [10] |
萨姆布鲁克J, 拉塞尔D W. 分子克隆实验指南[M]. 3版. 黄培堂, 译. 北京: 科学出版社, 2002.
SAMBROOK J, RUSSELL D W. Molecular cloning: A laboratory manual[M]. 3rd ed. HUANG P T, trans. Beijing: Science Press, 2002. (in Chinese) http://www.oalib.com/references/18480118 |
| [11] |
余静丹. 鲍曼不动杆菌噬菌体的分离鉴定及生物学特性的研究[D]. 长春: 吉林大学, 2013.
YU J D. Isolation, characterization and biological features of lytic bacteriophages infecting Acinetobacter baumannii clinical isolates[D]. Changchun: Jilin University, 2013. (in Chinese) |
| [12] | NASU H, ⅡDA T, SUGAHARA T, et al. A filamentous phage associated with recent pandemic Vibrio parahaemolyticus O3:K6 strains[J]. J Clin Microbiol, 2000, 38(6): 2156–2161. |
| [13] |
冯烨, 刘军, 孙洋, 等. 噬菌体最新分类与命名[J]. 中国兽医学报, 2013, 33(12) :1954–1958.
FENG Y, LIU J, SUN Y, et al. An introduction to current classification and nemenclature of bacterial viruses[J]. Chinese Journal of Veterinary Science, 2013, 33(12): 1954–1958. (in Chinese) |
| [14] |
包红朵, 张鹏禹, 周艳, 等. 沙门氏菌裂解性噬菌体的分离鉴定及其生物学特性[J]. 食品科学, 2015, 36(5) :131–136.
BAO H D, ZHANG P Y, ZHOU Y, et al. Isolation and biological characteristics of lytic Salmonella bacteriophage[J]. Food Science, 2015, 36(5): 131–136. DOI: 10.7506/spkx1002-6630-201505025 (in Chinese) |
| [15] | BUENO E, GARCÍA P, MARTÍNEZ B, et al. Phage inactivation of Staphylococcus aureus in fresh and hard-type cheeses[J]. Int J Food Microbiol, 2012, 158(1): 23–27. DOI: 10.1016/j.ijfoodmicro.2012.06.012 |
| [16] | FAUQUET C M, MAYO M A, MANILOFF J, et al. Virus taxonomy:Ⅷth report of the international committee on taxonomy of viruses[M]. Amsterdam: Elsevier Academic Press, 2005. |
| [17] | KING A M Q, ADAMS M J, CARSTENS E B, et al. Virus taxonomy:ninth report of the international committee on taxonomy of viruses[M]. Amsterdam: Elsevier Academic Press, 2011. |
| [18] | ANANY H, LINGOHR E J, VILLEGAS A, et al. A Shigella boydii bacteriophage which resembles Salmonella phage ViI[J]. Virol J, 2011, 8(1): 242. DOI: 10.1186/1743-422X-8-242 |
| [19] |
张文惠, 安小平, 范航, 等. 一株粪肠球菌噬菌体的分离及其生物学特性研究[J]. 生物技术通讯, 2013, 24(4) :484–487.
ZHANG W H, AN X P, FAN H, et al. Isolation and characterization of an Enterococcus faecalis phage[J]. Letters in Biotechnology, 2013, 24(4): 484–487. (in Chinese) |
| [20] |
邢少贞, 张湘莉兰, 舒鹏, 等. 粪肠球菌噬菌体vB_E. faecalis_IME196的生物学特性及其全基因组分析[J]. 微生物学通报, 2016, 43(9) :2040–2048.
XING S Z, ZHANGXIANG L L, SHU P, et al. Characterization and complete genome sequence analysis of Enterococcus faecalis bacteriophage vB_E. faecalis_IME196[J]. Microbiology China, 2016, 43(9): 2040–2048. (in Chinese) |



