2. 石河子大学生命科学学院, 石河子 832003
2. College of Life Sciences, Shihezi University, Shihezi 832003, China
microRNAs (miRNA) 为一类长21~23 nt的内源性非编码小RNAs[1-2],它不编码蛋白质,在生物体内广泛存在,没有明确的开放阅读框,能够在转录水平或翻译水平发挥生物学功能[3]。有研究表明,miRNA参与了卵巢的各种功能,包括卵子发生、卵泡发育与闭锁和黄体形成及退化等多个生物学过程,进而从转录后水平研究卵巢功能的分子调控机制[4]。miR-12-92和miR-290-295簇正调控原始生殖细胞发育,而miR-141、miR-200a、miR-200c和miR-323在原始生殖细胞分化过程中逐渐降低表达[5]。miR-290-295与原始生殖细胞迁移和存活有关[6]。miRNA可以通过直接或者间接的方式调控卵泡功能和激素分泌[7]。R.Di等[8]首次确定了滩羊非发情季节卵巢miRNA表达谱,共鉴定出了63个已知的,136个保守的和3个新预测的miRNAs,其中miR-n-142是非发情季节表达最丰富的miRNA,其靶基因主要富集在氧化磷酸化、甘油脂代谢和磷脂酰肌醇信号通路中。
哈萨克羊为中国3大粗毛绵羊品种之一,拥有较高的肉脂生产性能,是典型的季节性繁殖绵羊。而绵羊季节性发情排卵、季节产羔导致绵羊的利用率很低,造成整个绵羊养殖业的低效率,是绵羊高效养殖的主要瓶颈。人们普遍认为绵羊的季节性发情受光周期的调控,现已初步确定了其季节性发情调控机制,主要包括两大系统:即TSH/Dio系统和Kisspeptin/GPR54系统[9]。在绵羊实际生产中,影响绵羊季节性发情的因素很多,营养条件作为一个重要的影响因素,在绵羊季节性发情过程中同样也发挥了重要作用。Z.Kiyma等[10]研究发现,体况较差母羊通常会出现产后不排卵的情况,部分会增加产羔至再受孕时间跨度,可能是卵泡的生长和卵母细胞的成熟在这种情况下受到抑制的结果。马辽伟等[11]研究指出,在天然草场营养匮乏期,适度提高补饲料的能量水平,可以提高母羊的发情率和受胎率。相比之下,营养水平与绵羊季节性发情间的相互作用研究甚少,鉴于此,本研究将从构建不同营养水平的哈萨克羊群入手,利用Solexa测序技术来筛选乏情季节发情和乏情哈萨克羊卵巢组织中差异表达的miRNAs,并进行生物学分析。本研究将初步鉴定因营养水平变化诱导绵羊季节性发情改变中起重要作用的miRNAs,对进一步了解绵羊发情性状的分子调控机制具有重要的促进意义。
1 材料与方法 1.1 试验动物分组在非繁殖季节 (3~5月份),选择年龄相近 (3~4周岁),体重接近 (45~55 kg),健康的哈萨克成年母羊36只,饲养于石河子大学实验站,随机分成试验组与对照组,每组18只。对照组每天自主采食苜蓿干草 (主要成分:粗蛋白16.05%、粗灰分9.11%、粗脂肪2.73%、粗纤维58.3%、钙1.43%、磷0.15%,消化能16.11 MJ·kg-1)1.5 kg,而试验组在对照组饲喂的基础上添加精料 (主要成分:粗蛋白18.73%、粗灰分11.03%、粗脂肪2.52%、粗纤维13.23%、钙1.5%、磷0.4%,消化能11.72 MJ·kg-1)0.4 kg。据美国绵羊饲养标准 (NRC,1985) 中规定的营养需求量,对照组绵羊的营养摄入已经满足成年母羊的营养需求,达到绵羊的饲养标准;高营养试验组绵羊在此基础额外补饲精料0.4 kg·只-1,使得试验组绵羊的营养摄入量全部提高。试验羊群在产羔前一个月 (3月份) 开始饲喂,两组绵羊分圈饲养于同一羊场,饲养条件与免疫措施一致。
1.2 主要试剂酶联免疫测定 (ELISA) 试剂盒 (购自BLUE GENE),TRizol试剂 (TRizol Reagent, Invitrogen 15596-026);RT-PCR试剂盒 (Prime ScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time), TaKaRa code:DRR047A);miRcute miRNA cDNA第一链合成试剂盒 (天根生化科技 (北京) 有限公司,KR201);miRcute miRNA荧光定量检测试剂盒 (天根生化科技 (北京) 有限公司,FP401)。
1.3 试验方法 1.3.1 发情鉴定非繁殖季节绵羊的发情鉴定:采用公羊试请和外阴观察相结合的方法。选择成年种公羊,捆绑试情布,早晚各试情一次,并观察绵羊外阴部的变化。试情公羊接近母羊,母羊主动靠近接受公羊爬跨,而且外阴部红润肿胀,并伴随有黏液流出,鉴定为发情母羊。不发情绵羊则表现为躲避试情公羊,当强性牵引接近时,往往会出现抗拒行为。羔羊断奶1个月后 (5月份) 即开始试情。
1.3.2 样品采集绵羊在第一次发情时采样,共屠宰3只高营养试验组发情母羊和3只对照组未发情母羊 (5月份,平均年龄4周岁),分别采集卵巢组织,进行编号,放入液氮保存。
1.3.3 总RNA提取及鉴定待样品全部采集完,提取各样本总RNA。鉴定总RNA的纯度、含量及其完整性。随后,将样品通过干冰送深圳华大基因科技服务有限公司,使用生物分析仪Agilent 2100 Bioanalyzer进行检测,结果较好的样本进行混样并建库。
1.3.4 miRNA测序及初步分析分别对非繁殖季节发情和乏情母羊卵巢 (混样) 进行建库,总计2个库 (发情羊卵巢 (OEN)vs乏情羊卵巢 (OAN))。检测合格的样品总RNA,分离18~30 nt的Small RNA,分别在5′和3′加上特定的接头后,反转录为cDNA进行RT-PCR反应,然后利用HiSeq测序完成文库构建。HiSeq测序所得49 nt序列,通过过滤得到可信的目标序列,包括序列的种数 (Unique tags) 和序列的总数 (Total tags),对这些序列的质量、长度及样品间公共序列进行统计。
1.3.5 miRNA生物信息学分析通过SOAP或者bowtie软件,将过滤后得到的sRNA序列定位到绵羊基因组图谱上,分析这些sRNA的表达及在基因组上的分布,再通过GenBank数据库[ftp://ftp.ncbi.nlm.nih.gov/genbank/]和Rfam数据库 (http://rfam.janelia.org/) 筛选并去除重复rRNA、scRNA、snoRNA、snRNA和tRNA等相关序列。随后,筛选的序列在miRBase (version 21.0) [http://www.mirbase.org/ftp.shtml]进行比对,确定已知miRNAs,用mirdeep软件预测新的miRNAs。
1.3.6 miRNA的差异分析对两个对比样品中表达的已知和未知miRNA进行统计,判断在两样品之间的表达量是否存在显著性差异,通过log2-ratio和Scatter plot图比较两者miRNA表达量的差异。
1.3.7 实时荧光定量PCR (qRT-PCR) 验证在microRNA文库中,随机选取6个miRNA,以U6为内参基因,对乏情期发情和乏情母羊卵巢进行表达量验证。按照miRNA第一链合成试剂盒 (天根生物技术公司) 说明书,以1 μg总RNA为模板反转为cDNA,随后使用miRNA荧光定量检测试剂盒 (天根)。qRT-PCR反应体系:模板1.0 μL cDNA (按照1:4稀释使用),10 μL 2× miRcute miRNA Premix SYBR (TIANGEN),0.4 μL miRNA特异引物 (表 1),0.4 μL下游引物 (试剂盒自带),加8.2 μL ddH2O,使总体积为20 μL。反应条件:94 ℃ 2 min; 94 ℃ 20s,60 ℃ 34 s,总共40个循环。所有的反应设置3个重复。数据结果通过2-△△CT法进行相对定量的统计分析。
|
|
表 1 引物序列 (卵巢) Table 1 Primer sequence (ovary) |
对差异表达的已知miRNA进行靶基因预测,用targetscan和RNAhybrid软件进行预测,取交集或并集作为预测结果。KEGG通路分析针对的是靶基因预测结果 (以下简称“候选靶基因”),在生物体内,不同基因相互协调行使其生物学功能,通过Pathway分析,可进一步了解基因的生物学功能。KEGG是有关通路的主要公共数据库,通路显著性富集分析以KEGG中的通路为单位,应用超几何检验,找出与整个参考基因相比较在候选靶基因中显著性富集的通路。
2 结果 2.1 高营养试验组发情结果观察在非繁殖季节对试验绵羊的发情情况进行观察并记录,结果发现高营养试验组发情绵羊为8只,不发情绵羊为10只,发情率为44.4%,而对照组发情绵羊3只,不发情绵羊为15只,发情率为16.7%。比较可知,高营养试验组发情率比对照组提高了27.7%,说明提高营养水平后,绵羊的发情并非自然发情,而是由高水平营养诱导发情。
2.2 总RNA提取总RNA经过Agilent 2100 Bioanalyzer检测后,其结果如图 1所示,图 1A显示发情母羊总RNA浓度为175 ng·μL-1,完整性系数 (RIN, RNAintegrity Number) 为8.4,图 1B显示乏情母羊总RNA浓度为309 ng·μL-1,完整性系数为8.5,且两样品的28S/18S均为1.5,符合深圳华大基因科技服务有限公司建库标准 (浓度ng·μL-1, 总量RIN>8.0, 28S/18S≥1.5),说明样品RNA的纯度高,完整性良好,可以用于后续试验。

|
A.发情母羊卵巢;B.乏情母羊卵巢 A. Ovary of estrous ewes; B. Ovary of anestrous ewes 图 1 样品总RNA质量检测 Figure 1 The sample quality detection of total RNA |
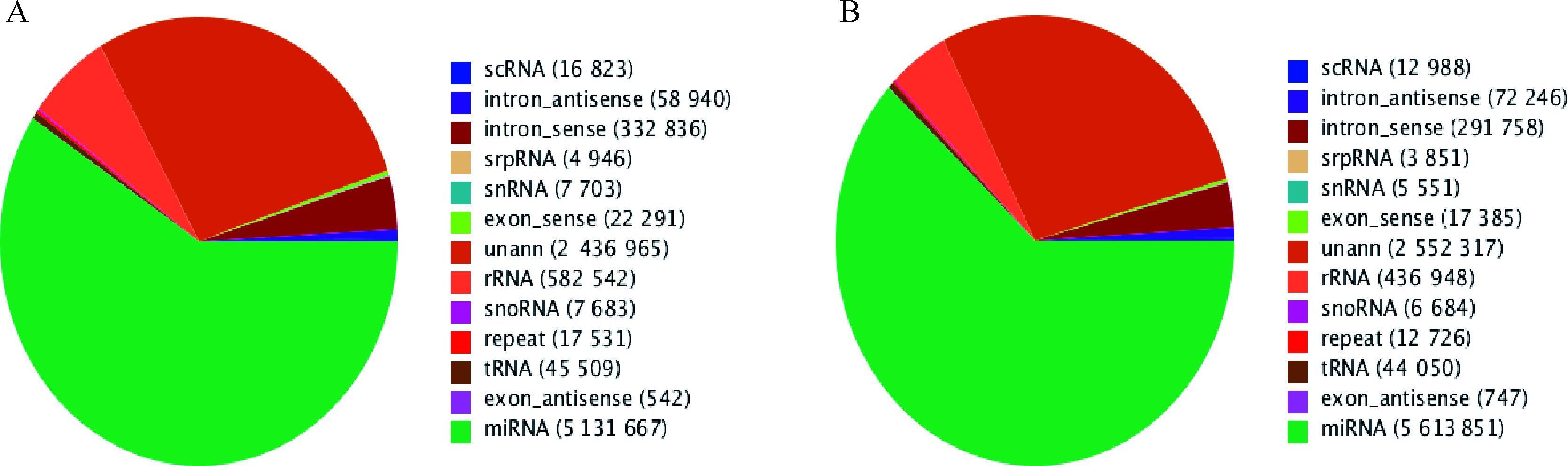
为了更好的理解乏情季节,不同营养水平诱导发情及乏情两个不同阶段母羊卵巢中小RNA的表达模式,本研究对以上两个不同时期的绵羊进行小RNA建库分析,建库的组分别为高营养水平诱导乏情季节发情母羊卵巢 (OEN) 和正常饲喂水平乏情季节乏情母羊卵巢 (OAN)。两文库分别获得8 665 978(OEN) 和9 071 102(OAN) chean reads,序列长度分析表明绝大多数长度为21~23 nt (图 2A, B)。进一步研究Solexa测序获得miRNA效率,通过和GenBank、Rfam database 11.0非编码小RNA、RNA重复序列、内含子和外显子及miRbase 21.0比对发现,大部分小RNA为microRNA (图 3A, B)。除了表达丰度最高的miRNA,测序获得的小RNA还有scRNAs、srpRNAs、snRNAs、rRNAs、snoRNAs、tRNA和其他sRNAs (图 3A, B)。

|
A.OEN; B.OAN 图 2 两文库中小RNA序列长度分布 Figure 2 Length distribution of tags produced by small RNA sequencing in the library |
|
A.OEN; B.OAN 图 3 两文库中小RNA的分类注释 Figure 3 Distribution of small RNA among differently expressed categories in the library |
OEN库中共鉴定出294个miRNA,其中有120个已知miRNA和174个未知miRNA;OAN库中共鉴定出307个miRNA,其中有121个已知miRNA和186个未知miRNA。OEN和OAN文库miRNA表达量进行比较发现,有9个已知和104个未知miRNA表达差异显著。这些miRNA有些是上调表达,有些是下调表达。在差异表达已知9个miRNA中,有3个为miR-200家族成员 (miR-200a/b/c),均在OEN对OAN中下调表达 (表 2)。在差异表达未知的104个miRNA中,OEN和OAN比较,有49个为上调表达,另外的为下调表达。其中表达量较高的新发现的差异miRNA有novel_miR_101,novel_miR_14,novel_miR_29等,通过和miRBase中其他物种的比对发现同源序列,通过染色体定位和发夹结构进行分析 (表 3和图 4所示)。
|
|
表 2 表达差异显著的已知miRNA Table 2 The significantly different expressed known miRNA |
|
|
表 3 新发现差异表达miRNA表达量较高序列染色体定位和同源序列 Table 3 Genome locations and homology ID of significantly different expressed novel miRNAs |

|
图 4 新发现差异表达miRNA表达量较高的发夹结构 Figure 4 The hairpin structure of significantly different expressed novel miRNAs |
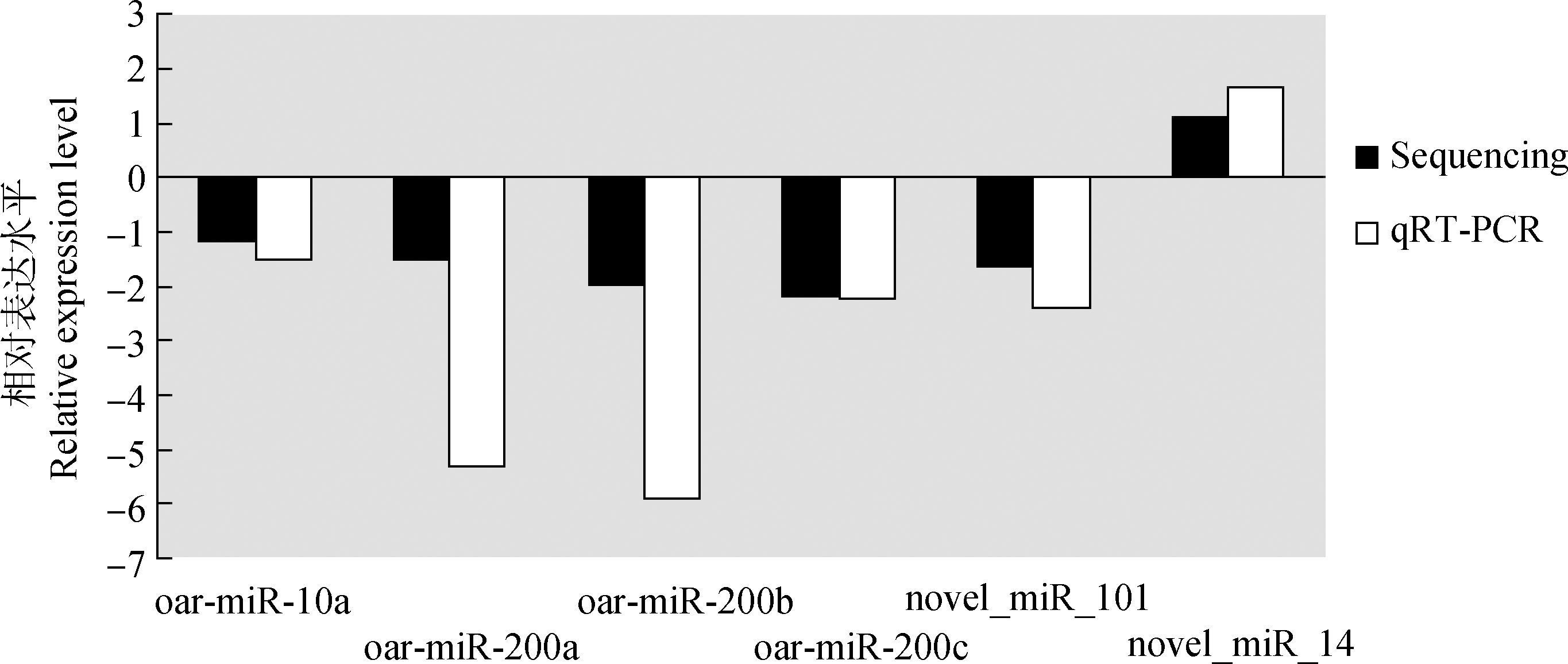
随机选择4个已知差异表达的miRNAs和2个未知差异表达的miRNAs,进行荧光定量PCR (qRT-PCR) 验证。定量PCR后采用2-△△CT进行计算,再以log2 (OEN/OAN) 得出相对表达情况,将计算所得的结果整理成柱状图 (图 5)。由图 5可知,随机选取的6个miRNAs表达量的差异趋势和高通量测序结果一致,由此证明高通量测序的可靠性。
|
图 5 Real-time qRT-PCR检测测序结果 Figure 5 Validation of the deep sequencing results by real time qRT-PCR |
本研究通过RNAhybrid和targetscan来预测靶基因。两软件重叠预测出已知miRNA的靶基因有298个,未知miRNA的靶基因18 481个。对其差异表达的miRNA靶基因进行KEGG通路分析,发现靶基因共富集178条调控通路中,而有7条KEGG通路得到显著富集 (P<0.05)(表 4),依次是PPAR信号通路,脂肪细胞因子信号通路,Ⅱ型糖尿病,甘氨酸、丝氨酸和苏氨酸代谢,萜类化合物生物合成,MAPK信号通路,甘氨酸、丝氨酸和苏氨酸代谢,其他多糖降解,氨基糖和核苷酸糖代谢通路,其中甘氨酸、丝氨酸和苏氨酸代谢为人们感兴趣的营养代谢通路。在代谢通路 (ko00564:甘油磷脂代谢中) 富集到4个靶基因,尽管这条通路没有得到显著富集,但是其中的基因也是一个重要的研究对象。
|
|
表 4 预测靶基因调控通路部分 Table 4 Pathways of predicted target genes (partical) |
营养与发情密切相关,各种营养物质或组分均对母畜的发情、配种、受胎、胚胎发育和存活等起着重要作用。有研究表明,添加复合营养补充剂可显著改善产奶性能、显著缩短产后首次发情时间及提高受胎率[12]。绵羊日粮营养水平的提高,可有效提升卵巢机能活动,长期限饲将推迟性成熟[13]。母牛长期能量不足不仅会推迟母牛初情期的到来,还会延长成年母牛产后乏情,进而延长母牛的平均产犊间隔,降低繁殖力[14]。综上表明,发现营养不良或营养水平低下,都会导致能量供给不足,使得母畜初情期推迟或者发情期间隔延长,进而从侧面证明了高营养水平能够促进绵羊的发情。景炜等[15]研究结果显示,提高多浪羊日粮能量水平,可显著提高其发情率。叶酸的摄入不足会改变发情周期,而补充ω-3脂肪酸能够使发情周期恢复到正常水平[16]。能量摄入量可很大程度影响后备母猪初情期的到来,高能量水平会促进后备母猪的初情期的到来,而低能量水平会推迟后备母猪初情期的到来[17]。这与本研究结果一致,高营养水平试验组绵羊的发情率要明显高于对照组,主要是因为绵羊机体在丰富的营养状态下,能量充足,促使卵巢功能活跃,有利于绵羊发情。本研究在乏情期,通过在哈萨克绵羊产羔前后补饲精料,使哈萨克羊在产羔后出现了发情绵羊,从而验证提高营养水平可以诱导绵羊乏情期发情。
3.2 卵巢OEN vs OAN差异表达miRNA功能分析动物卵巢在下丘脑-垂体-卵巢性腺轴的最末端,受下丘脑、垂体的调控,一方面表面有FSH和LH受体,和垂体分泌的FSH和LH激素结合,刺激卵巢内激素及相关信号通路的发生,垂体又受下丘脑GnRH激素的调控;另一方面,卵巢自身分泌多种激素,进行自分泌和旁分泌,周期性调控发情过程。MicroRNA是近年来的研究热点之一,研究人员发现miRNA在众多领域发挥着转录后水平的调控作用。X.P.An等[18]确定了单羔羊和双羔羊发情期卵巢miRNA表达谱,共鉴定出了771个miRNAs共表达,其中hsa-miR-4532_Lt1R-3, bta-miR-2892-p5_1ss8CG, and ggo-miR-4488-p3_1ss10CG是表达最丰富的miRNA,其靶基因LHβ,SAMD4B和GPR35参与卵巢类固醇合成和GnRH信号通路中,而这些靶基因已有研究报道在卵泡发育、细胞增殖、存活、控制排卵等过程中具有重要作用[19-21]。段新崇等[22]筛选出oar-miR-200a、oar-miR-200b、oar-miR-200c是小尾寒羊间情期和发情期显著差异表达的miRNAs,这与本研究结果一致。
营养对miRNA表达影响的研究主要集中在人和鼠上[23-24],关于营养水平对绵羊发情miRNA表达影响却很少报道。本研究通过对KEGG富集通路分析发现,甘氨酸、丝氨酸和苏氨酸代谢是显著富集的通路之一,有5个靶基因参与了该通路。而对通路中的靶基因进一步分析发现,其中的一个靶基因甘氨酸氮甲基转移酶 (Glycine N-methyltransferase,GNMT) 是叶酸代谢中一种重要的蛋白质[25],它作为调节SAM (S-腺苷甲硫氨酸) 和SAM:SAH (S-腺苷半胱氨酸) 比值的调节者,影响叶酸代谢的整体方向[26]。而叶酸对繁殖性能具有重要作用,高振华等[27]研究发现,增加母猪日粮中的叶酸含量,可以有效提高发情率和产羔率。推测靶基因GNMT通过调控叶酸代谢对发情起重要作用。
在甘油磷脂代谢通路预测到的4个基因中,通过代谢通路图可以找到预测靶基因人VID组磷脂酶A2(PLA2G4D) 是产物花生四烯酸的上游基因,该产物指向发情相关通路GnRH信号通路、卵巢类固醇生成和催产素信号通路。花生四烯酸指向的卵巢类固醇生成通路下游基因有ALOX5、CYP2J和PTGS2,均为17β雌二醇的上游基因,向下游调控卵泡发育,F.Luo等[28]也有相似的报道。故miRNA可能通过干扰PLA2G4D来调控卵泡发育,进而启动非季节性发情周期。对该通路ALOX5基因的研究发现,干扰该基因可以引起肥胖、瘦素水平的提高并损坏胰岛素的分泌功能[29]。孔路军等[30]对脂肪型和瘦肉型猪的研究中发现,肥胖基因及其产物瘦素和血清中的FSH和LH呈正相关,进而与繁殖性能关联。瘦素对繁殖功能调节机制研究的逐渐深入,发现瘦素可能发挥代谢信号的作用,将机体的营养情况传递到生殖内分泌系统,在机体合适的情况下激活下丘脑-垂体-性腺轴 (HPG),对母畜发情、受精卵着床、胚胎早期发育、妊娠维持、胎儿生长发育等繁殖活动发挥重要作用[31]。推测靶基因PLA2G4D可能通过卵巢类固醇合成通路作用于ALOX5影响雌二醇和瘦素的分泌进而调控发情过程。
4 结论本研究成功构建了在非繁殖季节由营养诱导舍饲绵羊发情和乏情卵巢组织miRNA文库,在两个时期共筛选出9个已知和104个未知的差异表达的miRNAs。结合靶基因预测和KEGG通路富集分析,推测差异表达的miRNAs通过叶酸代谢或卵巢类固醇合成通路,对非季节性发情过程起重要作用。
| [1] | BARTEL D P. microRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281–297. DOI: 10.1016/S0092-8674(04)00045-5 |
| [2] | ECKSTEIN F. Small non-coding RNAs as magic bullets[J]. Trends Biochem Sci, 2005, 30(8): 445–452. DOI: 10.1016/j.tibs.2005.06.008 |
| [3] | SHENG Y R, LI J B, ZOU C C, et al. Down regulation of miR-101-3p by hepatitis B virus promotes proliferation and migration of hepatocellular carcinoma cells by targeting Rab5a[J]. Arch Virol, 2014, 159(9): 2397–2410. DOI: 10.1007/s00705-014-2084-5 |
| [4] |
徐源, 孙铁成, 张爱玲, 等. 卵巢miRNA研究进展[J]. 畜牧兽医学报, 2014, 45(4) :509–516.
XU Y, SUN T C, ZHANG A L, et al. Progress on the research of ovarian miRNA[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(4): 509–516. (in Chinese) |
| [5] | HAYASHI K, DE SOUSA LOPES S M C, KANEDA M, et al. microRNA biogenesis is required for mouse primordial germ cell development and spermatogenesis[J]. PLoS One, 2008, 3(3): 1738. DOI: 10.1371/journal.pone.0001738 |
| [6] | MEDEIROS L A, DENNIS L M, GILL M E, et al. Mir-290-295 deficiency in mice results in partially penetrant embryonic lethality and germ cell defects[J]. Proc Natl Acad Sci USA, 2011, 108(34): 14163–14168. DOI: 10.1073/pnas.1111241108 |
| [7] | XU S, LINHER-MELVILLE K, YANG B B, et al. micro-RNA378(miR-378) regulates ovarian estradiol production by targeting aromatase[J]. Endocrinology, 2011, 152(10): 3941–3951. DOI: 10.1210/en.2011-1147 |
| [8] | DI R, HE J N, SONU S H, et al. Characterization and comparative profiling of ovarian microRNAs during ovine anestrus and the breeding season[J]. BMC Genomics, 2014, 15: 899. DOI: 10.1186/1471-2164-15-899 |
| [9] |
黄冬维, 储明星. 动物季节性繁殖分子调控机理研究进展[J]. 遗传, 2011, 33(7) :35–46.
HUANG D W, CHU M X. Research progress in molecular mechanism of animal seasonal reproduction[J]. Hereditas (Beijing), 2011, 33(7): 35–46. (in Chinese) |
| [10] | KIYMA Z, ALEXANDER B M, VAN KIRE E A, et al. Effects of feed restriction on reproductive and metabolic hormones in ewes[J]. J Anim Sci, 2004, 82(9): 2548–2557. DOI: 10.2527/2004.8292548x |
| [11] |
马辽伟, 侯生珍, 王志有, 等. 补饲不同能量水平的精料补充料对放牧藏母羊发情受胎的影响[J]. 江苏农业科学, 2015, 43(12) :242–244.
MA L W, HOU S Z, WANG Z Y, et al. Effects of supplementary concentrate supplemented with different energy levels on embryo conception of sheep[J]. Jiangsu Agricultural Sciences, 2015, 43(12): 242–244. (in Chinese) |
| [12] |
姚洪军, 赵春雨, 仲昭鑫, 等. 添加复合营养补充剂对奶牛发情及产奶性能的影响[J]. 中国兽医杂志, 2016, 52(10) :14–16.
YAO H J, ZHAO C Y, ZHONG Z X, et al. Effects of compound nutritional supplement on estrus and milk production of dairy cows[J]. Chinese Journal of Veterinary Medicine, 2016, 52(10): 14–16. DOI: 10.3969/j.issn.0529-6005.2016.10.005 (in Chinese) |
| [13] | VIÑOLES C, FORSBERG M, MARTIN G B, et al. Short-term nutritional supplementation of ewes in low body condition affects follicle development due to an increase in glucose and metabolic hormones[J]. Reproduction, 2005, 129(3): 299–309. DOI: 10.1530/rep.1.00536 |
| [14] | SHORT R E, ADAMS D C. Nutritional and hormonal interrelationships in beef cattle reproduction[J]. J Anim Sci, 1998, 68(1): 29–39. |
| [15] |
景炜, 蒲松. 日粮不同能量和蛋白水平对多浪羊繁殖性能及血液生化指标的影响[J]. 中国草食动物, 2010, 30(5) :21–25.
JING W, PU S. Effect of diets with different level energy and protein on reproductive performance and serum biochemical indexes in ewes[J]. China Herbivore, 2010, 30(5): 21–25. (in Chinese) |
| [16] | AKDHAVA A P, MEHER A A, JOSHI S R. Preconceptional omega-3 fatty acid supplementation on a micronutrient-deficient diet improves the reproductive cycle in Wistar rats[J]. Reprod Fertil Dev, 2013, 25(7): 1085–1094. DOI: 10.1071/RD12210 |
| [17] |
刘顺德, 时兴伟, 杨涛. 能量和蛋白质摄入量对母猪繁殖性能的影响[J]. 畜牧兽医杂志, 2001, 20(3) :25–29.
LIU S D, SHI X W, YANG T. Effect of Energy and Protein Intake on the Reproductive Performance of Sow[J]. Journal of Animal Science and Veterinary Medicine, 2001, 20(3): 25–29. (in Chinese) |
| [18] | AN X P, SONG Y X, HOU J X, et al. Identification and profiling of microRNAs in the ovaries of polytocous and monotocous goats during estrus[J]. Theriogenology, 2016, 85(4): 769–780. DOI: 10.1016/j.theriogenology.2015.09.056 |
| [19] | JOHNSON A E M, FREEMAN E W, COLGIN M, et al. Induction of ovarian activity and ovulation in an induced ovulator, the maned wolf (Chrysocyon brachyurus), using GnRH agonist and recombinant LH[J]. Theriogenology, 2014, 82(1): 71–79. DOI: 10.1016/j.theriogenology.2014.03.009 |
| [20] | GE L C, CHEN Z J, LIU H Y, et al. Involvement of activating ERK1/2 through G protein coupled receptor 30 and estrogen receptor α/β in low doses of bisphenol A promoting growth of Sertoli TM4 cells[J]. Toxicol Lett, 2014, 226(1-2): 81–89. |
| [21] | PANGAS S A. Bone morphogenetic protein signaling transcription factor (SMAD) function in granulosa cells[J]. Mol Cell Endocrinol, 2012, 356(1): 40–47. |
| [22] |
段新崇, 魏彦辉, 李阳, 等. 小尾寒羊间情期和发情期microRNAs差异表达分析[J]. 畜牧兽医学报, 2016, 47(7) :1324–1332.
DUAN X C, WEI Y H, LI Y, et al. Analyzing the differential expression of microRNAs in estrus and diestrus of Small Tailed Han sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7): 1324–1332. (in Chinese) |
| [23] | POGRIBNY I P, TYRNDYAK V P, ROSS S A, et al. Differential expression of microRNAs during hepatocarcinogenesis induced by methyl deficiency in rats[J]. Nutr Rev, 2008, 66(S1): S33–S35. |
| [24] | ZHANG J, ZHANG F, DIDEL O T, et al. Maternal high fat diet during pregnancy and lactation alters hepatic expression of insulin like growth factor-2 and key microRNAs in the adult offspring[J]. BMC Genomics, 2009, 10: 478. DOI: 10.1186/1471-2164-10-478 |
| [25] | BEAGLE B, YANG T L, HUNG J, et al. The glycine N-methyltransferase (GNMT) 1289 C->T variant influences plasma total homocysteine concentrations in young women after restricting folate intake[J]. J Nutr, 2005, 135(12): 2780–2785. |
| [26] |
安宇. 叶酸代谢网络酶基因遗传多态性与原发性肝癌的遗传易感性的研究[D]. 上海: 复旦大学, 2008.
AN Y.Association study on polymorphisms of one-carbon pathway with susceptibility of Hepatocellular carcinoma[D]. Shanghai:Fudan University, 2008. (in Chinese) |
| [27] |
高振华, 张军, 孟艳, 等. 叶酸水平对母猪繁殖性能的影响[J]. 饲料研究, 2010(12) :18–20.
GAO Z H, ZHANG J, MENG Y, et al. Effects of folic acid level on reproductive performance of sow[J]. Feed Research, 2010(12): 18–20. (in Chinese) |
| [28] | LUO F, JIA R, YING S, et al. Analysis of genes that influence sheep follicular development by different nutrition levels during the luteal phase using expression profiling[J]. Anim Genet, 2016, 47(3): 354–364. DOI: 10.1111/age.2016.47.issue-3 |
| [29] | MEHRABIAN M, SCHULTHESS F T, NEBOHACOVA M, et al. Identification of ALOX5 as a gene regulating adiposity and pancreatic function[J]. Diabetologia, 2008, 51(6): 978–988. DOI: 10.1007/s00125-008-1002-3 |
| [30] |
孔路军, 傅金恋, 刘宗慧, 等. 脂肪型和瘦肉型猪肥胖基因表达差异及其与繁殖性能的关系[J]. 中国畜牧杂志, 2005, 41(7) :9–12.
KONG L J, FU J L, LIU Z H, et al. Expression difference of obese gene between fat and lean type pig and correlation with reproduction performance[J]. Chinese Journal of Animal Science, 2005, 41(7): 9–12. (in Chinese) |
| [31] |
齐长学, 付世新, 张丽, 等. 瘦素 (leptin) 与雌性哺乳动物的繁殖活动关系的研究进展[J]. 中国奶牛, 2008(10) :38–40.
QI C X, FU S X, ZHANG L, et al. Research advance in the relationship between leptin and propagation of female mammalian[J]. China Dairy Cattle, 2008(10): 38–40. DOI: 10.3969/j.issn.1004-4264.2008.10.019 (in Chinese) |



