2. 四川农业大学 预防兽医研究所, 成都 611130;
3. 四川农业大学 动物疫病与人类健康四川省重点实验室, 成都 611130
2. Institute of Preventive Veterinary Medicine, Sichuan Agricultural University, Chengdu 611130, China;
3. Key Laboratory of Animal Disease and Human Health of Sichuan Province, Sichuan Agricultural University, Chengdu 611130, China
疫苗免疫是防控病毒性疾病的重要手段,人类以此控制并消灭了天花、牛瘟等传染病[1-3]。灭活疫苗和减毒活疫苗是目前应用最为广泛的两类传统疫苗[3-4]:灭活疫苗安全性高,但存在免疫保护期不够长、制备成本较高等不足;减毒活疫苗免疫效力及免疫保护期等常常优于灭活疫苗,但对于变异能力较强、危险性较高的病毒免疫常有其局限性[5-6]。基于此,有望克服灭活疫苗和减毒活疫苗不足的新型疫苗逐渐成为疫苗研究领域的热点之一。新型疫苗包括亚单位疫苗、合成肽疫苗、核酸疫苗、重组载体疫苗等[7-8]。其中,重组活病毒载体疫苗的研发关键在于利用基因修饰技术将其他病毒抗原性基因整合到载体病毒基因组,得到表达目的抗原的重组病毒粒子[9-10]。重组病毒能感染宿主细胞、表达所承载的外源基因并且递呈相应抗原,诱导机体产生体液免疫应答和细胞免疫应答[11]。自科学家们使用牛痘病毒(vaccinia virus, VACV或VV)作为载体递呈抗原研发重组活病毒疫苗[12],迄今已有许多病毒被研究证实具备作为疫苗载体的潜力[8],其中疱疹病毒因其感染性强、基因组庞大、基因操作技术成熟等特点而成为其中之一[13]。
鸭肠炎病毒(duck enteritis virus, DEV),又名鸭瘟病毒(duck plague virus, DPV),属于疱疹病毒科(Herpesvirales)、α疱疹病毒亚科(Alphaherpesvirinae)、马立克病毒属(Mardivirus)[14-15]。DEV基因组为双股线状DNA,全长约160 kb,由1个长独特区(unique long, UL)、1个短独特区(unique short, US)以及其两侧的重复序列(internal and terminal invertedrepeat sequences, IRS and TRS)组成:UL-IRS-US-TRS[15-16]。和其他疱疹病毒一样,DEV基因组存在大量复制非必需区域[17],可作为外源基因的插入位点[18],具备作为多联重组活疫苗载体的条件。本文对以鸭肠炎病毒作为载体的重组病毒活载体疫苗的研究进展进行总结,以期为DEV疫苗研发提供参考。
1 重组鸭肠炎病毒构建构建重组鸭肠炎病毒的核心技术手段是在DEV基因组插入外源基因并在宿主细胞内包装出具有感染性的重组病毒粒子。疱疹病毒基因组庞大而复杂,对其进行DNA修饰曾十分困难[19],但随着分子生物学及相关实验技术的快速发展,目前针对疱疹病毒基因组进行点突变、基因缺失、基因插入等技术手段已十分成熟[13, 20-21]。目前,各国研究人员已通过细胞内同源重组、Fosmid多片段拯救系统、细菌人工染色体(bacterial artificial chromosome, BAC)感染性克隆三种方法构建了多株重组鸭肠炎病毒(图 1)。
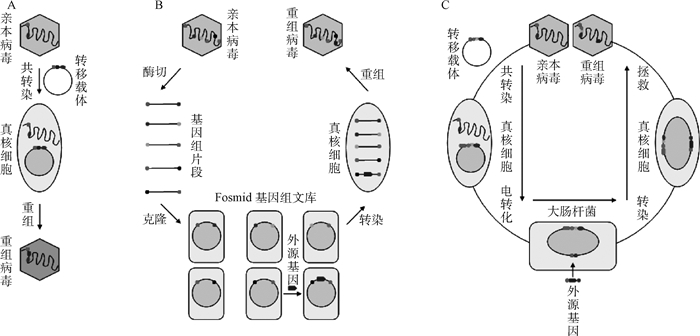
|
A.细胞内同源重组;B. Fosmid基因组文库病毒拯救系统;C.细菌人工染色体反向遗传系统 A. Recombination of transfer vector and DEV genome; B. Fosmid genome library virus rescue system; C. BAC reversed genetics system 图 1 重组鸭肠炎病毒的构建 Figure 1 Construction of recombinant DEVs |
真核细胞内含有能介导同源DNA之间发生重组的一系列重组酶,可通过构建包括插入位点两侧同源序列的转移载体在病毒基因组目的区域插入外源基因表达盒[22]。除了外源基因表达盒,转移载体一般还包含一个筛选标记,如绿色荧光蛋白(green fluorescent protein, GFP)基因[23]、大肠杆菌gpt基因[24]、lacZ基因[25]等,用于重组病毒筛选、纯化或区别于亲本株;筛选标记两侧分别含有与目的插入区域两侧同源的序列(1~2 kb),常称作左右同源臂,同源重组即在此同源区域发生,外源基因和筛选标记一起插入病毒基因组,获得能够感染细胞的重组病毒。X.M.Liu等[24]就以此方法将大肠杆菌gpt基因与鹅源H5N1型高致病性禽流感病毒(avian influenza virus, AIV)HA基因同时插入到DEV疫苗株(DEV C-KCE strain)基因组,重组成功的病毒能编码鸟嘌呤磷酸核糖转移酶,使之能在MPA/xanthine/hypoxanthine筛选培养液培养的细胞中增殖,多轮药物筛选后病毒能得以纯化。采用转移载体、基因组DNA共转染的方法,H.X.Li等[23]构建了不含报告基因、表达鸡传染性支气管炎病毒(infectious bronchitis virus, IBV)结构蛋白的重组鸭肠炎病毒。首先将DEV基因组与含EGFP基因的转移载体共转染鸡胚成纤维(CEF)细胞,得到插入EGFP、缺失US10基因的重组病毒rDEV-EGFP,并通过挑取带有荧光的空斑纯化、增殖病毒;再以rDEV-EGFP基因组和含有结构蛋白基因表达盒的转移载体共转染CEF细胞,通过挑取不带荧光的病毒空斑纯化、增殖病毒,成功获得了三株表达IBV不同结构蛋白的重组鸭肠炎病毒。Y. Sun等[26]用同样的方法构建缺失UL2、插入EGFP基因的重组病毒rDEV-△UL2-GFP,在EGFP报告基因的指示作用下插入了H9N2型AIV HA基因。此方法不需构建DEV病毒拯救系统,仅需构建转移载体转染至DEV感染的细胞或将之与DEV基因组共转染就可能实现重组病毒的构建。但转移载体的构建往往需要多步克隆,费时费力;另外,带有荧光标记的重组病毒也需要数轮挑斑纯化才能用于后续试验及免疫保护,如果混有野毒株反而对免疫动物存在威胁。
1.2 Fosmid多片段拯救系统Fosmid克隆载体可容纳数十kilobase(kb)的DNA片段,对于鸭肠炎病毒来说是较为理想的基因组文库克隆载体。DEV基因组DNA可通过酶切或物理作用随机打断分为数个末端相互重叠的25~50 kb的片段,并在各片段两端引入FseⅠ-SbfⅠ-PmeⅠ酶切位点,片段克隆入Fosmid载体后可在大肠杆菌(E.coli)中作为质粒复制、保存。外源基因可通过细菌体内常见的基因工程技术插入至任一包含DEV基因组片段的Fosmid质粒,提取覆盖病毒全基因组的各Fosmid质粒DNA,酶切线性化后共转染进宿主细胞,通过各片段之间同源序列在细胞内发生同源重组拯救出具有感染性的重组鸭肠炎病毒,观察细胞病变判断重组病毒是否拯救成功。J.X.Liu等、P.C.Chen等[27-29]利用Fosmid DEV拯救系统先后构建了三株表达禽流感病毒HA基因或鸭坦布苏病毒(duck Tembusu virus, DTMUV)E基因的重组鸭肠炎病毒。此系统所拯救出的重组病毒不会带有野毒株,不需挑斑纯化,可直接获得纯化的重组病毒。但此系统需要将DEV基因组分段克隆至数个Fosmid载体,重组病毒的拯救效率取决于覆盖基因组的几个片段末端同时发生同源重组的概率,因细胞内同源重组效率较低,无法通过条件诱导来进行控制,导致实验的可重复性较差。
1.3 细菌人工染色体感染性克隆自从首个疱疹病毒(鼠巨细胞病毒)细菌人工染色体成功构建以来,BAC技术就一直被认为是研究疱疹病毒的有力工具[13, 30]。BAC是基于大肠杆菌F因子所构建的低拷贝质粒载体,具有容量大、遗传稳定、遗传操作简单的特点[31]。DEV BAC的成功构建可允许其基因组克隆在大肠杆菌内以质粒的形式进行复制[32],利用成熟的Red同源重组技术可对基因组进行遗传操作[20, 33-35],并可通过转染BAC DNA至宿主细胞拯救出重组病毒[13, 32]。
构建DEV BAC是对其基因组进行遗传修饰、获得重组病毒的前提,通过多步克隆构建含有报告基因(如红、绿色荧光基因)和BAC mini-F序列(包含BAC功能元件)的转移载体,将其与环化DEV基因组DNA共转染宿主细胞[22, 36],报告基因与mini-F序列通过同源重组插入到DEV基因组复制非必需区域得到含有报告基因的重组病毒;挑取空斑纯化之后抽提重组病毒环化期基因组DNA并电转化至大肠杆菌,经药物抗性(如氯霉素抗性)筛选等获得成功转入DEV BAC的大肠杆菌。
在含有DEV BAC克隆的大肠杆菌中可对基因组进行外源基因的插入。与真核细胞不同,含有BAC克隆的大肠杆菌中同源重组的发生可通过λ噬菌体Red操纵子Exo、Beta、Gam蛋白介导[37-38],仅需30~50 bp同源臂就可完成同源重组[34]。目前已有数种E. coli同源重组方法在BAC系统中得到应用,其中应用最为广泛的是两步同源重组法,即Cre/loxP或FLP/FRT介导的同源重组[39-41],其基本原理是将两端带有loxP(或FRT)位点的抗性基因(如卡那霉素抗性基因)连同外源基因一起插入E. coli中BAC靶点,再诱导辅助质粒编码的Cre(或FLP)重组酶识别、剪切loxP(或FRT)位点之间的抗性基因。此方法的瑕疵在于会在插入靶点留下一个loxP(或FRT)位点[20],于是无痕同源重组法应运而生,B. K. Tischer等[33-34]利用I-SceⅠ归巢内切酶引发DNA内部双链断裂可刺激抗性基因两侧同源序列发生重组[42-43],以此无痕去除抗性基因。另外,M. Z. Li等[35]使用MAGIC (mating-assisted genetically integrated cloning)方法在细菌接合转移的基础上插入外源基因时也利用了I-SceⅠ归巢内切酶的定向切割刺激同源重组发生。重组病毒基因组中BAC mini-F序列的存在是制约其成为商品化疫苗的重要因素,一般来说构建DEV BAC时会预先在mini-F序列两侧引入loxP位点,以便在Cre重组酶作用下去除mini-F序列。除此之外,通过在mini-F序列一侧插入两段分别反向同源于其左右臂的序列也可促使重组病毒在细胞内去除mini-F序列[22, 44-46]。BAC系统在基因插入和病毒拯救等方面的高效使之成为了疱疹病毒基因修饰的首选工具,但其不足之处在于mini-F序列会影响重组病毒疫苗产业化,而去除mini-F序列也并不轻松。
2 外源基因的表达重组鸭肠炎病毒构建的目的主要是作为重组疫苗载体表达禽类其他传染病病原免疫原基因,达到一次接种预防多种疾病的目的。因此插入其中的外源基因均为其他病毒/细菌免疫原性较强的基因,其编码蛋白通常具有诱导机体产生较强免疫应答的功能。目前,禽流感病毒HA基因[24, 26-28, 47-49]、鸭坦布苏病毒E、PrM基因[29, 49]、鸭甲肝病毒(duck hepatitis A virus)VP1基因[50]以及鸡传染性支气管炎病毒N、S、S1基因[23]已经成功作为外源基因插入并得以表达(表 1)。
|
|
表 1 重组鸭肠炎病毒基本信息 Table 1 General information of recombinant DEVs |
外源基因均以表达盒的形式插入DEV基因组,启动子序列之后通常包含单个外源基因的开放阅读框(open reading frame, ORF)。不过P.C.Chen等[29]在鸭坦布苏病毒前体膜蛋白PrM、截段E基因之前添加tPA信号肽序列,将包含PrM、截段E基因的表达盒插入DEV基因组构建了重组鸭肠炎病毒rDEV-PrM/TE,实现了M蛋白和截段E蛋白的融合表达。另外,Z. Zou等[50]在DHAV-1和DHAV-3 VP1基因之间添加口蹄疫病毒2A序列作为两个VP1蛋白的切割短肽,构建了同时表达DHAV-1、DHAV-3 VP1蛋白的重组鸭肠炎病毒。
DEV基因组共有七十多个基因ORF,从病毒复制的角度来说分为复制必需基因和非必需基因[15-16],因此非必需基因的ORF和两个ORF之间的非编码区成为了理论上可供外源基因插入的位点。目前,已研究报道DEV基因组诸多区域可供外源基因插入、表达且不影响病毒复制。插入位点对外源基因表达的影响并未系统地进行过研究,J.X.Liu等[27]将AIV HA基因分别插入至DEV UL41基因ORF和US7、US8之间构建了两株重组病毒rDEV-ul41HA和rDEV-us78HA,前者HA基因的表达量明显高于后者;但是X.M.Liu等[24]插入在US7、US8 ORF和US2 ORF的HA基因表达水平就没有显著差异。
3 重组DEV作为疫苗的免疫效果目前用于动物攻毒保护试验所构建的重组鸭肠炎病毒均使用DEV弱毒疫苗株(VAC或C-KCE株)作为载体,搭载了为抵御AIV、DTMUV、DHAV和IBV而选择插入的免疫原性基因。免疫效果评价一般包含疫苗安全性、免疫原性评估和攻毒免疫保护效果。
3.1 表达禽流感病毒HA基因的重组鸭肠炎病毒疫苗AIV HA基因编码重要抗原蛋白血凝素,可刺激机体产生中和抗体[52]。J.X.Liu等[27]首次构建了两株表达HA基因的重组鸭肠炎病毒rDEV-ul41HA和rDEV-us78HA,HA基因的插入没有影响DEV在CEF细胞上刺激产生中和抗体的能力,但(HA基因)插入在UL41基因ORF内部的rDEV-ul41HA用于DEV攻毒保护试验时未能同亲本株一样对免疫鸭产生100%的保护;重组病毒疫苗在抗AIV攻毒保护试验中免疫鸭3 d起就产生了免疫保护且在免疫后1~10周达到了100%的保护效力。基于以上试验基础,此团队构建了于DEV US7、US8之间插入AIV GD/322株HA基因的重组鸭肠炎病毒rDEV-re6,用于商品肉鸡免疫效果评价。结果表明rDEV-re6不能在鸡体内高效复制,安全性较高,相比于灭活禽流感疫苗可更为快速地产生免疫保护力[28]。HA基因发生抗原漂移较为频繁,表达HA基因的重组病毒是否能针对不同亚型的AIV感染产生免疫保护也是值得考虑的。Z. Zou等[49]使用AIV XN/07 HA基因构建重组病毒C-KCE-HA,免疫SPF鸭针对同源毒株AIV XN/07和异源毒株HM/06攻毒均产生了100%的保护。
重组病毒中HA基因在细胞上的成功表达并不一定意味着其能在宿主动物体内产生有效的中和抗体。X.M.Liu等[24]研究发现将HA基因插入至DEV C-KCE株基因组替换US2和US7、US8基因ORF所构建的重组病毒降低了亲本疫苗株对DEV感染的抵抗力;虽然HA基因在CEF细胞上正常表达,但重组病毒rDEV-△gIgE-HA或rDEV-△US2-HA却无法在鸭体内刺激产生HI抗体。有研究报道称重组鸭肠炎病毒疫苗对不同宿主动物的免疫效果不同,J.C.Wang等[48]构建的DEV-H5(UL55)能在免疫鸡体内产生很高的HI抗体滴度,但在鸭体内抗体水平则极低。此重组病毒疫苗还引起了1周龄免疫鸡出现鸭瘟的临床症状,而3周龄免疫鸡不会出现类似情况,作者认为可能是因为经由鸡胚致弱的疫苗株DEV C-KCE在传代过程中对雏鸡产生了一定的致病性。
3.2 其他重组鸭肠炎病毒疫苗除禽流感病毒HA基因外,鸭坦布苏病毒、鸭甲肝病毒和鸡传染性支气管炎病毒编码结构蛋白的基因也都被成功地插入到DEV基因组以构建重组病毒。Z. Zou等研究发现[51]鸭坦布苏病毒主要表面抗原E蛋白能在重组鸭肠炎病毒免疫鸭中产生高滴度中和抗体。P.C.Chen等[29]同时构建了表达坦布苏病毒截段E蛋白和同时表达前体M蛋白、截段E蛋白的两株重组鸭肠炎病毒rDEV-TE和rDEV-PrM/TE,同样能刺激免疫鸭体内产生高滴度中和抗体, 并且发现二次免疫所产生的抗体滴度明显高于单次免疫,并且经rDEV-PrM/TE免疫两次的鸭能对鸭坦布苏病毒感染产生100%的抵抗力。
近年来,鸭甲肝病毒1型和3型混合感染给养鸭业造成巨大损失。Z. Zou等[50]构建了同时表达1型和3型DHAV VP1基因的重组DEV,能在免疫后两周在鸭体内产生较高滴度的中和抗体,且在免疫后3 d就能针对DHAV-1/3攻毒产生100%的保护力。
IBV感染很少造成鸡的死亡,但会导致蛋鸡产蛋率下降,危害鸡业发展。H.X.Li等[23]将表达IBV N、S蛋白及S蛋白N端S1亚单位蛋白的三株重组鸭肠炎病毒免疫鸡,使大多数鸡经IBV攻毒后不产生临床症状,并且发现当rDEV-N和rDEV-S1共同免疫时攻毒保护效果达到最佳。
3.3 重组DEV疫苗在家禽中的应用重组DEV疫苗免疫鸡、鸭均能产生相应的免疫保护,但其在鸡群和水禽中的应用却有不同之处。鸡不属于DEV天然宿主,重组DEV无法在鸡体内正常复制、增殖,但能表达、递呈外源抗原蛋白刺激机体产生免疫应答[23, 28]。这意味着DEV对鸡来说是较为安全的抗原递呈载体,可在此基础之上研制表达鸡类高危传染病原抗原基因的重组DEV疫苗。不容忽视的是,DEV在一定条件下也有感染鸡并使之发病的可能。J.C.Wang等[48]报道使用经鸡胚致弱的疫苗株C-KCE免疫一周龄SPF雏鸡出现了鸭瘟临床症状。
不同于鸡,DEV可在鸭体内正常复制,重组DEV可作为二联或多联疫苗同时预防鸭瘟和其他传染病。目前,重组载体疫苗研究中的DEV均使用疫苗株作为载体,在安全免疫的前提下外源蛋白质能随着DEV在鸭体内复制而充分表达,刺激机体产生长时效的免疫保护[27-28, 49-51]。除外源抗原性基因的表达,重组DEV在水禽上的应用还应考虑亲本DEV免疫原性是否受外源插入蛋白质影响及弱毒活疫苗毒力返强等问题。
4 展望重组活病毒疫苗利用安全的减毒活疫苗为载体递呈其他病原的免疫原性基因所编码的蛋白质,在安全免疫的前提下刺激宿主机体产生特异性免疫应答,以期达到一种疫苗预防多种疾病的目的。DEV庞大而复杂的基因组为外源基因提供了诸多可插入位点,在未来禽类新型疫苗研制中将发挥重要作用。但重组DEV疫苗的研究起步较晚,许多问题有待进一步研究和解决,比如插入位点对外源基因表达和抗原递呈的影响、外源基因对亲本鸭肠炎病毒免疫原性的影响、外源基因表达水平和引起免疫应答能力的关系、疫苗的安全性等。因此,对重组鸭肠炎病毒载体活疫苗进行优化,解决外源基因和载体序列对免疫应答的影响、有效地控制弱毒活疫苗的潜在散毒风险、实现科研成果产业化将是科学家们进一步研究的重点。
| [1] | NUNNALLY B K, TURULA V E, SITRIN R D. Vaccine analysis:strategies, principles, and control[M]. Berlin Heidelberg: Springer-Verlag, 2015: 1-80. |
| [2] | ADA G. Overview of vaccines and vaccination[J]. Mol Biotechnol, 2005, 29(3): 255–271. DOI: 10.1385/MB:29:3 |
| [3] | PLOTKIN S A. Vaccines:the fourth century[J]. Clin Vaccine Immunol, 2009, 16(12): 1709–1719. DOI: 10.1128/CVI.00290-09 |
| [4] | DE GROOT A S, EINCK L, MOISE L, et al. Making vaccines "on demand":a potential solution for emerging pathogens and biodefense?[J]. Hum Vaccines Immunother, 2013, 9(9): 1877–1884. DOI: 10.4161/hv.25611 |
| [5] | NGCOBO N J, CAMERON N A. The decision making process on new vaccines introduction in South Africa[J]. Vaccine, 2012, 30(3): C9–C13. |
| [6] | PULENDRAN B, AHMED R. Immunological mechanisms of vaccination[J]. Nat Immunol, 2011, 12(6): 509–517. |
| [7] | PETROVSKY N. Editorial (thematic issue:the coming of age of DNA vaccines)[J]. Curr Gene Ther, 2014, 14(3): 147–148. DOI: 10.2174/156652321403140819121725 |
| [8] | SOUZA A P D, HAUT L, REYES-SANDOVAL A, et al. Recombinant viruses as vaccines against viral diseases[J]. Braz J Med Biol Res, 2005, 38(4): 509–522. DOI: 10.1590/S0100-879X2005000400004 |
| [9] | PLOTKIN S A, PLOTKIN S L. The development of vaccines:how the past led to the future[J]. Nat Rev Microbiol, 2011, 9(12): 889–893. DOI: 10.1038/nrmicro2668 |
| [10] | DUAN Z Q, XU H Q, JI X Q, et al. Recombinant Newcastle disease virus-vectored vaccines against human and animal infectious diseases[J]. Future Microbiol, 2015, 10(8): 1307–1323. DOI: 10.2217/FMB.15.59 |
| [11] | EWER K J, LAMBE T, ROLLIER C S, et al. Viral vectors as vaccine platforms:from immunogenicity to impact[J]. Curr Opin Immunol, 2016, 41: 47–54. DOI: 10.1016/j.coi.2016.05.014 |
| [12] | PANICALI D, DAVIS S W, WEINBERG R L, et al. Construction of live vaccines by using genetically engineered poxviruses:biological activity of recombinant vaccinia virus expressing influenza virus hemagglutinin[J]. Proc Natl Acad Sci U S A, 1983, 80(17): 5364–5368. DOI: 10.1073/pnas.80.17.5364 |
| [13] | WARDEN C, TANG Q Y, ZHU H. Herpesvirus BACs:past, present, and future[J]. J Biomed Biotechnol, 2011, 2011: 124595. |
| [14] | KING A M Q, ADAMS M J, CARSTENS E B, et al. Virus taxonomy:ninth report of the international committee on taxonomy of viruses[M]. Oxford: Elsevier, 2012: 1221-1234. |
| [15] | LI Y F, HUANG B, MA X L, et al. Molecular characterization of the genome of duck enteritis virus[J]. Virology, 2009, 391(2): 151–161. DOI: 10.1016/j.virol.2009.06.018 |
| [16] | WU Y, CHENG A C, WANG M S, et al. Complete genomic sequence of Chinese virulent duck enteritis virus[J]. J Virol, 2012, 86(10): 5965. DOI: 10.1128/JVI.00529-12 |
| [17] | DHAMA K, KUMAR N, SAMINATHAN M, et al. Duck virus enteritis (duck plague)-a comprehensive update[J]. Vet Q, 2017, 37(1): 57–80. DOI: 10.1080/01652176.2017.1298885 |
| [18] | WU Y, LI Y G, WANG M S, et al. Preliminary study of the UL55 gene based on infectious Chinese virulent duck enteritis virus bacterial artificial chromosome clone[J]. Virol J, 2017, 14: 78. DOI: 10.1186/s12985-017-0748-y |
| [19] | WAGNER M, RUZSICS Z, KOSZINOWSKI U H. Herpesvirus genetics has come of age[J]. Trends Microbiol, 2002, 10(7): 318–324. DOI: 10.1016/S0966-842X(02)02394-6 |
| [20] | LAI C, FISCHER T, MUNROE E. Homologous recombination using bacterial artificial chromosomes[J]. Cold Spring Harb Protoc, 2015, 2015(2): 180–190. |
| [21] | YANG J J, SUN B B, HUANG H, et al. High-efficiency scarless genetic modification in Escherichia coli by using lambda red recombination and I-SceI cleavage[J]. Appl Environ Microbiol, 2014, 80(13): 3826–3834. DOI: 10.1128/AEM.00313-14 |
| [22] | TISCHER B K, KAUFER B B. Viral bacterial artificial chromosomes:generation, mutagenesis, and removal of mini-F sequences[J]. J Biomed Biotechnol, 2012, 2012: 472537. |
| [23] | LI H X, WANG Y L, HAN Z X, et al. Recombinant duck enteritis viruses expressing major structural proteins of the infectious bronchitis virus provide protection against infectious bronchitis in chickens[J]. Antiviral Res, 2016, 130: 19–26. DOI: 10.1016/j.antiviral.2016.03.003 |
| [24] | LIU X M, WEI S S, LIU Y, et al. Recombinant duck enteritis virus expressing the HA gene from goose H5 subtype avian influenza virus[J]. Vaccine, 2013, 31(50): 5953–5959. DOI: 10.1016/j.vaccine.2013.10.035 |
| [25] | PERELYGINA L, PATRUSHEVA I, VASIREDDI M, et al. B virus (Macacine herpesvirus 1) glycoprotein D is functional but dispensable for virus entry into macaque and human skin cells[J]. J Virol, 2015, 89(10): 5515–5524. DOI: 10.1128/JVI.03568-14 |
| [26] | SUN Y, YANG C H, LI J P, et al. Construction of a recombinant duck enteritis virus vaccine expressing hemagglutinin of H9N2 avian influenza virus and evaluation of its efficacy in ducks[J]. Arch Virol, 2017, 162(1): 171–179. DOI: 10.1007/s00705-016-3077-3 |
| [27] | LIU J X, CHEN P C, JIANG Y P, et al. A duck enteritis virus-vectored bivalent live vaccine provides fast and complete protection against H5N1 avian influenza virus infection in ducks[J]. J Virol, 2011, 85(21): 10989–10998. DOI: 10.1128/JVI.05420-11 |
| [28] | LIU J X, CHEN P C, JIANG Y P, et al. Recombinant duck enteritis virus works as a single-dose vaccine in broilers providing rapid protection against H5N1 influenza infection[J]. Antiviral Res, 2013, 97(3): 329–333. DOI: 10.1016/j.antiviral.2012.12.015 |
| [29] | CHEN P C, LIU J X, JIANG Y P, et al. The vaccine efficacy of recombinant duck enteritis virus expressing secreted E with or without PrM proteins of duck Tembusu virus[J]. Vaccine, 2014, 32(41): 5271–5277. DOI: 10.1016/j.vaccine.2014.07.082 |
| [30] | MESSERLE M, CRNKOVIC I, HAMMERSCHMIDT W, et al. Cloning and mutagenesis of a herpesvirus genome as an infectious bacterial artificial chromosome[J]. Proc Natl Acad Sci U S A, 1997, 94(26): 14759–14763. DOI: 10.1073/pnas.94.26.14759 |
| [31] | SHIZUYA H, BIRREN B, KIM U J, et al. Cloning and stable maintenance of 300-kilobase-pair fragments of human DNA in Escherichia coli using an F-factor-based vector[J]. Proc Natl Acad Sci U S A, 1992, 89(18): 8794–8797. DOI: 10.1073/pnas.89.18.8794 |
| [32] | CHEN L, YU B, HUA J G, et al. Construction of a full-length infectious bacterial artificial chromosome clone of duck enteritis virus vaccine strain[J]. Virol J, 2013, 10(1): 328. DOI: 10.1186/1743-422X-10-328 |
| [33] | TISCHER B K, VON EINEM J, KAUFER B, et al. Two-step red-mediated recombination for versatile high-efficiency markerless DNA manipulation in Escherichia coli[J]. Biotechniques, 2006, 40(2): 191–197. DOI: 10.2144/000112096 |
| [34] | TISCHER B K, SMITH G A, OSTERRIEDER N. En passant mutagenesis:a two step markerless red recombination system[M]//BRAMAN J. In Vitro Mutagenesis Protocols. 3rd ed. Totowa, NJ:Humana Press, 2010:421-430. http://www.springerlink.com/content/fulltext.pdf?id=doi:10.1007/978-1-60761-652-8_30 |
| [35] | LI M Z, ELLEDGE S J. MAGIC, an in vivo genetic method for the rapid construction of recombinant DNA molecules[J]. Nat Genet, 2005, 37(3): 311–319. DOI: 10.1038/ng1505 |
| [36] | TOBLER K, FRAEFEL C. Infectious delivery of alphaherpesvirus bacterial artificial chromosomes[M]//NARAYANAN K. Bacterial Artificial Chromosomes. New York, NY:Humana Press, 2015, 217-230. http://europepmc.org/abstract/MED/25239748 |
| [37] | COPELAND N G, JENKINS N A, COURT D L. Recombineering:a powerful new tool for mouse functional genomics[J]. Nat Rev Genet, 2001, 2(10): 769–779. |
| [38] | YU D G, ELLIS H M, LEE E C, et al. An efficient recombination system for chromosome engineering in Escherichia coli[J]. Proc Natl Acad Sci U S A, 2000, 97(11): 5978–5983. DOI: 10.1073/pnas.100127597 |
| [39] | DATSENKO K A, WANNER B L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proc Natl Acad Sci U S A, 2000, 97(12): 6640–6645. DOI: 10.1073/pnas.120163297 |
| [40] |
刘陆罡, 纪晓俊, 沈梦秋, 等. 大肠杆菌无痕重组的策略与应用[J]. 中国生物工程杂志, 2014, 34(8): 88–96.
LIU L G, JI X J, SHEN M Q, et al. Red-mediated scarless recombination:strategies and applications[J]. China Biotechnology, 2014, 34(8): 88–96. (in Chinese) |
| [41] | YOON Y G, CHO J H, KIM S C. Cre/loxP-mediated excision and amplification of large segments of the Escherichia coli genome[J]. Genet Anal:Biomol Eng, 1998, 14(3): 89–95. DOI: 10.1016/S1050-3862(97)10005-5 |
| [42] | OUEDRAOGO J P, ARENTSHORST M, NIKOLAEV I, et al. I-SceI-mediated double-strand DNA breaks stimulate efficient gene targeting in the industrial fungus Trichoderma reesei[J]. Appl Microbiol Biotechnol, 2015, 99(23): 10083–10095. DOI: 10.1007/s00253-015-6829-1 |
| [43] | ARAZOE T, YOUNOMARU T, OHSATO S, et al. Site-specific DNA double-strand break generated by I-SceI endonuclease enhances ectopic homologous recombination in Pyricularia oryzae[J]. FEMS Microbiol Lett, 2014, 352(2): 221–229. DOI: 10.1111/fml.2014.352.issue-2 |
| [44] | TISCHER B K, KAUFER B B, SOMMER M, et al. A self-excisable infectious bacterial artificial chromosome clone of varicella-zoster virus allows analysis of the essential tegument protein encoded by ORF9[J]. J Virol, 2007, 81(23): 13200–13208. DOI: 10.1128/JVI.01148-07 |
| [45] | WUSSOW F, FICKENSCHER H, TISCHER B K. Red-mediated transposition and final release of the mini-F vector of a cloned infectious herpesvirus genome[J]. PLoS One, 2009, 4(12): e8178. DOI: 10.1371/journal.pone.0008178 |
| [46] | ROTH S J, HÖPER D, BEER M, et al. Recovery of infectious virus from full-length cowpox virus (CPXV) DNA cloned as a bacterial artificial chromosome (BAC)[J]. Vet Res, 2011, 42: 3. DOI: 10.1186/1297-9716-42-3 |
| [47] | WANG J C, OSTERRIEDER N. Generation of an infectious clone of duck enteritis virus (DEV) and of a vectored DEV expressing hemagglutinin of H5N1 avian influenza virus[J]. Virus Res, 2011, 159(1): 23–31. DOI: 10.1016/j.virusres.2011.04.013 |
| [48] | WANG J C, GE A M, XU M W, et al. Construction of a recombinant duck enteritis virus (DEV) expressing hemagglutinin of H5N1 avian influenza virus based on an infectious clone of DEV vaccine strain and evaluation of its efficacy in ducks and chickens[J]. Virol J, 2015, 12: 126. DOI: 10.1186/s12985-015-0354-9 |
| [49] | ZOU Z, HU Y, LIU Z G, et al. Efficient strategy for constructing duck enteritis virus-based live attenuated vaccine against homologous and heterologous H5N1 avian influenza virus and duck enteritis virus infection[J]. Vet Res, 2015, 46: 42. DOI: 10.1186/s13567-015-0174-3 |
| [50] | ZOU Z, MA J, HUANG K, et al. Live attenuated vaccine based on duck enteritis virus against duck hepatitis a virus types 1 and 3[J]. Front Microbiol, 2016, 7: 1613. |
| [51] | ZOU Z, LIU Z G, JIN M L. Efficient strategy to generate a vectored duck enteritis virus delivering envelope of duck Tembusu virus[J]. Viruses, 2014, 6(6): 2428–2443. DOI: 10.3390/v6062428 |
| [52] | EL ZOWALATY M E, BUSTIN S A, HUSSEINY M I, et al. Avian influenza:virology, diagnosis and surveillance[J]. Future Microbiol, 2013, 8(9): 1209–1227. DOI: 10.2217/fmb.13.81 |



