2. 福建省农业科学院生物技术研究所, 福州 350013;
3. 福建省畜禽疫病防治工程技术研究中心, 福州 350013;
4. 安徽省广德县畜牧兽医水产局, 广德 242200
2. Biotechnology Institute of Fujian Academy of Agricultural Sciences, Fuzhou 350013, China;
3. Fujian Animal Diseases Control Technology Development Center, Fuzhou 350013, China;
4. Animal Husbandry and Fisheries Bureau of Guangde County, Anhui Province, Guangde 242200, China
番鸭呼肠孤病毒病病原为呼肠孤病毒科正呼肠孤病毒属番鸭呼肠孤病毒(muscovy duck reovirus,MDRV)[1],自1997年以来在中国福建、广东、广西、浙江等省番鸭养殖地区相继流行,临床上以软脚、肝脾出现大量灰白色针尖状坏死点为特征,多发于10~30日龄番鸭。发病率为30%~90%,病死率为60%~80%,且日龄越小死亡率越高,病鸭耐过后成为僵鸭。该病1950年首次报道于南非[2],1972年法国首次从发病番鸭中分离到MDRV[3]。
番鸭养殖产业对于福建、广东和浙江等省有着重要经济意义,但目前番鸭呼肠孤病毒病的存在,严重阻碍了番鸭养殖业的正常发展。国内研究学者主要在病原学、诊断学和疫苗学等方面研究较为深入,在该病致病机制和免疫机制方面也有一些报道,但仍未有较为全面的认识。目前关于该病的差异蛋白质组学研究尚未见报道,本研究运用双向电泳技术、质谱分析技术和生物信息学技术研究感染MDRV的发病番鸭与健康番鸭的差异表达蛋白质,将为揭示病毒与宿主细胞的相互作用、病毒致病的分子机制以及为寻找病毒作用宿主细胞的靶标等研究提供有意义的信息。
1 材料与方法 1.1 病毒株及试验动物44只健康雏番鸭购自福建省某健康种鸭场;MDRV-MW9710 C11代株由福建省农业科学院畜牧兽医研究所动物病毒研究室分离、鉴定并保存。
1.2 主要试剂和设备IPG胶条、IPG buffer、尿素、硫脲、碘乙酰胺、CHAPS、DTT、DeStreak试剂、2D clean-up试剂盒、蛋白质定量试剂盒2-D Quant kit均购自GE Healthcare公司;Tris、SDS、甘氨酸、丙烯酰胺、过硫酸铵、TEMED购自Genview公司;考马斯亮蓝G-250购自SIGMA公司;其他试剂均为国产分析纯。
Ettan IPGphor Ⅲ等电聚焦系统、Ettan IPGphor Manifold胶条槽、Ettan DALTsix大型垂直电泳系统、MultiTemp(tm) Ⅲ恒温循环水浴、ImageScanner Ⅲ扫描仪等均为GE Healthcare公司产品。双向电泳凝胶图像分析软件PDQuest 8.0购自Bio-Rad公司。
1.3 番鸭肝的采集及样品制备44羽4日龄健康番鸭随机分成2组,每组22只。人工感染组每羽腿肌接种0.2 mL MDRV-MW9710株,健康对照组接种相同剂量的Hank’s液,同条件隔离饲养。无菌采集感染后第5天的番鸭肝,用-70 ℃预冷的研钵将肝样品磨成粉末。加入10 mL含总蛋白酶抑制剂的裂解液溶解,然后进行超声波处理,裂解5次,每次持续2 s,间隔10 s,室温下放置30 min,于15 ℃ 40 000 g离心1 h,取上清。按2-D-clean up kit试剂盒方法纯化蛋白质,用2-D Quant kit蛋白质定量试剂盒测定蛋白质浓度,分装至Eppendorf管中,-70 ℃冰箱保存。空白对照组雏番鸭肝总蛋白质的制备同感染组。
1.4 双向电泳及图谱分析按照参考文献[4]方法进行。
1.5 差异表达蛋白质胶点的鉴定与分析根据双向图谱分析结果,挑选差异表达蛋白质胶点送深圳华大科技基因服务有限公司进行MALDI-TOF-TOF质谱分析,差异表达蛋白质胶点包括了仅存在于某组2-DE电泳图谱中的蛋白质点,以及表达水平差异超过3倍的蛋白质点。使用蛋白质搜索鉴定软件Mascot 2.3.02,结合NCBI和GO数据库对差异表达蛋白质点进行亚细胞定位和功能分类。
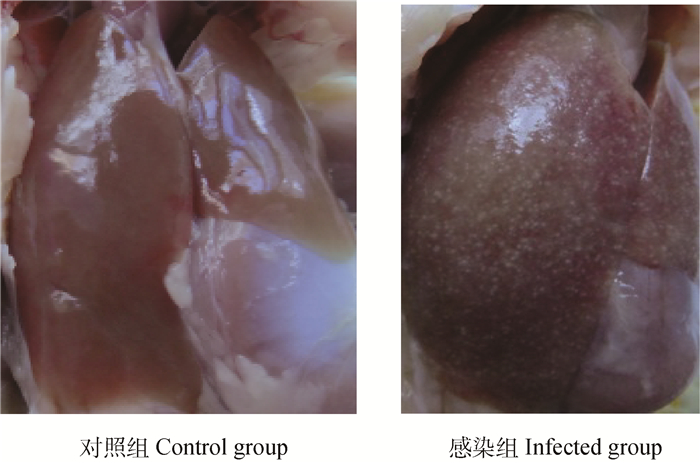
2 结果 2.1 番鸭肝病变及样品制备健康雏番鸭接种MDRV后5 d的肝出现MDRV的典型病变,在肝表面和切面分布大量灰白色坏死点(图 1)。取典型病变肝制备的样品总蛋白质质量浓度均在5~10 mg·mL-1之间,且每个样品蛋白质质量浓度均互相接近,符合双向电泳样品要求。
|
图 1 攻毒后第5天对照组和MDRV感染组番鸭肝 Figure 1 Liver lesions of muscovy duckings of the control and the treatment at the 5th day after challenge |
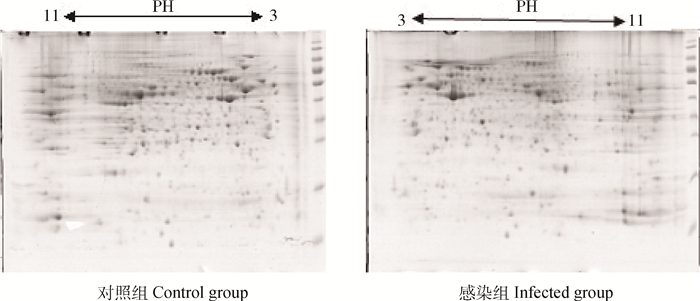
将上述制备的感染组和对照组番鸭肝蛋白质样品进行了三次重复双向电泳,经考马斯亮蓝G-250染色后发现3次重复电泳图谱基本一致(图 2),绝大部分点在凝胶上的相对位置不变,仅个别点由于个体差异处于稍偏位置,试验重复性较高。在双向电泳图谱中,可见大部分蛋白质点位于25~100 ku,蛋白质相对分子质量小于10 ku的蛋白质几乎没有。
|
图 2 对照组和MDRV感染组番鸭肝蛋白质的代表性双向电泳图谱 Figure 2 Proteomic patterns of the livers by two-dimensional gel electrophoresis |
挑选49个差异蛋白质胶点进行质谱分析,结果共鉴定出38个差异表达蛋白质,其中4个仅在感染MDRV番鸭肝表达(表 1),7个仅在健康对照番鸭肝表达(表 1);27个为二者共表达蛋白质点,其中10个表达蛋白质点MDRV感染后下调(表 1)、17个表达蛋白质点MDRV感染后上调(表 1)。
|
|
表 1 38个差异表达蛋白信息 Table 1 Differentially expressed protein spots by LC-MS/MS |
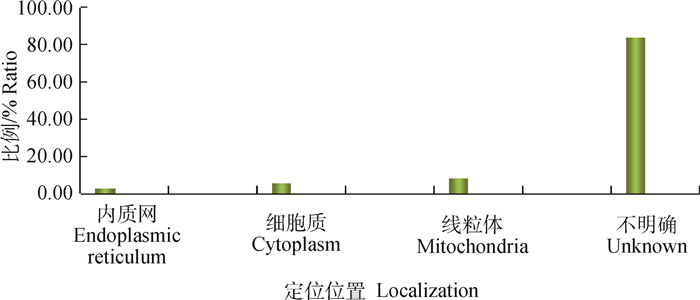
通过检索NCBI和GO数据库,对38个蛋白质进行亚细胞定位,可分为4类。位于内质网的蛋白质占2.70%,细胞质占5.41%,线粒体占8.11%,定位未明确的蛋白质占83.78%(图 3)。根据Panther Classification System功能分析的结果,这38个蛋白质可以归类为结合功能(42.9%)、催化活性(28.6%)、转录调节活性(14.3%)、结构分子活性(7.1%)和转运体活性(7.1%)(图 4)。
|
图 3 38个差异蛋白的亚细胞定位 Figure 3 Sub-cellular localization of the 38 identified-proteins |

|
图 4 38个差异蛋白的分子功能分析 Figure 4 Molecular-function distribution of the 38 identified-proteins |
本研究运用双向电泳技术、质谱分析技术和生物信息学技术研究感染MDRV的发病番鸭与健康番鸭的38个差异表达蛋白质,将为揭示病毒与宿主细胞的相互作用、病毒致病的分子机制以及为寻找病毒作用宿主细胞的靶标等研究提供有意义的信息。
通过检索NCBI和GO数据库,38个差异蛋白质分为4类亚细胞。蛋白质占比分别如下:位于内质网为2.70%,细胞质为5.41%,线粒体为8.11%,定位未明确的蛋白质为83.78%。由于鸭的蛋白质组数据库信息不全,大多数蛋白质都是预测为某种蛋白质,所以这些蛋白质难以进行亚细胞定位。根据Panther Classification System分析的结果,这38个蛋白质可以归类为结合功能(42.9%)、催化活性(28.6%)、转录调节活性(14.3%)、结构分子活性(7.1%)和转运体活性(7.1%),推测肝中具有结合功能和具有催化活性的蛋白质容易受到番鸭呼肠孤病毒感染的影响,肝的代谢和抗氧化活性变化可能是MDRV人工感染发病番鸭肝特点之一。
3.2 重组激活基因与自身免疫重组激活基因(RAGs)表达与机体自身免疫密切相关。有研究表明,B1细胞及NZB小鼠的B细胞中有高水平的RAGs mRNA和Ig基因重排现象[5]。此外,病毒超抗原诱导RAGs表达引起的TCRα链位点断裂和第二次Ig基因重排,说明RAG酶对免疫耐受的诱导产生过程有重要意义[6]。RAG1蛋白仅在感染MDRV的番鸭肝中表达产生,提示感染番鸭的体内产生了自身反应性抗体。
3.3 细胞活动异常CIT(丝氨酸/苏氨酸激酶21) 属于AGC丝氨酸/苏氨酸蛋白激酶家族,与驱动蛋白KIF14一起参与细胞分裂[7]。CIT表达减弱时,会引起细胞分裂受阻,数量下降,动物生长发育减缓甚至停滞。α-烯醇化酶(α-enolase)的表达减弱会影响横纹肌的发育和再生功能;热休克蛋白70 kDa蛋白9(heat shock 70 kDa protein 9) 控制着细胞增殖和细胞老化[8],在对强直性肌营养不良症2型的蛋白质组进行分析时也发现影响因子GRP75[9]。
感染MDRV番鸭肝中类氯离子通道蛋白2(chloride intracellular channel protein 2-like)表达增强。氯离子通道蛋白2除具有氯离子通道活性外,还具有调节钙离子通道RYR2活性和抑制钙离子内流作用,参与细胞电位、细胞的增殖与分化及凋亡等多种生理过程。有研究证实,氯离子通道蛋白在多种肿瘤细胞中表达异常,可能与肿瘤细胞增殖、侵袭转移有关[10-11]。
肌动蛋白是微丝的结构蛋白,参与构成具有收缩功能的组织,对于细胞活动有着重要意义。有研究发现,β-肌动蛋白在多种疾病中表达异常[12-13]。但是MDRV组番鸭的β-肌动蛋白表达增强意义有待研究。
MDRV感染后下调表达的类CDK5调节亚基相关蛋白2(CDK5 regulatory subunit-associated protein 2-like)和仅在健康对照组表达的Pericentrin蛋白提示发病番鸭机体内出现细胞凋亡异常的现象。细胞骨架由微管、微丝和中间丝三种结构组成。细胞骨架在保持细胞形态结构和细胞运动方面发挥着重要作用。CDK5调节亚基相关蛋白2会促进细胞骨架构成成分之一的微管的聚合,Pericentrin蛋白是中心粒周围区域的保守性蛋白,与微管的形成有关。这些蛋白质异常表达会诱导细胞骨架的紊乱,进而导致细胞凋亡的产生。细胞凋亡的蛋白质异常表达在蛋白质水平上解释了过去研究者观察到的病理现象和临床症状。陈少莺等[14]电镜下观察人工感染MDRV发病雏番鸭的心、肝、脾、胸腺、法氏囊等组织器官的超微结构,发现各实质器官出现不同程度的细胞变性、水肿以及坏死。免疫器官中的部分淋巴细胞、浆细胞坏死和不同程度凋亡, 淋巴细胞数量明显减少。虽然本试验以肝为试验材料,但是可以推测感染MDRV番鸭脾等免疫器官中可能也出现了与细胞骨架构成有关的蛋白质异常表达,引起细胞凋亡,进而导致免疫抑制。
仅在感染MDRV组表达的3-磷酸甘油醛脱氢酶也证实机体发生了细胞凋亡。3-磷酸甘油醛脱氢酶被认为主要在细胞质中参加糖酵解,但3-磷酸甘油醛脱氢酶也在细胞核内发挥促进细胞凋亡作用。有研究表明,E3泛素连接酶Siam介导3-磷酸甘油醛脱氢酶入核,随后通过p300/CREB乙酰化而激活p53,从而诱导细胞凋亡[15]。
3.4 神经系统受损CIT不但与细胞分裂有关,而且对中枢神经系统的发育也有重要作用,CIT表达减弱提示发病番鸭神经系统发育受阻。磷酸丙糖异构酶缺乏症会导致神经功能障碍[16],陈少莺等发现MDRV人工感染后多数病鸭脑壳膜出血,血管扩张充血,血管外间隙扩大,脑实质结构疏松,神经胶质细胞增生[17]。本研究的MDRV感染组磷酸丙糖异构酶缺乏也说明感染鸭的神经系统受到损伤。
3.5 与肿瘤相关蛋白质本研究在感染MDRV组鉴定的蛋白质组中还发现与肿瘤相关的蛋白质。MDRV组中表达下调的蛋白质有抑制素(prohibitin)、膜联蛋白A2(annexin A2) 等。虽然抑制素具体的作用机制不明确,但能抑制DNA的合成,可能是一种肿瘤抑制基因产物。膜联蛋白A2与抑制素可以形成复合物,并且两者之间具有高度亲和力[18]。膜联蛋白A2与DNA合成有关,在肿瘤的发生、浸润和转移中起作用。有研究表明,膜联蛋白A2的表达减弱可能提示前列腺癌病情恶化[19]。但也有研究表明,膜联蛋白A2的表达受到细胞周期的调控[20]。所以MDRV组中膜联蛋白A2的表达减弱很难判断其是否促进病情的恶化。
3.6 修复机制与此同时,番鸭体内也在进行着修复机制。表达增强的Utrophin蛋白是与抗肌萎缩蛋白(dystrophin)结构和功能上均相似的蛋白质,Utrophin蛋白可以替代抗肌萎缩蛋白恢复杜氏肌营养不良症(Duchenne muscular dystrophy, DMD)肌肉的病理变化[21]。在人类医学上,Utrophin被认为是DMD的一个潜在的治疗剂[22]。预测的Peroxiredoxin 1 variant 2属于过氧化氢酶家族,作用机制还未完全解释清楚,但目前知道它具有清除多余的过氧化氢等功能。正常情况下,生物体内的过氧化氢和抗过氧化氢的氧化代谢处于平衡状态;病理情况下,过氧化氢产生过多或机体抗氧化能力下降就会破坏平衡状态,进而引起细胞凋亡等结果。MDRV组中的Putative peroxiredoxin 1 variant 2蛋白表达增强,是否提示机体在积极消除过氧化氢,达到保护细胞的作用。血红蛋白和鸭卵转铁蛋白的增多同样提高了肝的抗氧化能力。
表达增强的L-乳酸脱氢酶是一种糖酵解酶,具有氧化还原活性。其水平升高,提示肝细胞受损,肝代谢异常。在研究中发现MDRV组的番鸭肝坏死点,也与L-乳酸脱氢酶水平变化相吻合。
4 结论应用蛋白质组学技术(二维双向凝胶电泳技术、MALDI-TOF-TOF质谱仪分析和Mascot 2.3.02鉴定技术)研究人工感染番鸭呼肠孤病毒(MDRV)的番鸭肝和健康对照番鸭肝的蛋白质组差异,共鉴定出38个差异表达蛋白质,其中感染组番鸭肝中有10个表达下调的蛋白质和17个表达上调的蛋白质,7个表达蛋白质仅出现在健康对照组,4个表达蛋白质仅出现在感染组。38个蛋白质可以归类为结合功能(42.9%)、催化活性(28.6%)、转录调节活性(14.3%)、结构分子活性(7.1%)和转运体活性(7.1%)。
| [1] |
胡奇林, 陈少莺, 林锋强, 等. 番鸭呼肠孤病毒的鉴定[J]. 病毒学报, 2004, 20(3): 242–248.
HU Q L, CHEN S Y, LIN F Q, et al. The identification of muscovy duck reovirus[J]. Chinese Journal of Virology, 2004, 20(3): 242–248. (in Chinese) |
| [2] | KASCHULA V R. A new virus disease of the Muscovy-duck [Cairina moschata (Linn.)] present in Natal[J]. J South Afr Vet Assoc, 1950, 21(1): 18–26. |
| [3] | GAUDRY D, CHARLES J M, TEKTOFF J. A new disease expressing itself by a viral pericarditis in Barbary ducks[J]. C R Acad Sci Hebd Seances Acad Sci D, 1972, 274(21): 2916–2919. |
| [4] |
黄梅清, 朱果真, 陈仕龙, 等. 感染新型鸭呼肠孤病毒的番鸭肝脏蛋白质组双向电泳方法的建立[J]. 中国农学通报, 2013, 29(26): 19–24.
HUANG M Q, ZHU G Z, CHEN S L, et al. Establishment of two-dimensional electrophoresis for proteme of liver from muscovy duck experimentally infected with norvel duck reovirus[J]. Chinese Agricultural Science Bulletin, 2013, 29(26): 19–24. DOI: 10.11924/j.issn.1000-6850.2013-1350 (in Chinese) |
| [5] | VERKOCZY L K, BERINSTEIN N L. Isolation of genes negatively or positively co-expressed with human recombination activating gene 1 (RAG1) by differential display PCR (DD RT-PCR)[J]. Nucleic Acids Res, 1998, 26(19): 4497–4507. DOI: 10.1093/nar/26.19.4497 |
| [6] | HUANG C Y, GOLUB R, WU G E, et al. Superantigen-induced TCR α locus secondary rearrangement: role in tolerance induction[J]. J Immunol, 2002, 168(7): 3259–3265. DOI: 10.4049/jimmunol.168.7.3259 |
| [7] | GRUNEBERG U, NEEF R, LI X L, et al. KIF14 and citron kinase act together to promote efficient cytokinesis[J]. J Cell Biol, 2006, 172(3): 363–372. DOI: 10.1083/jcb.200511061 |
| [8] | ORNATSKY O I, CONNOR M K, HOOD D A. Expression of stress proteins and mitochondrial chaperonins in chronically stimulated skeletal muscle[J]. Biochem J, 1995, 311(1): 119–123. DOI: 10.1042/bj3110119 |
| [9] | RUSCONI F, MANCINELLI E, COLOMBO G, et al. Proteome profile in Myotonic Dystrophy type 2 myotubes reveals dysfunction in protein processing and mitochondrial pathways[J]. Neurobiol Dis, 2010, 38(2): 273–280. DOI: 10.1016/j.nbd.2010.01.017 |
| [10] | SONTHEIMER H. An unexpected role for ion channels in brain tumor metastasis[J]. Exp Biol Med, 2008, 233(7): 779–791. DOI: 10.3181/0711-MR-308 |
| [11] | KUNZELMANN K. Ion channels and cancer[J]. J Membr Biol, 2005, 205(3): 159–173. DOI: 10.1007/s00232-005-0781-4 |
| [12] | GLARE E M, DIVJAK M, BAILEY M J, et al. β-actin and GAPDH housekeeping gene expression in asthmatic airways is variable and not suitable for normalising mRNA levels[J]. Thorax, 2002, 57(9): 765–770. DOI: 10.1136/thorax.57.9.765 |
| [13] | HE J Q, SANDFORD A J, WANG I M, et al. Selection of housekeeping genes for real-time PCR in atopic human bronchial epithelial cells[J]. Eur Respir J, 2008, 32(3): 755–762. DOI: 10.1183/09031936.00129107 |
| [14] |
陈少莺, 胡奇林, 程晓霞, 等. 番鸭呼肠孤病毒病雏番鸭实质器官的超微结构[J]. 中国兽医学报, 2006, 26(6): 662–664.
CHEN S Y, HU Q L, CHENG X X, et al. Ultrastructure observation of muscovy ducks infected with muscovy duck reovirus[J]. Chinese Journal of Veterinary Science, 2006, 26(6): 662–664. (in Chinese) |
| [15] | SEN N, HARA M R, KORNBERG M D, et al. Nitric oxide-induced nuclear GAPDH activates p300/CBP and mediates apoptosis[J]. Nat Cell Biol, 2008, 10(7): 866–873. DOI: 10.1038/ncb1747 |
| [16] | DAAR I O, ARTYMIUK P J, PHILLIPS D C, et al. Human triose-phosphate isomerase deficiency: a single amino acid substitution results in a thermolabile enzyme[J]. Proc Natl Acad Sci U S A, 1986, 83(20): 7903–7907. DOI: 10.1073/pnas.83.20.7903 |
| [17] |
陈少莺, 胡奇林, 江斌, 等. 番鸭肝白点病病理学研究[J]. 福建农业学报, 2002, 17(4): 220–222.
CHEN S Y, HU Q L, JIANG B, et al. Pathology of Muscovy duck liver white-spots disease[J]. Fujian Journal of Agricultural Sciences, 2002, 17(4): 220–222. (in Chinese) |
| [18] | BACHER S, ACHATZ G, SCHMITZ M L, et al. Prohibitin and prohibitone are contained in high-molecular weight complexes and interact with α-actinin and annexin A2[J]. Biochimie, 2002, 84(12): 1205–1218. DOI: 10.1016/S0300-9084(02)00027-5 |
| [19] | LIU J W, SHEN J J, TANZILLO-SWARTS A, et al. Annexin Ⅱ expression is reduced or lost in prostate cancer cells and its re-expression inhibits prostate cancer cell migration[J]. Oncogene, 2003, 22(10): 1475–1485. DOI: 10.1038/sj.onc.1206196 |
| [20] | CHIANG Y, SCHNEIDERMAN M H, VISHWANATHA J K. Annexin Ⅱ expression is regulated during mammalian cell cycle[J]. Cancer Res, 1993, 53(24): 6017–6021. |
| [21] | PEARCE M, BLAKE D J, TINSLEY J M, et al. The utrophin and dystrophin genes share similarities in genomic structure[J]. Hum Mol Genet, 1993, 2(11): 1765–1772. DOI: 10.1093/hmg/2.11.1765 |
| [22] | BLAKE D J, TINSLEY J M, DAVIES K E. Utrophin: a structural and functional comparison to dystrophin[J]. Brain Pathol, 1996, 6(1): 37–47. DOI: 10.1111/bpa.1996.6.issue-1 |



