2. 省部共建国家重点实验室培育基地-江苏省食品质量安全重点实验室, 南京 210014
2. Key Lab of Food Quality and Safety of Jiangsu Province—State Key Laboratory Breeding Base, Nanjing 210014, China
猪鼻支原体(Mycoplasma hyorhinis,Mhr)临床感染率较高,主要诱导感染猪发生多发性浆膜炎、肺炎、关节炎、中耳炎等疾病,导致生产性能下降,饲料报酬率降低,对养猪业造成一定程度的经济损失[1-6]。目前猪鼻支原体的诊断方法主要有分离培养、PCR、免疫组化及原位杂交等方法[7-11],以上方法主要针对抗原进行检测,相比而言,血清学诊断是临床的主要检测手段,目前没有商品化的猪鼻支原体血清抗体检测试剂盒,仅有一些血清抗体检测的报道,如全菌蛋白检测方法、吐温20膜蛋白检测方法,但这些方法与其他猪源性支原体之间存在着较高的交叉反应[12-13],不利于临床猪鼻支原体的准确诊断。
Mhr可变脂蛋白(variable lipoprotein,Vlp)家族是Mhr表面的重要抗原,目前发现该家族蛋白共有7个成员[14-15]。本研究通过将Vlp家族7个成员的Ⅲ区短肽进行混合后作为特异性检测抗原,初步建立Mhr血清IgG抗体的间接ELISA方法,通过检验该方法的交叉性、重现性检验及临床样品的检测来评价该方法的实用性,为该病的血清学诊断方法的研发提供了一定的依据。
1 材料与方法 1.1 试验材料 1.1.1 血清Mhr阴性血清采用未免疫猪支原体疫苗、通用支原体16S套式PCR及猪鼻支原体全菌蛋白ELISA检测确认无支原体感染的1到2月龄阴性猪血清30份。Mhr阳性血清采用灭活Mhr抗原接种无菌接生0日龄断奶猪制备的高免血清(全菌蛋白ELISA检测滴度大于1:6 400)。猪肺炎支原体(Mycoplasma hyopneumoniae,Mhp)阳性血清、猪滑液支原体(Mycoplasma hyosynoviae,Mhs)阳性血清、絮状支原体(Mycoplasma flocculare,Mf)阳性血清、猪瘟(classical swine fever virus,CSFV)阳性血清、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)阳性血清、猪圆环病毒2型(porcine circovirus type 2,PCV2) 阳性血清、猪伪狂犬病毒(porcine pseudorabies virus,PRV)阳性血清均由本实验室保存。临床血清(247份)来源于江苏地区的4个规模猪场,包括仔猪、保育猪、育肥猪及后备猪/公猪/母猪血清。
1.1.2 主要试剂BSA均为进口分装;HRP-羊抗猪IgG(BETHYL);TMB显色液(碧云天);Mhp血清抗体试剂盒(IDEXX)。
1.1.3 主要仪器ELX800酶标仪(购自美国博腾仪器有限公司)。
1.1.4 试验动物1月龄大小三元猪,试验前通过16S套式PCR及猪鼻支原体全菌蛋白ELISA检测确认无支原体感染
1.2 试验方法 1.2.1 包被抗原的制备7种Vlp成员的Ⅲ区重复短肽通过化学合成,短肽合成结果:VlpA, NH2-CKTENTQQSEAPGTKTENTQQSEAPGT-COOH; VlpB, NH2-CGTGSDSQDSGAKGTGSDSQDSGAK-COOH; VlpC, NH2-CEAAPKSPESGSQEATPKSPESGSQ-COOH; VlpD, NH2-CSDSTSTSKEQGSSDSTSTSKEQGS-COOH; VlpE, NH2-CDPKESNPSNPTTSDGQHSNPSNPTTS-COOH; VlpF, NH2-CGSTPTPEQGNNQGGSTPTPEQG NNQG-COOH; VlpG, NH2-CGSTTESSGQADSG STTESSGQADS-COOH。
将合成好的肽段与KLH偶联,构建KLH-Vlp蛋白,最后将7种KLH-Vlp蛋白按照等摩尔比混合为包被抗原。
1.2.2 间接ELISA方法的初步建立 1.2.2.1封闭液的选择:3%BSA、5%BSA、2.5%脱脂乳、5%脱脂乳、1%酪蛋白、1%明胶溶液(PBS稀释),分别按200 μL·孔-1加入抗原包被板以及不含抗原的酶标板中,37 ℃封闭2 h;以封闭液作为稀释液,将猪鼻支原体阴阳性血清分别做1:100稀释,酶标二抗1:10 000稀释,进行ELISA方法检测,以检测的阳性OD450 nm与阴性OD450 nm的比值(P/N)为封闭液选择的标准。
1.2.2.2抗原包被浓度及血清稀释度的选择:采用棋盘滴定法,用0.05 mol·L-1碳酸盐缓冲液(pH9.6) 倍比稀释抗原(0.078~10 μg·mL-1) 100 μL·孔-1横向包被酶标板,4 ℃过夜;阳性血清及阴性血清分别从1:50进行倍比稀释(1:50~1:800),100 μL·孔-1纵向加入已封闭的抗原包被板中,其余试验步骤均按ELISA方法进行,试验结果以阳性OD450 nm设为1.0左右,阴性OD450 nm设为0.15左右的范围选择P/N值最大为最佳稀释条件。
1.2.2.3一抗孵育时间选择:将血清加入抗原包被板后,分别37 ℃孵育0.5、1、2 h,其余试验步骤均按ELISA方法进行,试验结果选择P/N值最大为最佳孵育时间。
1.2.2.4酶标二抗最佳工作浓度及时间:完成一抗孵育后,将酶标抗体分别稀释至1:20 000、1:40 000、1:60 000,100 μL·孔-1,分别37 ℃孵育0.5、1 h,其余试验步骤均按ELISA方法进行,试验结果选择P/N值最大为最佳条件。
1.2.2.5显色时间确定:二抗孵育结束后,加入TMB显色液100 μL·孔-1,放置于37 ℃孵育5、10、15、20 min后终止读数,试验结果选择P/N值最大为最佳显色时间。
1.2.3 阴阳性判定值的确定在选定间接ELISA的最佳条件后,使用该方法对30份阴性血清进行检测,根据检测样品的OD450 nm平均值和标准差设定该间接ELISA方法的判定值:x+3s;待检样品的OD450 nm值若大于判定值,则该样品为阳性,反之,则判为阴性。
1.2.4 交叉反应试验用建立的间接ELISA方法分别检测CSFV、PRRSV、PRV、PCV2等猪常见病原阳性血清以及Mhp、Mf、Mhs猪源支原体阳性血清,同时设立猪鼻支原体阳性血清及阴性血清对照,观察该间接ELISA方法与其他病原血清的交叉性。
1.2.5 重现性试验 1.2.5.1批内重现性试验:采用同一批次的ELISA包被板对10份临床血清,每个血清重复三孔,计算其检测值的变异系数(CV),分析该方法的批内重现性。
1.2.5.2批间重现性试验:用三个不同批次包被的ELISA板对10份临床血清进行检测,计算其检测值的变异系数(CV),分析该方法的批间重现性。
1.2.6 敏感性和特异性试验选取猪鼻支原体阳性血清样本25份用于评价本方法的特异性。由于尚无特异性的检测方法或试剂盒,本试验从临床阳性感染场中选择猪鼻支原体全菌蛋白ELISA及猪鼻支原体套式PCR检测均为阳性,3月龄以上的猪血清为阳性样本。选取未免疫猪支原体疫苗、通用支原体16S套式PCR及猪鼻支原体全菌蛋白ELISA检测确认无支原体感染的1到2月龄阴性猪血清25份用于评价本方法的敏感性。
1.2.7 吐温20膜蛋白间接ELISA根据参考文献中的试验方法[16],用吐温20提取猪鼻支原体的膜蛋白作为包被抗原。0.05 mol·L-1碳酸盐缓冲液将抗原浓度调整为10 μg·mL-1,4 ℃包被过夜;封闭液为5% BSA,封闭完成后将猪鼻支原体阴阳性血清及待检血清1:100稀释后100 μL·孔-1,37 ℃孵育30 min;二抗为羊抗猪IgG-HRP,1:10 000稀释100 μL·孔-1,37 ℃孵育30 min。该方法的判定标准参照“1.2.3”。
1.2.8 人工感染血清样品及临床血清样品检测参考文献方法[17],通过滴鼻和腹腔注射方法人工感染2头1月龄三元猪,同时设立2头对照,用已建立的Vlp-ELISA方法检测感染后28 d的血样;此外,采集江苏地区247份血样(包括仔猪、保育猪、育肥猪、公猪/后备猪/母猪血样),利用建立的Vlp-ELISA、吐温20膜蛋白-ELISA以及猪肺炎支原体血清抗体检测试剂盒(IDEXX)进行猪鼻支原体和猪肺炎支原体血清抗体检测。其检测结果根据判定标准判定检测样品的阴阳性,并计算该检测样品的阳性率。
2 结果 2.1 间接ELISA条件筛选经方阵滴定结果表明当血清最佳稀释度为1:100,包被抗原的浓度为0.312 5 μg·mL-1时P/N值最高;封闭液以5%BSA为最佳;以封闭液为稀释液稀释血清后加入孔内反应30 min时P/N值为最高,因此一抗孵育时间为30 min;二抗的最佳反应时间为30 min,稀释比为1:20 000;显色时间为10 min。
2.2 ELISA判定值的确定对30份经Mhr套式PCR检测抗原为阴性的猪血清进行ELISA方法检测,测得阴性血清的平均OD值为0.101,标准差为0.055,因此ELISA方法的判定值为0.27。当样品OD值≥0.27时,判定为阳性。
2.3 重现性试验试验测得批内变异系数范围为1.03%~6.38%;批间的变异系数范围为2.82%~8.61%。批内变异系数和批间变异系数均小于10%(表 1),可见该ELISA方法有重现性良好。
|
|
表 1 批内、批间重现性试验结果 Table 1 Reproducibility analysis of the Vlp-ELISA |
试验结果(图 1)表明吐温20膜蛋白ELISA与猪肺炎支原体及猪滑液支原体存在明显的交叉反应,所建立的Vlp-ELISA方法与其余三种猪源性支原体阳性血清无交叉反应,且该ELISA方法与CSFV、PCV2、PRRSV、PRV等猪常见传染病阳性血清无交叉反应。
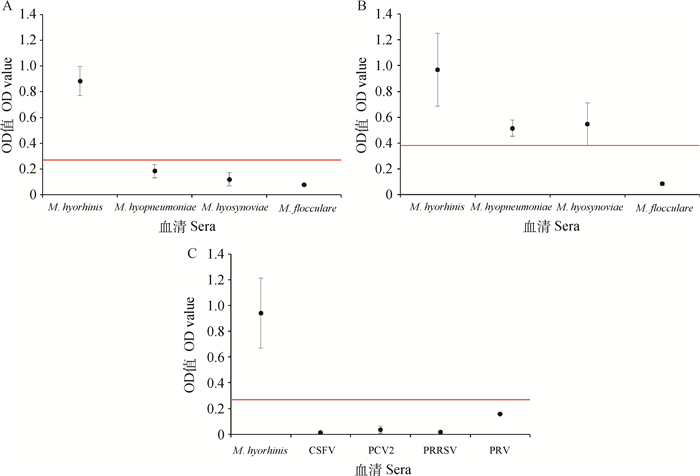
|
A.Vlp-ELISA方法检测四种支原体阳性血清试验结果;B.吐温20膜蛋白ELISA方法检测四种支原体阳性血清试验结果;C. Vlp-ELISA方法检测猪常见传染病阳性血清试验结果 M. hyorhinis, M. hyopneumoniae, M. hyosynoviae, and M. flocculare positive serum samples were detected by Vlp-ELISA (A) and Tween20 extracts-ELISA (B). Common swine disease positive sera samples were detected by the Vlp-ELISA (C) 图 1 交叉性试验结果 Figure 1 The result of the cross-reactivity test |
检测阳性血清及阴性血清样本各25份,结果显示,Vlp-ELISA方法检测为阳性的有21份,阳性符合率为84%;检测为阴性的有25份,阴性符合率为100%。
2.6 临床样品检测 2.6.1 人工感染猪血清检测结果采集感染后28 d的试验猪血清样品进行Vlp-ELISA方法检测,结果显示,猪血清抗体呈阳性,结果见图 2。
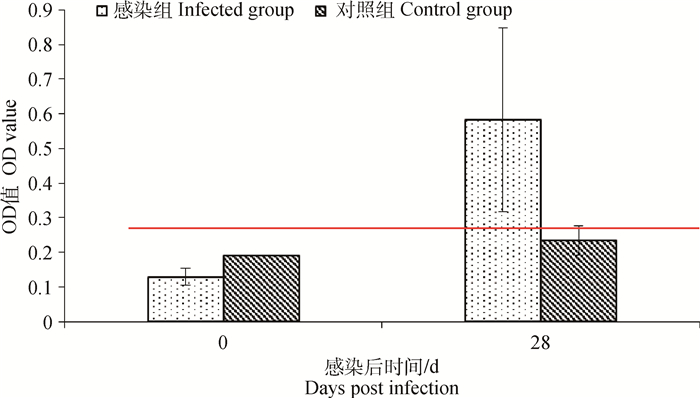
|
图 2 人工感染血清检测结果 Figure 2 The detection results of sera from the experimentally-infected pigs by Vlp-ELISA |
用建立的Vlp-ELISA方法、吐温20膜蛋白ELISA方法和IDEXX Mhp试剂盒检测了临床样品247份(表 2)。Vlp-ELISA方法测得仔猪、保育猪、育肥猪、公猪/后备猪/母猪Mhr抗体阳性率分别为10.1%、2.3%、30.6%、88.2%,吐温20-膜蛋白ELISA对这4个猪群测定的抗体阳性率分别为25.8%、15.9%、47.2%、88.2%,两种ELISA方法结果对不同猪群检测的阳性率趋势相同。同时对样品进行了Mhp抗体检测,阳性率分别为74.2%、30.7%、22.2%和85.3%。
|
|
表 2 临床样品检测结果 Table 2 The detection results of sera from pigs of different ages by Vlp-ELISA and Tween 20 extracts-ELISA |
猪鼻支原体是猪鼻腔内的常在菌,可以引起多发性浆膜炎、关节炎、肺炎、中耳炎,临床上易与副猪嗜血杆菌和链球菌混淆,需通过实验室检测进行确诊。目前针对猪鼻支原体诊断方法主要依靠支原体的分离培养技术和PCR检测技术。猪鼻支原体的分离培养主要是从病猪组织中分离支原体,该方法一般需要消耗两到三周的时间,费时费力。PCR方法主要是以P37[18]或者是16S rRNA[11]为目的基因,通过检测猪群中采集到的鼻拭子及口腔拭子中猪鼻支原体进行诊断,虽然该方法中的拭子获得较为方便,但是在拭子的采集过程中常会因为采集方法的不规范而导致后续的检测中出现假阴性;而在敏感性比较高的套式PCR和荧光定量PCR检测中,也常会因为试验操作不注意引起污染而造成假阳性结果。
相对于上述两种检测方法,血清抗体ELISA检测方法具备操作简单,快捷,并可进行猪群样品的大量检测的优点。猪源支原体成员之间普遍存在交叉性,F. M. Siqueira等通过比较Mhp、Mhr和Mf的基因组序列发现,三个菌种在总数为557、648和572的常见编码序列(CDSs)中有382个序列相同[19]。目前除了Mhp的血清抗体检测试剂盒以外,猪鼻支原体、猪肺炎支原体及絮状支原体均无血清学诊断方法和试剂盒,即使市场上销售的一些用于检测猪肺炎支原体血清抗体的商业试剂盒在检测其他猪源性支原体时同样显示出一定的交叉反应[13]。因此,选择一个特异性高的抗原是建立ELISA方法的关键。J. C. Gomes Neto等报道以吐温20提取支原体膜蛋白为抗原的ELISA方法,用于检测猪鼻支原体攻毒后猪的血清抗体,该方法在试验过程中也出现了支原体之间的交叉反应[13]。试验中我们也重复该方法检测了4种猪源支原体的阳性血清,该结果与J. C. Gomes Neto等的研究结果相似。
Vlp家族是猪鼻支原体重要的表面蛋白,该家族可以通过不同成员的表达变异介导Mhr表面抗原变化,达到免疫逃逸的目的,从而介导长期持续的临床感染[20]。笔者通过blast的比对发现Mhr的Vlp家族蛋白的序列特异性较高,其中Ⅲ区肽段为重复区且在表面暴露较好,所以本研究通过将Vlp家族7个成员的Ⅲ区短肽进行混合后作为包被抗原建立了Mhr ELISA诊断方法,此方法包含Vlp蛋白表达的所有可能性,可以有效避免猪鼻支原体不同Vlp成员表达变化产生的影响。交叉性试验显示该抗原与猪肺炎支原体、猪絮状支原体及猪滑液支原体的猪阳性血清无交叉反应性,同时与其他常见猪病病原阳性血清无交叉反应性。
本试验中我们将建立的Vlp-ELISA方法对人工感染的猪鼻支原体的猪血清进行检测,检测结果显示猪血清从0到28 d由阴性转为阳性。此外,笔者还用该方法和吐温20膜蛋白-ELISA方法对247份临床血清进行检测,并对比了这两种方法的检测结果。结果发现,吐温20膜蛋白-ELISA的阳性率高于新建立的Vlp-ELISA方法。但我们同样将这些临床样品进行了猪肺炎支原体抗体的检测,结果显示有一部分血清为猪肺炎支原体阳性血清;因此吐温20膜蛋白-ELISA检测结果中可能存在一部分假阳性,进一步说明笔者建立的Vlp-ELISA相比吐温20膜蛋白-ELISA方法特异性更强。
从两个方法的血清抗体检测结果来看,仔猪与保育猪的阳性率都相对较低,其中仔猪的血清抗体阳性率高于保育猪,这可能是由于仔猪体内的母源抗体引起的。随着猪日龄的增加,环境中的猪鼻支原体持续感染,猪群中的猪鼻支原体血清抗体阳性率不断升高,其中公猪、后备母猪及母猪阳性率最高。根据不同猪群的抗体消长水平来看,Vlp-ELISA方法和吐温20膜蛋白-ELISA检测结果呈现一致性。
4 结论将Vlp家族7个成员的Ⅲ区短肽混合后作为包被抗原建立猪鼻支原体血清抗体间接ELISA方法,该方法与其他猪源性支原体和常见猪传染病的阳性血清无交叉反应,稳定性良好,为今后猪鼻支原体血清抗体水平检测及试剂盒应用奠定了基础。
| [1] | BARDEN J A, DECKER J L, DALGARD D W, et al. Mycoplasma hyorhinis swine arthritis Ⅲ. Modified disease in piney woods swine[J]. Infect Immun, 1973, 8(6): 887–890. |
| [2] | FRIIS N F, FEENSTRA A A. Mycoplasma hyorhinis in the etiology of serositis among piglets[J]. Acta Vet Scand, 1994, 35(1): 93–98. |
| [3] | MORITA T, OHIWA S, SHIMADA A, et al. Intranasally inoculated Mycoplasma hyorhinis causes eustachitis in pigs[J]. Vet Pathol, 1999, 36(2): 174–178. DOI: 10.1354/vp.36-2-174 |
| [4] | LIN J H, CHEN S P, YEH K S, et al. Mycoplasma hyorhinis in Taiwan: diagnosis and isolation of swine pneumonia pathogen[J]. Vet Microbiol, 2006, 115(1-3): 111–116. DOI: 10.1016/j.vetmic.2006.02.004 |
| [5] | LOBO E, POVEDA C, SUAREZ A, et al. Mycoplasmas hyorhinis in different regions of cuba. diagnosis[J]. Braz J Microbiol, 2011, 42(2): 721–725. DOI: 10.1590/S1517-83822011000200039 |
| [6] | MAKHANON M, TUMMARUK P, THONGKAMKOON P, et al. Comparison of detection procedures of Mycoplasma hyopneumoniae, Mycoplasma hyosynoviae, and Mycoplasma hyorhinis in lungs, tonsils, and synovial fluid of slaughtered pigs and their distributions in Thailand[J]. Trop Anim Health Prod, 2012, 44(2): 313–318. DOI: 10.1007/s11250-011-0022-z |
| [7] | CLAVIJO M J, OLIVEIRA S, ZIMMERMAN J, et al. Field evaluation of a quantitative polymerase chain reaction assay for Mycoplasma hyorhinis[J]. J Vet Diagn Invest, 2014, 26(6): 755–760. DOI: 10.1177/1040638714555175 |
| [8] | MORITA T, FUKUDA H, AWAKURA T, et al. Demonstration of Mycoplasma hyorhinis as a possible primary pathogen for porcine otitis media[J]. Vet Pathol, 1995, 32(2): 107–111. DOI: 10.1177/030098589503200202 |
| [9] | KIM B, LEE K, HAN K, et al. Development of in situ hybridization for the detection of Mycoplasma hyorhinis in formalin-fixed paraffin-embedded tissues from naturally infected pigs with polyserositis[J]. J Vet Med Sci, 2010, 72(9): 1225–1227. DOI: 10.1292/jvms.10-0062 |
| [10] | GOMES NETO J C, BOWER L, ERICKSON B Z, et al. Quantitative real-time polymerase chain reaction for detecting Mycoplasma hyosynoviae and Mycoplasma hyorhinis in pen-based oral, tonsillar, and nasal fluids[J]. J Vet Sci, 2015, 16(2): 195–201. DOI: 10.4142/jvs.2015.16.2.195 |
| [11] | CARON J, OUARDANI M, DEA S. Diagnosis and differentiation of Mycoplasma hyopneumoniae and Mycoplasma hyorhinis infections in pigs by PCR amplification of the p36 and p46 genes[J]. J Clin Microbiol, 2000, 38(4): 1390–1396. |
| [12] | FREEMAN M J, ARMSTRONG C H, SANDS-FREEMAN L L, et al. Serological cross-reactivity of porcine reference antisera to Mycoplasma hyopneumoniae, M. flocculare, M. hyorhinis and M. hyosynoviae indicated by the enzyme-linked immunosorbent assay, complement fixation and indirect hemagglutination tests[J]. Can J Comp Med, 1984, 48(2): 202–207. |
| [13] | GOMES NETO J C, STRAIT E L, RAYMOND M, et al. Antibody responses of swine following infection with Mycoplasma hyopneumoniae, M. hyorhinis, M. hyosynoviae and M. flocculare[J]. Vet Microbiol, 2014, 174(1-2): 163–171. DOI: 10.1016/j.vetmic.2014.08.008 |
| [14] | CITTI C, WATSON-MCKOWN R, DROESSE M, et al. Gene families encoding phase-and size-variable surface lipoproteins of Mycoplasma hyorhinis[J]. J Bacteriol, 2000, 182(5): 1356–1363. DOI: 10.1128/JB.182.5.1356-1363.2000 |
| [15] | ROSENGARTEN R, WISE K S. The Vlp system of Mycoplasma hyorhinis: combinatorial expression of distinct size variant lipoproteins generating high-frequency surface antigenic variation[J]. J Bacteriol, 1991, 173(15): 4782–4793. DOI: 10.1128/jb.173.15.4782-4793.1991 |
| [16] | CHEN D J, WEI Y W, HUANG L P, et al. Synergistic pathogenicity in sequential coinfection with Mycoplasma hyorhinis and porcine circovirus type 2[J]. Vet Microbiol, 2016, 182: 123–130. DOI: 10.1016/j.vetmic.2015.11.003 |
| [17] | BEREITER M, YOUNG T F, JOO H S, et al. Evaluation of the ELISA and comparison to the complement fixation test and radial immunodiffusion enzyme assay for detection of antibodies against Mycoplasma hyopneumoniae in swine serum[J]. Vet Microbiol, 1990, 25(2-3): 177–192. DOI: 10.1016/0378-1135(90)90075-7 |
| [18] | KANG I, KIM D, HAN K, et al. Optimized protocol for multiplex nested polymerase chain reaction to detect and differentiate Haemophilus parasuis, Streptococcus suis, and Mycoplasma hyorhinis in formalin-fixed, paraffin-embedded tissues from pigs with polyserositis[J]. Can J Vet Res, 2012, 76(3): 195–200. |
| [19] | SIQUEIRA F M, THOMPSON C E, VIRGINIO V G, et al. New insights on the biology of swine respiratory tract mycoplasmas from a comparative genome analysis[J]. BMC Genomics, 2013, 14: 175. DOI: 10.1186/1471-2164-14-175 |
| [20] | CITTI C, WISE K S. Mycoplasma hyorhinis vlp gene transcription: critical role in phase variation and expression of surface lipoproteins[J]. Mol Microbiol, 1995, 18(4): 649–660. DOI: 10.1111/mmi.1995.18.issue-4 |



