目前我国现有牛存栏数1.38亿头,牛肉产量达到675.9万t,是世界第四大牛肉生产国[1-2]。随着养牛业的发展,牛传染病的发病率也在逐年升高,已经成为制约养牛业发展的一大重要因素。具体表现为:老病仍在流行,新病陆续出现,病原出现了新的血清型或变异株,给牛病的防控带来困难[3]。每年因疾病死亡造成了严重的经济损失,据统计2015年全年国内肉牛因传染病全程死亡率高达5%,导致的直接经济损失高达90亿~150亿元[4]。口蹄疫病毒(food-and-mouth disease virus,FMDV)、蓝舌病病毒(bluetongue virus,BTV)、水疱性口炎病毒(vesicular stomatitis virus,VSV)、牛病毒性腹泻病毒(bovine viral diarrheal virus,BVDV)、牛轮状病毒(bovine rotavirus,BRV)、产肠毒大肠杆菌(enterotoxigenic E. coli,ETEC)、牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV,又名bovine herpesvirus 1) 和小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)是严重危害养牛业的8种主要传染病病原,这些病原的存在,时时刻刻危害着养牛业的发展。FMDV、VSV和BTV是牛的高度急性传染病,一般呈暴发性流行,临床上在口腔、蹄部及乳房出现病变,症状十分相似,难以区分,死亡率高,被世界动物卫生组织(OIE)列为必须报告的传染病[5-8]。BVDV、BRV和ETEC是引起牛腹泻的主要病原体。BVDV以持续性感染无症状形式存在,牛群中相当一部分牛是BVDV携带者,BVDV降低机体抵抗力,常伴随着其他疾病暴发,症状为急性水样腹泻,急速消瘦[9-11]。IBR属于免疫抑制性疾病,病毒感染机体后还可继发细菌感染,据调查不仅各品种的牛均有感染的报道,而且感染地区遍布全国各省市,感染率居高[12]。PPR是近年来出现的外来新病,OIE将其列为必须报告的动物疫病,在我国被列为一类动物疫病[13]。这些疾病是养牛业的巨大潜患,一旦暴发,将会造成巨大的经济损失。因此开展牛传染病快速检测技术的研究势在必行。
快速准确地检测诊断传染病是进行有效防控的前提和基础[14]。目前用于鉴别诊断这些牛传染病的检测方法有很多种,如病毒分离、荧光抗体染色技术、ELISA方法、PCR方法、荧光PCR和LAMP等。但这些方法在临床实际应用中仍然存在着不足之处:病毒分离培养技术特异性强,但是其耗时长,敏感性不高;荧光抗体检测技术检测速度快,但对病料的新鲜度和抗体的特异性要求较高;ELISA方法特异性好,但只能检测单一病毒;PCR、荧光PCR和LAMP,特异性好,但只能对单一或2~4种病原体进行检测,无法实现真正意义上的同时对多种病原体实行高通量检测。
GeXP多基因表达分析系统是一种新型的高通量的基因检测技术,将多重PCR技术和毛细管电泳技术有效地结合起来,采用荧光标记通用引物和特异性嵌合引物(即基因特异性引物5′端连接通用引物)相结合从而引发多重PCR体系的扩增,可同时对多达30个目的基因进行有效检测分析,实现真正意义上的高通量检测鉴别多种病原体的目的[15-19]。因此针对以上问题,本研究旨在建立一种同时鉴别FMDV、BTV、VSV、BVDV、BRV、ETEC、IBRV和PPRV的GeXP高通量检测方法。开展这种高通量检测和新型快速检测技术的研究,为8种牛常见病原体的检测提供技术支撑,可用于牛病流行病学的监测和突发疫情的鉴别诊断,保障养牛业的健康发展。
1 材料与方法 1.1 试剂和仪器Genome Lab GeXP Starter试剂盒、DNA size standard kit-400 Base Pairs、分离缓冲液、分离胶、液体石蜡、上样板和毛细管购自美国贝克曼公司,JumpStart Taq DNA聚合酶,Mg2+购自美国SIGMA公司,pEASY-T1载体、DNA/RNA共提试剂盒购自北京全式金生物技术有限公司,反转录、premixTaq PCR试剂盒购自宝生物工程(大连)有限公司,MidiPlasmidkid质粒提取试剂盒购自天根生化科技(北京)有限公司,T7体外转录试剂盒购自Fermentas公司。PCR仪购自美国Thermo公司,NanoDrop ND-2000紫外分光光度计购自美国NanoDrop公司,GeXP多基因表达分析系统购自美国贝克曼公司。
1.2 样品的准备O型、A型、AsiaⅠ型口蹄疫灭活疫苗购自兰州兽医研究所,O型、A型、AsiaⅠ型口蹄疫灭活病毒,新泽西型(NJ型)和印第安型(IND型)水疱性口炎灭活病毒,蓝舌病灭活病毒(4型、8型、9型、15型、17型、18型),小反刍兽疫灭活病毒由云南出入境检验检疫局惠赠。3株牛病毒性腹泻病毒参考毒株,2株牛轮状病毒参考毒株,1株牛传染性鼻气管炎病毒参考毒株购自中国兽医药品监察所,14株BVDV广西分离株,8株BRV广西分离株和3株ETEC由本实验室分离、保存。参照全式金RNA/DNA共提试剂盒说明书,抽提毒株的RNA/DNA,RNA病毒需反转录成cDNA,将cDNA和DNA模板于-20 ℃保存,备用。
1.3 引物的设计从GenBank数据库中下载8种病原体的基因序列,将序列经过MegAlign软件进行比对分析,选择保守和特异的区域,用Primer premier 5.0软件设计特异性引物。分别在各对特异性引物的正、反向5′端加通用引物标签:Tag-F:5′-AGGTGACACTATAGAATA和Tag-R:5′-GTACGACTCACTATAGGGA,构成8对特异性嵌合引物,引物由北京华大公司合成,PAGE纯化,引物信息见表 1。
|
|
表 1 引物信息 Table 1 Primer Sequences |
反应体系为20 μL:cDNA/DNA模板1 μL(含cDNA/DNA 106~10 ng),Genome Lab GeXP Starter Kit 5× buffer 4 μL(buffer内含通用引物,工作浓度为0.25 μmol·L-1), MgCl2(25 μmol·L-1) 4 μL,嵌合引物混合物1 μL(各引物浓度见表 1),Thermo-Start DNA polymerase 10 U,超纯水补足体积。
反应程序:95 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,10个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 30 s,10个循环;94 ℃ 30 s,50 ℃ 30 s,72 ℃30 s,10个循环;72 ℃延伸5 min,结束反应。
毛细管电泳检测结果:取3 μL PCR产物和36.75 μL样品缓冲液,0.25 μL DNA size standard kit-400 Base Pairs漩涡振荡混匀,加入上样板中,每孔滴加1滴石蜡封闭液面,避免甲酰胺氧化和样品蒸发。在缓冲液板上每孔加入4/5的缓冲液,进行毛细管电泳。毛细管电泳条件:90 ℃ 120 s,变性;2.0 kV 30 s,吸入样品;6.0 kV 35 min,分离样品。不同大小片段的PCR产物在电泳中分离,仪器通过检测PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件Express Profiler software分析结果,横坐标表示片段大小,纵坐标表示荧光信号强度,即PCR产物的含量。
1.5 质粒标准品的准备用特异性引物扩增各毒株的目的片段,与pEASY-T1载体连接后构建GeXP各目的片段的重组质粒(pEASY-T1-BTV、pEASY-T1-FMDV、pEASY-T1-IBRV、pEASY-T1-BRV、pEASY-T1-ETEC、pEASY-T1-VSV、pEASY-T1-BVDV和pEASY-T1-PPRV),提取阳性克隆质粒。用NanoDrop紫外分光光度计测定pEASY-T1-IBRV和pEASY-T1-ETEC质粒浓度。参照T7体外转录试剂盒说明书将提取的阳性克隆质粒(pEASY-T1-BTV、pEASY-T1-FMDV、pEASY-T1-BRV、pEASY-T1-VSV、pEASY-T1-BVDV和pEASY-T1--PPRV)体外转录为RNA,用NanoDrop测定RNA浓度,根据相对分子质量及浓度计算各质粒拷贝数为拷贝数制备标准品,将各质粒浓度稀释到108~1拷贝·μL-1,-70 ℃保存备用。
1.6 特异性试验将8对特异嵌合引物参照表 1浓度混合,配制成GeXP多重PCR反应的引物工作液,参照“1.4”的反应体系和程序,进行多引物单一模板和多引物多模板的试验,验证GeXP多重PCR体系中引物的特异性。多引物单一模板:在8对引物同时存在的多重反应体系中,逐一与每个病原体核酸模板反应;多引物多模板:在8对引物同时存在的多重反应体系中,将8种牛传染病cDNA/DNA全部混合作为模板,进行GeXP多重PCR特异性分析。
1.7 敏感性试验将8种质粒等量混合,保证每种质粒浓度为108、107、106、105、104、103、102、10、1拷贝·μL-1,将所制备的标准样品参照“1.4”的反应体系和程序,进行GeXP多重PCR灵敏性分析。
1.8 模拟混合感染干扰性试验为了测试不同模板之间浓度差异较大时,高浓度模板是否抑制低浓度模板的扩增,是否仍能敏感的检测到低浓度的模板,使用不同浓度的核酸组合为模板进行GeXP多重PCR。制备2组不同模板浓度的模拟混合感染样品(最高模板浓度至少是最低模板浓度的104倍),样品A:BTV(108拷贝·μL-1)+FMDV(104拷贝·μL-1)+IBRV(104拷贝·μL-1)+BRV(104拷贝·μL-1)+ETEC(106拷贝·μL-1),样品B:IBRV(103拷贝·μL-1)+BRV(105拷贝·μL-1)+ETEC(105拷贝·μL-1)+BVDV(105拷贝·μL-1)+PPRV(107拷贝·μL-1),进行GeXP多重PCR干扰性分析。
1.9 临床样品的检测305份临床样品包括:156份粪便拭子,30份眼拭子,30份鼻黏液拭子,70份抗凝血,2份OP液(食道-咽部分泌物),2份水疱液,15份组织样品(10份直肠黏膜,2份水疱皮,3份淋巴结)。临床样品2012-2014采集于年广西各地,263份样品来源于各地奶牛场无症状奶牛,28份样品来源于具有腹泻、消瘦、流鼻涕等临床症状的牛,14份样品来源于具有“精神不撅,吞咽困难,发烧,口腔糜烂出现水疱,口鼻白沫”等症状的牛。拭子样品用1 mL PBS洗脱,离心取上清抽提总RNA/DNA;组织样品混合匀浆后抽提总RNA/DNA,按照建立的GeXP多重PCR方法进行检测,同时以本研究设计的特异性引物进行SYBR Green Ⅰ荧光PCR,并将阳性PCR产物克隆至pEASY-T1载体,送深圳华大公司测序,以验证阳性样品结果。
2 结果 2.1 引物验证GeXP多重PCR多引物单模板扩增毛细管电泳结果显示,8种牛病原体目的基因的扩增片段大小分别如下,BTV:135~137 bp,FMDV:165~167 bp,IBRV:187~189 bp,BRV:211~214 bp,ETEC:252~254 bp,VSV:278~281 bp,BVDV:308~310 bp,PPRV:342~345 bp。由于GeXP本身系统的误差,扩增片段大小与理论值存在±2 bp偏差,属于正确结果,与试验相符。
2.2 特异性试验分析经过体系优化,最终嵌合引物的比例和浓度见表 1。应用建立的GeXP多重PCR方法,以表 2中所列毒株为模板进行多引物单一模板特异性试验,每个反应只出现特异性单峰,无其他信号峰,且片段大小与引物设计预期相符:BTV、FMDV、IBRV、BRV、ETEC、VSV、BVDV和PPRV分别出现136.72、165.03、188.21、211.71、252.24、278.04、309.58和344.20 bp特异性单峰。阴性对照均无扩增,无目的信号峰值,仅有DNA标准的信号峰,结果见图 1。
|
|
表 2 毒株和菌株来源 Table 2 Sources of Pathogens |

|
图 1 GeXP多重PCR多引物单一模板多引物结果 Figure 1 Specificity results of the GeXP-mono PCR assay |
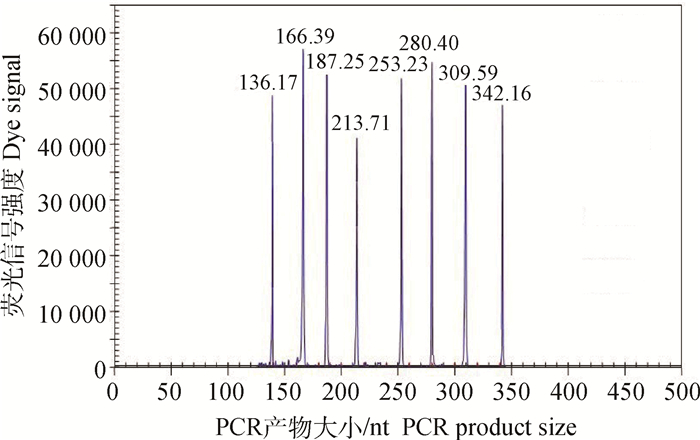
进行多引物多模板特异性试验,8种病原混合模板检测,可同时检出8个目的信号峰。136.17、166.39、187.25、213.71、253.23、280.40、309.59、342.16 bp分别为BTV、FMDV、IBRV、BRV、ETEC、VSV、BVDV和PPRV的信号峰,无其他杂峰,表明样品中同时含有8种牛病原体,与试验设计符合,结果见图 2。
|
图 2 GeXP多重PCR多引物多模板结果 Figure 2 Specificity results of the GeXP-multiplex PCR assay with mixed template of 8 cattle infectious pathogens |
在8对引物同时存在的GeXP多重体系中,检测10倍梯度稀释的混合模板标准品,结果显示(图 3),均可在100拷贝·μL-1反应信号水平上同时特异性检测出8种牛病原体,可见该方法灵敏性高。

|
图 3 GeXP多重PCR敏感性试验结果 Figure 3 Sensitivity results of GeXP-multiplex PCR assay |
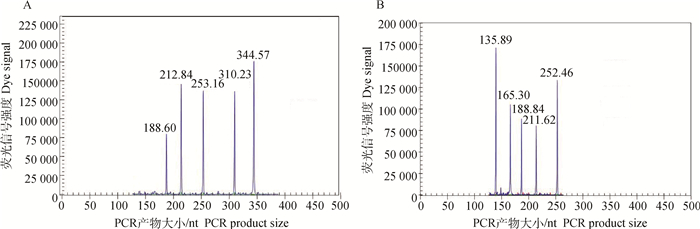
将2组不同模板浓度组合的模拟混合感染样品用建立的GeXP多重PCR方法进行检测,得到与预期相符合特异性峰。图 4所示为不同模板浓度组合的模拟混合感染样品的毛细管电泳结果。结果显示,当起始模板的浓度悬殊较大时,仍能准确敏感地检测出低浓度的模板,干扰性小,如图 4所示。
|
样品A. BTV (108拷贝·μL-1)+FMDV (104拷贝·μL-1)+IBRV (104拷贝·μL-1)+BRV (104拷贝·μL-1)+ETEC (106拷贝·μL-1);样品B. IBRV (103拷贝·μL-1)+BRV (105拷贝·μL-1)+ETEC (105拷贝·μL-1)+BVDV (105拷贝·μL-1)+PPRV (107拷贝·μL-1) Sample A. BTV (108 copies·μL-1)+FMDV (104 copies·μL-1)+IBRV (104 copies·μL-1)+BRV (104 copies·μL-1)+ETEC (106 copies·μL-1); Sample B. IBRV (103 copies·μL-1)+BRV (105 copies·μL-1)+ETEC (105 copies·μL-1)+BVDV (105 copies·μL-1)+PPRV (107 copies·μL-1) 图 4 GeXP多重PCR敏感性试验结果 Figure 4 Interference results of GeXP-multiplex PCR assay |
305份临床样品的检测结果见表 3。结果显示,应用建立的GeXP多重PCR结果与荧光PCR结果相符,并且测序结果显示阳性结果均为对应的病原体,无非特异性扩增的假阳性。305份样品中,146份检测结果为阳性,其中单重感染为90份(29.5%),混合感染28份(9.2%),混合感染样品中,BVDV+ETEC混合感染23份(7.5%),BRV+ETEC混合感染5份(1.6%)。
|
|
表 3 GeXP多重PCR对305份临床样品的检测结果 Table 3 Clinical detection results of 305 samples |
FMDV、BTV、VSV、BVDV、BRV、ETEC、IBRV和PPRV是养牛业常见的8种传染病病原,相关疾病感染率高,广泛地存在全国各地,一旦暴发流行,将造成巨大的经济损失。准确地诊断监测是传染病防控的有效手段,目前中国动物疾病预防控制中心每年需对全国各地FMDV、PPRV和BTV进行流行病学监测。因此,有必要建立一种特异、敏感、高通量的检测诊断方法,为牛传染病的防控提供技术支持。
GeXP多基因表达分析系统是目前最方便、快速的高通量检测技术。目前最常见多种病原体的检测技术是常规多重PCR和荧光多重PCR,但它们检测目的基因数量有限,常规多重PCR受PCR产物条带的大小和琼脂糖凝胶电泳的限制最多只能检测到4重,荧光多重PCR受激发光和吸收光的限制最多检测3重,都达不到真正的高通量、快速检测和分析多种病原的目的。本研究借助的GeXP多基因表达分析系统是一种新型高通量的基因检测技术,将多重PCR技术和毛细管电泳技术有效地结合起来,荧光基团标记的PCR产物最终通过毛细管电泳进行区分,可区分相差大于7 bp以上的PCR产物。引物合成时,在基因特异性引物5′端加上通用引物序列,形成特异性嵌合引物。PCR扩增时,目的基因与特异性嵌合引物相结合进行第一次扩增,随后荧光标记通用引物和特异性嵌合引物相结合进行第二次扩增,因此把多对引物的扩增转化为1对通用引物的扩增,使各模板的扩增效率趋于一致,而大大减少各引物间的干扰抑制作用,从而达到真正的高通量检测鉴别多个病原体的目的。设计引物时,每对引物扩增的PCR产物之间至少相差7 bp即可区分,通过毛细管电泳辨认扩增片段大小从而判定检测结果。这项技术目前已经应用于多种动物疾病的诊断:如9种鸡呼吸道病,11种鸭病,8种猪呼吸道和繁殖障碍病原体,8种鸡免疫抑制病,H5亚型禽流感等[20-24]。目前常见的另一种高通量检测技术是基因芯片,朱晓光等应用基因芯片技术检测6种麻疹病毒属病毒,史茜等建立了牛新孢子虫基因芯片检测方法[25-26]。基因芯片技术虽然灵敏度和特异性均好,但芯片影响因素较多,标签确认困难,结果不能直接读取,一次需检测多个样品,成本高。GeXP多基因表达分析系统低成本,操作简便,可直接读取结果,可灵活选择检测样品数量,适用于临床样品的检测。
临床检测结果中,BVDV与ETEC,BRV与ETEC混合感染率高,分别是7.5%和1.6%,没有检出BVDV和BRV混合感染结果。我们推测BVDV感染牛时,引起机体免疫力下降,使其他病原体容易入侵机体,因此常伴有ETEC的共感染。BRV主要感染1月龄内的犊牛,虽然有些轮状病毒感染犊牛没有特征性临床症状表现,但仍能从其粪便中检测到BRV的病毒粒子,BR急性腹泻通常是由于BRV与ETEC混合感染造成的,破坏绒毛肠细胞,使肠绒毛吸收功能失去平衡,分泌强于吸收而导致腹泄。由于感染BVDV和BRV的牛发病年龄有相差,因此很少见BVDV与BRV共感染。这些混合感染的样品均采集自腹泻重症表现的牛,这些牛吸吮反应下降,水样腹泻带血,部分粪伴有黏膜脱落,脱水严重,犊牛同时伴有右下腹部鼓胀,小肠积水。由这些临床症状看来,混合感染加剧了疾病的发生,非常严重。在临床样品的检测中,没有检测到VSV。有263份样品采集自没有任何症状的牛,但仍能检测到病原,其中以BVDV感染最多,再次证明了这些病毒在牛群中间广泛存在,是养牛业的安全隐患,必须准确检测并淘汰才能保障养牛业的健康发展。
在实际操作中,由于每种疾病病原富集的部位不同,所以需采集不同的样品进行检测。可从同一机体采集不同样品,进行混合,对混合样品统一处理后抽提RNA/DNA进行检测。除ETEC和IBRV外,其他都是RNA病毒,故使用RNA/DNA共提试剂盒进行核酸抽提,再进行反转录,使用的反转录试剂盒对核酸中的DNA成分无影响,全程只需一次抽提,一次PCR,一次电泳,即可得到8种牛病的检测结果。一次GeXP最多可检测96份样品, 其高通量的优势非常适合大规模检测或流行病学调查。
4 结论成功建立同时监测8种牛常见病原体的GeXP多重PCR方法,能够特异、敏感、高通量地鉴别检测8种牛常见传染病,可以成为临床鉴别诊断和流行病学调查的有用工具。
| [1] |
目前我国肉牛养殖的现状以及前景分析[N]. 2015-10-29. http://www.ar114.com.cn/news/show.php?itemid=78926.
Current situation and prospect analysis on breeding cattle in China[N]. 2015-10-29. http://www.ar114.com.cn/news/show.php?itemid=78926.(in Chinese) |
| [2] |
周作集, 刘克俊, 李芳芳, 等. 广西肉牛的发展现状和对策[J]. 广西畜牧兽医, 2014, 30(5): 233–236.
ZHOU Z J, LIU K J, LI F F, et al. The present situation and strategies of cattle industry in Guangxi province[J]. Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2014, 30(5): 233–236. (in Chinese) |
| [3] | SIERRA S, DÁVILA M, LOWENSTEIN P R, et al. Response of foot-and-mouth disease virus to increased mutagenesis: influence of viral load and fitness in loss of infectivity[J]. J Virol, 2000, 74(18): 8316–8323. DOI: 10.1128/JVI.74.18.8316-8323.2000 |
| [4] | CERNICCHIARO N, WHITE B J, RENTER D G, et al. Evaluation of economic and performance outcomes associated with the number of treatments after an initial diagnosis of bovine respiratory disease in commercial feeder cattle[J]. Am J Vet Res, 2013, 74(2): 300–309. DOI: 10.2460/ajvr.74.2.300 |
| [5] | BRITO B P, RODRIGUEZ L L, HAMMOND J M, et al. Review of the global distribution of foot-and-mouth disease virus from 2007 to 2014[J]. Transbound Emerg Dis, 2017, 64(2): 316–332. DOI: 10.1111/tbed.2017.64.issue-2 |
| [6] | MARTÍN-ACEBES M A, GONZÁLEZ-MAGALDI M, ROSAS M F, et al. Subcellular distribution of swine vesicular disease virus proteins and alterations induced in infected cells: a comparative study with foot-and-mouth disease virus and vesicular stomatitis virus[J]. Virology, 2008, 374(2): 432–443. DOI: 10.1016/j.virol.2007.12.042 |
| [7] | NAYDUCH D, COHNSTAEDT L W, SASKI C, et al. Studying Culicoides vectors of BTV in the post-genomic era: resources, bottlenecks to progress and future directions[J]. Virus Res, 2014, 182: 43–49. DOI: 10.1016/j.virusres.2013.12.009 |
| [8] | WERNERY U, KINNE J. Foot and mouth disease and similar virus infections in camelids: a review[J]. Rev Sci Tech, 2012, 31(3): 907–918. DOI: 10.20506/rst.issue.31.3.51 |
| [9] | SANTMAN-BERENDS I M G A, MARS M H, VAN DUIJN L, et al. Evaluation of the epidemiological and economic consequences of control scenarios for bovine viral diarrhea virus in dairy herds[J]. J Dairy Sci, 2015, 98(11): 7699–7716. DOI: 10.3168/jds.2014-9255 |
| [10] | KHATIB L A, TSAI Y L, OLSON B H. A biomarker for the identification of cattle fecal pollution in water using the LTIIa toxin gene from enterotoxigenic Escherichia coli[J]. Appl Microbiol Biotechnol, 2002, 59(1): 97–104. DOI: 10.1007/s00253-002-0959-y |
| [11] |
谢金鑫, 段招军, 李丹地, 等. 中国大庆奶牛中发现轮状病毒G10P[11][J]. 病毒学报, 2010, 26(5): 407–409.
XIE J X, DUAN Z J, LI D D, et al. Detection of bovine rotavirus G10P[11] in a diary farm in Daqing, China[J]. Chinese Journal of Virology, 2010, 26(5): 407–409. (in Chinese) |
| [12] |
甘瑜萍, 余祖琼, 黄恒, 等. 我国牛传染性鼻气管炎的流行与防控现状[J]. 黑龙江畜牧兽医, 2016(2): 113–114.
GAN Y P, YU Z Q, HUANG H, et al. Epidemic and control of infectious bovine rhinotracheitis[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(2): 113–114. (in Chinese) |
| [13] | WU X, LI L, LI J, et al. Peste des petits ruminants viruses re-emerging in China, 2013-2014[J]. Transbound Emerg Dis, 2016, 63(5): e441–e446. DOI: 10.1111/tbed.2016.63.issue-5 |
| [14] |
胡长敏, 郭爱珍, 潘志明, 等. 发达国家重大牛病防控历史和经验[J]. 中国兽医学报, 2011, 31(3): 453–456.
HU C M, GUO A Z, PAN Z M, et al. Lessons from the history of cattle major epidemic disease control in developed countries[J]. Chinese Journal of Veterinary Science, 2011, 31(3): 453–456. (in Chinese) |
| [15] | DREW J E, MAYER C D, FARQUHARSON A J, et al. Custom design of a GeXP multiplexed assay used to assess expression profiles of inflammatory gene targets in normal colon, polyp, and tumor tissue[J]. J Mol Diagn, 2011, 13(2): 233–242. DOI: 10.1016/j.jmoldx.2010.10.001 |
| [16] | YANG M J, LUO L, NIE K, et al. Genotyping of 11 human papillomaviruses by multiplex PCR with a GeXP analyzer[J]. J Med Virol, 2012, 84(6): 957–963. DOI: 10.1002/jmv.23275 |
| [17] | HU X M, ZHANG Y, ZHOU X M, et al. Simultaneously typing nine serotypes of enteroviruses associated with hand, foot, and mouth disease by a GeXP analyzer-based multiplex reverse transcription-PCR assay[J]. J Clin Microbiol, 2012, 50(2): 288–293. DOI: 10.1128/JCM.05828-11 |
| [18] | RAI A J, KAMATH R M, GERALD W, et al. Analytical validation of the GeXP analyzer and design of a workflow for cancer-biomarker discovery using multiplexed gene-expression profiling[J]. Anal Bioanal Chem, 2009, 393(5): 1505–1511. DOI: 10.1007/s00216-008-2436-7 |
| [19] | QIN M, WANG D Y, HUANG F, et al. Detection of pandemic influenza A H1N1 virus by multiplex reverse transcription-PCR with a GeXP analyzer[J]. J Virol Methods, 2010, 168(1-2): 255–258. DOI: 10.1016/j.jviromet.2010.04.031 |
| [20] | XIE Z X, LUO S S, XIE L J, et al. Simultaneous typing of nine avian respiratory pathogens using a novel GeXP analyzer-based multiplex PCR assay[J]. J Virol Methods, 2014, 207: 188–195. DOI: 10.1016/j.jviromet.2014.07.007 |
| [21] | ZHANG Y F, XIE Z X, XIE L J, et al. GeXP analyzer-based multiplex reverse-transcription PCR assay for the simultaneous detection and differentiation of eleven duck viruses[J]. BMC Microbiol, 2015, 15: 247. DOI: 10.1186/s12866-015-0590-6 |
| [22] | ZHANG M X, XIE Z X, XIE L J, et al. Simultaneous detection of eight reproductive and respiratory swine pathogens using a novel GeXP analyser-based multiplex PCR Assay[J]. J Virol Methods, 2015, 224: 9–15. DOI: 10.1016/j.jviromet.2015.08.001 |
| [23] | ZENG T T, XIE Z X, XIE L J, et al. Simultaneous detection of eight immunosuppressive chicken viruses using a GeXP analyser-based multiplex PCR assay[J]. Virol J, 2015, 12: 226. DOI: 10.1186/s12985-015-0455-5 |
| [24] | LI M, XIE Z X, XIE Z Q, et al. Simultaneous detection of four different neuraminidase types of avian influenza A H5 viruses by multiplex reverse transcription-PCR using a GeXP analyser[J]. Influenza Other Respir Viruses, 2016, 10(2): 141–149. DOI: 10.1111/irv.2016.10.issue-2 |
| [25] |
朱晓光, 李斌, 刘冰, 等. 麻疹病毒属病毒检测基因芯片的建立[J]. 中国病原生物学杂志, 2010, 5(5): 329–331, 405.
ZHU X G, LI B, LIU B, et al. Microarray for species-specific detection of Morbillivirus[J]. Journal of Pathogen Biology, 2010, 5(5): 329–331, 405. (in Chinese) |
| [26] |
史茜, 唐慧芬, 牛国辉, 等. 牛新孢子虫基因芯片检测方法的建立[J]. 中国预防兽医学报, 2014, 36(9): 715–719.
SHI Q, TANG H F, NIU G H, et al. Development gene microarray method for the detection of bovine Neospora caninum[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(9): 715–719. (in Chinese) |



