2. 中国农业科学院特产研究所, 长春 130112
2. Institute of Special Animal and Plant Science, Chinese Academy of Agricultural Sciences, Changchun 130112, China
在畜牧业生产中,许多生产性状受性别控制。奶牛作为重要的经济动物,只有母牛可以产奶,性别决定和性别控制对奶业生产具有重要意义。
SRY是哺乳动物性别决定的开关[1-2],其mRNA调控早期性腺中支持细胞(Sertoli)的分化和睾丸的正常发育[3]。在两性发育潜能的性腺分化前,雌、雄小鼠中大部分性别基因的表达模式相似,交配12.5 d (Day postcoitum,dpc)后很多基因的表达量发生明显变化,如SRY和SOX9基因仅在雄性小鼠的睾丸中表达,在雌性中不表达。人SRY基因在性腺和多种组织中表达,从妊娠41 d持续到成年[4-5]。绵羊SRY的表达始于23 dpc,27~44 dpc到高峰,且持续到出生[6]。猪SRY基因在21 dpc就能检测到,23 dpc表达量最高,52 dpc仍能检测到[7]。SOX9是SRY的靶基因,参与脊椎动物的多种发育机制的调控[8-9]。小鼠SOX9最初在雌雄生殖嵴中都表达;当SRY基因启动表达后,该基因在雄性生殖嵴中上调,直到SRY停止表达;而在雌性中则不表达[10-11]。小鼠SOX9的表达沉默可导致XY胚胎中卵巢的发育[12-13],而功能获得(Gain of function,GOF)突变可引起人和转基因小鼠XX胚胎向雄性发育[14]。在其它哺乳动物中,由于SRY基因持续表达时间较长而不会发生SOX9引发的性反转。
正常情况下,DAX1的表达被SRY抑制,直到雄性小鼠的精索发育时,则停止表达,而在雌性小鼠的卵巢中则持续表达。当DAX1有两个活性拷贝或过量表达时,可与其它基因协同作用而遏止SRY表达,引起XY小鼠和斑马鱼的性反转[15-16]。但DAX1的功能缺失突变并不能引起XY人和猴子的雌性发育[17-19]。因此,SRY和DAX1是小鼠睾丸正常发育和睾丸决定所必需的。
FOXL2基因是哺乳动物卵巢中最早出现的性别分化标志,也是维持卵巢功能的重要的常染色体基因,在卵巢组织中大量表达[20-21]。人FOXL2仅特异性的表达于眼睑和卵巢组织,通过TGF-β信号通路在卵泡的发育和功能维持中起重要作用[22-23]。小鼠FOXL2在7~17 dpc胎儿中表达量较低,而正在发育的眼睑和成年雌鼠卵巢中表达较高。成年雌鼠、人和山羊的卵巢颗粒细胞大量表达FOXL2,而基质和卵母细胞则表达量很低[24-25]。
目前关于性别决定和性别发育的理论大多来自于小鼠和人类,而关于牛性别相关基因表达模式的研究较少。因此,本研究对19个已知胎龄的牛胎儿中SRY、SOX9、DAX1和FOXL2等4个重要的性别相关基因在生殖嵴和中肾中进行了定量和定性分析,以期从分子水平揭示牛性别发育机制,为家畜的性别控制提供理论基础。
1 材料与方法 1.1 已知胎龄牛胎儿的获得选择中国农业科学院北京畜牧兽医研究所昌平实验基地牛场的48头荷斯坦奶牛,采用两次注射前列腺素法(Prostaglandin,PG)对受体进行同期发情处理,选用荷斯坦公牛的常规冻精(HS03025,山东奥克斯畜牧种业公司)进行人工输精,并记录配种日期。对母牛实施剖腹产手术获得19个已知胎龄的胎儿(配种当天为0 dpc);剪取其一侧的泌尿生殖嵴于液氮保存,用于4个性别相关基因表达的定量检测;另一侧生殖嵴和中肾用4%多聚甲醛固定,用于4个蛋白的免疫组化检测;剩余的胎儿组织于-20 ℃保存,用于牛胎儿的性别鉴定。
1.2 牛胎儿的性别鉴定所用的材料是牛早期胎儿,无法从外观上辨别其性别,为了快速准确鉴定胎儿性别,通过扩增AML、WSY、A12和B34 4个基因鉴定牛胎儿的性别[26-27]。分别提取牛胎儿的基因组DNA作为模板进行PCR扩增。反应体系共20 μL,其中上下游引物(10 μmol·L-1)各1 μL,模板DNA 1 μL,2×Tagplus buffer 10 μL,dd H2O 7 μL。扩增条件为94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环。PCR产物用2%琼脂糖凝胶电泳检测,凝胶成像系统观察电泳结果,每个反应重复3次。4个基因的引物序列见表 1。
|
|
表 1 基因引物和探针序列 Table 1 Primers and probes for genes |
实时荧光定量PCR(Quantitative real-time PCR,qRT-PCR)用于SRY、SOX9、DAX1和FOXL2基因表达水平的检测。参照NCBI中已公布的牛SRY(NM_001014385.1)、SOX9(AF278703)、DAX1(XM_597595)、FOXL2(NM_001031750.1) 及GAPDH(NM_001034034.1) 基因的mRNA序列设计TaqMan引物及探针,序列见表 1。首先用ABI9700基因扩增仪进行4个目的基因片段的PCR扩增,反应体系为50 μL,其中ddH2O 37.8 μL,10×Taq buffer 5 μL,dNTPs(25 mmol·L-1)0.4 μL,上下游引物(10 μmol·L-1)各1 μL,PlatinumTaq(5 U·μL-1)0.3 μL,镁离子(25 mmol·L-1) 3 μL,cDNA 1.5 μL。扩增参数为95 ℃预变性5 min;94 ℃变性30 s,56 ℃退火45 s,68 ℃延伸60 s,共35个循环。PCR产物纯化后连接pMD18-T载体构建重组质粒,测序后序列正确的质粒用于标准曲线的建立。将标准品原液按照106、105、104、103、102拷贝·μL-1数量级进行梯度稀释,并以其为模板实施qRT-PCR,每个样品重复3次,根据Ct值(阈值循环数)及模板起始拷贝数制作标准曲线。
用Tagman探针法进行4个目的基因的定量检测。取牛胎儿生殖嵴,提取总RNA,并反转录为cDNA,以此为模板进行qRT-PCR。反应体系20 μL,其中ddH2O 7 μL,上下游引物(10 μmol·L-1)各1 μL,2×Taq Plus PCR MasterMix 10 μL,cDNA模板1 μL。扩增参数为95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共30个循环。将扩增的结果代入标准曲线计算出实际拷贝数;以GAPDH为内参, 并计算2-ΔΔCt,每个基因检测结果的最大值为100%,利用Origin8软件分析绘图。
1.4 免疫组织化学对性别相关基因蛋白的定位收集的生殖嵴和中肾用4%多聚甲醛固定过夜,经梯度乙醇脱水后,用二甲苯透明,然后于熔融的石蜡中浸透,每次30 min,3次后包埋。包埋好的石蜡块进行切片,厚度为6 μm。切割后铺于经APES处理的载玻片上,60 ℃烤片50 min,采用常规方法进行脱蜡。切片上滴加3% H2O2,室温孵育10 min,以消除内源性过氧化酶活性;PBS (Gibco, Life Technology)洗片后,封闭液0.5% BSA-PBS室温作用30 min。用0.5% BSA-PBS稀释一抗(1:100) 后,滴加于切片上,4 ℃过夜;PBS洗涤15 min,加二抗,37 ℃孵育30 min。洗片后,加DAB显色液室温显色3 min,自来水充分冲洗。苏木精复染1 min,1%盐酸乙醇溶液分化,蒸馏水充分洗涤终止反应,用中性树胶封片。切片于生物显微镜(奥林巴斯,日本)下观察并照相。免疫标记所用的一抗分别为兔抗SOX9抗体(Abcam,英国), 兔抗SRY抗体(Sigma,美国); 兔抗DAX1抗体(Abcam,英国)和兔抗FOXL2多抗(Thermo,美国)。二抗为生物素-链霉卵白素标记的山羊抗兔IgG(北京中杉金桥生物技术有限公司),细胞膜或胞质中呈现棕黄色颗粒为阳性表达,蓝色颗粒为阴性表达。本文根据4个基因的定量分析结果,分别选取具有代表性的胎龄来展示其蛋白定位图,SRY蛋白定位的雄性和雌性胎儿的胎龄为43、53、80 dpc;SOX9蛋白定位的雄性胎儿的胎龄为44、50、53、80 dpc,雌性的胎龄为45、50、53、80 dpc;DAX1蛋白定位的雄性和雌性胎儿的胎龄为38、43、50、53 dpc;FOXL2蛋白定位的雄性和雌性胎儿的胎龄为43、50、53、80 dpc。另外,80 dpc雄性胎儿的中肾由于保存不当而丢失,80 dpc雌性胎儿的中肾组织中SRY蛋白的定位由于操作不当,没有获得其阳性染色图片。
1.5 数据分析性别相关基因表达水平试验重复3次,数据以“平均数±标准差(SD)”表示。采用SAS 8.0软件的单因素方差(One-way ANOVA)分析方法进行数据分析,P<0.05为差异显著。
2 结果 2.1 牛胎儿的性别鉴定本研究采用4对引物进行牛胎儿的性别鉴定。用WSY和B34基因的引物,雄性胎儿组织可分别获得699和268 bp的片段,而雌性则均不能扩增到特异性片段(图 1A,1C)。用AML基因的引物,雄性组织中可同时获得458和395 bp的2条特异性条带,而雌性则只有458 bp的1条片段(图 1B)。利用A12基因的引物,雄性和雌性都可以获得1条216 bp的条带(图 1C)。经4对引物的鉴定,收集的19个已知胎龄的牛胎儿中,10个为雄性,9个为雌性,其性别和胎龄对照见表 2。

|
1.空白对照; 2、4、5、6、7、10、11、23.雌性; 3、8、9、12、14~20、22.雄性; 13.雌性的阳性对照; 21.雄性的阳性对照; M. Marker。1′、3′、6′、7′.雌性; 2′、4′、5′、8′.雄性; 9′.雄性的阳性对照; 10′.雌性的阳性对照; 11′.空白对照。1″和2″.分别以A12和B34基因引物扩增的雌性的阳性对照; 3″和4″.雌性; 5″和6″.雄性; 7″和8″.分别以A12和B34基因引物扩增的雄性的阳性对照 1.Blank control; 2, 4-7, 10, 11, 23.Female; 3, 8, 9, 12, 14-20, 22.Male; 13.Positive control of female; 21.Positive control of male; M.Marker; 1′, 3′, 6′, 7′. Female; 2′, 4′, 5′, 8′. Male; 9′. Positive control of male; 10′.Positive control of female; 11′. Blank control; 1″, 2″.Positive control of female with A12 and B34 genes; 3″, 4″. Female; 5″, 6″. Male; 7″, 8″. Positive control of male with A12 and B34 genes 图 1 WSY(A)、AML(B)、A12和B34(C)对部分牛胎儿性别鉴定的电泳图 Figure 1 Sex identification of bovine fetuses with WSY(A), AML(B), A12 and B34(C) genes |
|
|
表 2 获得的19个牛胎儿的性别和胎龄对照表 Table 2 Sex and gestational ages of 19 fetuses of dairy cattle |
采用qRT-PCR对4个性别相关基因在牛胎儿生殖嵴中的表达水平进行定量检测。总体上,SRY基因只在雄性胎儿中表达,而DAX1、SOX9和FOXL2基因则在雄性和雌性中均有不同程度的表达(图 2)。在雄性胎儿中,SRY基因的表达量从35 dpc开始急剧上调,40 dpc时达到高峰,而后迅速下调,至43 dpc时又开始上调。可见,SRY基因在35~80 dpc的早期胎儿生殖嵴中均有表达,而在雌性中一直没有表达(图 2B)。雄性胎儿中,SOX9基因的表达量从35 dpc时开始上调,40 dpc时达到峰值;然后经历16 d的上下波动,表达量上调至80 dpc达到最高。而雌性中,SOX9基因表达量从38 dpc开始升高,随后该基因的表达量起伏变化,分别在43和48 dpc时达到峰值,之后则急剧下调至微量表达,并维持到80 dpc。另外,SOX9在雌性胎儿生殖嵴中的表达上调晚于雄性,而下调表达又早于雄性;50 dpc后其在雌雄胎儿间的表达差异更显著,在雄性中持续上调至表达量的最高值,而在雌性则下调至最低表达水平(图 2C)。雌性胎儿中,DAX1基因的表达从38 dpc开始显著上调,经过42 d的3次上下波动后,在80 dpc达到最高水平,其中在41和45 dpc时表达量较高。在43~56 dpc的雄性胎儿中,DAX1基因的表达水平不断变化,直到80 dpc时达到最高点;从40~48 dpc的发育过程中,雌性生殖嵴中DAX1基因的表达量高于雄性(图 2A)。在39 dpc雌性胎儿生殖嵴中,FOXL2基因的表达水平显著上调,41 dpc时至第1个峰值;之后显著下调,并经过9 d的平稳过渡,其表达量第2次显著上调,53 dpc时达到第2个峰值;然后表达量继续升高,80 dpc时达到最高值。而在雄性胎儿从33~80 dpc发育的过程中,FOXL2基因一直维持微量表达(图 2D)。
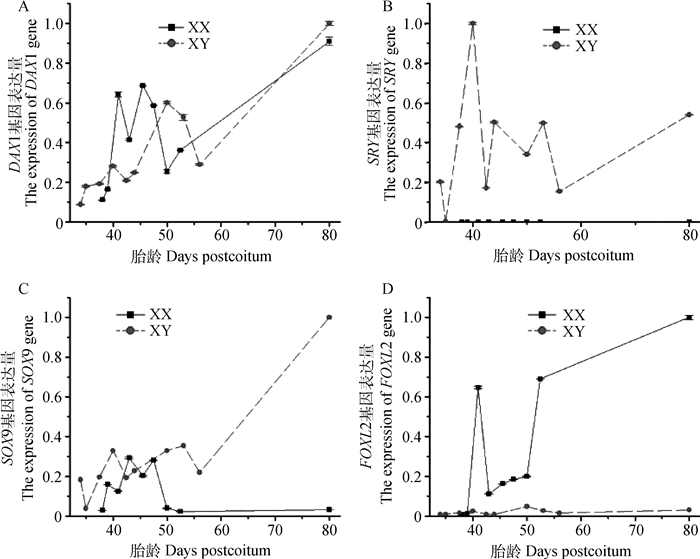
|
图 2 牛胎儿SRY、SOX9、DAX1和FOXL2基因的mRNA表达水平 Figure 2 Expression of SRY, SOX9, DAX1 and FOXL2 in early bovine fetuses |
采用组织学和免疫组化方法对SRY、SOX9、DAX1和FOXL2蛋白在不同胎龄的牛胎儿生殖嵴和中肾组织中的表达进行检测。SRY在43~53 dpc的牛雄性生殖嵴和中肾管细胞的胞质中表达,但在中肾组织的间质细胞中未见表达;在80 dpc生殖嵴中SRY蛋白没有表达,因为此时的生殖嵴已经高度分化。而雌性生殖嵴和中肾组织中,所有发育阶段均未检测到SRY蛋白的表达(图 3)。
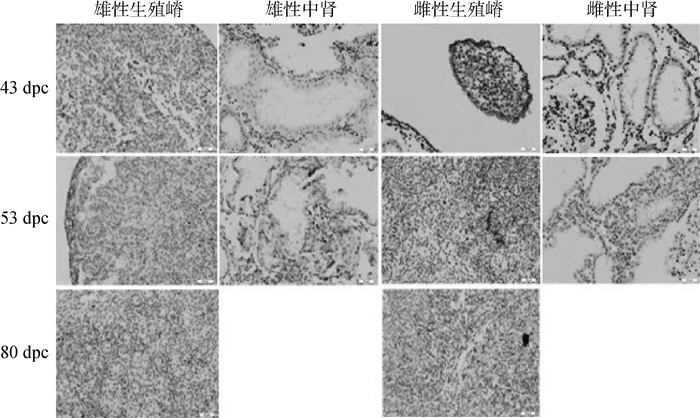
|
图 3 牛胎儿生殖嵴和中肾中SRY蛋白的免疫组化染色(200×) Figure 3 Location of SRY protein in the urogenital crests and mesonephroi in bovine fetuses(200×) |
在44、50和53 dpc的雄性生殖嵴和中肾组织中SOX9蛋白均显著表达;位于44 dpc生殖嵴所有细胞的胞质和细胞膜,而在50和53 dpc的组织中则只表达于胞质;在中肾中,SOX9蛋白表达于中肾管细胞的胞质和细胞膜,而间质细胞中则不表达,二者形成鲜明的对比。雌性牛胎儿中,SOX9蛋白在4个胎龄的生殖嵴和中肾中均有表达,其中在45 dpc生殖嵴、50和53 dpc中肾组织中高表达;50和53 dpc生殖嵴中表达量稍低;其亚细胞定位与雄性胎儿相同。在80 dpc胎儿的生殖嵴(高度分化)中,SOX9蛋白在雌性围绕滤泡组织表达,在雄性则围绕索状组织表达,且均表达于细胞质中(图 4)。
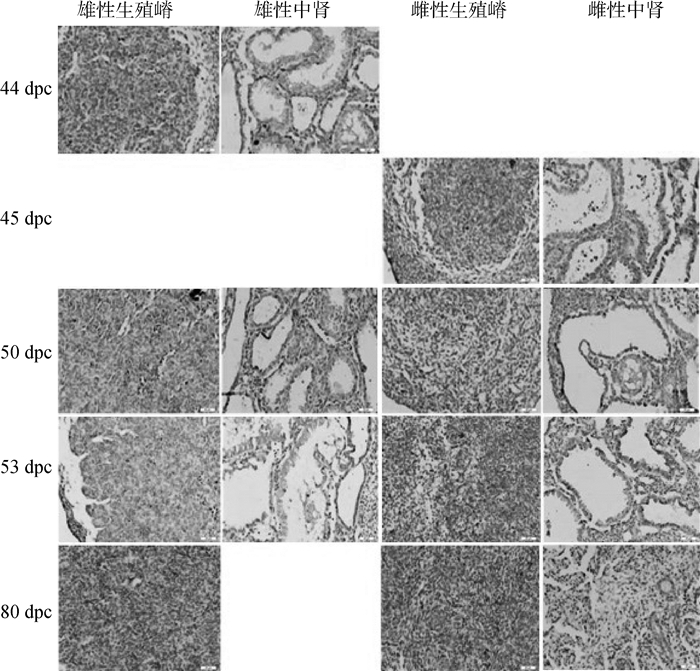
|
图 4 牛胎儿生殖嵴和中肾中SOX9蛋白的免疫组化染色(200×) Figure 4 Location of SOX9 protein in the urogenital crests and mesonephroi in bovine fetuses(200×) |
在38 dpc牛胎儿中,DAX1蛋白低表达于雌性生殖嵴和中肾细胞,雄性组织中不表达。43 dpc雌性和雄性生殖嵴中,DAX1蛋白的表达增强,位于生殖嵴的边缘细胞中,而内部组织细胞则不表达。在雌性和雄性中肾组织中,DAX1蛋白表达量均显著升高,尤其是在中肾管细胞的胞质和细胞膜中,可见其在雌雄两性的表达没有显著差异。50 dpc雄性中肾管细胞也呈现DAX1蛋白的高表达。除上述组织外,DAX1在雌性和雄性的其他组织中均呈低表达或不表达(图 5)。
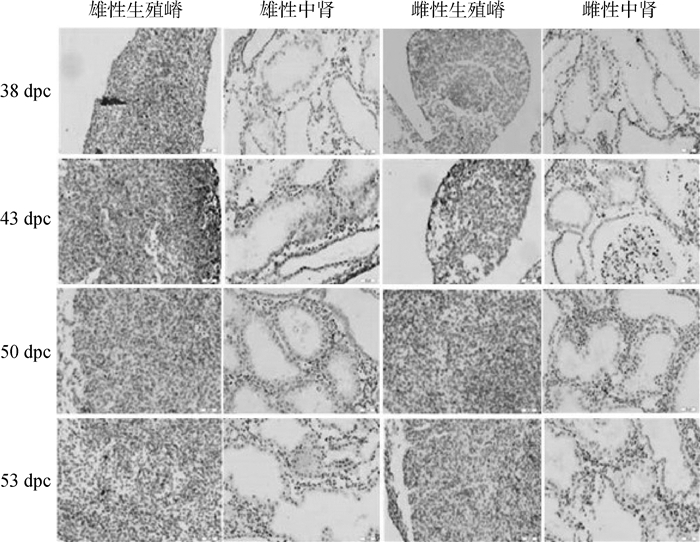
|
图 5 牛胎儿生殖嵴和中肾中DAX1蛋白的免疫组化染色(200×) Figure 5 Location of DAXl protein in the urogenital crests and mesonephroi in bovine fetuses(200×) |
FOXL2蛋白在43 dpc的雌性和雄性生殖嵴中均表达于细胞质;其在同期的雌、雄性中肾的中肾管中表达量显著增加,雌性高于雄性;且在间质细胞质中也有该蛋白的表达,但表达量较小。在50~80 dpc雄性生殖嵴和中肾中均没有检测到FOXL2蛋白的表达,而其在同期的雌性中肾中明显表达,雌性生殖嵴中表达水平较低;该蛋白在中肾管细胞中的表达量显著高于间质细胞。然而,在53 dpc雌性和雄性生殖嵴及中肾中均没有检测到FOXL2蛋白的表达(图 6)。

|
图 6 牛胎儿生殖嵴和中肾中FOXL2蛋白的免疫组化染色(200×) Figure 6 Location of FOXL2 protein in the urogenital crests and mesonephroi in bovine fetuses(200×)(200×) |
由于大家畜世代间隔长、繁殖力低、价格昂贵,目前关于大家畜胎儿性别相关基因表达和性别发育的研究较少。本研究分别从RNA和蛋白水平对SRY、SOX9、DAX1、FOXL2基因在不同发育阶段的牛胎儿中的表达进行定量和定性检测。结果表明,牛早期胎儿雄性的性别决定时间在35~39 dpc,雌性则在39~41 dpc;且SRY和FOXL2分别为牛早期胎儿雄性和雌性的性别决定基因,初步揭示了牛早期胎儿性别相关基因的表达规律,为家畜性别控制提供理论基础。
TaqMan探针荧光定量方法因其特异性好、灵敏度高而常被用于基因表达水平的检测[28],本研究利用该方法对4个性别相关基因的mRNA表达水平进行了检测,结果表明,SRY基因只在雄性胎儿表达,而DAX1、SOX9、FOXL2在雌性和雄性胎儿中都表达,只是表达量有所不同。已有的研究表明,SRY存在于Y染色体,是雄性特异性基因,而DAX1、SOX9、FOXL2为常染色体基因,与本文的结果相同[4, 29]。在雄性牛胎儿中,从35~80 dpc,SRY基因的表达量起伏波动,在整个早期胎儿发育阶段都有表达,但没有明显的波峰波谷;该蛋白的定位分析结果也如此。因此,SRY基因在牛和人或小鼠的表达模式不同[30]。另外,D.G.Ross等研究结果中SRY mRNA表达量在一次上调后即下调,并维持低水平,这与本研究的结果有差异[31]。遗憾的是没有获得SRY蛋白在40 dpc雄性生殖嵴的免疫组化片子,所以没有观察到该蛋白的大量表达。根据本文中SOX9基因的表达曲线,在35 dpc雄性胎儿中开始上调,40 dpc时下调,然后又上下波动;而雌性则从38 dpc时开始上调,39 dpc时其表达量达到第一个峰值后开始下调。可见,SOX9在雄性和雌性胎儿中的上调和下调表达时间不同;且在50 dpc后的雌雄两性间,SOX9基因的表达具有显著差异,并呈现相反的变化趋势,与其在小鼠中的表达量变化规律类似[32]。
笔者推测,SRY基因在35~40 dpc时启动雄性性别决定, FOXL2基因表达受抑制而SOX9和DAX1启动表达,从而促进具有双性发育潜能的生殖嵴向睾丸转化;若SRY不表达,FOXL2和DAX1基因则在39~41 dpc时表达上调,则有双性发育潜能的生殖嵴向卵巢转化。另外,SOX9基因在雌性分化中也具有重要作用,在41~48 dpc发育过程中FOXL2表达下调,SOX9立即上调直到卵巢分化结束;在50 dpc胎儿中FOXL2表达上调,SOX9则立即下调,之后一直低水平表达,而FOXL2基因却高水平表达,以维持卵巢功能和活性,这些结果均与已有的报道一致[21, 33-34]。再者,FOXL2基因在雄性胎儿中表达量低,而在雌性中表达量上下波动,表明其可能是决定雌性发育的重要基因,否定了“雌性是无SRY存在时的默认通路”的说法[35]。FOXL2是叉头状转录因子,存在于细胞核[36],而本研究在雌性和雄性生殖嵴、中肾管细胞中均检测到该蛋白,并定位于细胞质和细胞膜,也有研究表明该蛋白定位于细胞核外的其它区域[37-38]。
DAX1广泛表达于垂体、下丘脑、性腺和肾上腺等组织[39]。在小鼠,DAX1 与SRY基因表达模式相同,11.5 dpc开始表达于雌、雄两性生殖嵴。当双性发育潜能的生殖嵴向睾丸发育时,DAX1表达量显著下降,反之则其表达量维持恒定[40],与牛胎儿中的表达不同。本研究结果中,DAX1基因在雄性性别决定完成后开始上调表达,即雄性在SRY表达下调后,DAX1表达开始上调(43 dpc);而雌性胎儿则在SRY不表达时(41 dpc),其表达开始上调,初步验证在性别决定期SRY与DAX1有拮抗作用[41]。在性别分化后的雌性和雄性生殖嵴中,DAX1表达均先急剧下调后缓慢上调,这与雄鼠的表达模式相似,而与雌鼠不同[42]。性别分化后,DAX1在雄鼠胎儿中迅速下调又缓慢上调,在12 dpc胎儿的Leydig和Sertoli细胞中达到高峰,推测其在睾丸发育晚期具有调控雄性特异性基因表达的作用。而雌鼠中,DAX1在性腺中持续表达到成年,具体作用机制尚不清楚。
人和小鼠DAX1是剂量敏感型性别相关基因;同样,牛DAX1基因在雌性胎儿中的最高表达量是雄性的2倍。当人和小鼠DAX1基因为2个拷贝时,SRY基因正常表达的XY个体可发生性反转,因此其在雄性发育中可能发挥抑制作用,而在雌性发育中具有促进作用[43]。但与人和小鼠不同,DAX1基因位于牛常染色体上,那么其在牛性别发育中的作用及其剂量效应还需要进一步研究。
利用确定胎龄的牛胎儿作为研究对象,成本较高,试验样本量小,没有重复,性别相关基因的表达水平和定位结果是否存在个体差异尚待进一步探讨。
4 结论通过对牛早期胎儿性别发育相关基因的定量和定性研究,发现牛早期胎儿雄性的性别决定时间为35~39 dpc,雌性则为39~41 dpc;且SRY和FOXL2分别为牛早期胎儿雄性和雌性的性别决定基因,初步揭示了牛早期胎儿性别相关基因的表达规律,为家畜性别控制提供理论基础。同时,牛性别决定基因表达模式和性腺组织学跟人相似,妊娠期接近,因此研究牛性腺发育特点,为人类性腺发育异常等疾病的诊断和治疗提供思路。
| [1] | KASHIMADA K, KOOPMAN P. Sry: The master switch in mammalian sex determination[J]. Development, 2010, 137(23): 3921–3930. DOI: 10.1242/dev.048983 |
| [2] | GRAVES J A M. In retrospect: Twenty-five years of the sex-determining gene[J]. Nature, 2015, 528(7582): 343–344. |
| [3] | SVINGEN T, KOOPMAN P. Building the mammalian testis: Origins, differentiation, and assembly of the component cell populations[J]. Genes Dev, 2013, 27(22): 2409–2426. DOI: 10.1101/gad.228080.113 |
| [4] | HANLEY N A, HAGAN D M, CLEMENT-JONES M, et al. SRY, SOX9, and DAX1 expression patterns during human sex determination and gonadal development[J]. Mech Dev, 2000, 91(1-2): 403–407. DOI: 10.1016/S0925-4773(99)00307-X |
| [5] | MCCLELLAND K, BOWLES J, KOOPMAN P. Male sex determination: Insights into molecular mechanisms[J]. Asian J Androl, 2012, 14(1): 164–171. DOI: 10.1038/aja.2011.169 |
| [6] | PAYEN E, PAILHOUX E, ABOU MERHI R, et al. Characterization of ovine SRY transcript and developmental expression of genes involved in sexual differentiation[J]. Int J Dev Biol, 1996, 40(3): 567–575. |
| [7] | PARMA P, PAILHOUX E, COTINOT C. Reverse transcription-polymerase chain reaction analysis of genes involved in gonadal differentiation in pigs[J]. Biol Reprod, 1999, 61(3): 741–748. DOI: 10.1095/biolreprod61.3.741 |
| [8] | SEKIDO R, LOVELL-BADGE R. Sex determination involves synergistic action of SRY and SF1 on a specific Sox9 enhancer[J]. Nature, 2008, 453(7197): 930–934. DOI: 10.1038/nature06944 |
| [9] | CUTTING A, CHUE J, SMITH C A. Just how conserved is vertebrate sex determination?[J]. Dev Dyn, 2013, 242(4): 380–387. DOI: 10.1002/dvdy.23944 |
| [10] | BERGSTROM D E, YOUNG M, ALBRECHT K H, et al. Related function of mouse SOX3, SOX9, and SRY HMG domains assayed by male sex determination[J]. Genesis, 2000, 28(3-4): 111–124. DOI: 10.1002/(ISSN)1526-968X |
| [11] | GASCA S, CAÑIZARES J, DE SANTA BARBARA P, et al. A nuclear export signal within the high mobility group domain regulates the nucleocytoplasmic translocation of SOX9 during sexual determination[J]. Proc Natl Acad Sci U S A, 2002, 99(17): 11199–11204. DOI: 10.1073/pnas.172383099 |
| [12] | CHABOISSIER M C, KOBAYASHI A, VIDAL V I P, et al. Functional analysis of Sox8 and Sox9 during sex determination in the mouse[J]. Development, 2004, 131(9): 1891–1901. DOI: 10.1242/dev.01087 |
| [13] | BARRIONUEVO F, BAGHERI-FAM S, KLATTIG J, et al. Homozygous inactivation of Sox9 causes complete XY sex reversal in mice[J]. Biol Reprod, 2006, 74(1): 195–201. DOI: 10.1095/biolreprod.105.045930 |
| [14] | MACIEL-GUERRA A T, DE MELLO M P, COELI F B, et al. XX maleness and XX true hermaphroditism in SRY-negative monozygotic twins: Additional evidence for a common origin[J]. J Clin Endocrinol Metab, 2008, 93(2): 339–343. DOI: 10.1210/jc.2007-1115 |
| [15] | MEEKS J J, WEISS J, JAMESON J L. Dax1 is required for testis determination[J]. Nat Genet, 2003, 34(1): 32–33. DOI: 10.1038/ng1141 |
| [16] | CHEN S J, ZHANG H F, WANG F H, et al. nr0b1 (DAX1) mutation in zebrafish causes female-to-male sex reversal through abnormal gonadal proliferation and differentiation[J]. Mol Cell Endocrinol, 2016, 433: 105–116. DOI: 10.1016/j.mce.2016.06.005 |
| [17] | LUDBROOK L M, HARLEY V R. Sex determination: A 'window' of DAX1 activity[J]. Trends Endocrinol Metab, 2004, 15(3): 116–121. DOI: 10.1016/j.tem.2004.02.002 |
| [18] | KANG Y, ZHENG B, SHEN B, et al. CRISPR/Cas9-mediated Dax1 knockout in the monkey recapitulates human AHC-HH[J]. Hum Mol Genet, 2015, 24(25): 7255–7264. DOI: 10.1093/hmg/ddv425 |
| [19] | SMYK M, BERG J S, PURSLEY A, et al. Male-to-female sex reversal associated with an ~250 kb deletion upstream of NR0B1 (DAX1)[J]. Hum Genet, 2007, 122(1): 63–70. DOI: 10.1007/s00439-007-0373-8 |
| [20] | COCQUET J, PAILHOUX E, JAUBERT F, et al. Evolution and expression of FOXL2[J]. J Med Genet, 2002, 39(12): 916–921. DOI: 10.1136/jmg.39.12.916 |
| [21] | LOFFLER K A, ZARKOWER D, KOOPMAN P. Etiology of ovarian failure in blepharophimosis ptosis epicanthus inversus syndrome: FOXL2 is a conserved, early-acting gene in vertebrate ovarian development[J]. Endocrinology, 2003, 144(7): 3237–3243. DOI: 10.1210/en.2002-0095 |
| [22] | COCQUET J, DE BAERE E, GAREIL M, et al. Structure, evolution and expression of the FOXL2 transcription unit[J]. Cytogenet Genome Res, 2003, 101(3-4): 206–211. DOI: 10.1159/000074338 |
| [23] | CRISPONI L, DEIANA M, LOI A, et al. The putative forkhead transcription factor FOXL2 is mutated in blepharophimosis/ptosis/epicanthus inversus syndrome[J]. Nat Genet, 2001, 27(2): 159–166. DOI: 10.1038/84781 |
| [24] | UDA M, OTTOLENGHI C, CRISPONI L, et al. Foxl2 disruption causes mouse ovarian failure by pervasive blockage of follicle development[J]. Hum Mol Genet, 2004, 13(11): 1171–1181. DOI: 10.1093/hmg/ddh124 |
| [25] | BARON D, BATISTA F, CHAFFAUX S, et al. Foxl2 gene and the development of the ovary: A story about goat, mouse, fish and woman[J]. Reprod Nutr Dev, 2005, 45(6): 377–382. |
| [26] |
林博. 快速PCR方法的建立及其在牛精子和胚胎性别鉴定中的应用[D]. 北京: 中国农业科学院, 2010.
LIN B. Establishment of rapid PCR and application of sex determination of sperm and embryo of bovine[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-2010171315.htm |
| [27] |
王帅. 牛Y染色体插入型打靶载体的构建及阳性细胞系的筛选[D]. 兰州: 甘肃农业大学, 2011.
WANG S. The selection of transgenic bovine fetal fibroblasts with an insertional targeting vector[D]. Lanzhou: Gansu Agricultural University, 2011.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10733-1012000144.htm |
| [28] | ALVAREZ M L, DONÉ S C. SYBR® Green and TaqMan® quantitative PCR arrays: Expression profile of genes relevant to a pathway or a disease state[M]//Alvarez M, Nourbakhsh M. RNA Mapping. New York, NY: Humana Press, 2014, 1182: 321-359. |
| [29] | SONG Y N, LIU T J, WANG Y, et al. Mutation of the Sp1 binding site in the 5' flanking region of SRY causes sex reversal in rabbits[J]. Oncotarget, 2017, 8(24): 38176–38183. DOI: 10.18632/oncotarget.16979 |
| [30] | LARNEY C, BAILEY T L, KOOPMAN P. Switching on sex: Transcriptional regulation of the testis-determining gene Sry[J]. Development, 2014, 141(11): 2195–2205. DOI: 10.1242/dev.107052 |
| [31] | ROSS D G F, BOWLES J, HOPE M, et al. Profiles of gonadal gene expression in the developing bovine embryo[J]. Sex Dev, 2009, 3(5): 273–283. DOI: 10.1159/000252791 |
| [32] | DA SILVA S M, HACKER A, HARLEY V, et al. Sox9 expression during gonadal development implies a conserved role for the gene in testis differentiation in mammals and birds[J]. Nat Genet, 1996, 14(1): 62–68. DOI: 10.1038/ng0996-62 |
| [33] | LAVERY R, LARDENOIS A, RANC-JIANMOTAMEDI F, et al. XY Sox9 embryonic loss-of-function mouse mutants show complete sex reversal and produce partially fertile XY oocytes[J]. Dev Biol, 2011, 354(1): 111–122. DOI: 10.1016/j.ydbio.2011.03.029 |
| [34] | SÁNCHEZ L, CHAOUIYA C. Primary sex determination of placental mammals: A modelling study uncovers dynamical developmental constraints in the formation of Sertoli and granulosa cells[J]. BMC Syst Biol, 2016, 10: 37. DOI: 10.1186/s12918-016-0282-3 |
| [35] |
徐超. 牛SOX9基因的克隆及早期胎儿性别相关基因的表达分析[D]. 北京: 中国农业科学院, 2010.
XU C. Bovine SOX9 cloning and analysis of sex-related gene expression in early fetus[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-82101-2010171027.htm |
| [36] | MOUMNÉ L, FELLOUS M, VEITIA R A. Deletions in the polyAlanine-containing transcription factor FOXL2 lead to intranuclear aggregation[J]. Hum Mol Genet, 2005, 14(23): 3557–3564. DOI: 10.1093/hmg/ddi383 |
| [37] | GOVERNINI L, CARRARELLI P, ROCHA A L L, et al. FOXL2 in human endometrium: Hyperexpressed in endometriosis[J]. Reprod Sci, 2014, 21(10): 1249–1255. DOI: 10.1177/1933719114522549 |
| [38] | GEORG I, BARRIONUEVO F, WIECH T, et al. Sox9 and Sox8 are required for basal lamina integrity of testis cords and for suppression of FOXL2 during embryonic testis development in mice[J]. Biol Reprod, 2012, 87(4): 99. |
| [39] | ZAZOPOULOS E, LALLI E, STOCCO D M, et al. DNA binding and transcriptional repression by DAX-1 blocks steroidogenesis[J]. Nature, 1997, 390(6657): 311–315. DOI: 10.1038/36899 |
| [40] | MIZUSAKI H, KAWABE K, MUKAI T, et al. Dax-1 (dosage-sensitive sex reversal-adrenal hypoplasia congenita critical region on the X chromosome, gene 1) gene transcription is regulated by Wnt4 in the female developing gonad[J]. Mol Endocrin, 2003, 17(4): 507–519. DOI: 10.1210/me.2002-0362 |
| [41] | GOODFELLOW P N, CAMERINO G. DAX-1, an 'antitestis' gene[J]. Cell Mol Life Sci, 1999, 55(6-7): 857–863. DOI: 10.1007/PL00013201 |
| [42] | SWAIN A, ZANARIA E, HACKER A, et al. Mouse Dax1 expression is consistent with a role in sex determination as well as in adrenal and hypothalamus function[J]. Nat Genet, 1996, 12(4): 404–409. DOI: 10.1038/ng0496-404 |
| [43] | LUDBROOK L M, BERNARD P, BAGHERI-FAM S, et al. Excess DAX1 leads to XY ovotesticular disorder of sex development (DSD) in mice by inhibiting steroidogenic factor-1 (SF1) activation of the testis enhancer of SRY-box-9 (Sox9)[J]. Endocrinology, 2012, 153(4): 1948–1958. DOI: 10.1210/en.2011-1428 |



