牦牛是青藏高原等地区的特有畜种,是当地牧民重要的生活、生产资料。但是,由于牦牛存在生长速度慢、产奶量低、品种选育遗传进展慢等问题,致使牦牛业的经济发展受到了严重阻碍[1]。而牦牛与普通牛的杂交后代(犏牛),具有明显的杂交优势,生长发育快、产奶量高,并且抗病能力强,深受当地牧民的喜爱。但F1代犏牛雄性不育,因此,犏牛不能通过横交方式繁殖后代,只能采用自然交配或人工授精使母犏牛与公牦牛或普通牛回交来繁殖后代,但回交繁殖的后代生产性能低下,并无经济效益。随着体外受精和胚胎移植技术(In vitro fertilization and embryo transfer, IVF-ET)的完善和发展,采用牦牛卵母细胞与奶牛精子进行体外受精的方法来获取犏牛胚胎,然后将犏牛胚胎移植入母犏牛子宫中,从而实现母犏牛繁殖高经济价值的犏牛这一目标,并将对牦牛杂交改良工作的可持续发展发挥重要的推动作用。为避免时间和地域的限制,在进行犏牛胚胎移植前,必须对犏牛胚胎进行冷冻保存。玻璃化冷冻法(Vitrification)可避免冰晶的形成,操作简单、冷冻效率高,在目前众多胚胎冷冻保存方法中应用最为广泛[2]。经过玻璃化冷冻后的冻融囊胚,不可避免地还是会遭受一定程度的冷冻损伤,冻融囊胚移植的妊娠率一般比鲜胚移植低10个百分点以上[3-4],而且胚胎冷冻保存的存活率本身也有待提高。在牛胚胎玻璃化冷冻研究中发现,第7天扩张囊胚冷冻存活率为80%,而桑椹胚冷冻存活率仅为62%[5]。目前,通常采用形态学方法对胚胎进行质量评估,但形态学评估具有明显的局限性,不能有效地阐述胚胎的冷冻损伤机制。近年来,随着转录组测序(RNA-seq)技术的发展,可以更便捷、准确地从分子水平来探究冻融囊胚的损伤机制。转录组(Transcriptome)是指在某一特定条件下细胞转录的所有RNA,包括mRNA和非编码RNA[6]。转录组研究作为基因功能和结构研究的基础,可以有效地发掘相关的功能基因,有助于全方位理解细胞基因的表达[7]。有关牦牛卵母细胞转录组[8]和牦牛胚胎转录组[9]的研究也在陆续开展,但未见犏牛胚胎玻璃化冷冻方面的报道。本研究以犏牛新鲜囊胚和经玻璃化冷冻复苏后的冻融囊胚为研究对象,应用RNA-seq技术对其进行高通量测序,通过转录组数据注释和生物信息学分析,比较玻璃化冷冻前后犏牛囊胚差异表达基因,从转录组学角度探讨冻融囊胚的冷冻损伤机制,为完善胚胎的玻璃化冷冻提供新思路,同时为进一步完善犏牛基因结构信息和挖掘与犏牛囊胚玻璃化冷冻相关的新基因提供理论基础。
1 材料与方法 1.1 卵巢与冻精来源牦牛卵巢采自四川省广汉市向阳屠宰场,娟姗牛冻精购自四川省家畜改良站。
1.2 试剂与耗材FSH(Folltropin®-V)、LH(Lutropin®-V)购自BIONICHE公司;胎牛血清(FCS)和双抗(Pen Strep)均为Gibco产品;胚胎培养液G-IVFTM Plus,G-1TM Plus、G-2TM Plus、SpermRinseTM和透明质酸酶(HYASE-10×)购自Vitrolife公司;Medium199(10×)、雌二醇(β-Estradiol)和丙酮酸钠(Sodium pyruvate)均为Sigma产品。玻璃化冷冻试剂盒(VT101)、玻璃化解冻试剂盒(VT102) 均购自Kitazato公司;细胞裂解液和RNase Inhibitor由安诺优达基因科技(北京)有限公司提供;RNeasy Micro Kit购自Qiagen公司;SMARTer PCR cDNA synthesis Kit购自TaKaRa公司;Agilent 2100 High Sensitivity DNA Assay Kit购自美国Agilent Technologies公司;Gel Extraction Kit购自CWBIO公司。
1.3 犏牛胚胎的体外生产牦牛卵巢采于四川省广汉市向阳牛市屠宰场。牦牛屠宰后,在15 min内迅速采摘牦牛卵巢于35 ℃添加青霉素和链霉素(100 μg·mL-1)的无菌生理盐水恒温保温壶中,3 h运送回实验室。用10 mL一次性无菌注射器抽取直径2~8 mm卵泡中的卵泡液,在体视显微镜下挑选胞质均匀且外周被3层以上颗粒细胞包裹的COCs。将挑选出的COCs在卵母细胞体外成熟(In vitro maturation, IVM)清洗盘中洗涤2~3遍,再以50枚·孔-1的数量转入IVM四孔板中,然后置于38.5 ℃、5% CO2、饱和湿度的CO2培养箱中成熟培养24 h。
用吸卵针轻微吹打已成熟的卵母细胞,去除部分颗粒细胞,保留2~3层颗粒细胞,再将卵母细胞移入已平衡8 h的体外受精(In vitro fertilization, IVF)液中清洗2~3次,再以约30枚·滴-1的卵母细胞量转入另一IVF微滴中,加入已解冻并获能的精子(精子密度至少2×106个·mL-1),置于38.5 ℃、5% CO2、90% N2、饱和湿度的培养箱中受精24 h。
用吸卵针将已受精的卵母细胞移至G-1微滴中,清洗2~3次,再以20枚·滴-1的量转入另一G-1微滴中,三气培养箱培养72 h。随后,挑选已均匀分裂的胚胎在G-2微滴中清洗2~3次,再以10枚·滴-1的量转入另一G-2微滴中,培养48 h。
1.4 犏牛囊胚玻璃化冷冻与解冻采用Kitazato公司的玻璃化冷冻试剂盒(VT101)、玻璃化解冻试剂盒(VT102),按照使用说明书上的步骤进行犏牛囊胚玻璃化冷冻与解冻。
1.5 冷冻前后囊胚的收集在体外受精的第6天收集发育良好且未孵化的3枚新鲜囊胚混合,再选取经玻璃化冷冻保存,并解冻复苏良好的3枚冻融囊胚混合。分别将新鲜组和冻融组目标回收囊胚在等渗透压、无钙镁的PBS溶液中清洗2~3遍,去除残留血清和培养液。洗涤后,将尽可能携带少于0.5 μL液体体积的2组目标囊胚分别移入含有细胞裂解液和RNase Inhibitor的2个单细胞采集管中,-80 ℃超低温冰箱保存。
1.6 RNA提取,文库的构建及测序采用RNeasy Micro Kit,按步骤提取单细胞采集管中新鲜囊胚和冻融囊胚样本的总RNA。使用Smart-Seq2方法[10]进行扩增:加入反应buffer、反转录酶、含公共序列的Oligo-dT引物和TSO引物,反应得到一链扩增产物;不转管,直接加入含共同序列的ISPCR引物和PCR扩增试剂,反应得到长度约1~2 kb的二链扩增产物cDNA。对富集扩增的cDNA采用Agilent 2100 High Sensitivity DNA Assay Kit检测扩增产物cDNA样品片段分布情况。根据检测结果,对扩增产物cDNA质量进行判定,进行后续文库构建。
两个样本各选取20 ng扩增产物cDNA作为起始原料进行文库构建。使用Bioruptor® Sonication System(Diagenode Inc.)进行样本cDNA片段化,使之断裂为200 bp左右的小片段。然后用2%琼脂糖凝胶电泳检测片段化处理效果。经超声打断后,进行样本cDNA末端修复、加碱基A、测序接头拼接等各步反应,每步反应后,使用Beckman Ampure XP磁珠进行纯化。取接头产物进行PCR扩增,样本分别引入不同的Index标签,便于上机测序时区分。最后用2%琼脂糖凝胶电泳检测PCR扩增产物后,切取DNA片段的凝胶块,使用CWBIO Gel Extraction Kit快速琼脂糖凝胶DNA回收试剂盒回收DNA,再溶于EB缓冲液中,即为最终的文库。最后使用HiSeq 2500测序平台对构建好的两个文库进行单细胞高通量测序。
1.7 数据分析对原始数据进行过滤,去除低质量序列和测序接头序列,得到Clean Reads。采用TopHat v2.0.12软件将测序过滤后所得的Clean Reads与参考基因组进行比对分析。利用RPKM法[11](Reads Per kb per Million reads)计算基因表达量。对于设置生物学重复的试验,采用DESeq2进行基因差异表达分析,而本研究无生物学重复,故采用DEGseq法[12]进行基因差异表达分析,比较处理组与参考组,并以|log2 ratio|≥1和Q<0.05作为基因差异表达的阈值,得到差异表达基因(Differentially expressed genes, DEGs)的个数。将DEGs与参考基因比较,得出DEGs显著富集的GO功能条目,并进一步挖掘出与DEGs显著相关的生物学功能。然后将DEGs向Gene Ontology数据库(http://www.geneontology.org/)各个条目进行映射,计算其数目,对P值进行校正后,以P<0.05为阈值,满足条件的GO条目即为在DEGs中显著富集的GO条目。通过与KEGG(Kyoto encyclopedia of genes and genomes)数据库进行比对,对基因涉及的信号通路进行分析。应用ASprofile软件对可变剪切进行分析。利用Samtools-0.1.19[13]进行单核苷酸多态性(Single nucleotide polymorphysm, SNP)分析。
1.8 差异表达基因的RT-qPCR验证为验证测序结果的准确性,根据测序结果随机选取4个DEGs(2个上调DEGs,2个下调DEGs),并选取H2A作为内参基因,采用RT-qPCR方法验证DEGs的表达情况。采用Primer Premier 5软件进行基因定量引物设计,引物序列见表 1。以合成的犏牛新鲜囊胚和冻融囊胚cDNA第一链为模板,扩增BAD、HSP110等基因。RT-qPCR反应体系为10 μL:上下游引物各0.8 μL,Sso AdvancedTM SYBR® Green Super mix 5 μL,ddH2O 2.9 μL,cDNA模板0.5 μL。RT-qPCR扩增程序:95 ℃预变性3 min;95 ℃变性10 s,60 ℃(根据实际引物退火温度进行调整)退火20 s,72 ℃延伸60 s,30个循环;最后72 ℃延伸5 min;4 ℃保存。试验结果采用Pfaffl法[14]分析4个DEGs在两样本中的相对表达量。
|
|
表 1 实时荧光定量PCR引物信息 Table 1 Primers for quantitative RT-PCR |
新鲜囊胚和冻融囊胚过滤后得到的高质量序列占Raw Reads的比例(Clean Reads rate)分别为97.07%和95.88%,Q30百分比分别达到92.02%和91.91%(表 2),说明测序质量和文库构建质量较高,测序数据准确可靠,可满足后续分析。从碱基含量分布图(图 1)可知,测序结果中两样本碱基A-T、C-G含量都基本对应重合,说明碱基组成稳定平衡,测序质量高。从碱基质量分布图(图 2)可知,两样本碱基质量稳定在30%~40%,低质量碱基比例小,说明测序质量较好。
|
|
表 2 测序产量统计 Table 2 Statistics of sequencing output |
|
A.犏牛新鲜囊胚;B.犏牛冻融囊胚。图 2同 A. Fresh cross-bred blastocysts of the yak; B. Vitrified-thawed cross-bred blastocysts of the yak. The same as figure 2 图 1 碱基含量分布 Figure 1 The distribution of base content |
|
图 2 碱基质量分布 Figure 2 The distribution of the base quality |
采用TopHat软件将犏牛新鲜囊胚和犏牛冻融囊胚两样本过滤后的Clean Reads与参考基因组进行比对,比对统计结果如表 3所示。由表 3可知,新鲜囊胚和冻融囊胚两样本的Clean Reads与比对上参考基因的Reads的比例都大于80%,说明样品无外源物种污染。在基因表达水平的Reads值的基础上,采用DEGseq法[12]对犏牛新鲜囊胚和犏牛冻融囊胚进行基因差异表达分析,并选取|log2 ratio|≥1和Q<0.05设为基因差异表达的阈值,得到上下调基因个数。犏牛冻融囊胚经过玻璃化冷冻、解冻复温后,相比与犏牛新鲜囊胚有7 570个基因上调表达,3 626个基因下调表达,两样本总共有11 196个DEGs。根据上下调基因,绘制的差异表达基因火山图(图 3)更能直观反映DEGs的情况。可变剪接分析表明,犏牛新鲜囊胚和冻融囊胚分别有49 016和64 352个可变剪切事件。SNP分析显示,犏牛新鲜囊胚和冻融囊胚两样本分别检测到116 681和224 750个SNPs位点。
|
|
表 3 样本与参考基因比对统计结果 Table 3 Summary of mapping result (mapping to reference genes) |

|
图 3 差异表达基因火山图 Figure 3 The volcano plot of differentially expressed genes |
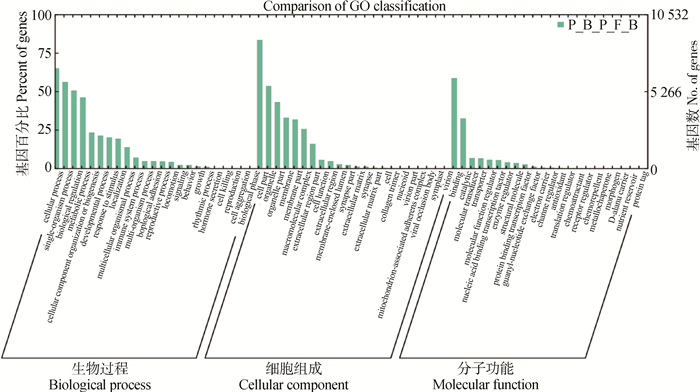
测序得到的unigenes与GO数据库进行比对后,参考GO数据库序列注释测序基因。经GO注释分类后发现,犏牛新鲜囊胚和冻融囊胚共中有10 532个unigenes被分于3个主要GO分类条目中,其中包括23个生物过程(Biological process, BP)、22个细胞组成(Cellular component, CC)和22个分子功能(Molecular function, MF)的次级条目(图 4)。在BP分类中,细胞过程(Cellular process, CP)类别最为显著富集;在CC分类中,细胞组成(Cell part, CP)类别极显著富集;在MF分类中,整合(Binding)类别极显著富集。
|
图 4 差异表达基因的GO功能分类 Figure 4 Go functional classifications of differentially expressed genes |
为了进一步了解获得的预测蛋白的生物学功能及相互作用,将所有的预测蛋白与KEGG蛋白质数据库进行了比对。在犏牛冻融囊胚与新鲜囊胚间差异表达基因通路功能注释中,共有12 315个unigene注释到318条通路,其中有14条显著富集(表 4)。其中,剪接体通路和泛素介导蛋白水解通路二者富集程度最高,且犏牛冻融囊胚相比新鲜囊胚大部分DEGs上调表达。筛选出重要Pathway及所包含的相关差异表达基因见表 5。
|
|
表 4 差异表达基因通路显著性富集分析 Table 4 Pathway significant enrichment analysis of differentially expressed genes |
|
|
表 5 重要通路和差异表达基因 Table 5 Significant pathways and differentially expressed genes |
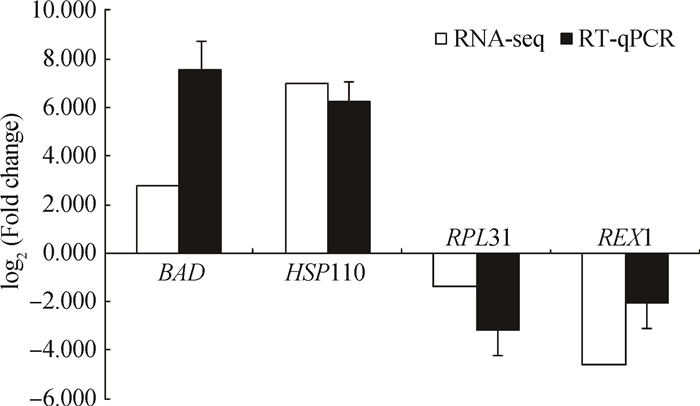
为验证测序结果的准确性,根据测序结果随机选取4个差异表达基因(DEGs)(2个上调DEGs,2个下调DEGs),并选取H2A作为内参基因,采用RT-qPCR方法验证DEGs的表达情况。以新鲜囊胚为基础,分别以单细胞RNA-seq和RT-qPCR两种方法测得的mRNA表达量数据来分析基因表达差异倍数[即log2(冻融囊胚表达量/新鲜囊胚表达量)]。结果表明,单细胞RNA-seq和RT-qPCR两种方法计算得到的差异倍数基本一致(图 5)。验证说明了高通量测序的准确性。
|
图 5 RT-qPCR与RNA-Seq两种方法的差异倍数比较 Figure 5 Comparison of the fold changes between RT-qPCR and RNA-seq |
本研究应用Smart-Seq2方法对犏牛新鲜囊胚和冻融囊胚进行富集扩增,充分保持原有mRNA种类的复杂性,保证了扩增样本的测序数据具有和原始未扩增富集样本的测序数据的一致性。使用Illumina HiSeq 2500平台对犏牛新鲜囊胚和冻融囊胚进行了高通量测序,经一系列数据处理分析得到11 196个DEGs。
对DEGs进行GO功能分析,共有10 532个unigenes得到了表达注释,涉及23个BP、22个CC和22个MF 3大类别。在BP分类中,DEGs主要富集于刺激检测、单(多)细胞生物过程,另外也参与了G蛋白偶联受体信号通路、细胞表面受体信号通路在内的信号传导过程。结果表明,刺激反应、G蛋白偶联受体信号通路在冻融囊胚中表现活跃,具有重要作用。在CC分类中,DEGs主要富集于质膜、质膜积分在内的细胞外围部分,说明犏牛新鲜囊胚在经玻璃化冷冻、解冻复温为冻融囊胚过程后,玻璃化冷冻对囊胚细胞膜的影响很大。细胞膜又称质膜,是由蛋白质和脂质组成围绕在细胞最外层的生物膜,可分割细胞内外环境,对细胞与外围环境之间进行物质和能量的交换起决定性作用。研究表明,细胞膜对低温非常敏感,冷冻时冰晶的形成或解冻时未加冷冻保护剂就直接将胚胎至于高渗解冻液中致使胚胎过快吸水膨胀,这些都会对细胞膜造成严重破坏[15]。在MF分类中,DEGs主要富集于受体活性和信号转导活性方面,具体还涉及信号受体活性、跨膜信号受体活性和G蛋白偶联受体活性。说明冻融囊胚受体活性,特别是跨膜信号受体等活性相比新鲜囊胚受到较大影响。GO分析提示,犏牛新鲜囊胚经玻璃化冷冻、解冻复温后,因冷冻低温刺激致使细胞膜受到了一定程度的冷冻损伤,细胞表面的受体活性,特别是跨膜信号受体活性和G蛋白偶联受体活性受到了较大影响。
在犏牛冻融囊胚与新鲜囊胚间差异表达基因Pathway功能注释中,共有12 315个Unigene注释到318条Pathway,其中有14条显著富集。在14条显著富集通路中,剪接体通路最为显著富集。mRNA前体通过不同的剪切形式可产生不同的mRNA剪切异构体,不同的mRNA剪切异构体又可被翻译成不同的蛋白质,所以mRNA的可变剪切极大地丰富了蛋白质的多样性。标准的剪接体由5个小核糖核蛋白(U1、U2、U4、U5、U6) 和几个剪接体相关蛋白组成。在剪接体富集通路中,mRNA前体剪接因子19(Pre-mRNA processing factor 19, Prp19)、mRNA前体剪接因子4(Pre-mRNA processing factor 4, Prp4) 等大部分mRNA前体剪接因子在犏牛冻融囊胚中都上调表达。研究发现,Prp19的上调表达,可能会干涉导致HeLa等细胞发生调亡[16],激活前体mRNA剪接体并介导DNA损伤响应[17],另外Prp19干涉影响了微管和着丝粒之间的附着,导致细胞有丝分裂前中期染色体不能正常排列到赤道板上。Prp4可影响一类特殊的基因,使其内含子剪切效率降低,导致DNA突变的发生[18]。RNA内含子剪切效率降低,容易造成无义介导的mRNA降解,从而降低了蛋白质的表达水平,对蛋白质功能造成严重影响。所以,剪接体通路的显著富集,大多数差异基因的上调表达,表明犏牛新鲜囊胚经玻璃化冷冻后发生了大量的可变剪接,而一些mRNA前体剪接因子的上调,则会对细胞产生不利影响。
泛素介导蛋白水解通路可通过控制蛋白质在细胞内的存活时间来调控多种生理活动,除了参与蛋白质降解,在信号传导、DNA修复、细胞凋亡和细胞周期调控等生命活动中也发挥着重要作用[19]。泛素需与泛素活化酶(Ubiquitin activating enzyme, E1)、泛素结合酶(Ubiquitin conjugating enzyme, E2)、泛素连接酶(Ubiquitin ligase, E3) 依次作用才能和蛋白质成功连接。K.Reynaud等[20]研究发现卵母细胞的成熟需要泛素介导蛋白水解途径来激活减数分裂的重启。本研究Ubiquitin途径蛋白降解调节细胞周期的UBE1、UBLE1A、UBE2A、UBE2F等在犏牛冻融囊胚中都表达增强。推测泛素在囊胚玻璃化冷冻这一过程中可能选择性地降解了胚胎细胞的蛋白质,具体作用有待进一步研究。
钙调蛋白(Calmodulin, CaM, 又称钙调素),是一种存在于真核细胞内最重要的钙受体蛋白,是钙离子(Ca2+)信号传导系统中的重要组成部分。本研究中,嗅觉传导通路显著富集,CaM(CAMK2) 是在犏牛冻融囊胚中唯一表达量下调的差异基因。CaM参与细胞增殖的调控,可促进细胞的增殖和分裂,对细胞骨架、酶活性和细胞运动也有一定的调控作用。当细胞受到外界刺激,使细胞质内Ca2+浓度增高时,就会加速CaM与Ca2+结合的进程,并与靶蛋白相互作用,使机体产生一系列生理反应[21]。研究发现,烟草幼苗细胞[22]、小鼠胚胎成纤维细胞[23]、小鼠早期囊胚[24]等动植物细胞在一定温度范围内热应激后,Ca2+浓度和CaM表达量都相应升高。H.T.Liu等[25]研究发现热应激可能会促进细胞膜上钙离子通道的激活,从而致使细胞外Ca2+能够快速进入细胞内与CaM结合。本研究中,犏牛新鲜囊胚经玻璃化冷冻后,嗅觉传导通路中的CaM表达量显著降低,推测冷应激可能会对细胞膜造成了一定的影响,延缓了Ca2+由胞外通过钙离子通道进入胞内的进程,从而降低了CaM与Ca2+的结合,致使CaM的表达量显著降低。本研究嗅觉传导通路中,蛋白激酶A(Protein Kinase A, PKA)在犏牛冻融囊胚中表达量显著上调。cAMP/PKA信号转导途径是一条由G蛋白偶联受体介导的细胞信号传导通路,激活后的PKA可通过使蛋白质磷酸化而发挥重要的生物学作用,参与调节细胞增殖分化、新陈代谢、基因转录等过程。Sonic Hedgehog(SHH)是经典的控制胚胎发育的信号传导通路,研究发现,PKA会抑制SHH信号通路的活性,并且PKA使蛋白质磷酸化会抑制SHH信号通路中Gli基因的表达,对SHH信号通路起负调控作用[26-27]。所以,推测犏牛新鲜囊胚经玻璃化冷冻后,导致嗅觉传导通路中PKA表达量显著上调,会对胚胎发育带来不利影响。
在14条显著富集通路中,内质网蛋白加工是其中一条显著富集的通路,内质网相关降解途径上的热休克蛋白(Heat shock proteins, Hsps)的表达量具有显著差异,其中Hsp70在犏牛冻融囊胚中表达量显著上调,而Hsp40、Hsp90表达量显著下调。Hsps除了因受到热刺激产生外,体外冷刺激、缺氧、重金属、化学物质、有毒物质等因素也都可以诱导Hsps的产生,所以热休克蛋白也被称为应激蛋白(Stress protein)。Hsp70可参与细胞增殖, 在细胞有丝分裂过程中也起到一定的作用。研究发现,当细胞因外界变化出现应激反应而处于相对不利的环境中时,Hsp70的合成量会显著增加,30 min内可增加到最高水平,诱导的Hsp70可以降低细胞、组织和器官受外界有害环境的影响,具有一定的保护机制[28]。许文兵[29]在比较程序化冷冻法和玻璃化冷冻法对转基因克隆牛囊胚冷冻效果试验中发现,程序化冷冻处理组和玻璃化冷冻处理组中的Hsp70基因相对表达量都高于新鲜囊胚组,且程序化冷冻处理组表达量最高,得出了玻璃化冷冻相对优于程序化冷冻的结论。另外,研究发现哺乳动物胚胎在应激条件下诱导合成大量的Hsp70的同时, 其它Hsps的合成却会受到一定程度的抑制甚至停止[30]。玻璃化冷冻是一种剧烈的冷应激,本研究中犏牛新鲜囊胚经玻璃化冷冻后,Hsp70表达量显著上升,而Hsp40、Hsp90显著下降,这与上述论证吻合,说明Hsp70合成量的增加是为了保护胚胎抵抗冷应激。正常情况下的细胞凋亡有益于胚胎的发育,可以清除衰老细胞和对机体不利的成分,增强胚胎的新陈代谢,但细胞凋亡异常表达时,则会对胚胎的正常发育产生严重影响。玻璃化冷冻可能会导致细胞凋亡异常,但本研究中,内质网蛋白加工通路上的细胞凋亡促进基因Bax在犏牛冻融囊胚中却是下调表达,B淋巴细胞癌-2基因(B-cell lymphoma-2, Bcl-2) 的表达也未发生显著变化。S.A.Gordon等[31]研究证实了这一现象,发现上调表达的Hsp70可抑制P53及P53介导的细胞凋亡,并抑制Bax基因的上调表达,但不会对Bcl-2的表达产生影响。说明Hsp70在胚胎发育过程中可通过抑制细胞异常凋亡的方式来发挥生物学作用保护胚胎,避免胚胎因受外界有害环境的影响而导致细胞凋亡异常的发生。
神经活性配体受体相互作用信号通路是质膜上所有与细胞内外信号通路相关的配体、受体的集合[32]。本研究中,该通路得到了显著富集,其中促甲状腺激素(TSH)、促甲状腺激素受体(TSHR)在犏牛冻融囊胚中显著上调表达,而促卵泡素受体(FSHR)下调表达。TSHR在细胞的信号传导中发挥作用,TSHR只有跟TSH特异性结合时,二者才能发挥其生物学功能。FSHR是G-蛋白偶联受体家族中的一员,研究发现FSHR结构和功能的改变可能与卵巢对促性腺激素的反应有关,并且FSHR的基因突变可使卵巢功能降低[33]。犏牛囊胚经玻璃化冷冻后,神经活性配体受体相互作用信号通路富集,说明此通路对维持胚胎稳定具有重要作用。
细胞因子受体相互作用通路可通过可溶性蛋白或者糖蛋白接收来自细胞外的信号传导,调节细胞的应激、分裂或宿主系统的炎症反应[34]。细胞因子是指由多种细胞分泌、具有调节细胞生长分化并参与炎症反应的多功能的小分子肽总称。细胞因子包括细胞白介素、干扰素、趋化因子、肿瘤坏死因子和集落刺激因子等。本研究细胞因子受体相互作用通路中,趋化因子CCL2、CCL3、CCR2等在犏牛冻融囊胚中都显著上调表达。CCL2在控制血管平滑肌细胞、排卵和妊娠上具有重要作用,而且CCL2还可提高胚胎在恶劣环境中的适应性[35]。研究发现,在细胞培养基中添加了重组的人CCL2后,细胞增殖速度得到明显提高,并且还具有抗细胞凋亡的作用[36]。猜测趋化因子CCL2等的上调表达,可能是冷冻应激引起的,属于一种保护机制,可提高了胚胎的适应性,防止细胞凋亡程序紊乱。
犏牛冻融囊胚相对于犏牛新鲜囊胚共筛选出11 196个差异表达基因,其中上调表达基因有7 570个,下调表达基因有3 626个。KEGG注释结果表明,犏牛冻融囊胚与新鲜囊胚差异表达基因共涉及318条通路,其中有14条显著富集。虽然玻璃化冷冻胚胎解冻后复苏率较高,但玻璃化冷冻对胚胎转录组有显著影响,推测犏牛囊胚冷冻损伤机制可能是通过剪接体、泛素介导蛋白水解和内质网蛋白加工等通路的相互协调以及Prp19、Prp4、CaM、PKA、Hsp70、CCL2等基因的差异表达来发挥生物学作用。
4 结论本研究首次从分子水平初步阐释了冷冻胚胎移植后的妊娠率低于鲜胚移植的生物学机制。为完善胚胎的玻璃化冷冻提供新思路,同时为进一步完善犏牛基因结构信息和挖掘与犏牛囊胚玻璃化冷冻相关的新基因提供理论基础。
| [1] | WIENER G, HAN J L, LONG R J. The yak[M]. 2nd ed. Bangkok: RAP Publication, 2003. |
| [2] |
郑爱燕, 丁洁, 顾斌, 等. 玻璃化冷冻与程序化冷冻对胚胎发育潜能及临床结局的影响[J]. 生殖与避孕, 2013, 33(1): 16–20.
ZHENG A Y, DING J, GU B, et al. Comparison of development potential of embryos and its clinical outcome after cryopreservation with vitrification and programmed freezing[J]. Reproduction & Contraception, 2013, 33(1): 16–20. DOI: 10.7669/j.issn.0253-357X.2013.01.0016 (in Chinese) |
| [3] | HASLER J F. Factors affecting frozen and fresh embryo transfer pregnancy rates in cattle[J]. Theriogenology, 2001, 56(9): 1401–1415. DOI: 10.1016/S0093-691X(01)00643-4 |
| [4] | SPELL A R, BEAL W E, CORAH L R, et al. Evaluating recipient and embryo factors that affect pregnancy rates of embryo transfer in beef cattle[J]. Theriogenology, 2001, 56(2): 287–297. DOI: 10.1016/S0093-691X(01)00563-5 |
| [5] | CAMPOS-CHILLÒN L F, WALKER D J, DE LA TORRE-SANCHEZ J F, et al. In vitro assessment of a direct transfer vitrification procedure for bovine embryos[J]. Theriogenology, 2006, 65(6): 1200–1214. DOI: 10.1016/j.theriogenology.2005.07.015 |
| [6] | WANG Z, GERSTEIN M, SNYDER M, et al. RNA-Seq: a revolutionary tool for transcriptomics[J]. Nat Rev Genet, 2009, 10(1): 57–63. DOI: 10.1038/nrg2484 |
| [7] |
周超平, 李鑫辉. 单细胞转录组研究进展[J]. 生物化学与生物物理进展, 2013, 40(12): 1193–1200.
ZHOU C P, LI X H. Research progress in analyzing transcriptome at the level of single cells[J]. Progress in Biochemistry and Biophysics, 2013, 40(12): 1193–1200. (in Chinese) |
| [8] |
兰道亮, 熊显荣, 林宝山, 等. 基于微量RNA高通量测序技术的牦牛MⅡ期卵母细胞转录组研究[J]. 畜牧兽医学报, 2014, 45(5): 722–732.
LAN D L, XIONG X R, LIN B S, et al. Transcriptome analysis of yak Metaphase Ⅱ (MⅡ) oocytes by a micro-transcriptome sequencing method[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(5): 722–732. (in Chinese) |
| [9] |
罗斌. 牦牛体外受精胚胎的发育转录组研究[D]. 成都: 西南民族大学, 2016.
LUO B. Transcriptomic analysis of the regulation of yak embryonic development in vitro[D]. Chengdu: Southwest Minzu University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10656-1016776928.htm |
| [10] | PICELLI S, BJÖRKLUND Å K, FARIDANI O R, et al. Smart-seq2 for sensitive full-length transcriptome profiling in single cells[J]. Nat Methods, 2013, 10(11): 1096–1098. DOI: 10.1038/nmeth.2639 |
| [11] | WAGNER G P, KIN K, LYNCH V J. Measurement of mRNA abundance using RNA-seq data: RPKM measure is inconsistent among samples[J]. Theory Biosci, 2012, 131(4): 281–285. DOI: 10.1007/s12064-012-0162-3 |
| [12] | WANG L K, FENG Z X, WANG X, et al. DEGseq: an R package for identifying differentially expressed genes from RNA-seq data[J]. Bioinformatics, 2010, 26(1): 136–138. DOI: 10.1093/bioinformatics/btp612 |
| [13] | LI H, HANDSAKER B, WYSOKER A. The sequence alignment/map format and SAMtools[J]. Bioinformatics, 2009, 25(16): 2078–2079. DOI: 10.1093/bioinformatics/btp352 |
| [14] | PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9): e45. DOI: 10.1093/nar/29.9.e45 |
| [15] | ZERON Y, TOMCZAK M, CROWE J, et al. The effect of liposomes on thermotropic membrane phase transitions of bovine spermatozoa and oocytes: implications for reducing chilling sensitivity[J]. Cryobiology, 2002, 45(2): 143–152. DOI: 10.1016/S0011-2240(02)00123-2 |
| [16] |
李昂, 孙兴, 范克科. Prp19干涉导致细胞染色体错误排列及有丝分裂前中期阻滞[J]. 中国实验血液学杂志, 2016, 24(5): 1552–1557.
LI A, SUN X, FAN K K. Knock-down of pre-mRNA splicing factor Prp19 causes chromosome misalignment and prometaphase arrest[J]. Journal of Experimental Hematology, 2016, 24(5): 1552–1557. (in Chinese) |
| [17] | YIN J, ZHANG Y A, LIU T T, et al. DNA damage induces down-regulation of Prp19 via impairing Prp19 stability in hepatocellular carcinoma cells[J]. PLoS One, 2014, 9(2): e89976. DOI: 10.1371/journal.pone.0089976 |
| [18] |
高旭利. 禾谷镰刀菌蛋白激酶Prp4调控mRNA剪切机制研究[D]. 杨凌: 西北农林科技大学, 2016.
GAO X L. The role of Prp4 kinase in pre-mRNA splicing in fusarium graminearum[D]. Yangling: Northwest A & F University, 2016.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-1016161243.htm |
| [19] | KOMANDER D. The emerging complexity of protein ubiquitination[J]. Biochem Soc Trans, 2009, 37(5): 937–953. DOI: 10.1042/BST0370937 |
| [20] | REYNAUD K, CORTVRINDT R, SMITZ J, et al. Effects of Kit Ligand and anti-Kit antibody on growth of cultured mouse preantral follicles[J]. Mol Reprod Dev, 2000, 56(4): 483–494. DOI: 10.1002/(ISSN)1098-2795 |
| [21] | CHEN S C, SONG Y J, CAO J L, et al. Localization and function of calmodulin in live-cells of Aspergillus nidulans[J]. Fungal Genet Biol, 2010, 47(3): 268–278. DOI: 10.1016/j.fgb.2009.12.008 |
| [22] | GONG M, VAN DER LUIT A H, KNIGHT M R, et al. Heat-shock-induced changes in intracellular Ca2+ level in tobacco seedlings in relation to thermoto-lerance[J]. Plant Physiol, 1998, 116(1): 429–437. DOI: 10.1104/pp.116.1.429 |
| [23] |
张霞, 曹荣峰, 丛霞, 等. CaM对小鼠胎儿成纤维细胞Hsp70表达的影响[J]. 中国农业科学, 2011, 44(7): 1495–1501.
ZHANG X, CAO R F, CONG X, et al. Effect of CaM on expression of inducible Hsp70 in MEF[J]. Scientia Agricultura Sinica, 2011, 44(7): 1495–1501. (in Chinese) |
| [24] |
索佳佳, 张保珍, 孙春玲, 等. 钙调蛋白(CaM)对附植前小鼠胚胎热休克蛋白70(HSP70) 表达的影响[J]. 农业生物技术学报, 2013, 21(6): 690–697.
SUO J J, ZHANG B Z, SUN C L, et al. Effect of calmodulin (CaM) on expression of inducible heat shock protein (HSP70) in mice(Mus musculus) preimplantation embryo[J]. Journal of Agricultural Biotechnology, 2013, 21(6): 690–697. (in Chinese) |
| [25] | LIU H T, SUN D Y, ZHOU R G. Ca2+ and AtCaM3 are involved in the expression of heat shock protein gene in Arabidopsis[J]. Plant Cell Environ, 2005, 28(10): 1276–1284. DOI: 10.1111/pce.2005.28.issue-10 |
| [26] | BARZI M, BERENGUER J, MENENDEZ A, et al. Sonic-hedgehog-mediated proliferation requires the localization of PKA to the cilium base[J]. J Cell Sci, 2010, 123(1): 62–69. DOI: 10.1242/jcs.060020 |
| [27] |
成小林, 李正东, 蒋蓓琦, 等. 转染LKB1基因乳腺癌细胞与胚胎发育信号通路及cAMP/PKA通路的关系[J]. 复旦学报:医学版, 2011, 38(6): 485–491.
CHENG X L, LI Z D, JIANG B Q, et al. Interactions between the Sonic Hedgehog signaling pathway and the cAMP/PKA signaling pathway in LKB1 transfected breast cancer cells[J]. Fudan University Journal of Medical Sciences, 2011, 38(6): 485–491. (in Chinese) |
| [28] | MCCULLY J D, MYRMEL T, LOTZ M M, et al. The rapid expression of myocardial HSP 70 mRNA and the heat shock 70 k protein can be achieved after only a brief period of retrograde hyperthermic perfusion[J]. J Mol Cell Cardiol, 1995, 27(3): 873–882. DOI: 10.1016/0022-2828(95)90037-3 |
| [29] |
许文兵. 转基因克隆牛胚胎的玻璃化冷冻[D]. 杨凌: 西北农林科技大学, 2012.
XU W B. The vitrification of transgenic cloned bovine embryos[D]. Yangling: Northwest A & F University, 2012.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10712-1012435650.htm |
| [30] |
师志海, 李守军, 杨林. Hsp70与胚胎发育[J]. 畜牧兽医科技信息, 2006(6): 13–14.
SHI Z H, LI S J, YANG L. Hsp70 and embryonic development[J]. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2006(6): 13–14. (in Chinese) |
| [31] | GORDON S A, HOFFMAN R A, SIMMONS R L, et al. Induction of heat shock protein 70 protects thymocytes against radiation-induced apoptosis[J]. Arch Surg, 1997, 132(12): 1277–1282. DOI: 10.1001/archsurg.1997.01430360023004 |
| [32] | LAUSS M, KRIEGNER A, VIERLINGER K, et al. Characterization of the drugged human genome[J]. Pharmacogenomics, 2007, 8(8): 1063–1073. DOI: 10.2217/14622416.8.8.1063 |
| [33] | MUTTUKRISHNA S, MCGARRIGLE H, WAKIM R, et al. Antral follicle count, anti-mullerian hormone and inhibin B: predictors of ovarian response in assisted reproductive technology?[J]. BJOG, 2005, 112(10): 1384–1390. DOI: 10.1111/bjo.2005.112.issue-10 |
| [34] | DEY R, JI K M, LIU Z G, et al. A cytokine—cytokine interaction in the assembly of higher-order structure and activation of the interleukine-3: receptor complex[J]. PLoS One, 2009, 4(4): e5188. DOI: 10.1371/journal.pone.0005188 |
| [35] |
樊自尧. CCL2-CCR2自分泌在胚胎附植期猪子宫内膜的表达分布和功能研究[D]. 北京: 中国农业大学, 2015.
FAN Z Y. Location and function of CCL2-CCR2 autocrine in the porcine endometrium during implantation[D]. Beijing: China Agricultural University, 2015.(in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10019-1015582999.htm |
| [36] | HE Y Y, DU M R, GUO P F, et al. Regulation of C-C motif chemokine ligand 2 and its receptor in human decidual stromal cells by pregnancy-associated hormones in early gestation[J]. Hum Reprod, 2007, 22(10): 2733–2742. DOI: 10.1093/humrep/dem208 |



