哺乳动物的卵巢是产生雌性配子(卵子)的场所,经历卵泡发育和成熟、卵泡的募集、选择、优势化和闭锁的一系列过程;此外,卵巢还具有重要的内分泌功能,研究显示卵巢能分泌雌激素、孕酮、生长因子、抑制素、活化素、雄激素和催产素等物质[1]。卵巢组织中卵泡的发育、排卵及黄体的形成是一个很复杂的过程,它伴随着一系列复杂的由类固醇激素及生长特异性调控的卵母细胞和卵泡细胞的变化[2]。卵泡闭锁是指卵泡发育到一定的阶段后停止发育并退化的现象[1],哺乳动物的卵泡闭锁是一种正常的繁殖生理过程。细胞凋亡是卵泡闭锁的主要机制[3],卵泡闭锁是一种选择性的生理性细胞死亡过程,一般包括卵母细胞的凋亡及颗粒细胞的凋亡两方面,是多因素参与的复杂调控过程。胎儿时期卵母细胞的凋亡、每个卵泡周期非优势卵泡的清除以及植入前胚胎细胞的凋亡,均保证了卵巢、卵泡、卵母细胞和胚胎的正常发育,为获得优秀后代提供了保障[4]。
猪作为一种重要的经济动物,也是近年来生物学和医学研究的常用模式生物,有关其卵巢发育及卵泡闭锁的形态生理学和生殖内分泌学研究一直被人们重视。分别对胎猪的卵巢发育和卵子发生进行了显微和超微结构观察[4-8],发现在猪卵巢发育过程中,大多数卵原细胞和卵母细胞均发生了退化现象。S.H.Kim等[9]认为猪卵巢卵泡发育过程中的程序性细胞死亡是依赖于不同的途径,其中普通猪是依赖于自噬相关基因的表达,而小型猪是依赖于凋亡相关基因的调控。
目前,针对出生后发育不同阶段猪卵巢组织的观察及卵泡闭锁和卵母细胞凋亡研究多以体外培养、卵母细胞核质成熟影响因素等方面为主,而有关出生后猪卵巢卵泡发育过程、卵母细胞发育变化以及卵泡闭锁和卵母细胞凋亡规律的研究报道较少。本研究以出生后不同时期猪卵巢为试验材料,运用常规石蜡切片-HE染色方法对出生后不同日龄猪卵巢组织结构及各级卵泡的发育变化特点进行观察,进一步运用DNA缺口原位末端标记检测(TUNEL)技术研究各日龄猪卵巢组织中卵泡闭锁及卵母细胞的凋亡规律,为探明哺乳动物卵泡发育和闭锁机理提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 猪卵巢取自陕西省杨凌高新示范区某生猪屠宰场3、40、50、60、72、86、95及165日龄猪卵巢各3例。
1.1.2 主要仪器设备与试剂LEICA RM 2126型石蜡切片机(徕卡仪器有限公司);Motic数码显微镜(厦门Motic实业有限公司);GTK-2002自动恒温摊烤烘片机(西安瑞丰仪器设备有限公司);Sartorius AA-160型电子读数分析天平(北京赛多利斯仪器系统有限公司);101型电热鼓风干燥箱(北京科伟永兴仪器有限公司)。苏木精(上海蓝季科技发展有限公司);醇溶性伊红(北京化工厂);TUNEL方法采用的细胞凋亡检测试剂盒Ⅳ(In situ cell apoptosis detection kit)(FITC+POD)(BOSTER生物公司),-20 ℃保存,使用前置于4 ℃溶解;DAB显色试剂盒(Solarbio公司)。
1.2 试验方法 1.2.1 猪卵巢形态发育指标测定分别测量各日龄猪左右两侧卵巢的长、宽、厚及重量,长、宽、厚均以平均值表示,卵巢重量以“平均值±SD”表示。
1.2.2 卵巢石蜡切片制备与HE染色卵巢组织修整为1.0 cm×1.0 cm×0.5 cm大小,置于Bouin氏液中固定24~72 h,按常规切片制作方法进行水洗、脱水、透明、浸腊、石蜡包埋、连续切片,片厚5 μm, 裱片于载玻片上,共制备3套切片,以备HE染色、TUNEL染色及阴性对照用。
切片脱蜡复水,苏木精染液15 min,1%的盐酸酒精分化,自来水兰化15~30 min,伊红染色5 min,自来水冲洗1次,梯度浓度乙醇脱水,二甲苯透明,中性树胶封片。
1.2.3 TUNEL染色切片脱蜡至水,加0.01 mol·L-1 TBS 1:200新鲜稀释Proteinase K 37 ℃恒温消化5~10 min,0.01 mol·L-1 TBS漂洗。甩去切片上多余液体后,每张切片加20 μL标记液(每张切片取TdT和DIG-d-UTP各1 μL,加入18 μL标记缓冲液中,混匀),置样品于湿盒中37 ℃ 2 h;0.01 mol·L-1 TBS洗2 min×3次。加封闭液50 μL·切片-1,室温下30 min,甩掉封闭液,不洗。每张切片滴加抗体50 μL(工作浓度1:100),湿盒中37 ℃ 30 min。0.01 mol·L-1 TBS充分漂洗。用抗体稀释液以1:100稀释SABC-FITC+POD,混匀后,每张切片滴加50 μL、37 ℃作用30 min。0.01 mol·L-1 TBS漂洗后,每张切片滴加50 μL DAB显色液,显色15~20 min,水洗;苏木素染液复染胞核。按常规方法脱水,透明,封片。
1.2.4 结果观察及照相染色后的切片在光学显微镜下观察、记录,Motic数码显微照相系统拍照。根据TUNEL染色程度判定阳性反应的强度,胞核呈棕黄色表示强阳性反应,用“+++”表示;胞核黄色表示阳性反应较强,用“++”表示;染色呈淡黄色为弱阳性反应,用“+”表示;胞核无黄色着染为阴性反应,用“-”表示。根据切片观察结果,对不同日龄猪卵巢组织切片中的各级卵泡数量和凋亡卵泡数量进行计数,卵泡闭锁率计算公式:各级卵泡闭锁率=(该级卵泡闭锁数量/卵泡总数)×100%。
2 结果 2.1 不同发育阶段猪卵巢的形态结构及发育规律 2.1.1 不同日龄猪卵巢形态发育对不同日龄的猪卵巢重量、大小及镜下皮质和髓质面积分别进行测量和统计(表 1),由表 1可知,猪卵巢在60日龄前生长较缓慢,72~165日龄生长较迅速;3日龄时皮质区面积要大于髓质区,随日龄增加,皮质所占比例逐渐增大,髓质则逐渐缩小,到86日龄后,其所占总面积百分比渐趋稳定。
|
|
表 1 不同日龄猪卵巢发育情况 Table 1 Development of pig ovaries at different stages |
参照文献[10],将猪卵巢发育组织学分为3个阶段:卵原细胞增殖期(3日龄)、卵泡缓慢生长期(40~60日龄)、卵泡快速生长期(72~165日龄)。在卵原细胞增殖期,卵巢皮、髓质界限不清,存在尚未完全退化的“卵巢网”结构;此期以卵原细胞的增殖分裂为特点, 皮质外围可见大量增殖的卵原细胞(图 1A);在卵泡缓慢生长期,皮、髓质界限仍不明显,皮质主要被大量成群的原始卵泡占据,在60日龄数量最多,仅在靠近髓质处可见数个生长卵泡;随日龄增加,原始卵泡数量开始减少,而初级和次级卵泡的数量及体积均明显增加(图 1B、1C);在卵泡快速生长期,皮、髓质界限清晰。原始卵泡数量继续减少,而生长卵泡的数量及体积均不断增大(图 1D、1E),初级卵泡的数量在86日龄时,达到最大值;72 d时,卵巢中出现三级(有腔)卵泡(图 1D),至95日龄,卵巢中出现近成熟卵泡(图 1F)。

|
A.3 d;B.40 d; C.50 d; D.72 d; E. 86 d; F.95 d。箭头区域(MM).原始卵泡群。PF.初级卵泡; ★.次级卵泡;AF.有腔卵泡;ZP.透明带 A.3 d; B.40 d; C.50 d; D.72 d; E. 86 d; F.95 d. Arrowhead area. Primordimal follicles groups. PF. Primary follicles; ★. Secondary follicles; AF. Antral follicles; ZP. Zona pellucida 图 1 猪卵巢组织学结构 Figure 1 Histological structure of pig ovaries |
HE染色后,在各时期均可见到卵泡的闭锁现象:在卵原细胞增殖期,主要是较多卵原细胞的凋亡,卵巢皮质深层可观察到部分凋亡的原始卵泡,其卵母细胞皱缩、核固缩深染。在卵泡缓慢生长期,可观察到大量原始卵泡和个别初级卵泡的闭锁现象,甚至有的整个原始卵泡群都呈现一致的闭锁,其卵母细胞核裂解消失,卵母细胞呈空泡状,外围颗粒细胞胞核也高度浓缩。在卵泡快速生长期,仍然可观察到各级卵泡的闭锁现象,尤以原始卵泡的退化最为显著。
经TUNEL法染色的组织切片,凋亡细胞的胞核被深染。在卵原细胞增殖期,可见大量卵原细胞、原始卵泡及初级卵泡出现阳性反应,主要是卵原细胞核及卵母细胞核的着色(图 2A、B),也可见到部分早期初级卵泡的卵泡细胞的阳性反应(图 2B)。在卵泡缓慢生长期,各级生长卵泡均可出现闭锁,小的初级卵泡主要以卵母细胞胞核着色为主,后期的初级卵泡则同时伴有卵母细胞和卵泡细胞的阳性反应(图 2C);次级卵泡则主要以卵泡细胞的胞核着色为主,核深染,而中央初级卵母细胞的核着色较浅。在卵泡快速生长期,随着卵泡的快速生长,各级卵泡的闭锁也变得更加明显。早期生长卵泡的闭锁特点与卵泡缓慢生长期基本一致(图 2D),但三级卵泡及大的次级卵泡呈现明显的闭锁特征:周围的颗粒层细胞(尤其是放射冠细胞)核呈深染,中央的卵母细胞核则染色浅或不着色(图 2E、F),提示这些卵泡的闭锁主要是由颗粒细胞凋亡所致。
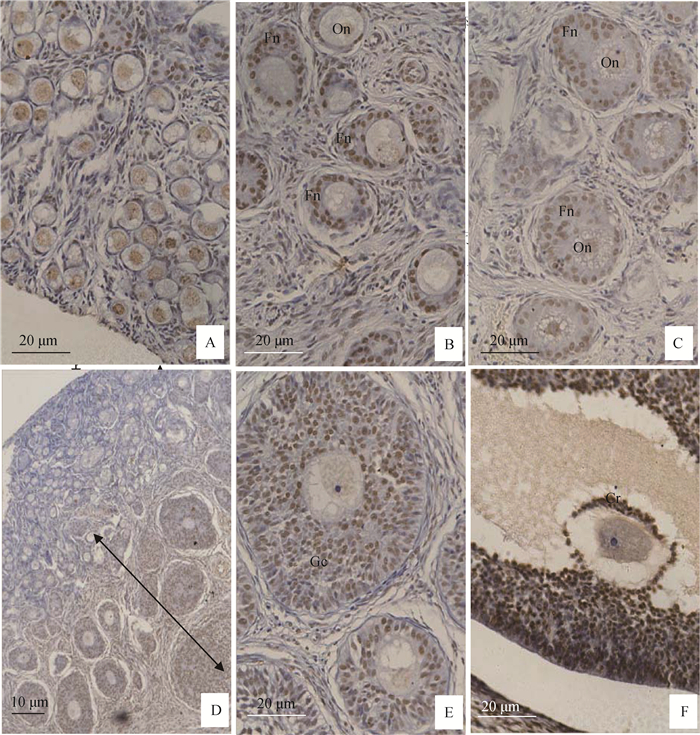
|
A.3 d;B.60 d; C.72 d; D.86 d; E. 95 d; F.165 d。箭头.次级和有腔卵泡出现闭锁;On.卵母细胞核;Fn.卵泡细胞核;Gc.颗粒细胞层;Cr.放射冠细胞 A.The pig ovary of 3 day post partum (dpp); B.The pig ovary of 60 dpp; C.The pig ovary of 72 dpp; D.The pig ovary of 86 dpp; E. The pig ovary of 95 dpp; F.The pig ovary of 165 dpp. Arrowhead area. The secondary follicles and antral follicles appeared atresia; On. Oocytes nucleus; Fn. Follicular nucleus; Gc. Granulosa cell layer; Cr.Corona radiata cell 图 2 猪卵巢组织TUNEL染色结果 Figure 2 The results of TUNEL staining in pig ovaries |
不同日龄猪卵巢组织TUNEL染色的定位情况及着色程度如表 2所示。
|
|
表 2 不同日龄猪卵巢组织TUNEL染色结果 Table 2 TUNEL staining results of pig ovary tissue at different stages |
结合HE以及TUNEL染色结果,对不同日龄猪卵巢中各级卵泡凋亡率进行统计,结果如表 3所示。由表 3可知,随着日龄增大,猪卵巢内原始卵泡和初级卵泡的闭锁率基本呈递增趋势,在卵泡快速生长期,原始卵泡凋亡比例激增,并在95日龄时达到最大(64.3%)。初级卵泡闭锁率随日龄呈递增趋势;有腔卵泡在72日龄出现后,其闭锁率基本保持在50%左右,因近成熟卵泡出现于95日龄,因此只统计了165日龄的闭锁率,约为36.8%。
|
|
表 3 不同日龄猪卵巢组织各级卵泡闭锁率统计结果 Table 3 Statistical results of follicular atresia rate of pig ovary tissue in different stages |
卵泡的生长发育闭锁凋亡遵循一定的规律。W.Ding等[11]发现,在猪交配后的第70~90天,单个卵泡的比例从1.6%增长到74.4%;在交配后第70~90天,是原始卵泡形成的主要阶段,但是从交配后第90天~出生后第1天,原始卵泡的数量开始减少。交配后的第120天时,原始卵泡被激活,随着胎龄的增加,卵原细胞逐渐分化为生长卵泡。同样,在出生后的牛卵巢[12]及雌鹿[13]卵巢中,也发现卵原细胞的比例是随年龄增长而减少的,而生长卵泡的数量逐渐增加。本研究也观察到了相似的结果,随着日龄增大,猪卵巢内卵原细胞数量呈递减趋势,而原始卵泡的数量呈现先增后减的趋势,在60日龄达到最大值。生长卵泡的数量同样呈现先增后减的趋势,在86日龄达到最大值。直到72日龄时卵巢中出现有腔卵泡;至95日龄,卵巢中出现近成熟卵泡。方天等[14]的研究表明,20日龄的猪卵巢中已经出现有腔卵泡,且颗粒层细胞在5层以内,多数初级和有腔卵泡为闭锁卵泡,这与本研究结果不同,可能是由于品种不同所致。
在卵泡发育的整个过程中均存在卵泡闭锁现象[15-18],该过程受多种因素影响和调控,在甾体激素、转移生长因子家族、IGF-1、IGF-BP及抑制素的作用下,会有一个或多个卵泡从被募集的一批卵泡中选择出来,其他未被选择的卵泡将走向闭锁的命运[19]。本研究也发现在各日龄猪卵巢中均存在广泛的卵泡闭锁现象。猪出生时卵巢中约有110万个卵原细胞,但是在卵泡发育的过程中大多数的生殖细胞均会退化,这一过程开始于胎儿期[20]。在胚胎发育时期,凋亡是生殖细胞减少的主要机制,大量的卵原细胞巢状结构解体,颗粒细胞则是在出生后逐渐死亡[21-22]。
在哺乳动物的卵巢中,只有少数卵泡分化成熟,并最终排卵,约70.0%~99.9%的卵泡在发育的不同阶段中发生闭锁而消失[23]。J.L.Tilly[24]的研究证实在鸡的卵泡闭锁过程存在着颗粒细胞凋亡现象。随着胚胎的生长发育,卵原细胞发生有丝分裂和减数分裂,并于减数分裂前期的双线期发生停滞,这时的卵原细胞即初级卵母细胞,若存在梭形颗粒细胞和基膜的包被,则可以形成初级卵泡;若无相应的细胞包被则这些初级卵母细胞即发生凋亡。因此,在初始卵泡的形成过程中,出现了大量的生殖细胞凋亡现象,并导致卵泡的闭锁[25]。在卵原细胞的退化期,大量的卵原细胞闭锁,仅部分卵原细胞进一步发育为原始卵泡,继续生长,而从初级卵泡发育到次级和近成熟卵泡,卵泡在结构和功能上都经历了从募集到选择及优势化的过程,同时还伴随有卵泡的闭锁,以达到卵泡发育的平衡[10]。本研究结果表明,处于卵原细胞增殖期的猪卵巢,可见大量原始卵泡及初级卵泡的闭锁,其闭锁主要源自卵泡卵母细胞的凋亡。在卵泡缓慢生长期,各级生长卵泡均可出现闭锁,初级卵泡的闭锁主要由卵母细胞的凋亡引起,也有部分是同时伴有卵母细胞和卵泡细胞的凋亡;次级卵泡的闭锁则主要以颗粒层细胞的凋亡所致。在卵泡快速生长期,随着卵泡的快速生长,各级卵泡的闭锁也变得更加明显,有腔卵泡的闭锁主要是由颗粒细胞凋亡引起,这与相关文献描述一致。已有研究证实,卵泡闭锁与颗粒细胞的凋亡密切相关:小鼠BRE(Brain and reproductive organ-expressed)基因的缺失使其DNA损伤造成颗粒细胞的凋亡从而诱导卵泡的闭锁;通常BRE基因在卵母细胞和颗粒细胞中表达;由于小鼠卵泡中的BRE基因缺失使其卵泡闭锁程度加深进而影响卵泡的发育[26]。此外,一些信号分子通过信号通路调控颗粒细胞的凋亡和卵泡的闭锁,如FSHR、TGFβ通过诱导特定的microRNA调控卵泡的闭锁[27];有研究显示,颗粒细胞凋亡触发卵泡闭锁,进一步研究发现,miR-26b靶向DNA损伤相关基因ATM调控颗粒细胞凋亡[28]。颗粒细胞发生凋亡的最明显表现是染色质固缩,总是聚集在核膜,边界表现出明显的颗粒块状或是新月形小体[29]。
4 结论本研究结果显示,在72日龄之前的猪卵巢组织中原始卵泡和初级卵泡的卵母细胞核与卵泡细胞核呈现阳性反应,表明卵母细胞与卵泡细胞的凋亡导致早期卵泡的闭锁;在95和165日龄的猪卵巢组织,有腔卵泡的颗粒细胞层及放射冠细胞呈强阳性反应,表明次级卵泡的闭锁主要是颗粒细胞的凋亡所致。而有关卵泡闭锁中涉及的卵母细胞和颗粒细胞凋亡机制尚需进一步研究。
| [1] |
沈霞芬, 卿素珠.
家畜组织学与胚胎学[M]. 5版. 北京: 中国农业出版社, 2015: 218-226.
SHEN X F, QING S Z. Histology and embryology of domestic animal[M]. 5th ed. Beijing: China Agriculture Press, 2015: 218-226. (in Chinese) |
| [2] | EPPIG J J. Oocyte control of ovarian follicular development and function in mammals[J]. Reproduction, 2001, 122(6): 829–838. DOI: 10.1530/rep.0.1220829 |
| [3] |
陈秀萍, 姜勋平. 动物卵巢细胞凋亡及其调控机制[J]. 黑龙江动物繁殖, 2004, 12(3): 13–15, 18.
CHEN X P, JIANG X P. Apoptosis in ovary and its regulation[J]. Heilongjiang Journal of Animal Reproduction, 2004, 12(3): 13–15, 18. (in Chinese) |
| [4] |
成志军, 陶勇, 章孝荣. 胎猪卵巢发生过程中的组织学变化[J]. 细胞生物学杂志, 2008, 30(3): 352–356.
CHENG Z J, TAO Y, ZHANG X R. Histological change during fetal pig ovarigenesis[J]. Chinese Journal of Cell Biology, 2008, 30(3): 352–356. (in Chinese) |
| [5] | BLACK J L, ERICKSON B H. Oogenesis and ovarian development in the prenatal pig[J]. Anat Rec, 1968, 161(1): 45–55. DOI: 10.1002/(ISSN)1097-0185 |
| [6] |
成志军, 陶勇, 徐伟, 等. 早期猪胎儿卵巢的组织学观察[J]. 畜牧兽医学报, 2009, 40(1): 32–37.
CHENG Z J, TAO Y, XU W, et al. Histological observation on ovary of early fetal pig[J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(1): 32–37. (in Chinese) |
| [7] | PELLINIEMI L J. Ultrastructure of the early ovary and testis in pig embryos[J]. Am J Anat, 1975, 144(1): 89–111. DOI: 10.1002/(ISSN)1553-0795 |
| [8] | BIELANSKA-OSUCHOWSKA Z. Oogonia and oocytes degeneration and the nutritive macrophages in the process of the development of the ovary in embryos of the domestic pig (Sus scrofa dom. L.)[J]. Z Anat Entwicklungsgesch, 1973, 142(1): 37–52. DOI: 10.1007/BF00519875 |
| [9] | KIM S H, MIN K S, KIM N H, et al. Differential expression of programmed cell death on the follicular development in normal and miniature pig ovary[J]. PLoS One, 2012, 7(10): e46194. DOI: 10.1371/journal.pone.0046194 |
| [10] | SHENG J, YANG Y E, LIU W, et al. Location of oocyte-specific linker histone in pig ovaries at different developmental stages postpartum[J]. Theriogenology, 2015, 83(7): 1203–1212. DOI: 10.1016/j.theriogenology.2014.12.027 |
| [11] | DING W, ZHANG W, HUI F M, et al. Cell-specific expression and immunolocalization of nitric oxide synthase isoforms and soluble guanylyl cyclase α1 and β1 subunits in the ovary of fetal, neonatal and immature pigs[J]. Anim Reprod Sci, 2012, 131(3-4): 172–180. DOI: 10.1016/j.anireprosci.2012.02.013 |
| [12] | ERICKSON B H. Development and senescence of the postnatal bovine ovary[J]. J Anim Sci, 1966, 25(3): 800–805. DOI: 10.2527/jas1966.253800x |
| [13] | ZHOU Z, WAN Y, ZHANG Y, et al. Follicular development and expression of nuclear respiratory factor-1 and peroxisome proliferator-activated receptor γ coactivator-1 alpha in ovaries of fetal and neonatal doelings[J]. J Anim Sci, 2012, 90(11): 3752–3761. DOI: 10.2527/jas.2011-4971 |
| [14] |
方天, 丁威, 张伟, 等. 猪卵巢发育的组织学观察及磷酸二酯酶3A的表达研究[J]. 南京农业大学学报, 2010, 33(6): 101–104.
FANG T, DING W, ZHANG W, et al. Histological observation and expression patterns of phosphodiesterase 3A in the development of porcine ovaries[J]. Journal of Nanjing Agricultural University, 2010, 33(6): 101–104. (in Chinese) |
| [15] | WEI Q W, SHI F X. Cleavage of poly (ADP-ribose) polymerase-1 is involved in the process of porcine ovarian follicular atresia[J]. Anim Reprod Sci, 2013, 138(3-4): 282–291. DOI: 10.1016/j.anireprosci.2013.02.025 |
| [16] | WEI Q W, DING W, SHI F Z. Roles of poly (ADP-ribose) polymerase (PARP1) cleavage in the ovaries of fetal, neonatal, and adult pigs[J]. Reproduction, 2013, 146(6): 593–602. DOI: 10.1530/REP-13-0174 |
| [17] | LEFÈVRE B. Follicular atresia: Its features as predictive markers for the outcome of assisted reproduction[J]. Gynecol Obstet Fertil, 2011, 39(1): 58–62. DOI: 10.1016/j.gyobfe.2010.11.011 |
| [18] | MATSUDA F, INOUE N, MANABE N, et al. Follicular growth and atresia in mammalian ovaries: Regulation by survival and death of granulosa cells[J]. J Reprod Dev, 2012, 58(1): 44–50. DOI: 10.1262/jrd.2011-012 |
| [19] |
吕落彬. 母猪卵泡闭锁和凋亡的调节[J]. 黑龙江动物繁殖, 2015, 23(3): 15–16.
LÜ L B. Regulation of follicular atresia and apoptosis in sows[J]. Heilongjiang Journal of Animal Reproduction, 2015, 23(3): 15–16. (in Chinese) |
| [20] | SIMPSON R T. Structure of the chromatosome, a chromatin particle containing 160 base pairs of DNA and all the histones[J]. Biochemistry, 1978, 17(25): 5524–5531. DOI: 10.1021/bi00618a030 |
| [21] | GHAFARI F, GUTIERREZ C G, HARTSHORNE G M. Apoptosis in mouse fetal and neonatal oocytes during meiotic prophase one[J]. BMC Dev Biol, 2007, 7: 87. DOI: 10.1186/1471-213X-7-87 |
| [22] | HARTSHORNE G M, LYRAKOU S, HAMODA H, et al. Oogenesis and cell death in human prenatal ovaries: What are the criteria for oocyte selection?[J]. Mol Hum Reprod, 2009, 15(12): 805–819. DOI: 10.1093/molehr/gap055 |
| [23] | VASKⅣUO T E, TAPANAINEN J S. Apoptosis in the human ovary[J]. Reprod Biomed Online, 2003, 6(1): 24–35. DOI: 10.1016/S1472-6483(10)62052-4 |
| [24] | TILLY J L. Apoptosis and ovarian function[J]. Rew Reprod, 1996, 1(3): 162–172. DOI: 10.1530/ror.0.0010162 |
| [25] | KAIPIA A, HSUEH A J W. Regulation of ovarian follicle atresia[J]. Annu Rev Physiol, 1997, 59: 349–363. DOI: 10.1146/annurev.physiol.59.1.349 |
| [26] | YEUNG C K, WANG G, YAO Y, et al. BRE modulates granulosa cell death to affect ovarian follicle development and atresia in the mouse[J]. Cell Death Dis, 2017, 8(3): e2697. DOI: 10.1038/cddis.2017.91 |
| [27] | DU X, ZHANG L F, LI X Y, et al. TGF-β signaling controls FSHR signaling-reduced ovarian granulosa cell apoptosis through the SMAD4/miR-143 axis[J]. Cell Death Dis, 2016, 7(11): e2476. DOI: 10.1038/cddis.2016.379 |
| [28] | LIN F, LI R, PAN Z X, et al. miR-26b promotes granulosa cell apoptosis by targeting ATM during follicular atresia in porcine ovary[J]. PLoS One, 2012, 7(6): e38640. DOI: 10.1371/journal.pone.0038640 |
| [29] |
高嘉敏, 金京顺, 金庆国, 等. 哺乳动物卵巢细胞凋亡的研究进展[J]. 延边大学农学学报, 2014, 36(4): 356–361.
GAO J M, JIN J S, JIN Q G, et al. Research progress on cell apoptosis in mammal ovary[J]. Journal of Agricultural Science Yanbian University, 2014, 36(4): 356–361. (in Chinese) |



