骨骼肌由具有不同收缩与代谢特性的异源性肌纤维组成,这些异源性肌纤维的特异性基因表达模式受到不同程序的调控[1-2]。动物肌纤维的生长发育与肉的产量和质量密切相关,肌纤维类型的差异导致骨骼肌在生理与代谢特征上的差异,进而引起肌肉品质的差异。不同表型骨骼肌其纤维类型组成在胚胎期已开始形成,而主要肌肉群肌纤维类型的基因表达模式在出生后早期已经完全建立[3-5]。已有的研究表明,出生后肌纤维类型的维持和调节主要由神经活性通过特定的信号通路来控制[6]。其中,钙调神经磷酸酶(Calcinerin, CaN或Cn)/NFAT信号通路被认为是动物出生后维持和调节骨骼肌肌纤维类型特异基因表达的重要通路之一。在骨骼肌中,激活后的CaN主要通过活化T细胞核因子(Nuclear factor of activated T Cells, NFAT)和肌细胞增强因子MEF2(Myocyte enhancer factor 2, MEF2)2类转录因子将细胞外信号传递到细胞核内,从而激活慢肌纤维类型特异基因的表达[5, 7]。另外,CaN/NFAT信号通路还被认为在促进肌管增值和肥大、调节骨骼肌生长方面起着重要作用[8]。CaN是目前已知的唯一依赖于Ca2+/钙调素(calmodulin, CaM)的丝氨酸/苏氨酸蛋白磷酸酶,由催化亚基CnA和调节亚基CnB按等比例紧密结合而组成的异源二聚体。CaN的2个亚基均有不同的亚型,但是只有CnAα、CnAβ和CnB1在骨骼肌中表达[9]。S. A. Parsons等[9]研究表明,小鼠不同表型骨骼肌中CnAα含量均显著高于CnAβ。单艳菊等[10]研究发现,鸭发育早期骨骼肌中CnAα与肌纤维类型和肌纤维生长发育密切相关。NFAT家族有5个成员,但只有NFATc1、NFATc2、NFATc3和NFATc4受到CaN调节,其中NFATc3是骨骼肌细胞分化最先被激活的NFAT亚型[11]。脊椎动物中MEF2家族包括MEF2A、MEF2B、MEF2C和MEF2D 4个成员,MEF2C是小鼠骨骼肌和心中最先表达的MEF2转录因子[12],在维持生后骨骼肌慢肌纤维比例以及肌细胞成熟中起着重要作用[13-15]。过氧化物酶体增殖物激活受体γ辅激活因子1(Peroxisome proliferatior-activated receptor-γ coacivator-1 alpha,PPARGC1A)作为核转录的辅助化因子,能够与多种不同转录因子结合,参与多种代谢过程。研究表明,在骨骼肌中PPARGC1A协同CaN的2个底物NFAT和MEF2调控机体肌肉质量和氧化型纤维表型[16-19]。
目前有关CaN/NFAT信号通路在鸡骨骼肌中的研究还很少,因此本研究旨在分析CaN/NFAT信号通路相关基因(CnAα、CnB1、NFATc3、MEF2C和PPARGC1A)在隐性白羽鸡不同表型骨骼肌中发育性表达规律,以及通路中各基因表达之间的关联性,为揭示CaN/NFAT信号通路在鸡骨骼肌生长发育和肌纤维类型形成中的分子机制提供理论依据。
1 材料与方法 1.1 试验时间和地点本试验于2015年3-12月在江苏省家禽科学研究所江苏省家禽遗传育种重点实验室进行。
1.2 试验动物试验鸡品种隐性白羽鸡来源于法国SASSO公司,1999年引进,现保存于江苏省家禽科学研究所国家地方鸡种资源基因库(江苏)。鸡群饲养管理条件一致,全程自由采食与饮水。营养水平:0~6周龄:粗蛋白19.00%、粗脂肪2.35%、粗纤维2.20%、粗灰分4.20%、代谢能11.54 MJ·kg-1、钙0.90%、总磷0.59%、有效磷0.35%;7~9周龄:粗蛋白14.20%、粗脂肪2.10%、粗纤维3.30%、粗灰分5.10%、代谢能11.12 MJ·kg-1、钙0.72%、总磷0.75%、有效磷0.30%。
选择0(初生)、1、3、5、7和9周龄6个时间点,每个时间点采样10只(公母各半),采集同侧腓肠肌和趾长伸肌后置于液氮保存。
1.3 总RNA的提取及反转录参照TRNzol-A+总RNA提取试剂DP421(TIANGEN, 中国北京)说明书提取总RNA,凝胶电泳检测RNA样品质量后,用TGem Plus全波长分光光度计(TIANGEN, 中国北京)测定其浓度,取2 μg总RNA,按照QuantScript RT Kit (KR103-04)(TIANGEN, 中国北京)说明书进行反转录。
1.4 实时荧光定量PCR(Quantitative real-time PCR, qRT-PCR)根据GenBank中相关基因序列设计引物,交由生工生物工程(上海)股份有限公司合成,引物序列见表 1。
|
|
表 1 基因引物序列 Table 1 Primers sequence of the studied genes for qRT-PCR |
在ABI7500型荧光定量PCR仪上采用SYBR Green Ⅰ法进行qRT-PCR,鸡ACTB基因作为内参基因,按照SuperRealPreMixSYBR Green (FP204-01)(TIANGEN, 中国北京)试剂盒推荐的体系,对退火温度、引物浓度和模板稀释倍数等进行优化。20 μL反应体系包括:2×SYBR Green Realtime PCR Master Mix 10 μL,50×ROX Reference Dye 0.4 μL,上下游引物(10 μmol·L-1)各0.4 μL,10倍稀释的cDNA模板1 μL,加ddH2O 7.8 μL。反应条件:95 ℃ 20 s,60℃ 20 s,72℃ 20 s,共40个循环。每个样品做3管平行试验,每次反应均使用纯水替代模板的阴性对照。
1.5 统计分析将隐性白羽鸡0周龄腓肠肌外侧头设为对照组,用2-ΔΔCt法[20]计算相对表达量。运用SPSS16.0软件ANOVA统计分析,其中用Univariate分析表达量在性别、日龄间的总体差异,用Least significant difference (LSD) Test确定同一种肌肉表型不同周龄间或者同一周龄不同表型肌肉间的表达差异显著性,用Bivariate Correlation来分析基因表达量之间的相关性,所有数据以“平均值±标准误”表示。
2 结果 2.1 CaN/NFAT信号通路相关基因mRNA在不同表型肌肉中的发育性表达多因素方差分析结果发现,CnAα、CnB1、NFATc3、MEF2C和PPARGC1A基因mRNA在隐性白羽鸡2种表型肌肉不同周龄的表达量在性别间的差异均不显著(腓肠肌外侧头:FCnAα=1.263,P>0.05;FCnB1=2.002,P>0.05; FNFATc3=0,P>0.05; FMEF2C=0.228,P>0.05; FPPARGC1A=0.942,P>0.05;趾长伸肌:FCnAα=0.117,P>0.05;FCnB1=0.37,P>0.05; FNFATc3=1.006,P>0.05; FMEF2C=0.058,P>0.05; FPPARGC1A=0.103,P>0.05),因此将公母联合在一起进行表达量差异分析。
2.1.1 CnAα基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达CnAα基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达结果见图 1A。从0到9周龄,总体上CnAα mRNA在2种肌肉表型肌肉中呈“先上升后下降再上升”的趋势,腓肠肌外侧头CnAα mRNA表达在0周龄时最低,1周龄显著上升(P < 0.05),并维持在相对稳定水平,至7周龄时下降至较低水平后又显著上升,9周龄时达到最高表达量,显著高于0、1和7周龄(P < 0.05);趾长伸肌CnAα mRNA表达在0周龄时相对较低,1周龄时急剧上升至最高水平,显著高于其他各周龄(P < 0.05),3周龄时又显著下降,至5周龄下降至最低水平,表达量显著低于其他各周龄(P < 0.05),7周龄再次显著上升(P < 0.05),9周龄继续上升到较高水平。2种表型肌肉相比,在0、1、7和9周龄时,腓肠肌外侧头CnAα mRNA表达低于趾长伸肌,且在1周龄时达极显著水平(P < 0.01);在3和5周龄时,腓肠肌外侧头CnAα mRNA表达则高于趾长伸肌,且在5周龄时达极显著水平(P < 0.01)。
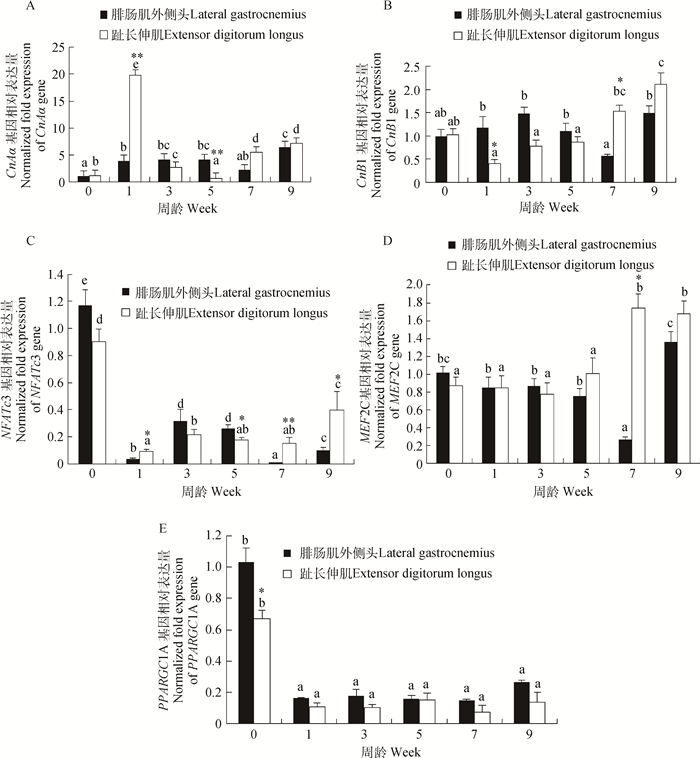
|
不同小写字母表示同一表型肌肉不同周龄间差异显著(P<0.05);*表示同一周龄不同表型肌肉间差异显著(P<0.05),**表示同一周龄不同表型肌肉间差异极显著(P<0.01) Different lowercase letters indicate that the expression in the same phenotype muscle is significantly different among different week ages (P < 0.05); * indicates the expression is significantly different between phenotypically distinct muscles at the same week age (P < 0.05), ** indicates the expression is extremely significantly different between phenotypically distinct muscles at the same week age (P < 0.01) 图 1 CaN/NFAT信号通路相关基因在隐性白羽鸡2种不同表型肌肉中的表达 Figure 1 Expression of CaN/NFAT-dependent pathway genes in 2 phenotypically distinct muscles in Recessive White chicken |
CnB1基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达结果见图 1B。从0到9周龄,CnB1 mRNA在2种表型肌肉中的表达趋势并不一致,腓肠肌外侧头CnB1 mRNA表达在0周龄时相对较低,然后逐渐上升,至5周龄时开始逐渐下降,7周龄时降至最低水平,9周龄时又显著上升到最高水平(P < 0.05);趾长伸肌CnB1 mRNA表达呈现先下降后上升的趋势,1周龄时表达水平最低,9周龄时表达水平最高。2种表型肌肉相比,在0、7和9周龄时,腓肠肌外侧头CnB1 mRNA表达低于趾长伸肌,且在7周龄时达显著水平(P < 0.05);在1、3和5周龄时,腓肠肌外侧头CnB1 mRNA表达则高于趾长伸肌,且在1周龄时达显著水平(P < 0.05)。
2.1.3 NFATc3基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达NFATc3基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达结果见图 1C。2种表型肌肉中NFATc3 mRNA表达趋势相似,呈现“波浪形”,即均是在0周龄时表达最高,显著高于其他周龄(P < 0.05),然后显著下降并维持在相对较低的水平,腓肠肌外侧头NFATc3 mRNA表达在7周龄时最低,趾长伸肌NFATc3 mRNA表达在1周龄时表达最低。2种表型肌肉相比,在1、7和9周龄时,腓肠肌外侧头NFATc3 mRNA表达低于趾长伸肌,且在1和9周龄时差异呈显著水平(P < 0.05),在7周龄时差异呈极显著水平(P < 0.01);而在0、3和5周龄时,腓肠肌外侧头NFATc3 mRNA表达则高于趾长伸肌,且在5周龄时差异呈显著水平(P < 0.05)。
2.1.4 MEF2C基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达MEF2C基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达结果见图 1D。从0到9周龄,2种表型肌肉中MEF2C mRNA表达总体上呈“先下降后上升”的趋势,腓肠肌外侧头MEF2C mRNA表达在0周龄时相对较高,1周龄时开始下降,至7周龄时下降至最低水平,显著低于其他各周龄(P < 0.05),9周龄时快速上升至最高水平,显著高于1、3、5和7周龄(P < 0.05);趾长伸肌MEF2C mRNA表达在0周龄时相对较低,1周龄时开始下降,至3周龄时下降至最低水平后,5周龄开始上升,7周龄时上升至最高水平后,9周龄略有下降,但仍保持较高水平,显著高于0、1、3和5周龄(P < 0.05)。2种表型肌肉相比,在0、1和3周龄时,腓肠肌外侧头MEF2C mRNA表达高于趾长伸肌,但差异不显著(P>0.05);而在5、7和9周龄时,腓肠肌外侧头MEF2C mRNA表达则低于趾长伸肌,且在7周龄时差异呈显著水平(P < 0.05)。
2.1.5 PPARGC1A基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达PPARGC1A基因mRNA在隐性白羽鸡腓肠肌外侧头和趾长伸肌中的发育性表达结果见图 1E。0~9周龄,2种表型肌肉中PPARGC1A mRNA表达趋势比较一致,即均在0周龄时最高,显著高于其他各周龄(P < 0.05),1周龄时开始下降,随后维持在相对较低的表达水平,至9周龄时略有上升,但与1、3、5和7周龄间相差不显著(P>0.05)。2种表型肌肉相比,腓肠肌外侧头PPARGC1A mRNA表达在各周龄时均高于趾长伸肌,且在0周龄时差异呈显著水平(P < 0.05)。
2.2 CaN/NFAT通路相关基因表达的协同关系隐性白羽鸡腓肠肌外侧头和趾长伸肌中CnAα、CnB1、NFATc3、MEF2C及PPARGC1A基因表达的关联分析结果见表 2和表 3。由表 2和表 3可知,2种表型肌肉中除CnAα与NFATc3基因的表达以及CnAα与PPARGC1A基因的表达呈负相关外,其余各基因表达之间均呈正相关,且2种表型肌肉中NFATc3与PPARGC1A基因的表达以及CnB1与MEF2C基因的表达均呈极显著正相关(P < 0.01)。另外,在腓肠肌外侧头中,CnAα与NFATc3以及PPARGC1A基因的表达呈显著负相关(P < 0.05),与CnB1基因的表达呈显著正相关(P < 0.05),与MEF2C基因的表达呈极显著正相关(P < 0.01)。在趾长伸肌中,CnB1与NFATc3及PPARGC1A基因的表达均呈显著正相关(P < 0.05)。
|
|
表 2 腓肠肌外侧头中CaN/NFAT信号通路相关基因表达的关联性 Table 2 Correlation of CaN/NFAT-dependent pathway genes expression in extensor digitorum longus |
|
|
表 3 趾长伸肌中CaN/NFAT信号通路相关基因表达的关联性 Table 3 Correlation of CaN/NFAT-dependent pathway genes expression in lateral gastrocnemius |
动物出生后肌肉的发育不仅包括肌纤维肥大,还伴随着肌纤维类型转换。出生后早期是肌纤维类型转换的重要阶段[21-22]。已有的研究表明,CaN/NFAT信号通路在哺乳动物出生后骨骼肌中起着维持和调节肌肉表型、促进不同类型肌纤维生长、维持肌肉质量的作用[23-25]。但目前对于CaN/NFAT信号通路的作用方式还存在争议。U.Dellling等[11]研究发现,NFATc3是成肌细胞分化时Cn最先激活的底物,但NFATc3却没有促进慢肌纤维肌球蛋白重链的表达,推测Cn通过NFATc3促进成肌细胞分化,但通过其他因子促进慢肌纤维肌球蛋白重链的表达。S.A.Parsons等[9]也通过Cn转基因小鼠表明,Cn通过非依赖于NFAT的机制调节肌纤维类型转换。D.L.Allen等[26]发现,在快型肌纤维MHCⅡa、Ⅱx和Ⅱb的启动子区域存在多种NFAT结合位点,且超表达CaN可以活化这些快肌纤维基因。但E.Calabria等[4]最新研究表明,Cn通过激活不同NFAT亚型,从而促进不同类型肌纤维肌球蛋白重链基因的表达。
J.T.Shu等[27]研究发现,IGF-I-CaN-NFAT信号通路在鸭早期骨骼肌纤维类型转换中可能发挥着调控作用。目前有关Cn信号通路在鸡骨骼肌中的研究还很少。本研究发现,CaN/NFAT信号通路相关基因CnAα、CnB1、NFATc3、MEF2C和PPARGC1A mRNA在出生后早期隐性白羽鸡腓肠肌外侧头(混合型肌肉)和趾长伸肌(快肌)中的发育表达模式具有年龄和表型特异性,但不存在性别特异性。除CnB1基因外,其他4个基因mRNA在2种表型骨骼肌中表达趋势均较相似。NFATc3和PPARGC1A基因mRNA在2种表型骨骼肌中均在0周龄时最高,显著高于其他周龄(P < 0.05);CnA mRNA在趾长伸肌1周龄时出现了急速上升,显著高于其他各周龄(P < 0.05);这可能与出雏后早期肌纤维类型发生转换有关。2种表型骨骼肌中5个基因mRNA的表达从7到9周龄均呈上升趋势,这可能与CaN/NFAT信号通路在肌纤维发育后期主要起促进肌纤维肥大有关。另外,本研究发现,同周龄2种表型肌肉相比,除腓肠肌外侧头PPARGC1A基因各周龄表达均高于趾长伸肌外,其他4个基因表达均是在3周龄时腓肠肌外侧头高于趾长伸肌,而在7和9周龄时低于趾长伸肌;这可能与CaN/NFAT信号通路根据肌肉表型和生长阶段,调节肌纤维生长发育有关[28-31]。
CaN在肌肉中的活性不仅与其催化亚单位CnA有关,还与其调节亚单位CnB有关[27]。本研究对隐性白羽鸡2种表型骨骼肌中CnAα、CnB1、NFATc3、MEF2C及PPARGC1A基因表达的关联分析结果发现,虽然2种表型骨骼肌中除CaN的催化亚单位CnAα基因的表达与其作用底物NFATc3基因的表达以及协同因子PPARGC1A基因的表达呈负相关,但其余各基因表达之间均呈正相关,初步揭示了这些基因间的共表达调控关系。
4 结论本试验研究了CaN/NFAT信号通路5个基因在鸡不同表型肌肉早期发育中的表达规律,发现5个基因mRNA的表达存在着共性,存在着发育时段和部位的差异,但尚未表现出性别差异,且5个基因之间存在着协同表达关系,提示CaN/NFAT信号通路可能参与调控了鸡骨骼肌肌纤维的生长和类型转换。
| [1] |
占思远, 李利, 王林杰, 等. 骨骼肌发育调控相关lncRNAs研究进展[J]. 畜牧兽医学报, 2016, 47(4): 637–644.
ZHAN S Y, LI L, WANG L J, et al. Research progress of long noncoding RNAs in the regulation of skeletal muscle development[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 637–644. (in Chinese) |
| [2] | SCHIAFFINO S, REGGIANI C. Molecular diversity of myofibrillar proteins: gene regulation and functional significance[J]. Physiol Rev, 1996, 76(2): 371–423. |
| [3] | GARRY D J, BASSEL-DUBY R S, RICHARDSON J A, et al. Postnatal development and plasticity of specialized muscle fiber characteristics in the hindlimb[J]. Dev Genet, 1996, 19(2): 146–156. DOI: 10.1002/(ISSN)1520-6408 |
| [4] | CALABRIA E, CICILIOT S, MORETTI I, et al. NFAT isoforms control activity-dependent muscle fiber type specification[J]. Proc Natl Acad Sci U S A, 2009, 106(32): 13335–13340. DOI: 10.1073/pnas.0812911106 |
| [5] | WU H, NAVA F J, MCKINSEY T A, et al. MEF2 responds to multiple calcium-regulated signals in the control of skeletal muscle fiber type[J]. EMBO J, 2000, 19(9): 1963–1973. DOI: 10.1093/emboj/19.9.1963 |
| [6] | SCHIAFFINO S, SANDRI M, MURGIA M. Activity-dependent signaling pathways controlling muscle diversity and plasticity[J]. Physiology (Bethesda), 2007, 22(4): 269–278. DOI: 10.1152/physiol.00009.2007 |
| [7] | CHIN E R, OLSON E N, RICHARDSON J A, et al. A calcineurin-dependent transcriptional pathway controls skeletal muscle fiber type[J]. Genes Dev, 1998, 12(16): 2499–2509. DOI: 10.1101/gad.12.16.2499 |
| [8] | HUDSON M B, PRICE S R. Calcineurin: a poorly understood regulator of muscle mass[J]. Int J Biochem Cell Biol, 2013, 45(10): 2173–2178. DOI: 10.1016/j.biocel.2013.06.029 |
| [9] | PARSONS S A, WILKINS B J, BUENO O F, et al. Altered skeletal muscle phenotypes in calcineurin Aα and Aβ gene-targeted mice[J]. Mol Cell Biol, 2003, 23(12): 4331–4343. DOI: 10.1128/MCB.23.12.4331-4343.2003 |
| [10] |
单艳菊, 宋迟, 束婧婷, 等. 钙调磷酸酶催化亚基A基因(PPP3CA)在不同品种鸭发育早期肌肉中的表达及其与肌纤维特性的相关性[J]. 农业生物技术学报, 2015, 23(2): 236–243.
SHAN Y J, SONG C, SHU J T, et al. Expression profile of protein phosphatase 3 catalytic A Gene(PPP3CA) mRNA in muscles of two duck breeds (Anas platyrhynchos domestica) and its relationship with myofiber traits during early development[J]. Journal of Agricultural Biotechnology, 2015, 23(2): 236–243. (in Chinese) |
| [11] | DELLING U, TURECKOVA J, LIM H W, et al. A calcineurin-NFATc3-dependent pathway regulates skeletal muscle differentiation and slow myosin heavy-chain expression[J]. Mol Cell Biol, 2000, 20(17): 6600–6611. DOI: 10.1128/MCB.20.17.6600-6611.2000 |
| [12] | EDMONDSON D G, LYONS G E, MARTIN J F, et al. Mef2 gene expression marks the cardiac and skeletal muscle lineages during mouse embryogenesis[J]. Development, 1994, 120(5): 1251–1263. |
| [13] | POTTHOFF M J, WU H, ARNOLD M A, et al. Histone deacetylase degradation and MEF2 activation promote the formation of slow-twitch myofibers[J]. J Clin Invest, 2007, 117(9): 2459–2467. DOI: 10.1172/JCI31960 |
| [14] | POTTHOFF M J, ARNOLD M A, MCANALLY J, et al. Regulation of skeletal muscle sarcomere integrity and postnatal muscle function by Mef2c[J]. Mol Cell Biol, 2007, 27(23): 8143–8151. DOI: 10.1128/MCB.01187-07 |
| [15] | ANDERSON C M, HU J X, BARNES R M, et al. Myocyte enhancer factor 2C function in skeletal muscle is required for normal growth and glucose metabolism in mice[J]. Skelet Muscle, 2015, 5: 7. DOI: 10.1186/s13395-015-0031-0 |
| [16] | ROBERTS-WILSON T K, REDDY R N, BAILEY J L, et al. Calcineurin signaling and PGC-1α expression are suppressed during muscle atrophy due to diabetes[J]. Biochim Biophys Acta, 2010, 1803(8): 960–967. DOI: 10.1016/j.bbamcr.2010.03.019 |
| [17] | BASSEL-DUBY R, OLSON E. Signaling pathways in skeletal muscle remodeling[J]. Annu Rev Biochem, 2006, 75: 19–37. DOI: 10.1146/annurev.biochem.75.103004.142622 |
| [18] | LIN J D, WU H, TARR P T, et al. Transcriptional co-activator PGC-1α drives the formation of slow-twitch muscle fibres[J]. Nature, 2002, 418(6899): 797–801. DOI: 10.1038/nature00904 |
| [19] | SHU J T, XU W J, ZHANG M, et al. Transcriptional co-activator PGC-1α gene is associated with chicken skeletal muscle fiber types[J]. Genet Mol Res, 2014, 13(1): 895–905. DOI: 10.4238/2014.February.14.19 |
| [20] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [21] | EIZEMA K, VAN DER WAL D E, VAN DER BURG M M, et al. Differential expression of calcineurin and SR Ca2+ handling proteins in equine muscle fibers during early postnatal growth[J]. J Histochem Cytochem, 2007, 55(3): 247–254. DOI: 10.1369/jhc.6A7039.2006 |
| [22] |
李玥, 袁丽霞, 杨晓静, 等. 早期和后期限饲对肉鸡腓肠肌肌纤维类型和生长轴相关基因表达的影响[J]. 动物学报, 2006, 52(6): 1133–1141.
LI Y, YUAN L X, YANG X J, et al. Effects of early and late feed restriction on myofiber types and expression of growth-related genes in gastrocnemius of broiler chickens[J]. Acta Zoologica Sinica, 2006, 52(6): 1133–1141. (in Chinese) |
| [23] | OH M, RYBKIN I I, COPELAND V, et al. Calcineurin is necessary for the maintenance but not embryonic development of slow muscle fibers[J]. Mol Cell Biol, 2005, 25(15): 6629–6638. DOI: 10.1128/MCB.25.15.6629-6638.2005 |
| [24] | MITCHELL P O, MILLS S T, PAVLATH G K. Calcineurin differentially regulates maintenance and growth of phenotypically distinct muscles[J]. Am J Physiol Cell Physiol, 2002, 282(5): C984–C992. DOI: 10.1152/ajpcell.00483.2001 |
| [25] | LOMONOSOVA Y N, TURTIKOVA O V, SHENKMAN B S. Erratum to: reduced expression of MyHC slow isoform in rat soleus during unloading is accompanied by alterations of endogenous inhibitors of calcineurin/NFAT signaling pathway[J]. J Muscle Res Cell Motil, 2016, 37(1-2): 53. DOI: 10.1007/s10974-015-9435-z |
| [26] | ALLEN D L, SARTORIUS C A, SYCURO L K, et al. Different pathways regulate expression of the skeletal myosin heavy chain genes[J]. J Biol Chem, 2001, 276(47): 43524–43533. DOI: 10.1074/jbc.M108017200 |
| [27] | SHU J T, LI H F, SHAN Y J, et al. Expression profile of IGF-I-calcineurin-NFATc3-dependent pathway genes in skeletal muscle during early development between duck breeds differing in growth rates[J]. Dev Genes Evol, 2015, 225(3): 139–148. DOI: 10.1007/s00427-015-0501-8 |
| [28] | WAN L, MA J S, XU G Y, et al. Molecular cloning, structural analysis and tissue expression of protein phosphatase 3 catalytic subunit alpha isoform (ppp3ca) gene in Tianfu goat muscle[J]. Int J Mol Sci, 2014, 15(2): 2346–2358. DOI: 10.3390/ijms15022346 |
| [29] | SCHULZ R A, YUTZEY K E. Calcineurin signaling and NFAT activation in cardiovascular and skeletal muscle development[J]. Dev Biol, 2004, 266(1): 1–16. DOI: 10.1016/j.ydbio.2003.10.008 |
| [30] | SAKUMA K, YAMAGUCHI A. The functional role of calcineurin in hypertrophy, regeneration, and disorders of skeletal muscle[J]. J Biomed Biot, 2010, 2010: 721219. |
| [31] | LIU J, LIANG X J, GAN Z J. Transcriptional regulatory circuits controlling muscle fiber type)switching[J]. Sci China Life Sci, 2015, 58(4): 321–327. DOI: 10.1007/s11427-015-4833-4 |



