2. 陕西师范大学 生命科学院, 陕西 西安 710062;
1. 长安大学, 陕西 西安 710064
2. College of Life Sciense, Shaanxi Normal University, Xi′an 710062, China;
1. Chang′An University, Xi′an 710064, China
细胞水平上的电磁波(场)生物学效应研究, 一直是生物电磁学研究的热点问题之一, 这是因为电磁场能调控细胞的许多功能[1-7], 如细胞生长、附着、细胞骨架的重组、增殖、胞内通道的激活、蛋白分泌和基因表达等。这些效应, 从原初条件看, 是因为静息状态下的细胞, 外加电磁场的作用, 在细胞膜上产生一个附加电位, 使膜两侧的离子浓度发生漂移, 从而引起细胞的电磁场生物学效应[8-9]。
研究发现:电磁波影响细胞膜的跨膜电位[10-18], 定态电磁场影响细胞膜两侧离子浓度[8-9, 18], 一定条件的脉冲电场能引起跨膜电位的变化[19], 产生电穿孔现象[20-21]。实验也发现:脉冲磁场作用于神经元细胞, 能引起离子通道以及神经元动作电位变化, 基于Hodgkin-Huxley模型的仿真研究也支持实验结果[22]。但脉冲波对细胞膜两侧离子浓度影响的规律有待研究。基于此, 本文在提出电磁场与生物组织相互作用物理模型的基础上, 给出了脉冲波(以矩形脉冲电场为例)作用下的细胞膜内、外离子跨膜迁移量的计算方法, 并进行了数值分析。
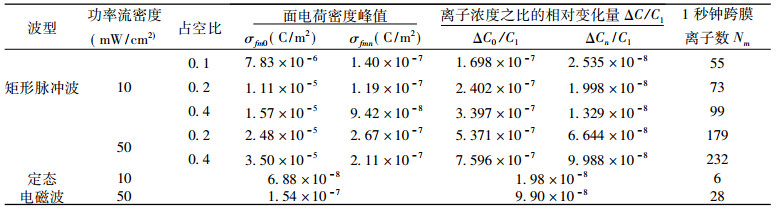
1 单细胞物理模型该文采用的物理模型如图 1, 该模型由4种媒质组成:空气(电磁参数接近真空), 细胞外液和细胞膜及细胞内液。设电场强度为E0的平面电磁波由空气垂直入射到细胞外液表面, 假设细胞外液中的电场强度为E1, 在电场强度E1作用下, 细胞膜内、外产生附加电位差(电压)ΔV, 该电压叠加在细胞膜的静息膜电位V0上。图 1中ε0为空气介电常数(电导率σ=0), ε1′和σ1分别为细胞外液的介电常数和电导率, ε2′和σ2为细胞膜的介电常数和电导率, 假设所有介质磁导率均与真空相同, 即μ=μ0。
|
图 1 电磁场与细胞相互作用模型 Fig. 1 A electromagnetic field-cell interaction model |
从生物物理学角度看, 生物组织可视为电磁媒质。正常情况下, 细胞膜内、外维持有一定的静息电位, 形成势垒。当外加电磁场作用于生物体时, 在细胞膜上产生附加电压, 使势垒发生变化, 变化的势垒影响离子对膜的通透性, 从而使膜两侧离子的平衡浓度发生漂移, 引起细胞生命状态的变化, 产生生物学效应[8-9]。
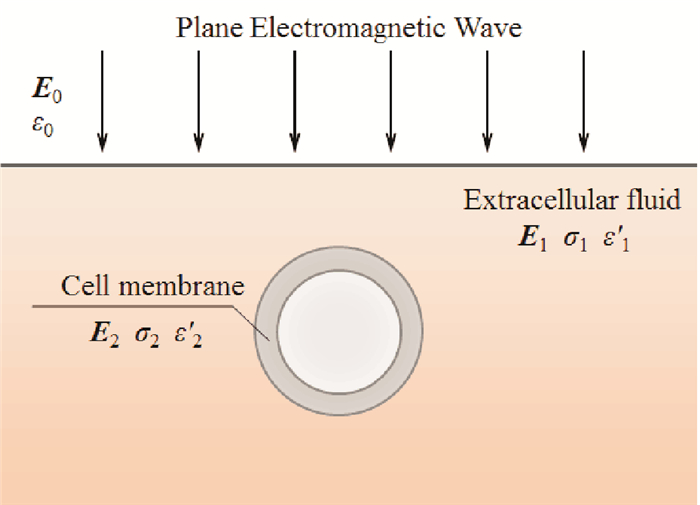
2.1 定态电磁波对离子跨膜迁移量的影响设外加平面电磁波角频率为ω, 外场在细胞膜内、外产生附加电压的峰值为Vm, 则加在膜两侧的电压为
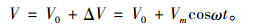
|
(1) |
由能斯托公式和玻尔兹曼公式, 电磁场作用前、后细胞膜内、外两侧的离子浓度比可表示为式(2),(3)[9-10]:
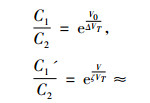
|
(2) |
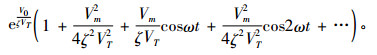
|
(3) |
式中, C1,C1′(mol/L)分别为外场作用前、后细胞膜外离子浓度,C2(mol/L)为细胞膜内离子浓度, ζ为考虑外加电磁场与细胞膜结构中的双脂层内带电粒子相互作用而引入的修正因子, VT为以电压形式表述的粒子的热运动能。考虑到讨论周期性变化事件时有意义的量是平均值, 则相对于无外场作用, 外电场引起的细胞膜外离子浓度相对变化量为
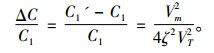
|
(4) |
Vm求解的步骤:
1) 由空气中电磁场的功率流密度P0求出空气中电场强度振幅值|E0|;
2) 由空气和细胞外介质的透射系数求出透射入皮肤表面处的电磁波电场振幅|E1|;
3) 计算波在细胞外介质中传播一段距离d而达到细胞膜表面时的振幅|E1(d)|;
4) 计算外加电磁波在细胞膜内产生的附加电压的振幅Vm。
由电磁理论, 求得细胞膜跨膜电位峰值为
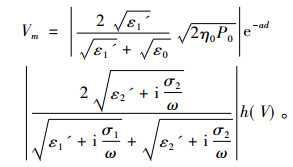
|
(5) |
式中, P0为从自由空间(空气)入射的定态电磁波的功率流密度, η0为空气波阻抗, α=ω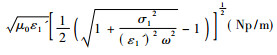
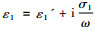
外加电磁波在细胞膜表面引起的面电荷密度幅值为
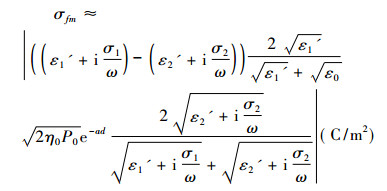
|
(6) |
由墨鱼神经干实测的静态伏安特性拟合曲线[23]可知, ζVT取值为5.2mV。当加在细胞膜的总电压为V时, 1秒钟流过细胞膜的二价离子数目平均值Nm为
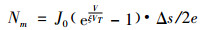
|
(7) |
其中, J0=0.09mA/cm2, Δs为细胞膜表面积(一般取Δs=10-6cm2), e为电子电荷量。
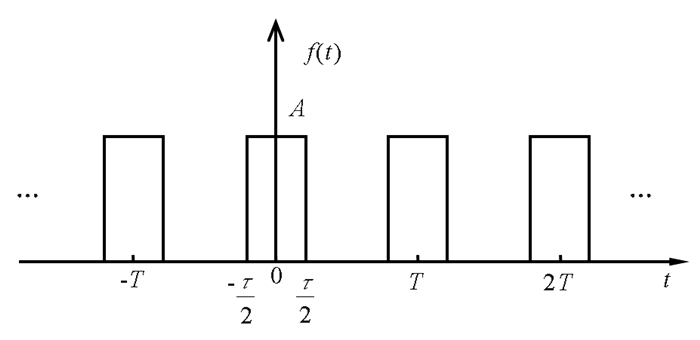
2.2 矩形脉冲波对细胞膜内、外离子浓度影响 2.2.1 矩形脉冲波的傅里叶展开如图 2, 假设照射生物体的矩形脉冲波幅度为A, 脉冲宽度为τ, 其重复周期为T, 该脉冲波表示为
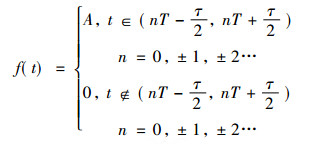
|
(8) |
|
图 2 矩形脉冲波 Fig. 2 A rectangular pulse wave |
若从空气入射到皮肤上的矩形脉冲波功率流密度为P0, 则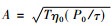
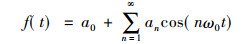
|
(9) |
其中, 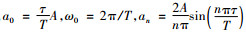
脉冲波作用下的细胞膜两侧电压为
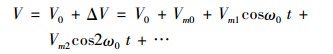
|
(10) |
其中, V0为细胞静息膜电位, Vm0是式(9)中a0在细胞膜两侧引起的电压幅值, Vm1,Vm2,…是频率分别为ω0,2ω0,…的定态电磁波在细胞膜两侧引起的电压幅值。则脉冲波在膜两侧引起的离子浓度之比相对变化量为
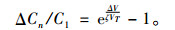
|
(11) |
取式(11)平均值, 则相对于无外场作用, 脉冲波引起的细胞膜外离子浓度相对变化量为
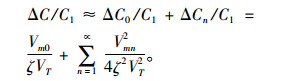
|
(12) |
其中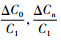
设从真空入射到细胞外液(用皮肤电常数描述)表面的单色平面电磁波的频率为108Hz, 入射功率流密度为P0=10mW/cm2(即100W/m2)。在该频率下, 皮肤的相对介电常数、电导率分别为εr1=69.449和σ1=0.510 2S/m(皮肤的电参数取干皮肤和湿皮肤电参数的平均值), 位于皮肤表面d=0.001m处细胞的相对介电常数和电导率分别取εr2=6.074 1和σ2=0.0362 9 S/m(为数值分析方便, 用脂肪电参数代替细胞膜电参数)。由前面讨论可得, 外加电磁场在细胞膜表面引起的面电荷密度σfm=6.88×10-8C/m2, 膜两侧离子浓度之比相对变化量ΔC/C1为1.98×10-9, 1秒钟跨膜离子数Nm为6个。表 1也给出了频率为108Hz,P0=50mW/cm2单色波引起的σfm,ΔC/C1和Nm值, 结果显示在频率一定情况下, P0越大, 则这些物理量的值也大。
|
|
表 1 电磁波引起的细胞膜表面离子浓度变化 Tab. 1 The ion concentration change of the cell membrane surface caused by electromagnetic wave |
取入射功率流密度为10mW/cm2、重复频率为108Hz的矩形脉冲波, 讨论在占空比(τ/T)分别为0.1,0.2和0.4时, 脉冲波对离子跨膜迁移的影响。通过计算, 对于占空比分别为0.1,0.2和0.4脉冲波, 直到第20次谐波的平均功率与矩形脉冲波的平均功率之比分别为94.99%,97.48%和98.73%, 所以, 在后面的数值讨论中, 取脉冲波为傅里叶级数中的直流分量和直到第20次谐波的定态电磁波的叠加。
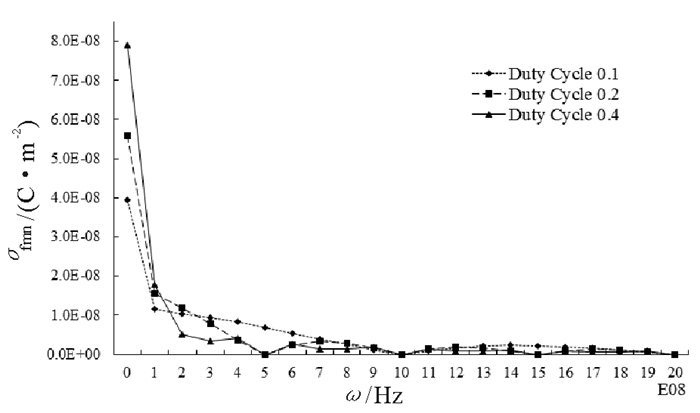
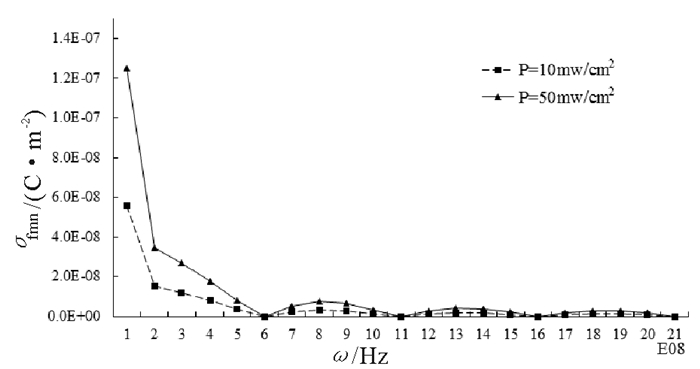
图 3给出了占空比分别为0.1,0.2和0.4, 入射平均功率流密度为10mW/cm2脉冲波对应各次谐波对皮肤下d=0.001m处的细胞作用时, 在细胞膜表面引起的面电荷密度的峰值随谐波频率变化关系图, 其中谐振频率1,2,3,…,20×108Hz分别为各次谐波对应的频率。图 4给出了占空比为0.2, 入射功率流密度分别为10mW/cm2、50mW/cm2的脉冲波作用引起的细胞膜面电荷密度的峰值随谐波频率变化关系图。在表 1中, 也给出了在不同参数的单色波和脉冲波作用下, 在细胞膜表面引起的附加面电荷密度的峰值σfm、细胞膜内、外离子浓度变化量之比的相对变化量ΔC/C1和1秒钟内穿过细胞膜的二价离子数目平均值Nm, 其中σfm0,σfmn, ΔC0/C1,ΔCn/C1分别为由脉冲波中的直流分量和谐波引起的细胞膜表面面电荷密度和离子浓度相对变化量。
|
图 3 膜表面电荷密度峰值随谐波频率变化图 Fig. 3 The peak value change curve of the cell-surface charge density vs. the harmonic wave frequency |
|
图 4 膜表面电荷密度峰值随谐波变化频率图 Fig. 4 The peak value change curve of the cell-surface charge density vs. the harmonic wave frequency |
图 3和表 1显示, 相同入射功率流密度, 不同占空比作用下的生物细胞, 占空比越大, 引起细胞膜表面总的面电荷密度σfm越大, 膜内、外离子浓度变化量之比的相对变化量ΔC/C1和跨膜离子的数目Nm也越大, 同时, 占空比越大, 脉冲中直流分量引起的σfm0和ΔC0/C1越大, σfmn和ΔCn/C1越小; 图 4和表 1也表明, 在占空比相同情况下, 入射功率越大, 引起的σfm,ΔC/C1和Nm也越大。
3.3 讨论一般细胞静息膜电位在-10mV~100mV之间, 设讨论的细胞静息膜电位为-50mV, 取ζVT为5.2mV, 则细胞膜内、外离子浓度比值为1.499×104, 正常细胞膜内外离子浓度比也在这个数量级上。考虑细胞膜去极化时所需的最小电位变化值取1mV, 则静息细胞膜表面固有电荷密度ρs0为1.973×10-4C/m2, 去极化时对应的面电荷密度的变化值Δρs0为3.94×10-6C/m2。将无电磁场作用与定态电磁波作用下离子跨膜迁移比较可知频率为108Hz, P0为10mW/cm2电磁波在细胞膜表面产生的附加面电荷密度峰值σfm约为细胞膜去极化时电荷密度变化值Δρs0的1.7%, 约为静息细胞膜表面固有面电荷密度ρs0的万分之3.4。
比较表 1中脉冲波和定态电磁波对离子跨膜迁移量影响, 可以看出, 入射功率流密度分别为10mW/cm2,50mW/cm2, 不同占空比的脉冲波, 引起的面电荷密度峰值约为10-5C/m2量级, 而连续波为10-8~10-7C/m2量级, 二者相差约102量级; 脉冲波引起的膜内、外离子浓度之比的相对变化量高出单色波约10倍; 而1秒内跨膜迁移的二阶离子数目脉冲波比定态电磁波高出约10倍。由此可以说, 脉冲波引起的电磁场生物学效应比相同入射功率流密度的定态电磁波更明显; 同时在表 1中也可以看出, 脉冲波引起的面电荷密度峰值σfm0远大于σfmn,ΔC0/C1比ΔCn/C1大10倍左右, 可以说脉冲波引起的生物学效应主要是由其直流分量引起的。
无外加电磁场作用下的生物系统, 细胞膜两侧有确定的静息膜电位, 稳定的膜内外离子浓度比。前述参数的定态电磁波和脉冲波作用下的生物系统, 引起膜表面电荷密度的变化及跨膜迁移离子数的变化。所以, 本文理论和数值计算结果将有助于电磁场生物学效应的机理研究向前推进。
4 结论本文从生物物理学角度, 利用电磁场理论分析并数值讨论了矩形脉冲波在细胞膜上引起膜表面面电荷密度、离子跨膜迁移量变化。结果表明:相同功率流密度矩形脉冲波要比定态电磁波在细胞膜表面引起更多的电荷堆积, 更多的离子跨膜迁移量, 表现出更明显的生物学效应; 同时, 结果也显示脉冲波引起的电磁场生物学效应主要是由脉冲波的直流分量引起。
本文电磁场与生物体相互作用的研究方法、结果, 可作为电磁场生物学效应机理研究的基础理论。
| [1] |
RADISIC M, PARK H, SHING H, et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds[J]. Proc Natl Acad Sci, 2004, 101: 18129-18134. DOI:10.1073/pnas.0407817101 |
| [2] |
TITUSHKIN I, CHO M. Regulation of cell cytoskeleton and membrane mechanics by electric field: role of linker proteins[J]. Biophys J, 2009, 96: 717-728. DOI:10.1016/j.bpj.2008.09.035 |
| [3] |
SHEIKN AQ, TAGHIAN T, HEMINGWAY B, et al. Regulation of endothelial MAPK/ERK signalling and capillary morphogenesis by low-amplitude electric field[J]. J R Soc Interface 10, 2013, 20120548. |
| [4] |
ZHANG J, REN R, LUO X, et al. A small physiological electric field mediated responses of extravillous trophoblasts derived from HTR8/SVneo cells: involvement of activation of focal adhesion kinase signaling[J]. Plos One, 2014, 9(3): e92252. DOI:10.1371/journal.pone.0092252 |
| [5] |
RACKAUSKAS G, SAYGILI E, RA NA, et al. Sub-threshold high frequency electrical field stimulation induces VEGF expression in cardiomyocytes[J]. Cell Transplant, 2014, 24(8): 1653. |
| [6] |
HERNANDEZ-BULE ML, PAINO CL, TRILLO MA, et al. Electric stimulation at 448 kHz promotes proliferation of human mesenchymal stem cells[J]. Cell Physiol Biochem, 2014, 34: 1741-1755. DOI:10.1159/000366375 |
| [7] |
AIDA LIUCIA-VALLDEPERAS, BENJAMIN SCACH EZ, CAROLINA SOLER BOTTIJA, et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells[J]. Stem Cell Res. Ther, 2014, 5: 93. DOI:10.1186/scrt482 |
| [8] |
张辉, 许家栋, 牛中奇. 离子跨膜迁移的几率波理论[J]. 生物医学工程学杂志, 2007, 24(2): 257-261. DOI:10.3321/j.issn:1001-5515.2007.02.003 |
| [9] |
牛中奇, 王海彬, 侯建强, 等. 电磁波对细胞内外离子浓度影响的基本理论[J]. 中国生物医学工程学报, 2002, 21(6): 552-556. DOI:10.3969/j.issn.0258-8021.2002.06.013 |
| [10] |
FRICKE H. The electric permittivity of a dilute suspension of membrane-covered ellipsoids[J]. J Appl Phys, 1953, 24: 644-646. DOI:10.1063/1.1721343 |
| [11] |
SCHWAN H P. Electrical properties of tissue and cell suspensions[J]. Adv Biol Med Phys, 1957, 5: 147-209. DOI:10.1016/B978-1-4832-3111-2.50008-0 |
| [12] |
GROSSE C, SCHWAN H P. Cellular membrane potentials induced by alternating fields[J]. Biophys J, 1992, 63: 1632-1642. DOI:10.1016/S0006-3495(92)81740-X |
| [13] |
KOTNIK T, BOBANOVIC F, MIKLAVC'IC D. Sensitivity of transmembrane voltage induced by applied electric fields-a theoretical analysis[J]. Bioelectrochem Bioenerg, 1997, 43: 285-291. DOI:10.1016/S0302-4598(97)00023-8 |
| [14] |
GIMSA J, WACHNER D. Analytical description of the transmembrane voltage induced on arbitrarity oriented ellipsoidal and cylindrical cells[J]. Biophys J, 2001, 81: 1888-1896. DOI:10.1016/S0006-3495(01)75840-7 |
| [15] |
GIMSA J, WACHNER D. On the analytical description of transmembrane voltage induced on spheroidal cells with zero membrane conductance[J]. Eur Biophys J, 2001, 30: 463-466. DOI:10.1007/s002490100162 |
| [16] |
PAVLIN M, MIKLAVCIC D. Effective Conductivity of Suspension of Permeabilized Cells: A Theoretical Analysis[J]. Biophys J, 2003, 85: 719-729. DOI:10.1016/S0006-3495(03)74515-9 |
| [17] |
KOTNIC T, MIKLAVCIC D. Analytical description of trans-membrane voltage induced by electric fields on spheroidal cells[J]. Biophys J, 2000, 79: 670-679. DOI:10.1016/S0006-3495(00)76325-9 |
| [18] |
覃玉荣.外电场作用下悬液中细胞电压变化建模研究[D].广州: 华南理工大学博士论文, 2005: 4. http://cdmd.cnki.com.cn/Article/CDMD-10561-2005107494.htm
|
| [19] |
郭飞, 李成祥, 唐贤伦, 等. 含电穿孔的细胞膜和核膜跨膜电位仿真[J]. 高电压技术, 2016, 42(8): 2528-2533. |
| [20] |
SCHOCNBACH K H, HARGRAVC B, JOSHI R P, et al. Bioelectric effects of intense nanosecond pulses[J]. IEEE Trans. on dielectric and electrical insulaton, 2007, 14(15): 1088-1109. |
| [21] |
YAO C, GUO F, LI C, et al. Gene transfer and drug delivery with electric pulse generators[J]. Current Drug Metabolism, 2013, 14(3): 319-323. DOI:10.2174/1389200211314030007 |
| [22] |
郑羽, 蔡迪, 王金海, 等. 脉冲磁场对神经元动作电位发放的影响[J]. 生理学报, 2014, 66(4): 438-448. |
| [23] |
李辑熙, 牛中奇. 生物电磁学概论[M]. 西安: 西安电子科技大学出版社, 1990: 283-285.
|
 2017, Vol. 47
2017, Vol. 47