脓毒症的最新定义是机体对感染的反应失调而导致危及生命的器官功能障碍[1]。由于其高发病率、高病死率和高医疗花费,一直备受关注。尽管目前对脓毒症发病机制认识存在不足,但微循环障碍是一个明确的环节[2]。在脓毒症恶化进展过程中,炎性因子大量释放,血管内皮细胞通透性增加,大量白蛋白和液体渗至组织间隙,引起低有效循环血容量、顽固性低血压、器官低灌注,是疾病进展过程中最复杂、最凶险的阶段,治疗矛盾多,一旦发生,预后极差[3]。尽管对脓毒症的病理生理学机制认识越来越清晰,但一般的支持治疗仍然是治疗的支柱,因为针对特定的单一治疗靶点进行免疫调节或抗凝治疗已被证明是无效的,可能是因为宿主对脓毒症反应的滞后性和异质性。在内皮细胞完整性破坏之前通过控制血管炎症来加强血管保护可能是一种有效的治疗方法。然而,至今还没有令人满意的同时保护血管内和抑制炎症的药物被开发出来。糖萼是炎症反应时最早被损伤的部位之一,是覆盖于血管内皮细胞管腔侧表面的多绒毛状结构,可维持脉管系统的稳态,包括控制血管通透性和微血管张力,防止微血管血栓形成,调节白细胞黏附等[4]。炎症早期其结构和功能的破坏导致器官功能障碍,与脓毒症发病率密切有关,但目前对于糖萼保护的研究还不深入,保护糖萼或许是未来治疗脓毒症、改善毛细血管渗漏症的靶点,发现新的治疗方法(无论是药理学的还是非药理学的)来保护糖萼免受破坏或许是预防和治疗脓毒症的新方向。
一、糖萼成分及结构糖萼,又称多糖包被或糖蛋白被膜,是覆盖于血管内皮细胞管腔侧表面的多糖蛋白复合物的总称,由于其脆性和不稳定性,很难观察其三维结构。普遍认为糖萼主要由蛋白聚糖(proteoglycan, PG)、氨基葡聚糖(glycosaminoglycans, GAG)、膜糖蛋白(glycoprotei)及血浆蛋白组成[5]。不同种类血管床、器官和血流速度的血管,其糖萼厚度也不同。PG是糖萼中最重要的骨架分子,是固定在内皮细胞顶端膜上的核心蛋白,GAG链以共价键附着于其上。PG有许多不同的类型,其中syndecan-1 (syndecan家族的一个亚型)是研究糖萼的主要目标。与PG相连的GAG链,是糖萼中最多的成分,包括硫酸肝素(Hs)的主要成分,在糖萼中占50%以上、硫酸软骨素(CS)、硫酸皮肤素(DS)、可能还有硫酸角质素(KS)等。这些GAGs带负电荷,使静电与血浆蛋白相互作用。透明质酸是一种大型的线性分子,它不与PG结合,而是与细胞膜CD44相互作用。与其他GAGs形成复合物,使其能够固水并稳定糖萼的凝胶状结构,具体结构如图 1所示[6]。血浆中多种蛋白质,如白蛋白、纤维蛋白原、纤连蛋白、血栓调节蛋白、抗凝血酶Ⅲ、超氧化物歧化酶和细胞黏附分子都与GAGs相互作用。
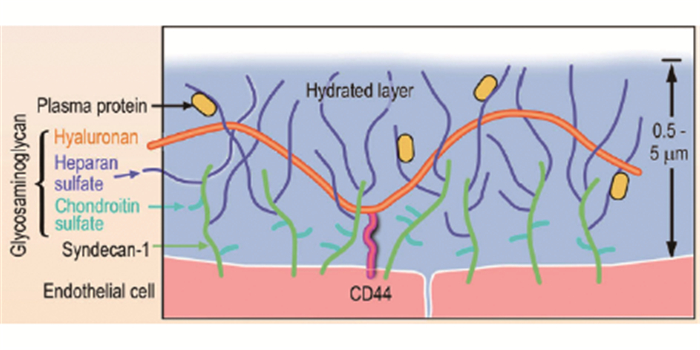
|
图 1 糖萼成分与结构 |
在生理状态下,糖萼是带负电荷的分子筛,作为血管通透性的屏障,这种“网状结构”限制带负电荷和/或大于70kda分子的通过[6]。通过形成一个跨血管白蛋白梯度,限制液体和血浆大分子向内皮细胞外转运,维持体液平衡和内皮细胞稳态[7, 8]。此外,糖萼可感应血液剪切力并将这些力传递给内皮细胞,启动一氧化氮介导的血管舒张;调节血细胞与内皮细胞的相互作用,可保护内皮细胞免受氧化应激影响,为维持血管内皮细胞正常结构功能所必需[9]。同时,糖萼在调节血管张力和抑制血管内凝血中也发挥了重要作用[10]。血管内皮是炎症的早期损伤部位,几乎所有危重病人都存在内皮屏障功能障碍[2]。细胞屏障破坏,血浆蛋白(如白蛋白)和液体渗透血管壁,导致液体渗漏、间质水肿、白细胞和血小板黏附。内皮细胞高通透性是脓毒症的一个标志[11],液体外渗、全身血管张力严重下降和微循环衰竭[12],导致分布性休克、急性肺损伤和肾损伤,临床研究已经证明脓毒症患者血液中糖萼成分水平与器官功能障碍、严重程度和死亡率之间的相关性[13]。
脓毒症时内皮细胞表面糖萼层变得更薄、更稀疏。由于糖萼在组织固定时难以保存其结构,且用于其可视化的实验工具有限,因此其研究较少。因此,对于糖萼来说,没有确定的损伤和破坏糖萼的时间进程。在脓毒症期间,糖萼通过炎性机制如金属蛋白酶、乙酰肝素酶和透明质酸酶降解。这些降解酶由活性氧和促炎性细胞因子如肿瘤坏死因子α和白细胞介素-1β激活[14]。炎症介导的糖萼降解导致血管过度通透性增加、未调节的血管舒张、微血管血栓形成和白细胞黏附增强。
目前的证据已明确支持糖萼在人体正常中的关键作用。糖萼降解不仅存在于危重病人,也存在于以微血管和内皮细胞功能障碍(如慢性肾功能衰竭、脑血管疾病、恶性肿瘤)为特征的其他疾病中。糖萼在维持内皮、血管、器官功能完整性方面的关键作用使其成为一个有希望的研究热点,可用于那些内皮完整性破坏作为病理机制的病例研究。此间危重病人受到特别关注,因为糖萼损害发生在急性疾病的早期阶段;这种早期损伤可能会导致器官功能障碍和死亡率增加。因此,在早期目标导向治疗理念下,针对糖萼的保护可能是一个早期目标,这一理念在过去十年中得到了推广,并已被证明可以降低严重脓毒症患者的死亡率[15]。疑似感染患者检测糖萼和糖萼的修复或许是预防脓毒症的一个潜在措施。
三、脓毒症时糖萼变化对各器官影响 (一) 全身血管系统对全身血管系统的研究表明,糖萼形成了一个实质的内皮表层(endothelial surface layer,ESL),对炎症、屏障功能和机械转导至关重要。肺部ESL明显大于全身ESL,提示其独特的生理功能[16]。ESL维持有选择性的内皮屏障,调节液体、蛋白质和细胞外渗对正常组织功能至关重要。内皮细胞屏障功能在肺循环中尤为重要,其中间质性水肿可抑制肺泡间气体扩散,导致急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)[17]。尽管经过了40年的深入研究,仍然没有针对ALI/ARDS的临床有效的、病理生理学上的靶向治疗,这反映了对肺内皮屏障功能障碍的机制的不完全理解。到目前为止,ALI/ARDS的研究主要集中在内皮细胞内信号级联,如细胞旁、细胞外转运及内皮细胞骨架的收缩。肺内皮屏障的完整性也取决于细胞外结构,包括血管基底膜和糖萼。糖萼与内皮细胞屏障功能的相关性一直被低估,部分原因是长期以来人们认为糖萼是一种小而无关紧要的结构。随着对其结构的认识,越来越多的科学关注ESL的生理重要性。脓毒症发生的30min内,肺部ESL迅速降解,这种降解与肝素酶的激活有关[18],这是一种针对硫酸肝素的葡萄糖醛酸酶,而硫酸肝素是主要的糖化酶。肝素酶介导的ESL损失,使肺内皮表面黏附分子(如ICAM-1、VCAM-1)与循环的中性粒细胞接触,促进中性粒细胞黏附和外渗[19]。
(二) 肾脏急性肾损伤(AKI)是危重症患者,尤其是脓毒症患者常见的并发症,但其病理生理机制尚不清楚,ESL的破坏被认为是脓毒症时微血管通透性增强的重要机制。一旦并发AKI,脓毒症患者死亡率增加一倍,医疗花费大大增加[20]。脓毒症AKI的发病机制复杂,包括肾内血流动力学改变、内皮细胞功能障碍、炎细胞浸润肾间质、肾小球血栓形成和坏死细胞碎片阻塞肾小管等。在肾脏中,血管通透性受到肾小球滤过屏障(GFB)的严格调控,GFB由肾小球内皮细胞、足细胞、它们之间的基底膜和相关的糖萼组成[21]。尽管在脓毒症期间,糖萼有可能发生改变,但目前还没有专门针对这一问题的研究。对GFB的选择通透性的影响最大是由糖蛋白、蛋白聚糖和可溶性成分等组成的糖萼结构[8]。Chiara Adembri等证实在脓毒症初始阶段即发生肾损害,它包括一些肾小体的结构和超微结构的改变以及GFB的糖萼组分的弥漫性改变,GFB丧失与糖萼裂解密切相关[22]。糖萼组分的修复可能是脓毒症患者维持GFB功能的一种潜在的治疗方法。
(三) 肠道屏障肠道屏障功能障碍导致的菌群失调及内毒素移位在脓毒症的发生发展中起到重要作用。同时,肠道更是脓毒症的受害器官。当发生脓毒症后,引发的多种炎性因子及体内毒素可将紧密连接的肠道屏障进行破坏,导致大量炎性因子及毒素进入肠道,致使肠道黏膜屏障受到严重损伤,从而增加了肠道的通透性,引发肠源性感染。相关研究表明,肝素酶通过破坏黏膜血管内皮糖萼,产生HS片段,在脓毒症早期加重炎症反应,导致脓毒症相关的急性肠损伤[23]。在动物研究中,肠系膜小静脉中血流动力学相关的糖萼降解或炎症降解后的恢复需要5~7d。目前脓毒症急性肠损伤与糖萼研究较少,但在重症胰腺炎时发生的3h内,大量TNF-α释放增加,肠黏膜内皮糖萼裂解增加,通透性增强,及早应用氢化可的松可抑制TNF-α保护糖萼,阻断此过程,降低胰腺炎大鼠死亡率[24]。
四、未来保护糖萼的措施内皮糖萼的降解与越来越多的病理状态相关,在受损后5~7d可自行恢复[25]。糖萼的关键功能是保护内皮细胞免受毛细血管渗漏、炎症和凝血的影响。糖萼降解导致血管内皮完整性丧失、毛细血管通透性增加、组织水肿、血小板聚集、白细胞黏附、促炎环境、高凝状态和血管反应性丧失[26],而维持内皮细胞完整性是维持器官功能和组织稳态的关键因素,因此在危重症中维持糖萼正常结构,维持其血管屏障功能,或许成为未来的治疗目标。寻找预防糖萼组分脱落、防止糖萼降解、促进糖萼结构恢复的治疗策略很有必要。然而迄今为止,还没有确定的药物可直接作用于糖萼的保护和再合成,目前对糖萼研究仍停留基础阶段。
(一) 补充GAGs,加速糖萼合成在动物实验和临床试验中都观察到了糖萼的脱落。因此,补充硫酸盐支持糖萼结构或重组内皮糖萼的多糖具有显著优势[27]。此外,在仓鼠中,输注两种糖原丰富的糖包被HA和CS,可以部分地再生被透明质酸酶破坏的糖萼,但单独使用这两种分子都没有效果[28]。
(二) 舒洛地特加速糖萼恢复舒洛地特是一种从猪肠黏膜中提取的硫酸肝素(80%)和硫酸皮肤素(20%)的混合物,在糖尿病肾病的临床试验中没有成功,但在静脉功能不全的临床中有应用[29]。在2型糖尿病患者中,舒洛地特在8周内恢复了视网膜循环中的糖萼成分[30]。在颈动脉球囊损伤大鼠中,舒洛地特恢复了糖萼,减少了损伤、凝血、脂质代谢和局部炎症[31]。在脓毒症小鼠中,舒洛地特也能加速糖萼的恢复,降低血管通透性,提高存活率[14]。
(三) 糖皮质激素糖皮质激素被广泛用作抗炎药,通过对白细胞的抗炎作用和减少细胞动力学对血管屏障的损伤来精确地保护糖萼[27]。在分离的猪心脏模型中,应用氢化可的松可以保护糖萼免受缺血/再灌注和TNF-a灌注的影响,但糖皮质激素的在治疗脓毒症中的应用尚存争议[32]。
(四) 液体复苏液体复苏疗法是脓毒症治疗的重要组成部分,但是过度的液体复苏(导致高血容量)可能增加糖萼降解。相反,新鲜冰冻血浆和白蛋白可减弱糖萼降解。在猪心脏移植诱导的缺血/再灌注中,白蛋白减少冠状动脉间质水肿和内皮细胞与内皮细胞的相互作用,有助于保持糖萼的完整性。白蛋白是多种生物活性分子的载体,包括S1P[33]。S1P通过抑制syndecan-1的脱落来保护糖萼。新鲜冰冻血浆也可以保护糖萼的完整性并保护syndecan-1[34]。新鲜冷冻血浆不仅是白蛋白的来源,还可抑制各种破坏糖萼的蛋白酶(多种金属基质蛋白酶)[35]。
糖萼是脓毒症病理生理学研究的一个重要方面。虽然其降解机制尚未完全阐明,但血浆和尿液中糖萼组分水平的升高可以作为脓毒症高危因素识别、诊断和预后的生物标志物,同时我们需要进一步的研究来建立以糖萼为靶点的治疗策略来治预防和治疗脓毒症。
| [1] |
Singer M, Deutschman CS, Seymour C W, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. Jama, 2016, 315(8): 775-787. DOI:10.1001/jama.2016.0289 |
| [2] |
Robinson BD, Shaji CA, Lomas A, et al. Measurement of Microvascular Endothelial Barrier Dysfunction and Hyperpermeability In Vitro[J]. Methods Mol Biol, 2018, 1717: 237-242. |
| [3] |
翟建华, 卢斌, 刘晨燕, 等. 脓毒症患者毛细血管渗漏综合征的危险因素分析[J]. 继续医学教育, 2019(5): 85-81. |
| [4] |
Miranda M, Balarini M, Caixeta D, et al. Microcirculatory dysfunction in sepsis:pathophysiology, clinical monitoring, and potential therapies[J]. Am J Physiol Heart Circ Physiol, 2016, 311(1): H24-H35. DOI:10.1152/ajpheart.00034.2016 |
| [5] |
Chen L. Glycocalyx in Sepsis Resuscitation[J]. Crit Care Nurs Q, 2016, 39(1): 38-41. DOI:10.1097/CNQ.0000000000000095 |
| [6] |
Woodcock TE, Woodcock TM. Revised Starling equation and the glycocalyx model of transvascular fluid exchange:an improved paradigm for prescribing intravenous fluid therapy[J]. Br J Anaesth, 2012, 108(3): 384-394. DOI:10.1093/bja/aer515 |
| [7] |
Salmon AH, Ferguson JK, Burford JL, et al. Loss of the endothelial glycocalyx links albuminuria and vascular dysfunction[J]. Am Soc Nephrol, 2012, 23(8): 1339-1350. DOI:10.1681/ASN.2012010017 |
| [8] |
Salmon AH, Satchell SC. Endothelial glycocalyx dysfunction in disease:albuminuria and increased microvascular permeability[J]. Pathol, 2012, 226(4): 562-574. DOI:10.1002/path.3964 |
| [9] |
Martin L, Koczera P, Zechendorf E, et al. The Endothelial Glycocalyx:New Diagnostic and Therapeutic Approaches in Sepsis[J]. Biomed Research International, 2016, 5: 1-8. DOI:10.14194/ijmbr.5.1.1 |
| [10] |
Spiess BD. Heparin:Effects upon the Glycocalyx and Endothelial Cells[J]. Extra Corpor Technol, 2017, 49(3): 192-197. |
| [11] |
Iba T, Levy JH. Derangement of the endothelial glycocalyx in sepsis[J]. Journal of Thrombosis and Haemostasis, 2019, 17(2): 283-294. DOI:10.1111/jth.14371 |
| [12] |
Chelazzi C, Villa G, Mancinelli P, et al. Glycocalyx and sepsis-induced alterations in vascular permeability[J]. Crit Care, 2015, 19: 26. DOI:10.1186/s13054-015-0741-z |
| [13] |
Rovas A, Seidel LM, Vink H, et al. Association of sublingual microcirculation parameters and endothelial glycocalyx dimensions in resuscitated sepsis[J]. Critical Care, 2019, 23(1): 260. DOI:10.1186/s13054-019-2542-2 |
| [14] |
Song JW, Zullo JA, Liveris D, et al. Therapeutic Restoration of Endothelial Glycocalyx in Sepsis[J]. Pharmacol Exp Ther, 2017, 361(1): 115-121. DOI:10.1124/jpet.116.239509 |
| [15] |
Burke-Gaffney A, Evans TW. Lest we forget the endothelial glycocalyx in sepsis[J]. Crit Care, 2012, 16(2): 121. DOI:10.1186/cc11239 |
| [16] |
Lukas M, Patrick K, Elisabeth Z, et al. The Endothelial Glycocalyx:New Diagnostic and Therapeutic Approaches in Sepsis[J]. BioMed Research International, 2016, 2016: 1-8. |
| [17] |
Rizzo AN, Dudek SM. Endothelial Glycocalyx Repair:Building a Wall to Protect the Lung during Sepsis[J]. Am J Respir Cell Mol Biol, 2017, 56(6): 687-688. DOI:10.1165/rcmb.2017-0065ED |
| [18] |
Schmidt EP, Yang Y, Janssen WJ, et al. The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis[J]. Nature Medicine, 2012, 18(1): 1217-1223. |
| [19] |
Yang Y, Schmidt EP. The endothelial glycocalyx:an important regulator of the pulmonary vascular barrier[J]. Tissue Barriers, 2013, 1(1): 23494. DOI:10.4161/tisb.23494 |
| [20] |
Ernst A, Schlattmann P, Waldfahrer F, et al. Investigate predictive capacity of in-hospital mortality of four severity score systems on critically ill patients with acute kidney injury[J]. Laryngorhinootologie, 2017, 96(8): 519-521. |
| [21] |
Szymczak M, Kužniar J, Klinger M. The role of heparanase in diseases of the glomeruli[J]. Arch Immunol Ther Exp (Warsz), 2010, 58(1): 45-56. DOI:10.1007/s00005-009-0061-6 |
| [22] |
Song JW, Zullo J, Lipphardt M, et al. Endothelial glycocalyx-the battleground for complications of sepsis and kidney injury[J]. Nephrol Dial Transplant, 2018, 33(2): 203-211. DOI:10.1093/ndt/gfx076 |
| [23] |
Chen S, He Y, Hu Z, et al. Heparanase Mediates Intestinal Inflammation and Injury in a Mouse Model of Sepsis[J]. Journal of Histochemistry & Cytochemistry, 2017, 65(4): 241-249. |
| [24] |
Gao SL, Zhang Y, Zhang SY, et al. The hydrocortisone protection of glycocalyx on the intestinal capillary endothelium during severe acute pancreatitis[J]. Shock, 2015, 43(5): 512-517. DOI:10.1097/SHK.0000000000000326 |
| [25] |
Potter DR, Jiang J, Damiano ER. The recovery time course of the endothelial cell glycocalyx in vivo and its implications in vitro[J]. Circ Res, 2009, 104(11): 1318-1325. DOI:10.1161/CIRCRESAHA.108.191585 |
| [26] |
Hana Koláǐová, Barbora Ambrûzová, Lenka Svihálkováŝ indlerová, et al. Modulation of Endothelial Glycocalyx Structure under Inflammatory Conditions[J]. Mediators of Inflammation, 2014, 2014(5): 694312. |
| [27] |
Chappell D, Hofmann-Kiefer K, Jacob M, et al. TNF-alpha induced shedding of the endothelial glycocalyx is prevented by hydrocortisone and antithrombin[J]. Basic Res Cardiol, 2009, 104(1): 78-89. DOI:10.1007/s00395-008-0749-5 |
| [28] |
Henry CB, Duling BR. Permeation of the luminal capillary glycocalyx is determined by hyaluronan[J]. Am J Physiol, 1999, 277(2): H508-514. |
| [29] |
Buse MG. Hexosamines, insulin resistance, and the complications of diabetes:current status[J]. Am J Physiol Endocrinol Metab, 2006, 290(1): E1-E8. DOI:10.1152/ajpendo.00329.2005 |
| [30] |
Broekhuizen LN, Lemkes BA, Mooij HL, et al. Effect of sulodexide on endothelial glycocalyx and vascular permeability in patients with type 2 diabetes mellitus[J]. Diabetologia, 2010, 53(12): 2646-2655. DOI:10.1007/s00125-010-1910-x |
| [31] |
Li T, Liu X, Zhao Z, et al. Sulodexide recovers endothelial function through reconstructing glycocalyx in the balloon-injury rat carotid artery model[J]. Oncotarget, 2017, 8(53): 91350-91361. |
| [32] |
Annane D. Corticosteroids for severe sepsis:an evidence-based guide for physicians[J]. Ann Intensive Care, 2011, 1(1): 7. DOI:10.1186/2110-5820-1-7 |
| [33] |
Adamson RH, Clark JF, Radeva M, et al. Albumin modulates S1P delivery from red blood cells in perfused microvessels:mechanism of the protein effect[J]. Am J Physiol Heart Circ Physiol, 2014, 306(7): H1011-1017. DOI:10.1152/ajpheart.00829.2013 |
| [34] |
Zeng Y, Adamson RH, Curry FR, et al. Sphingosine-1-phosphate protects endothelial glycocalyx by inhibiting syndecan-1 shedding[J]. Am J Physiol Heart Circ Physiol, 2014, 306(3): H363-372. DOI:10.1152/ajpheart.00687.2013 |
| [35] |
Peng Z, Pati S, Potter D, et al. Fresh frozen plasma lessens pulmonary endothelial inflammation and hyperpermeability after hemorrhagic shock and is associated with loss of syndecan 1[J]. Shock, 2013, 40(3): 195-202. DOI:10.1097/SHK.0b013e31829f91fc |
 2019, Vol. 3
2019, Vol. 3

