青枯雷尔氏菌(Ralstonia solanacearum)是一种重要的土传病原菌,具有广泛的寄主范围,可侵染50多科450余种植物[1]。其引起的烟草青枯病是限制我国烟草生产的主要病害之一。青枯雷尔氏菌通过根部伤口、根尖或次生根进入烟草根部,最终定殖于木质部,继而产生大量的胞外多糖堵塞维管束组织,造成叶片萎蔫、发黄坏死,最终导致烟株死亡,直接影响着我国烟叶的品质和产量,也造成了巨大的经济损失[2]。青枯菌致病因子包括IV型鞭毛系统[3-4]、胞外多糖[5]、Ⅲ型分泌系统[2]等。该病菌主要依靠IV型鞭毛系统介导的运动与趋向作用寻找、侵染寄主,并通过Ⅲ型分泌系统、II型分泌系统等将多种毒性因子输送到胞外致使植物患病[6-7]。PVH1452烟草品种能通过分泌较低含量的草酸来影响青枯雷尔氏菌生物膜的形成及其在烟株根部的定殖[8]。粤烟97品种能通过提高苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、多酚氧化酶(PPO)等防御酶活性来抵御青枯菌侵染[9]。近年来,我国烟区青枯病发病率呈逐年升高趋势。据不完全统计,2009年我国烟草青枯病发病面积将近2.6万hm2,造成的经济损失高达8 000万元,而2015年青枯病发病面积达到130万亩左右,造成经济损失大约5.5亿元[10]。
以往的研究主要集中在运用种植制度[11-12]、化学药剂[13]、有机肥料[14-16]等手段防治烟草青枯病,而关于烟草青枯病与土壤微生物群落特征之间的关系研究则较为分散且不系统。有研究指出,土壤微生物群落对烟草青枯病发病影响极为关键[17]。因此,本文总结了烟草青枯病发病情况与土壤微生物区系特征的变化关系,为推进烟草青枯病的生态防治提供理论和实践依据。
1 土壤理化性质与烟草青枯病众所周知,土壤理化性质与土壤微生物区系的健康息息相关。土壤理化条件的变化在一定程度上影响了土壤微生物的结构组成。例如土壤微生物总量以及细菌、放线菌和真菌数量与土壤有机质含量呈正相关[18];土壤细菌与土壤有机质、全氮、全磷及碱解氮含量显著相关[19]。研究表明,土壤酸化会降低硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)、绿菌门(Chlorobi)及接合菌门(Zygomycota)等碳氮代谢菌群丰度,易发生青枯病[20];而土壤全氮、速效磷含量的提高则会促使土壤微生物区系从细菌型向真菌型转化,有利于降低青枯病发生率[21]。陈娜[22]指出,烟田速效钾含量与节杆菌(Arthrobacter)等有益菌丰度呈正相关关系。李小龙等[23]发现,烟田交换性钙离子含量的增加能提高假单胞菌(Pseudomonas)和溶杆菌(Lysobacter)丰度。已有研究证明,假单胞菌和溶杆菌是重要的青枯病生防菌[24-25]。
土壤理化条件也影响土壤中青枯菌的数量。青枯菌在土壤生存需要适宜的温度、湿度和pH等条件,土壤温度低、湿度高、pH适中适合青枯菌存活,而干燥或淹水及过酸或过碱的土壤均不利于其生存。Shekhawat等[26]发现,当土壤温度为5℃或35℃、干土且通气差的条件下,青枯菌数量显著降低。喻延[27]也发现,过高或过低土壤pH均能降低青枯菌的数量,抑制病害的发生。土壤质地也是影响青枯菌生存的一个重要条件,沙壤土质地疏松、保水保肥能力及抑病性较强,因而沙壤土中青枯菌数量明显低于沙质土和粘质土[28]。此外,李集勤等[29]发现,随着土壤改良剂的施用,土壤交换性钙离子含量增加,青枯菌数量减少,病情指数降低。另有研究表明,土壤速效磷含量的增加,能有效抑制青枯菌的生长繁殖,降低青枯病发病率[30](图 1)。

|
| 图 1 土壤理化性质调控青枯病的发生 |
近年来,随着16S rRNA和18S rRNA基因测序等分子生物技术的快速发展,越来越多的研究开始关注土传病害与土壤微生物之间的联系。研究发现,微生物群落结构(Composition)在发病与健康土壤间的差异可能是影响烟草青枯病发生的关键因子之一[31-35](图 2)。群落结构反映的是物种组成及各物种的丰度[36],因而围绕主要物种及其群落组成变化与烟草青枯病的发病情况展开论述。
|
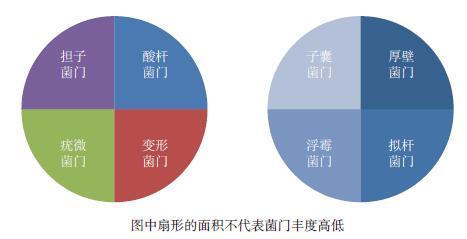
| 图 2 健康(左)与发病(右)烟田中的优势菌门 |
在烟草根际土壤中,主要微生物种类有细菌(Bacteria)、真菌(Fungus)和放线菌(Actinomyces)。青枯菌作为一种细菌性病原菌,在侵染烟株的过程中,会使烟株根际的主要微生物丰度发生变化。陈乾锦等[32]发现,发病土壤中细菌和真菌数量高于健康土壤,而放线菌数量却低于健康土壤,进一步对发病烟株生理期进行研究发现,细菌和真菌数量从移栽期到发病期(旺长期)呈增多趋势,且细菌相较于真菌更为显著。匡传富等[37]的研究有相似结果,1、2、3号土(青枯病程度由重到轻)中细菌、真菌数量依次由多到少,在生理期中的烟田细菌数量变化也较真菌显著。李黎绅等[38]的研究发现,发病严重的沙田土壤中细菌和真菌数量高于发病较轻或不发病的紫色土壤,而前者的放线菌数量却明显低于后者。李小龙等[23]也指出发病烟田中细菌和真菌数量高于健康烟田,而放线菌数量则与之相反。这可能是由于青枯雷尔氏菌影响了根际微生态环境,导致细菌数量增加,进而诱导发病机制[39]。再者,土壤中多种放线菌能产生抗菌素类物质,在一定程度上抑制了土传病害的发生。
2.2 微生物群落组成变化与烟草青枯病 2.2.1 细菌门水平变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteria)是烟株根际土壤细菌群落的3大优势菌门。健康和发病(青枯病,下同)土壤的细菌群落组成在门水平上相似,但相对丰度有显著性差异。健康土壤中酸杆菌门、变形菌门、疣微菌门(Verrucomicrobia)的丰度较高,而在发病土壤中厚壁菌门、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)的丰度较高。常安然等[40]分析了四种健康土壤的细菌群落发现,细菌以变形菌门和酸杆菌门为优势类群。Liu等[41]研究发现,常年连发病烟田中的变形菌门和酸杆菌门丰度相较于健康烟田显著降低。施河丽等[42]对健康和发病烟田的土壤微生物在细菌门水平进行对比发现,健康烟田酸杆菌门丰度比发病烟田高31.67%,疣微菌门丰度是发病烟田的2.28倍,而厚壁菌门、拟杆菌门丰度分别比发病烟田低27.56%和16.88%。林书震[33]研究发现,在健康烟田中变形菌门、疣微菌门丰度分别为32.3%和1.2%,而在发病烟田中分别为28.6%和0.9%,在移栽期与发病期酸杆菌门的丰度分别为19.2%和12.6%,浮霉菌门的丰度分别为1.8%和4.2%。在对邵武烟田的细菌群落进行分析时,发现发病烟田中浮霉菌门、拟杆菌门丰度较健康烟田分别高出0.32%和0.48%,发病期酸杆菌门的丰度则比移栽期低了2.99%[29]。
2.2.2 细菌属水平Berendsen等[43]认为,植物健康不单独由致病菌和有益微生物的丰度决定,而是受到多种微生物的共同影响。有研究发现,劳尔氏菌属在健康和发病烟田中均为优势菌属,尽管在健康土壤的丰度低于发病土壤,但差异并不显著[42]。在向立刚等[44]的研究中,同样发现劳尔氏菌属是健康土壤的优势菌属,但发病土壤的优势菌属为假单胞菌。刘晓姣[45]指出,作为具有潜在防治土传病害功能的芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)和假单胞菌属,其丰度在健康与发病土壤中并没有显著性差异,且假单胞菌属在发病烟田的丰度高于健康烟田。Wu等[46]研究发现,在混施土壤改良剂和生物有机肥的土壤中,有益菌大量富集并能联合抵制烟草青枯病。另有研究指出,根际土壤生态系统可以调控有益菌与青枯菌的竞争作用并使其达到最大化来提高作物根际抗性[47]。此外,一些未分类的细菌,其丰度在健康与发病土壤中也存在差异,如unclassified_f__Micrococcaceae在健康土壤中的丰度为3.0%,而在发病土壤中为1.2%;norank_p__Saccharibacteria在健康土壤中的丰度为1.4%,在发病土壤中为0.9%[33]。这些未分类的细菌可能会与一些菌属相互作用,进而影响烟草青枯病的发生,但因无法精确到物种水平上的分类,相关研究还相对较少。
2.2.3 真菌门、科水平烟草根际土壤的真菌类群主要富集了子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和未分类菌群。其中子囊菌门为真菌菌群中的第一优势菌门,该菌群在发病土壤中的丰度明显高于健康土壤。有研究指出,子囊菌门中含有大量病原菌,但这些病原菌不是作物的致病菌,它们通常在植物根部聚集造成根表层破坏,为一些致病菌的侵染创造条件[48]。子囊菌门在受害严重的烟田中丰度较高,可能为青枯菌的入侵创造了条件。担子菌门在健康烟田的丰度高于发病烟田,银耳纲(Tremellomycetes)属于担子菌门,Dipak等[49]研究指出,银耳纲中的一些真菌在抑制植株根际土传病害中发挥着重要作用,是有效控制病害的生防菌。在未分类菌群中,norank_k__Fungi的丰度相对较高。有研究指出norank_k__Fungi在健康烟田丰度是发病烟田的2.87倍[32]。另有报道,norank_k__Fungi在烟田移栽期平均丰度为15.2%,发病期仅为4.2%[33],表明norank-k-Fungi可能属于有益菌。真菌群落结构的变化可能影响着青枯病害程度[50-51]。如重度发病烟田中被孢霉科(Mortierellaceae)、丛赤壳科(Nectriaceae)丰度较轻度发病烟田分别降低了76.1%、92.3%,粪盘菌科(Ascobolaceae)丰度增加了64.9%[52];连续生物熏蒸处理烟田后,发现烟田毛发菌科、毛壳菌科(Chaetomiaceae)相对丰度增加,而随生物熏蒸年限的增加,青枯病害程度降低[53];赵文宗[54]发现5种嫁接处理的番茄有不同的发病程度,青枯病情指数和发病率与真菌数量呈极显著负相关,在青枯病症较重烟田中壶菌门(Chytridiomycota)丰度较高,病症较轻烟田中Basidiomycota丰度较高。
2.2.4 真菌属水平有关学者在真菌属水平上分析烟田发病原因时,发现假霉样真菌属(Pseudallescheria)、镰刀菌属(Fusarium)等是造成健康和发病烟田差异的主要菌属[32],且两种菌属均在发病烟田中丰度较高。林书震等[33]也发现在烟田发病期,Pseudallescheria丰度明显增加。Pseudallescheria属于子囊菌门中的小囊菌目(Microascales);Fusarium是对植物危害最大的丝状真菌,其分泌的毒素能引起100多种动植物病害[55],可能会促使烟草青枯病的发生。王婷婷等[56]从发病烟田健康烟株根围分离得到几种菌根真菌(Arbuscular Mycorrhiza Fungi,AMF)发现,几种AM真菌对青枯病有较好的防治效果。AM真菌对作物根际微生物群落结构的影响被认为是其抑制土传病害的一个重要机制[57-59]。土壤中某些真菌代谢物也能影响细菌的群落变化,例如AM真菌菌丝分泌物能显著提高番茄根际细菌数量,抑制青枯菌在根际土壤的定殖,降低青枯菌丰度[60];球黑孢菌(Nigrospora sphaerica)的代谢产物具有稳定的抑菌活性,能明显降低土壤青枯菌丰度[61];刺盘孢菌(Colletotrichum)分泌物芹菜素-8-C-葡萄糖苷(Apigenin-8-C-β-D-glucopyranoside)也能抑制青枯病生防菌Bacillus和Pseudomonas活性,降低它们在土壤中的丰度[62]。AM真菌还能促使植株根系分泌可溶性酚和结合态酚,加强对青枯菌的毒害作用[63]。谭树朋等[64]把AMF摩西球囊霉(Glomus mosseae,Gm)和地表球囊霉(G. versiforme,Gv)分别与促生长菌芽孢杆菌M3-4菌株互作,发现M3-4菌株能分泌一些化学物质促进AMF菌丝生长,而AMF菌丝的生长为M3-4菌株提供了良好的生态位,增加了M3-4菌株在根际土壤中的丰度,它们之间的相互促进作用能明显降低青枯病菌数量和病害发生率。
3 微生物生态网络土壤中的微生物极少单独存在,不同种群总是聚集在一起,微生物之间、微生物与其他生物之间及微生物与环境之间存在着各种相互作用。通过平板共培养已确定微生物之间有寄生、共生、拮抗等生存方式。因共培养不能精确的探究原位状况下土壤微生物间的相互作用,近些年研究者们运用计算机模拟生态网络构建的方法来探究微生物间的相互作用关系。微生物生态网络的构建原理是:如果有两种微生物或OTUs,其丰度呈相同或相反的变化规律,只要相关系数高于显著性阈值,那么就可以认为这两种微生物之间存在着正或负相互作用关系;如果计算所有微生物两两之间的相关性,就构成了一个完整的相互作用网络[65],如equation-based network[66]、Bayesian network[67]、relevance network[68]、CoNet network[69-70]以及random matrix theory(RMT)-based network[71]等。微生物生态网络的构建不仅有利于了解原位状况下土壤微生物间的相互关系,也为维持土壤健康提供了技术支撑。
3.1 土壤微生物生态网络与烟草青枯病物种间大量的相互作用对病原菌入侵有很强的抵抗力[72]。Yang等[73]基于随机矩阵模型对不同发病率烟田进行生态网络构建,结果发现轻度发病烟田比严重发病烟田有更多的节点数(Node)、连接数(Link)和更高的模块性(Module)。较多节点数和连接数表明生态网络更复杂,物种间有较多的相互作用,更高模块性表明某些菌属占据相同的生态位,可以稳定互惠或共生[71, 74]。Wei等[75]的研究也发现,与感染青枯病土壤相比,健康土壤的生态网络具有更高的节点数和边数、更长的平均路径长度和更高的模块性。类似地,在对番茄青枯病进行研究时发现具有低巢状、高连通性和明显生态位的群落社区,能有效降低病原菌的入侵成功率[48]。土壤微生物间的相互作用影响着烟草青枯病的发生,且土壤中微生物相互关系越复杂、拥有更多明显生态位,其病害发生率越低(图 3)。

|
| 图 3 土壤微生物多样性、微生物间的相互作用与青枯病发病率关系 |
普遍认为,作物都有能够抑制病原体的关键微生物群[76],其中一些关键微生物(Key)在维持整个生态系统结构和功能稳定方面也起着至关重要的作用[77-78]。为揭示与烟草青枯病相关的关键微生物,有学者在生态网络中引入最大连接度节点[79]、最大相互性与中心压力[80]、最高特征向量中心度的概念共同表征关键微生物[81]。结果发现不同取样点的健康烟田关键微生物类群较一致,主要包括芽孢杆菌属等,但不同取样点的中度发病和严重发病烟田关键微生物类群却不一致,这可能是由于发病烟田的致病因子复杂多变[82],其关键微生物也在不断变化。另有学者用NESH识别微生物网络中关键微生物类群发现,健康土壤中的芽孢杆菌、假单胞菌和放线菌是抑制青枯病菌的关键微生物[83],它们是非核糖体抗菌肽和聚酮类化合物等关键抑菌物质的最佳生产者[84-85],能有效防治烟草、苜蓿[86]、黄瓜[87]等多种作物的病害。此外,稀有类群也能发挥关键性作用,如Li等[88]研究发现,患病植物微生物群中缺乏某些稀有类群,致使作物受到了病原体感染。稀有类群可能是一个未开发的有益微生物库[89],能有选择性地在土壤中富集[90]。有益微生物富集的烟田,物种丰富度指数和多样性指数较高,青枯病害发生率较低[47],这可能是由于有益微生物串联了相关菌属形成了复杂的生态网络,进而抑制病害发生。
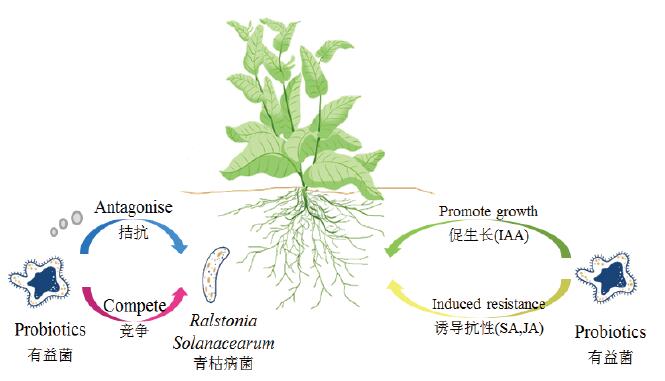
4 微生物防治烟草青枯病的作用机制利用土壤中的有益微生物及其代谢产物抵御作物病害是一种安全、可持续的防治方法,目前主要应用以下4种作用机制方式防治青枯病(图 4)。
|
| 图 4 有益微生物防治烟草青枯病的作用机制 |
有益微生物与病原菌的竞争作用主要包括营养竞争和侵染位点竞争。除2.2.4提到的菌根真菌外,郑继法等[91]从番茄、辣椒根际土壤中分离得到的产细菌素菌株,能同青枯菌争夺烟株根际营养和生态位点,对青枯病的防治有明显效果。易有金等[92]对烟株接种青枯菌和短短芽孢杆菌(Brevibacillus brevis),发现Brevibacillus brevis能优先定殖在烟株根部位点,阻止青枯菌的侵染。Yuan等[93]把Bacillus amyloliquefaciens SQR-7、SQR-101和B.methylotro-phicus SQR-29接种在烟苗中,发现这些内生菌能与青枯菌进行铁离子竞争,从而降低了病害发生率。
4.2 拮抗作用拮抗作用是指微生物产生的某些代谢物质对病原菌抑制或杀死的效应。刘雅婷等[94]从土壤中分离得到一些拮抗活性较强的菌株,这些菌株可以通过产生细菌素来抑制青枯菌的活性。Anuratha等[95]发现荧光假单胞杆菌(Pseudomonas fluorescens)产生的抗生素和噬铁素对青枯菌有较好的抑制作用。此外,陈亮等[96]发现解淀粉芽孢杆菌(Bacillus amyloliquefaciens)也能通过分泌脂肪酸等活性物质来抑制烟草青枯病菌的生长。
4.3 诱导抗性诱导抗性是指微生物能诱导植物体内产生有益于抗病性增强的生理生化反应。程小龙[97]通过对烟株外施适宜浓度的水杨酸(Salicylic acid,SA)来促进土壤中枯草芽孢杆菌(Bacillus subtilis)的生长,进而诱导增强了烟株对青枯病的抗性。陈达[98]利用无致病力的phcA、hrp青枯菌突变株诱导了烟株中茉莉酸(Jasmonic acid,JA)和SA信号途径的抗性基因表达,提高了烟株对青枯病的系统抗性。董春等[99]利用无致病力的青枯菌株Tm3对青枯菌株Tm46进行抑菌试验,发现Tm3菌株能诱导植株产生过敏性反应。
4.4 促进植物生长土壤中的有益微生物可以促进植株的生长发育,从而增强植株的抗病性。陈巧玲等[100]向生物有机肥中添加短芽孢杆菌(Brevibacillus)并施用于烟田发现,烟株生长迅速且青枯病害发生率明显降低。芽孢杆菌属中的一些微生物能产生IAA等生长调节剂促进植株生长,进而抵御青枯菌的侵染[93]。肖相政等[101]把枯草芽孢杆菌X-4接种到番茄植株上,发现与对照相比,接种植株生长迅速,生物量显著增加,且青枯病害程度较轻。
5 展望烟草青枯病是一种细菌性土传病害,也是危害我国烟草生产的主要病害之一。微生物是土壤生态系统最重要的组成部分,在作物土传病害的防治方面也起着十分重要的作用。近年来,随着分子生物技术的快速发展,越来越多的研究开始关注土壤微生物群落与土传病害的相互关系,利用微生物多样性控制作物病害已成为实现“绿色植物保护”极有希望的途径之一。目前在土壤微生物与青枯病发生关系方面的研究表明:土壤pH、速效钾、交换型钙离子、全氮等能分别影响碳氮代谢菌群、有益菌、生防菌及真菌丰度来调控烟草青枯病。土壤质地、温度、湿度、速效磷等能直接影响青枯病菌数量;Bacteria、Fungus对病害发生起正面作用,Actinomyces起负面作用;Node、Link、Module、Key等一些生态网络拓扑特性参数和关键微生物对病害的发生表现为一定程度的负效应。由于青枯菌致病系统复杂、致病因子多样,需多种手段并用来防治。微生态平衡是控制烟草青枯病重要的基础与保障,采取农业措施与生物防治相结合的措施,改善土壤环境,构建土壤营养、酸碱度、根际微生物与烟株生长的平衡体系,将有益于在烟草青枯病的防治中实现新的突破。
大多研究只分析了发病与健康土壤之间的差异种群,在有益微生物的挖掘以及利用方面未进行细致而深入的研究。因此,以下问题也值得进一步思考:(1)青枯病菌侵染烟株是一个动态变化过程,但大多数研究只比较了最终健康和发病土壤样品的差异特性,并没有关注发病过程中的微生物群落变化。(2)对于发病土壤中一些门和属分类下的微生物丰度变化,因未通晓其变化原因,所以不能阐明微生物的分类和功能差异是如何导致烟株发病的。(3)对微生物之间的相互作用研究得还不够深入,尚未明确哪些微生物联合侵染烟株或抵抗青枯病,更不清楚它们如何互相作用。(4)对关键微生物的研究还处于初级阶段,不能明确关键微生物如何发挥作用及如何串联其他菌属抵御青枯病。此外,矿质元素的缺失也是导致烟草青枯病发生的重要因子,但大多数集中在与大量元素相关的研究当中,对微量元素如钼、硒等相关报道则较少。
综上,今后的研究需聚焦发病过程中微生物区系的动态变化,挖掘有益微生物,重点探究有益微生物抵抗青枯菌的作用机制,致力解决生防菌在土壤中的定殖难题。另外,微量抗逆元素(如硒)对烟草青枯病根际土壤微生物区系的调控作用也值得进一步关注。
| [1] |
Salanoubat M, Genin S, Artiguenave F, et al. Genome sequence of the plant pathogen Ralstonia solancearum[J]. Nature, 2002, 415(6871): 497-502. DOI:10.1038/415497a |
| [2] |
Genin S. Molecular traits controlling host range and adaptation to plants in Ralstonia solanacearum[J]. The New phytologist, 2010, 187(4): 920-928. DOI:10.1111/j.1469-8137.2010.03397.x |
| [3] |
Liu HL, Kang YW, Genin S, et al. Twitching motility of Ralstonia solanacearum requires a type Ⅳ pilus system[J]. Microbiology-Sgm, 2001, 147(12): 3215-3229. DOI:10.1099/00221287-147-12-3215 |
| [4] |
Tans-Kersten J, Huang H Y, Allen C. Ralstonia solanacearum needs motility for invasion virulence on tomato[J]. Journal of Bacteriology, 2001, 183(12): 3597-3605. DOI:10.1128/JB.183.12.3597-3605.2001 |
| [5] |
Kao CC, Sequeira L. Extracellular polysaccharide is required for wild-type virulenceof Pseudomonas solanacearum[J]. Journal of bacteriology, 1992, 174(3): 1068-1071. DOI:10.1128/JB.174.3.1068-1071.1992 |
| [6] |
Li SL, Xu C, Wang J, et al. Cinnamic, myristic and fumaric acids in tobacco root exudates induce the infection of plants by Ralstonia solanacearum[J]. Plant Soil, 2016, 412(1-2): 381-395. |
| [7] |
林海云, 车建美, 刘波, 等. 青枯雷尔氏菌致病机制及其相关基因的研究进展[J]. 福建农业学报, 2011, 26(5): 899-906. Lin HY, Che JM, Liu B, et al. Pathogenic mechanism and related genes of Ralstonia solanacearum[J]. Fujian Agricultural Journal, 2011, 26(5): 899-906. |
| [8] |
王姣.草酸影响青枯雷尔氏菌与烟草互作的机制研究[D].重庆: 西南大学, 2019. Wang J. Mechanism of oxalic acid on the interaction between Ralstonia solanacearum and tobacco[D]. Chongqing : Southwest University, 2019. |
| [9] |
周星洋.外源诱导不同抗青枯病水平烟草生理生化反应的差异分析[D].广州: 华南农业大学, 2016. Zhou XY. Differential analysis of physiological and biochemical responses of tobacco with different levels of resistance to bacterial wilt induced by exogenous sources[D]. Guangzhou : South China Agricultural University, 2016. |
| [10] |
Liu Y, Wu DS, Liu QP, et al. The sequevardistribution of Ralstonia solanacearum in tobacco growing zones of China is structured byelevation[J]. European Journal of Plant Pathology, 2016, 147(3): 541-551. |
| [11] |
Niu J. Insight into the effects of different cropping systems on soil bacterial community and tobacco bacterial wilt rate[J]. Journal of Basic Microbiology, 2017, 57(1): 3-11. DOI:10.1002/jobm.201600222 |
| [12] |
King SR, Davis AR, Liu W, et al. Grafting for disease resistance[J]. Journal of the American Society for Horticultural Science, 2008, 43(6): 1673-1676. |
| [13] |
Yi Y, Liu R, Yin H, et al. Isolation, identifi-cation and field control efficacy of endophytic strain against tobacco bacterial wilt[J]. Journal of Applied Ecology, 2007, 18(3): 554-558. |
| [14] |
Liu Y, Shi J, Feng Y, et al. Tobacco bacterial wilt can be biologically controlled by the application of antagonistic strains in combination with organic fertilizer[J]. Biology and Fertility of Soils, 2013, 49(4): 447-464. DOI:10.1007/s00374-012-0740-z |
| [15] |
Yan XL, Xiang L, Yi C, et al. Field control efficiency of tobacco specific bio-organic fertilizer on tobacco bacterial wilt[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(5): 1203-1211. |
| [16] |
Paul JH, Geoff MP, Leo A, et al. Differences in microbial activity and microbial populations of peat associated with suppression of damping-off disease caused by Pythium sylvaticum. Applied and Environmental Microbiology, 2006, 72(10): 6452.
|
| [17] |
Cha JY, Han S, Hong HJ, et al. Microbial and biochemical basis of a Fusarium wilt suppressive soil[J]. Multidisciplinary Journal of Microbial Ecology, 2015, 10(1): 119-129. |
| [18] |
邹汉玄, 杨先跃, 曹斌, 等. 土壤微生物对柑桔生长及产量的影响[J]. 果树科学, 1994(1): 19-22. Zou HX, Yang XY, Cao B, et al. Effects of soil microorganisms on the growth and yield of Citrus[J]. Fruit tree science, 1994(1): 19-22. |
| [19] |
毛宁, 贾海燕, 杨建霞, 等. 不同生态类型土壤养分与微生物数量相关关系研究[J]. 陇东学院学报, 2019, 30(5): 72-76. Mao N, Jia HY, Yang JX, et al. Study on the correlation between soil nutrients and microbial population in different ecological types[J]. Journal of Longdong University, 2019, 30(5): 72-76. |
| [20] |
张淑婷.铝离子影响烟草青枯病发生的机制研究[D].重庆: 西南大学, 2018. Zhang ST. Mechanism of aluminum ion affecting tobacco bacterial wilt[D]. Chongqing : Southwest University, 2018. |
| [21] |
王茂胜, 姜超英, 潘文杰, 等. 不同连作年限的植烟土壤理化性质与微生物群落动态研究[J]. 安徽农业科学, 2008(12): 5033-5034. Wang MS, Jiang CY, Pan WJ, et al. Physicochemical properties and microbial community dynamics of tobacco planting soil with different continuous cropping years[J]. Anhui Agricultural Science, 2008(12): 5033-5034. |
| [22] |
陈娜. 钾肥对烟草青枯病的防控效果及其根际微生物群落的影响[J]. 安徽农业科学, 2018, 46(22): 125-127. Chen N. Control effect of Potassium Fertilizer on tobacco bacterial wilt and its effect on rhizosphere microbial community[J]. Anhui Agricultural Science, 2018, 46(22): 125-127. |
| [23] |
李小龙, 李红丽, 曾强, 等. 钙镁磷肥对青枯病发病烟株根际土壤微生物区系的影响[J]. 中国烟草学报, 2016, 22(1): 75-79. Li XL, Li HL, Zeng Q, et al. Effect of calcium magnesium phosphate on rhizosphere soil microflora of tobacco plants with bacterial wilt[J]. Chinese Journal of Tobacco, 2016, 22(1): 75-79. |
| [24] |
Yin DH, Wang N, Xia F, et al. Impact of biocontrol agents Pseudomonas fluorescens 2P24 and CPF10 on the bacterial community in the cucumber rhizosphere[J]. Europ J Soil Biol, 2013, 59: 36-42. DOI:10.1016/j.ejsobi.2013.09.001 |
| [25] |
Ji GH, Wei LF, He YQ, et al. Biological control of rice bacterial blight by Lysobacter antibioticus strain[J]. Biological Control, 2008, 45(3): 288-296. DOI:10.1016/j.biocontrol.2008.01.004 |
| [26] |
Shekhawat GS, Perombelon MC. Factors affecting survival in soil and virulence of Pseudomonas solanacearum[J]. Zeitschrift fuer Pflanzenkrankheiten und Pflanzenschutz, 1991, 98(3): 258-267. |
| [27] |
喻延.土壤pH值及不同调控措施对烟草青枯病发生情况的影响[D].重庆: 西南大学, 2016. Yu Y. Effects of soil pH and different control measures on tobacco bacterial wilt[D]. Chongqing : Southwest University, 2016. |
| [28] |
廖咏梅, 张桂英, 罗家立, 等. 土壤条件与番茄青枯病发生的关系探讨[J]. 广西植保, 1997(3): 13-16. Liao YM, Zhang GY, Luo JL, et al. Relationship between soil conditions and tomato bacterial wilt[J]. Guangxi plant protection, 1997(3): 13-16. |
| [29] |
李集勤, 陈俊标, 袁清华, 等. 客土改良对植烟土壤营养及烟草青枯病的影响[J]. 中国烟草科学, 2017, 38(1): 48-52. Li JQ, Chen JB, Yuan QH, et al. Effects of foreign soil improvement on soil nutrition and bacterial wilt of tobacco[J]. China Tobacco Science, 2017, 38(1): 48-52. |
| [30] |
何凯.生物有机肥和石灰石对青枯病防治及烟叶品质的影响[D].重庆: 西南大学, 2015. He K. Effects of bio organic fertilizer and limestone on bacterial wilt control and tobacco quality[D]. Chongqing : Southwest University, 2015. |
| [31] |
杨红武.不同耕作制土壤和叶面微生物群落与三种烟草病害的关系[D].长沙: 湖南农业大学, 2018. Yang HW. Relationship between soil and leaf microbial communities under different tillage systems and three tobacco diseases[D]. Changsha : Hunan Agricultural University, 2018. |
| [32] |
陈乾锦, 林书震, 李红丽, 等. 邵武烟田土壤微生物群落结构变化与烟草青枯病发生关系初报[J]. 中国烟草学报, 2019, 25(4): 4-10. Chen QJ, Lin SZ, Li HL, et al. A preliminary report on the relationship between the changes of soil microbial community structure and the occurrence of tobacco bacterial wilt in Shaowu tobacco field[J]. Chinese Journal of Tobacco, 2019, 25(4): 4-10. |
| [33] |
林书震.烟田土壤微生物特征及与青枯病发生关系研究[D].郑州: 郑州大学, 2019. Lin SZ. Study on the relationship between soil microbial characteristics and bacterial wilt in tobacco field[D]. Zhengzhou : Zhengzhou University, 2019. |
| [34] |
Wang R, Zhang H, Sun L, et al. Microbial community composition is related to soil biological and chemical properties and bacterial wilt outbreak[J]. Scientific Reports, 2017, 7(1): 343-345. DOI:10.1038/s41598-017-00472-6 |
| [35] |
She S, Niu J, Zhang C, et al. Significant relationship between soil bacterial community structure and incidence of bacterial wilt disease under continuous cropping system[J]. Archives of Microbiology, 2017, 199(2): 267-275. DOI:10.1007/s00203-016-1301-x |
| [36] |
刘开朗, 王加启, 卜登攀, 等. 环境微生物群落结构与功能多样性研究方法[J]. 生态学报, 2010, 30(4): 1074-1080. Liu K L, Wang J Q, Bu D P, et al. Research methods of community structure and functional diversity of environmental microorganism[J]. J Ecol, 2010, 30(4): 1074-1080. |
| [37] |
匡传富, 何志明, 汤若云, 等. 烟草青枯病土壤微生物数量及生理群的测定[J]. 中国烟草科学, 2003, 5(1): 43-45. Kuang CF, He ZM, Tang RY, et al. Determination of soil microbial quantity and physiological group of tobacco bacterial wilt[J]. China Tobacco Science, 2003, 5(1): 43-45. |
| [38] |
李黎绅, 李淑玲, 袁清华. 紫色土壤微生物种群和数量与烟草青枯病发生的关系研究[J]. 广州农业科学, 2013, 2(7): 80-85. Li LS, Li SL, Yuan QH. Study on the relationship between the microbial population and quantity of purple soil and the occurrence of tobacco bacterial wilt[J]. Guangzhou Agricultural Science, 2013, 2(7): 80-85. |
| [39] |
韩雪, 吴凤芝, 潘凯, 等. 根系分泌物与土传病害关系之研究综述[J]. 中国农学通报, 2006, 2(22): 316-318. Han X, Wu FZ, Pan K, et al. Review on the relationship between root exudates and soil borne diseases[J]. China Agronomy Bulletin, 2006, 2(22): 316-318. |
| [40] |
常安然, 李佳, 张耸, 等. 基于宏基因组学16S rDNA测序对烟草根际土壤细菌群落组成分析[J]. 中国农业科技导报, 2017, 19(2): 43-50. Chang AR, Li J, Zhang S, et al. Analysis of bacterial community composition in tobacco rhizosphere soil based on 16S rDNA sequencing of macrogenomics[J]. China Agricultural Science and Technology Herald, 2017, 19(2): 43-50. |
| [41] |
Liu XJ, Zhang ST, Jiang QP, et al. Using community analysis to explore bacterial indicators for disease suppression of tobacco bacterial wilt[J]. Scientific Reports, 2016, 6: 36773. DOI:10.1038/srep36773 |
| [42] |
施河丽, 向必坤, 谭军, 等. 烟草青枯病发病烟株根际土壤细菌群落分析[J]. 中国烟草学报, 2018, 24(5): 61-69. Shi HL, Xiang BK, Tan J, et al. Analysis of bacterial community in rhizosphere soil of tobacco plant with bacterial wilt[J]. Chinese Journal of Tobacco, 2018, 24(5): 61-69. |
| [43] |
Berendsen RL, Corné MJP, Bakker PAHM. The rhizosphere microbiome and plant health[J]. Trends Plant Sci, 2012, 17(8): 4-8. |
| [44] |
向立刚, 周浩, 汪汉成, 等. 健康与感染青枯病烟株不同部位细菌群落结构与多样性[J]. 微生物学报, 2018, 5(24): 3-5. Xiang LG, Zhou H, Wang HC, et al. Bacterial community structure and diversity in different parts of healthy and infected tobacco[J]. Journal of Microbiology, 2018, 5(24): 3-5. |
| [45] |
刘晓姣.烟草根际抑病土壤有益微生物的组学特征及对青枯病的拮抗作用研究[D].重庆: 西南大学, 2018. Liu XJ. Study on the histochemical characteristics of beneficial microorganisms and their antagonistic effect on bacterial wilt in tobacco rhizosphere disease resistant soil[D]. Chongqing : Southwest University, 2018: 107-109. |
| [46] |
Wu K, Yuan S, Wang L, et al. Effects of bio-organic fertilizer plus soil amendment on the control of tobacco bacterial wilt and composition of soil bacterial communities[J]. Biology and Fertility of Soils, 2014, 50(6): 961-971. DOI:10.1007/s00374-014-0916-9 |
| [47] |
Wei Z, Yang T, Friman VP, et al. Trophic network architecture of root-associated bacterial communities determines pathogen invasionand plant health[J]. Nature Communication, 2015, 6: 8413. DOI:10.1038/ncomms9413 |
| [48] |
韦中.生物有机肥防控土传番茄青枯病的效果及其机制研究[D].南京: 南京农业大学, 2012. Wei Z. Effect and mechanism of bio organic fertilizer on controlling soil borne tomato bacterial wilt[D]. Nanjing : Nanjing Agricultural University, 2012 : 51-53. |
| [49] |
Dipak SP, Daniel S, Chun TY, et al. Long-term no-till :a major driver of fungal communities in dryland wheat cropping systems[J]. Public Library of Science, 2017, 12(9). |
| [50] |
林书震, 李小龙, 李红丽, 等. 烟株生长过程中土壤微生物的变化特征[J]. 中国土壤与肥料, 2019(5): 14-24. Lin SZ, Li XL, Li HL, et al. Characteristics of soil microbial changes during tobacco growth[J]. Chinese Journal of soil and fertilizer, 2019(5): 14-24. |
| [51] |
蔡秋华, 赵正雄, 左进香, 等. 有机肥配施减量化肥对烤烟青枯病及其根际微生物的影响[J]. 烟草科技, 2018, 51(11): 20-27. Cai QH, Zhao ZX, Zuo JX, et al. Effects of organic fertilizer combined with reduced chemical fertilizer on tobacco bacterial wilt and rhizosphere microorganisms[J]. Tobacco science and technology, 2018, 51(11): 20-27. |
| [52] |
吴晓宗, 王岩. 生物有机肥防治烟草青枯病及对土壤微生物多样性的影响[J]. 中国土壤与肥料, 2019(4): 193-199. Wu XZ, Wang Y. Effect of bio organic fertilizer on tobacco bacterial wilt and soil microbial diversity[J]. Chinese Journal of soil and fertilizer, 2019(4): 193-199. |
| [53] |
沈桂花.生物熏蒸对烟草连作土壤微生物群落的影响及对青枯病的控制作用研究[D].重庆: 西南大学, 2019. Shen GH. Effect of biological fumigation on soil microbial community and control of bacterial wilt in tobacco continuous cropping system[D]. Chongqing : Southwest University, 2019. |
| [54] |
赵文宗.嫁接番茄抗青枯病特性及根系分泌物化感作用的研究[D].广西: 广西大学, 2019. Zhao WZ. Study on the resistance of grafted tomato to bacterial wilt and Allelopathy of root exudates[D]. Guangxi : Guangxi University, 2019. |
| [55] |
张卫娜, 贾谏, 陆晓宇, 等. 镰刀菌属真菌毒素的研究进展[J]. 广东农业科学, 2013, 40(15): 130-133. Zhang WN, Jia J, Lu XY, et al. Research progress of Fusarium mycotoxins[J]. Guangdong Agricultural Sciences, 2013, 40(15): 130-133. |
| [56] |
王婷婷.生防丛枝菌根真菌的发掘及在烟草上的应用研究初探[D].南京: 南京农业大学, 2013. Wang TT. Exploration of biocontrol arbuscular mycorrhizal fungi and their application in tobacco[D]. Nanjing : Nanjing Agricultural University, 2013. |
| [57] |
李海燕, 刘润进, 束怀瑞. 丛枝菌根真菌提高植物抗病性的作用机制[J]. 菌物系统, 2001(1): 435-439. Li HY, Liu RJ, Shu HR. The mechanism of arbuscular mycorrhizal fungi in improving plant disease resistance[J]. Mycological system, 2001(1): 435-439. |
| [58] |
胡正嘉, 王平. VA菌根真菌对棉花枯萎病的影响[J]. 土壤学报, 1994, 31. Hu ZJ, Wang P. Effects of VA mycorrhizal fungi on Fusarium Wilt of cotton[J]. Acta Sinica Sinica, 1994, 31. |
| [59] |
Hooker JE, Jaizme-Vega M, Atkinson D. Biocontrol of plant pathogens using arbuscular mycorrhzial fungi[M]. Impact of Arbuscular Mycorhizas on Sustainable Agriculture and Natural ecosystems. Verlag, Basel, Switzerland, 1994 :191-200.
|
| [60] |
朱红惠, 龙良坤, 羊宋贞, 等. AM真菌对青枯菌和根际细菌群落结构的影响[J]. 菌物学报, 2005(1): 137-142. Zhu HH, Long K, Yang SZ, et al. Effects of AM fungi on bacterial community structure of Ralstonia solanacearum and rhizosphere bacteria[J]. Acta mycologica Sinica, 2005(1): 137-142. |
| [61] |
赵子豪, 雷愉, 龙雯素, 等. 银杏内生真菌及其在姜青枯病防治方面的研究进展[J]. 湖南科技学院学报, 2019, 40(5): 31-35. Zhao ZH, Lei Y, Long WS, et al. Endophytic fungi of Ginkgo biloba and its application in the control of Ginger Bacterial Wilt[J]. Journal of Hunan University of science and technology, 2019, 40(5): 31-35. |
| [62] |
周松林, 陈双林, 谭光宏, 等. 一株银杏内生真菌菌株的抑菌活性成分研究[J]. 天然产物研究与开发, 2010, 22(2): 193-196. Zhou SL, Chen SL, Tan GH, et al. Study on the antibacterial activity of an endophytic fungus strain from Ginkgo biloba[J]. Natural Product Research and Development, 2010, 22(2): 193-196. |
| [63] |
朱红惠, 姚青, 李浩华, 等. AM真菌对青枯菌的抑制和对酚类物质的影响[J]. 微生物学通报, 2004(1): 1-5. Zhu HH, Yao Q, Li HH, et al. Inhibition of AM fungi on Ralstonia solanacearum and its effect on phenolic compounds[J]. Bulletin of Microbiology, 2004(1): 1-5. |
| [64] |
谭树朋, 孙文献, 刘润进. 球囊霉属真菌与芽孢杆菌M3-4协同作用降低马铃薯青枯病的发生及其机制初探[J]. 植物病理学报, 2015, 45(6): 661-669. Tan SP, Sun WW, Liu RJ. Synergistic effect of ascomycete and Bacillus M3-4 on reducing potato bacterial wilt and its mechanism[J]. Acta Phytopathology, 2015, 45(6): 661-669. |
| [65] |
顾静馨.土壤微生物生态网络的构建方法及其比较[D].扬州: 扬州大学, 2015. Gu JX. Construction methods and comparison of soil microbial ecological networks[D]. Yangzhou : Yangzhou University, 2015. |
| [66] |
Yeung MKS, Tegnér J, Collins JJ. Reverse engineering gene networks using singular value decomposition and robust regression[J]. Proc Natl Acad Sci, 2002, 99(9): 6163-6168. DOI:10.1073/pnas.092576199 |
| [67] |
Gerstung M, Baudis M, Moch H, et al. Quantifying cancer progression with conjunctive Bayesian networks[J]. Bioinformatics, 2009, 25(21): 2809-2815. DOI:10.1093/bioinformatics/btp505 |
| [68] |
Horvath S, Dong J, Miyano S. Geometric interpretation of gene Coexpression network analysis[J]. Public Library of Science Computational Biology, 2008, 4(8): e1000117. |
| [69] |
Detti A. Conet :a content centric inter-networking architecture[J]. Association for Computing Machinery Conference on Information Centric Networking, 2011, 11(8): 2-6. |
| [70] |
Soffer, Nitzan, Zaneveld, et al. Phage-bacteria network analysis and its implication for the understanding of coral disease[J]. Environmental Microbiology, 17(4): 1203-1218. DOI:10.1111/1462-2920.12553 |
| [71] |
Ji Z, Deng Y, Luo F, et al. Phylogenetic molecular ecological network of soil microbial communities in response to elevated CO2[J]. Microbiology, 2011, 2(4): e00122-11. |
| [72] |
Case TJ. Invasion resistance arises in strongly interacting species-rich model competition communities[J]. Proc Natl Acad Sci, 1990, 87(24): 9610-9614. DOI:10.1073/pnas.87.24.9610 |
| [73] |
Yang HW, Li J, Xiao Y, et al. An integrated Insight into the relationship between soil microbial community and tobacco bacterial wilt disease[J]. Front Microbiol, 2017, 8(9): 2179. |
| [74] |
Newman MEJ. Modularity and community structure in networks[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(23): 8577-8582. DOI:10.1073/pnas.0601602103 |
| [75] |
Wei Z, Gu Y, Friman VP, et al. Initial soil microbiome composition and functioning predetermine future plant health[J]. Science Advances, 2019, 5(9): eaaw0759. DOI:10.1126/sciadv.aaw0759 |
| [76] |
Wei Z, Yang X, Yin S, et al. Efficacy of Bacillus-fortified organic fertiliser in controlling bacterial wilt of tomato in the field[J]. Applied Soil Ecology, 2011, 48(2): 152-159. DOI:10.1016/j.apsoil.2011.03.013 |
| [77] |
Olesen JM, Bascompte J, Dupont YL, et al. The modularity of pollination networks[J]. Proc Natl Acad Sci, 2007, 104(50): 19891-19896. DOI:10.1073/pnas.0706375104 |
| [78] |
Lu L, Yin S, Liu X, et al. Fungal networks in yield-invigorating and debilitating soils induced by prolonged potato monoculture[J]. Soil Biology and Biochemistry, 2013, 65: 186-194. DOI:10.1016/j.soilbio.2013.05.025 |
| [79] |
Chaffron S, Rehrauer H, Pernthaler J, et al. A global network of coexisting microbes from environmental and whole-genome sequence data[J]. Genome Research, 2010, 20(7): 947-959. DOI:10.1101/gr.104521.109 |
| [80] |
Guimerà, Roger, Sales-Pardo M, et al. Classes of complex networks defined by role-to-role connectivity profiles[J]. Nature Physics, 2006, 3(1): 63-69. |
| [81] |
Bonacich P. Power and centrality :A family of measures[J]. American Journal of Sociology, 1987, 92(5): 1170-1182. DOI:10.1086/228631 |
| [82] |
Li S, Xu C, Wang J, et al. Cinnamic, myristic and fumaric acids in tobacco root exudates induce the infection of plants by Ralstonia solanacearum[J]. Plant Soil, 2017, 412(1): 381-395. |
| [83] |
Li M, Wang J, Jousset A, et al. Facilitation promotes invasions in plant-associated microbial communities[J]. Ecology Letters, 2019, 22(1): 149-158. |
| [84] |
Bais HP, Vivanco FJM. Biocontrol of Bacillus subtilis against infection of arabidopsis roots by Pseudomonas syringae is facilitated by biofilm formation and surfactin production[J]. Plant Physiology, 2004, 134(1): 307-319. |
| [85] |
Rangaswamy V, Jiralerspong S, Parry R, et al. Biosynthesis of the Pseudomonas polyketide coronafacic acid requires monofunctional and multifunctional polyketide synthase proteins[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(26): 15469-15474. DOI:10.1073/pnas.95.26.15469 |
| [86] |
Chater KF, Biró S, Lee KJ, et al. The complex extracellular biology of Streptomyces[J]. Federation of European Microbiological Societies Microbiology Reviews, 2010, 34(2): 171-198. |
| [87] |
Cao Y, Zhang Z, Ling N, et al. Bacillus subtilis SQR 9 can contro Fusarium wilt in cucumber by colonizing plant roots[J]. Biology and Fertility of Soils, 2011, 47(5): 495-506. DOI:10.1007/s00374-011-0556-2 |
| [88] |
Li M, Wei Z, Wang J, et al. Facilitation promotes invasion in plant-associated microbial communities[J]. Ecology Letters, 2018, 22(1): 149-158. |
| [89] |
Jousset A, Bienhold C, Chatzinotas A, et al. Where less may be more :how the rare biosphere pulls ecosystems strings[J]. Multidisciplinary Journal of Microbial Ecology, 2017, 11(4): 853-862. |
| [90] |
Santhanam R, Luu VT, Weinhold A, et al. Native root-associated bacteria rescue a plant from a sudden-wilt disease that emerged during continuous cropping[J]. Proc Natl Acad Sci, 2015, 112(5): e5013-e5020. |
| [91] |
郑继法, 丁爱云, 张建华, 等. 山东省烟草青枯病的发生和病原菌鉴定研究[J]. 山东农业大学学报, 1996(1): 17-22. Zheng JF, Ding AY, Zhang JH, et al. Study on the occurrence and pathogen identification of tobacco bacterial wilt in Shandong Province[J]. Journal of Shandong Agricultural University, 1996(1): 17-22. |
| [92] |
易有金, 尹华群, 罗宽, 等. 烟草内生短短芽孢杆菌的分离鉴定及对烟草青枯病的防效[J]. 植物病理学报, 2007(3): 301-306. Yi YJ, Yin HQ, Luo K, et al. Isolation and identification of endophytic Brevibacillus brevis and its control effect on tobacco bacterial wilt[J]. Journal of plant pathology, 2007(3): 301-306. |
| [93] |
Yuan S, Wang L, Wu K, et al. Evaluation of Bacillus fortified organic fertilizer for controlling tobacco bacterial wilt in greenhouse and field experiments[J]. Applied Soil Ecology, 2014, 75: 86-94. DOI:10.1016/j.apsoil.2013.11.004 |
| [94] |
刘雅婷. 烟草青枯病的研究进展[J]. 云南农业大学学报, 2001, 16(1): 72-76. Liu YT. Research progress of tobacco bacterial wilt[J]. Journal of Yunnan Agricultural University, 2001, 16(1): 72-76. |
| [95] |
Trigalet A. Use of Airulent mutants of Pseudomonas for the biological control of bacterial wilt of tomato plants[J]. Physiological and Molecular Plant Pathology, 1990, 36: 27-38. DOI:10.1016/0885-5765(90)90089-G |
| [96] |
陈亮, 周晓见, 董昆明, 等. 1株烟草青枯病生防细菌的分离与鉴定[J]. 江苏农业科学, 2012, 40(1): 104-107. Chen L, Zhou XJ, Dong KM, et al. Isolation and identification of a biocontrol bacterium against tobacco bacterial wilt[J]. Jiangsu agricultural science, 2012, 40(1): 104-107. |
| [97] |
程小龙.外源水杨酸诱导烟草抗青枯病的作用及机理研究[D].重庆: 西南大学, 2014. Cheng XL. Study on the effect and mechanism of exogenous Salicylic acid induced tobacco resistance to bacterial wilt[D]. Chongqing: Southwest University, 2014. |
| [98] |
陈达.拮抗菌和青枯菌无致病力突变株防控茄科作物青枯病的效应和机理研究[D].南京: 南京农业大学, 2014. Chen D. Study on the effect and mechanism of antagonistic bacteria and bacterial wilt resistant mutants on the control of Solanaceae bacterial wilt[D]. Nanjing : Nanjing Agricultural University, 2014. |
| [99] |
董春, 曾宪铭, 刘琼光. 利用无致病力青枯菌株防治番茄青枯病的研究[J]. 华南农业大学学报, 1999(4): 1-4. Dong C, Zeng XM, Liu QG. Study on the control of tomato bacterial wilt by non- pathogenic bacterial strains[J]. Journal of South China Agricultural University, 1999(4): 1-4. |
| [100] |
陈巧玲, 胡江, 汪汉成, 等. 生物有机肥对盆栽烟草根际青枯病原菌和短芽孢杆菌数量的影响[J]. 南京农业大学学报, 2012, 35(1): 75-79. Chen QL, Hu J, Wang HC, et al. The effect of bio-organic fertilizer on the quantity of original bacteria and Bacillus brevis of rhizosphere bacterial wilt of potted tobacco[J]. Journal of Nanjing Agricultural University, 2012, 35(1): 75-79. |
| [101] |
肖相政, 刘可星, 廖宗文, 等. 枯草芽孢杆菌X-4对土壤青枯菌消长变化及防病效果的影响[J]. 湖北农业科学, 2011, 50(12): 2425-2429. Xiao XZ, Liu KX, Liao ZW, et al. The effect of Bacillus subtilis x-4 on the growth and development of soil bacterial wilt and its disease control effect[J]. Hubei agricultural science, 2011, 50(12): 2425-2429. |




