2. 山东省盐碱地植物 - 微生物联合修复工程技术研究中心 山东省农业微生物重点实验室,泰安 271018
2. Shandong Engineering Research Center of Plant-Microbial Restoration for Saline-Alkali Land/Shandong Key Laboratory of Agricultural Microbiology, Tai'an 271018
人口的不断增长以及社会发展节奏的加快,导致了环境资源紧张、耕地面积逐渐减少,世界范围内土壤盐渍化问题也日趋严峻。受气候、地理、土壤质地等多种因素的影响,土壤中的可溶性盐类重新分配,逐渐在土壤表层积聚而形成盐碱地。据不完全统计,全球盐碱地总面积达10亿hm2,约占陆地总面积的1/10[1]。适量的无机盐离子会促进植物的生长,但当土壤盐分过高时,就会影响植物的生长发育,引起盐分胁迫。盐胁迫是影响作物生产的重要逆境因子[2]。新疆轻度盐渍化土壤上的作物产量较正常土地上的相比会降低10%-15%,中度盐渍化土壤上作物产量会降低20%,甚至更多[3];苏北沿海地区近海口处土壤盐分过高,土壤有机质含量低,几乎无植被生长;黄河三角洲受多种因素的影响而土壤盐渍化严重,土壤盐度与土壤中营养物质含量呈负相关[4],严重制约着当地的生态稳定和农业发展。为了更好地开发和利用盐碱土地资源,人们采取了优化灌溉、增施有机肥、施用石膏及腐殖酸等多种措施以降低土壤含盐量,但都收效甚微。近年来利用微生物的耐盐性对盐碱土进行改良,可以提高植物耐盐能力,此部分研究已成为土壤微生物学和微生物生态学的热点之一。
植物根际促生细菌(Plant growth-promoting rhizobacteria,PGPR)是一类定殖于植物根际的对植物生长起促进作用的细菌,具有加速营养物质的吸收利用、防治植物病害和应对非生物胁迫的能力[5]。目前已鉴定出多种PGPR菌株,其中的芽孢杆菌因抗逆能力强而备受关注。蜡样芽孢杆菌(Bacillus cereus)JYZ-SD2[6]在含氯化钠0%-6%的平板上均能生长;枯草芽孢杆菌(B. subtilis)BR5和巨大芽孢杆菌(B. megaterium)BN7[7]的氯化钠耐受能力达到了18%,并在盐渍土壤盆栽实验中表现出良好的促生效果;地衣芽孢杆菌(B. licheniformis)SSA61[8]甚至可在盐浓度高达25%的条件下生长繁殖。研究芽孢杆菌对盐胁迫的耐受机制及其促进植物耐盐生长的机理,对盐碱地的改良及开发利用具有重要意义。
1 芽孢杆菌的生物学特性与应用芽孢杆菌大多细胞壁较厚,肽聚糖层致密交联,主要存在于土壤等生境。芽孢杆菌具有产芽孢的能力,芽孢为一种休眠体构造,抗逆性极强,对干旱、盐害、化学药物等均具有一定程度的抵抗能力。芽孢杆菌可水解淀粉、还原硝酸盐、降解蛋白质等,为好氧或兼性厌氧菌[9]。
芽孢杆菌生理特征丰富多样,在农业、发酵工业、医药行业及食品领域等具有广泛的应用价值。芽孢杆菌在生长繁殖过程中产生的蛋白酶、淀粉酶、有机酸等,可促进复杂有机物的分解,使营养物质的吸收利用更加高效。芽孢杆菌可分泌产生多种活性代谢物,如多黏菌素、抗菌肽、抗病毒活性物质等,这些物质是天然药物的重要来源之一。另外,芽孢杆菌还是目前研究较多的一类有益生防细菌,其在农业生产上的作用主要可表现在两方面,其一为促生作用:如施用芽孢杆菌XT1[10]菌液的番茄、辣椒、南瓜和黄瓜的地上鲜重均有不同程度的增加;其二为抗菌与防治病害作用:芽孢杆菌具有广泛的抗菌活性,可拮抗许多病原真菌,研究表明,枯草芽孢杆菌与钾联用对黑腐皮菌有良好的抑制作用[11],对苹果树腐烂病具有一定的防治效果,一株内生芽孢杆菌OEE1[12]可用于防治橄榄黄萎病等。
2 芽孢杆菌的耐盐基因芽孢杆菌可通过多种作用增强植物耐盐性,促进盐胁迫条件下植株的生长,提高作物产量。芽孢杆菌的耐盐机制是通过调节自身耐盐基因的表达来实现的。近年来,芽孢杆菌相关耐盐基因也不断被挖掘,从基因角度深入认识芽孢杆菌的耐盐性有助于研究新的转基因耐盐作物,提高盐碱地的利用率。
2.1 Na+外排相关基因盐胁迫对细胞膜的损伤可使胞外大量盐离子输入细胞内,Na+过量累积会对微生物细胞造成毒害,此时Na+/H+逆向转运蛋白的存在对于维持细胞正常盐浓度和pH稳态起关键性作用。Na+/H+逆向转运蛋白又称Na+/H+泵,是一类负责离子交换的跨膜蛋白,可在ATP的驱动下可将胞内多余的Na+泵出细胞[13]。1997年研究者从芽孢杆菌(B. firmus)OF4811M中首次克隆出了编码Na+/H+逆向转运蛋白的基因nhaC[14];2008年Yang等[15]从达坂芽孢杆菌(Halobacillus dabanensis)中克隆得到基因nhaH,这是第一个来自中度嗜盐菌的与Na+外排有关的基因,其亲水性C-末端结构域只有9个氨基酸残基,用PCR方法构建C端亲水区域缺失突变株NHδC并转化大肠杆菌,其在高盐环境中的生长受到抑制;在枯草芽孢杆菌的基因组中也已鉴定出多个编码逆向转运蛋白基因,如mrp、tetA(L)、nhaC、nhaK、mleN及yvgP等[16],其中mrp是常见的编码逆向转运蛋白的基因,广泛存在于细菌和古细菌中。Mrp结构复杂,是由7个亚基构成的异源寡聚复合物,每个亚基对蛋白质活性的发挥都是不可或缺的[17]。在高浓度的钠离子、锂离子或钾离子存在的情况下,mrp系统对于维持细菌离子平衡和酸碱度稳态至关重要[18]。
2.2 胞内积累小分子物质的相关基因积累渗透压保护物质是微生物耐受高盐环境最常见的机制,一方面可缓解高盐压力;另一方面这些亲和性溶质可迅速的合成和降解,不会对细胞造成额外的负担。四氢嘧啶是一种小分子物质,在细胞内大量积累可起平衡渗透压的作用。张薇等[19]从中度嗜盐菌(B. alcalophilus DTY1)中克隆出了四氢嘧啶合成基因簇etcABC,etcA基因编码二氨基丁酸乙酰基转移酶,etcB编码二氨基丁酸氨基转移酶,etcC编码四氢嘧啶合成酶;鞠建松等将与四氢嘧啶合成有关的3个基因构建共表达质粒载体,转化后获得的重组菌株具有高效的四氢嘧啶合成能力,菌株也具有极强的耐盐性[20]。脯氨酸也是关注度较高的一类渗透压保护物质,芽孢杆菌在面对高盐环境时,可通过积累大量脯氨酸作为应激保护剂[21]。与脯氨酸合成有关的基因有proA(γ-谷氨酰磷酸还原酶)、proB(γ-谷氨酰胺激酶)、proH(δ1-吡咯啉-5-碳氧基酸还原酶)和proI(δ1-吡咯啉-5-羧酸还原酶)等。ProJ和ProH是面对渗透胁迫时产生脯氨酸的关键因子,它们的结构基因由SigA型启动子转录,但目前尚不清楚原核启动子的调控特征[22]。
2.3 应激蛋白基因芽孢杆菌细胞在受到外界刺激时,最显著的反应之一是诱导产生大量的应激蛋白(General stress proteins,GSPs)[23],GSPs是广泛存在于生物系统的一类保护性蛋白。早在1994年,科学家就从枯草芽孢杆菌中克隆出了与应激反应相关的cIpC基因。研究表明,当芽孢杆菌暴露于高温、高盐等多种环境压力时,cIpC基因转录水平就会显著提升[24]。近年来,科学家又从枯草芽孢杆菌中发现了小分子Hsp:YocM,其在盐胁迫反应中具有积极的作用。6% NaCl条件下yocM缺失菌株的存活会受到威胁,而野生型菌株YocM的表达明显增加,细胞生长状况良好[25]。YocM在细胞中的积累可以起到识别错误折叠蛋白质聚集体的作用,其与化学伴侣互作可清除蛋白质聚集体,分解受损的蛋白质等,增强对细胞的协同保护作用。此外,许多由热、乙醇、盐胁迫或葡萄糖、磷酸盐饥饿等诱导的GSPs的表达需要依赖σ调控因子[26]。盐胁迫条件下,枯草芽孢杆菌的转录组学和蛋白质组学分析发现σB、σW、σM和σX调节因子普遍存在[27]。σB依赖型应激蛋白最为常见,其至少可以分为5个功能组,这些功能组可为生长受限的枯草芽孢杆菌细胞提供多重应激抗性[26]。
2.4 DegS-DegU信号转导系统许多研究表明,DegS-DegU双组分系统参与了芽孢杆菌对盐胁迫条件的感知,调节相关基因的表达。DegS-DegU控制某些降解酶的合成,在枯草芽孢杆菌中,盐胁迫会强烈刺激编码左旋蛋白酶的sacB基因的表达(约9倍),并下调编码碱性蛋白酶的aprE基因的表达(约6倍)[28]。在高盐培养条件下,重组枯草芽孢杆菌AJ73(pCS9)的丝氨酸蛋白酶的生物合成得到增强,然而在缺乏调节蛋白DegS和DegU的重组枯草芽孢杆菌中,丝氨酸蛋白酶基因的表达被抑制,DegS-DegU系统参与了菌株AJ73(pCS9)中蛋白酶基因表达的正向调节[29]。DegS-DegU信号转导系统可调节大分子的合成、降解或转运入胞,从而参与渗透调节和渗透休克后的适应性。wapA属于受盐胁迫影响的DegS-DegU调节因子,在低盐浓度下高表达,而在高盐浓度下几乎完全被抑制,原因是盐胁迫诱导一额外的阻遏物作用于wapA控制区,从而下调其表达过程。WapA通过充当筛子、离子孔或通道来增加细胞壁的渗透性,关闭它的合成可以防止外部介质和细胞质室之间的过度交换[30]。鸟苷酸特异性核糖核酸酶(RNases)可为芽孢杆菌细胞提供有效磷元素,研究发现,逐渐提高环状芽孢杆菌(B. circulans)培养环境中的盐摩尔浓度,胞外鸟嘌呤核糖核酸酶Bci的水平会逐渐增加,研究者在RNase Bci启动子中发现了与调控蛋白DegU结合位点同源的序列,DegS-DegU系统也参与盐胁迫下RNase Bci表达的调节[31]。
2.5 其他基因有关芽孢杆菌耐盐基因的研究还有很多。例如芽孢杆菌N16-5暴露于高盐胁迫下,铁稳态调节因子fur的表达上调,fur可能在芽孢杆菌的盐适应中发挥作用[32]。将芽孢杆菌SJ-10的β-葡萄糖苷酶基因bglC[33]构建重组质粒转化大肠杆菌,重组菌在15% NaCl条件下的β-葡萄糖苷酶活性提高了3.3倍且热稳定性也提高1.5倍,而在45℃无盐条件下BglC蛋白110 min后完全丧失活性;此外,盐存在下的吉布斯自由能更高,由于在高盐度条件下酶活性和热稳定性得到提高,BglC是一种理想的耐盐酶。Zhang等[34]从地衣芽孢杆菌中克隆出了一种耐寒、耐碱、耐盐的酯酶Est700,在高盐浓度下稳定存在且没有活性损失。但Est700缺乏酸性表面,而酸性表面被认为是高盐度下酶稳定性的关键,这不同于所报道的大多数耐盐酯酶。
为了深入探究芽孢杆菌的耐盐促生机制,Wang等[35]对耐盐芽孢杆菌(B. flexus)KLBMP 4941进行了全基因组测序发现,它的基因组中存在很多与耐盐性相关的基因,如Na+输出相关基因mrpB、nhaC、yjbQ;钾转运蛋白基因ktrB;甘氨酸甜菜碱转运蛋白基因opuD、opuBA、opuCC;铁载体生物合成基因rhbC、rhbD、rhbE等。金和坡[36]对从酱油中分离出的两株具有良好耐盐特性的蜡样芽孢杆菌B25和B26也进行了全基因组测序与生物信息学分析,初步获得了49个可能与其耐盐性相关的基因,如感应蛋白基因kdpD、辅助蛋白基因czcD、分子伴侣groEL以及编码丙酮酸激酶、磷酸甘油酸酯酶、过氧化氢酶、葡萄糖酶等的一系列基因。这一研究对于建立微生物耐盐调控系统具有重要意义。
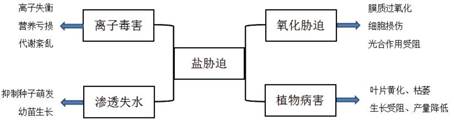
3 芽孢杆菌有助于植物的盐胁迫应答 3.1 植物的盐胁迫损伤高盐环境下植物的生长会受到抑制(图 1)。盐分胁迫会使植物细胞内丙二醛(MDA)的含量增加,过量的MDA会对细胞膜造成损害,引起质膜过氧化,影响细胞膜的通透性。细胞膜结构被破坏,离子交换失衡,胞外大量的Na+、Cl-进入细胞内,盐离子在胞内累积会降低细胞对Ca2+、K+、N元素、P元素等营养要素的吸收利用,进而影响植株的正常生物学功能。植株叶绿素含量也会受盐胁迫的影响,高盐条件下,叶绿体对光能的吸收和转化会减慢,植物的碳同化能力也会被抑制;以棉花为实验材料,研究盐胁迫对光合作用影响的实验证明,高盐条件下棉花叶片的最大羧化速率和最大电子传递速率均显著降低,净光合速率、叶肉导度和暗呼吸速率随盐分浓度的升高也下降[37]。盐胁迫还会对植株造成不可逆的氧化损伤;对小麦根系施加300 mmol/L的NaCl,4 h后其DNA发生片段化,盐胁迫会诱导根尖细胞发生程序性死亡[38]。种子能否萌发是决定植株生长发育状况的关键因素,而盐渍化土壤中含盐量高,细胞内的水势高于土壤介质,会造成种子渗透失水,种子的萌发过程就会被抑制;长穗偃麦草对低盐浓度具有一定的耐受性,但在高盐环境下生长的植株其种子活力指数、发芽率、发芽指数均显著降低,并且胚芽长、胚根长较对照组相比也逐渐下降。[39]
盐渍土不利于植物的生长,提高作物自身耐盐能力来适应高盐环境,可拓展作物种植范围,具有重要意义。芽孢杆菌是土壤中的优势微生物种群,具有优良的耐盐特性。表 1归纳了近5年国内外芽孢杆菌提高植物耐盐性、促进植株生长的一些相关研究。随着芽孢杆菌耐盐机制研究的深入,其对植物的盐胁迫应答作用也不断被揭示。
3.2.1 芽孢杆菌产生ACC脱氨酶提高植物耐盐性近几年研究发现,盐胁迫会引起植物激素乙烯的增加。正常生理条件下,乙烯具有促进果实成熟、诱导不定根和根毛发生等积极作用;但乙烯的过度合成会抑制植株根的伸长,乙烯还被称为逆境下植物生长的抑制剂和衰老促进剂。芽孢杆菌可产大量的ACC脱氨酶(1-氨基环丙烷-1-羧酸脱氨酶),它可将用于逆境乙烯合成的直接前体物质ACC分解为氨和ɑ-丁酮酸,以提高植物对逆境的适应能力,减轻甚至抵消盐胁迫的影响,促进植物生长。ACC脱氨酶是诱导植物耐盐胁迫的最有效机制之一[58]。从蜡样芽孢杆菌HK012[59]中克隆acds基因(编码ACC脱氨酶)并构建超表达载体,转入烟草细胞,转基因烟草的耐盐性明显增强。Misra等[53]所研究的3株芽孢杆菌在盐胁迫下均能积累ACC脱氨酶,并调节ACC-氧化酶(ACO)和ACC-合酶(ACS)等的活性来减轻乙烯的不利影响。从山东滨海盐碱土壤中筛选得到的耐盐菌株zhs2,其与芽孢杆菌属特征相符并具有ACC脱氨酶活性,将其作用于盐胁迫下的小麦种子,处理后的小麦幼苗相对根长较对照组增加26%,相对芽长也增加了20%[60]。施加暹罗芽孢杆菌(B. siamensis)PM13和甲基营养型芽孢杆菌(B. methylotrophicus)PM19[61]对盐胁迫下的小麦生长同样具有积极的影响,PM13和PM19不仅具有产ACC脱氨酶的能力,在盐胁迫条件下还可产生胞外多糖,胞外多糖对钠离子的螯合和ACC的降解具有积极作用,从而可有效降低盐胁迫对小麦生长的影响。
3.2.2 芽孢杆菌分泌铁载体提高植物耐盐性铁元素在自然环境中主要以Fe3+的形式存在,通常植物和各类微生物都难以利用。铁载体是铁的低分子量螯合剂,主要存在于微生物中。芽孢杆菌可分泌铁载体以增加铁元素的摄入量。枯草芽孢杆菌pk5-26[62]在严重盐胁迫条件下也能生长,并且对拟南芥的促生效果显著,经研究其不仅具有溶磷、固氮作用,还具有氧化锌以及分泌铁载体的功能。Ramadoss等[63]所研究的5株芽孢杆菌虽然都不产ACC脱氨酶,但均能减轻盐胁迫对小麦幼苗的影响,其中SL3和J8W具有良好的铁载体分泌能力。
3.2.3 芽孢杆菌调节植物激素的分泌促进植物在盐胁迫条件下的生长植物激素对于调节植物生长发育不可或缺,并且在诱导植物对各种生物和非生物胁迫的耐受性方面也起主要作用[64]。许多研究表明,植物在盐胁迫条件下体内激素水平会受到较大影响。以生长素(IAA)为例,苗期向日葵在受到浓度为100 mmol/L的NaCl处理30 h后,其根、茎、叶处IAA浓度与对照组相比分别降低约35%、11%和16%[65];酸枣幼苗在盐胁迫条件下叶和根的脱落酸(ABA)含量增加,IAA含量减少,IAA/ABA的比值整体显著下降[66]。部分芽孢杆菌具有产IAA的能力,短小芽孢杆菌(Brevibacillus parabrevis)BI07[67]在添加色氨酸的培养基中培养4 d,IAA产量可达36.1 μg/mL;解淀粉芽孢杆菌C3[68]产IAA能力最高可达251.37 μg/mL。Khan等[69]的研究发现,在受到高盐胁迫的大豆幼苗中IAA调节基因gmLAX3的表达减少,而在接种芽孢杆菌后,其表达从11.26%上调至43.13%,这说明芽孢杆菌调节IAA生成量也是增强植株耐盐性的重要因素。
3.2.4 芽孢杆菌通过调节渗透压缓解植物盐胁迫植物体内渗透压低于环境渗透压的状况称为渗透胁迫。盐害、干旱等是常见的植物渗透胁迫因素,也有研究称盐害是造成干旱胁迫的重要影响因子。芽孢杆菌可通过分泌四氢嘧啶、可溶性多糖、甜菜碱、氨基酸等不影响细胞正常代谢活动的小分子化合物来降低植株体内渗透势,提高细胞内水活度,减轻盐胁迫对植株造成的危害。王磊等[70]从山东烟台近海盐场泥样中分离到一株嗜盐芽孢杆菌YTM-5,高盐浓度条件下培养,其细胞内四氢嘧啶的浓度显著增加;地衣芽孢杆菌SSA61[8]长期暴露于盐胁迫条件下时,细菌细胞内脯氨酸浓度增加可达5倍,甘氨酸和甜菜碱的积累也近1.5倍。这些渗透调节物质的积累是芽孢杆菌在高盐条件下存活的原因之一,也会在一定程度上提高植物细胞内的渗透压,缓解植物盐胁迫。
3.2.5 芽孢杆菌通过溶磷作用提高植物耐盐性磷是植物生长所必须的微量元素,核酸和植酸是土壤中有机磷存在的主要形式,其有效性并不高,无机磷则以磷酸盐的形式存在。土壤中普遍处于缺磷状态,大多数农作物生长所需要的磷元素常靠施加磷肥来补充。芽孢杆菌除可产生特异性磷酸酶将有机磷转化为无机磷外[71],还可产植酸酶,将植酸降解从而提高土壤中磷元素的利用率。郭英等[72]将植酸酶活力较高枯草芽孢杆菌T2进行化学诱变,体外筛选得负突变株M3,T2菌株发酵液作用于盐处理的小麦水培液中,水培液中有效磷含量大幅提高,小麦长势良好,耐盐性明显增强,而M3菌株作用于同样处理的小麦根系,小麦鲜重等生物量不增反降。芽孢杆菌可通过改善植物磷营养状况提高植物耐盐性。Boukhris等[73]对突尼斯南部土壤中分离出的解淀粉芽孢杆菌(B. amyloliquefaciens)US573产生的胞外植酸酶进行了纯化和鉴定,这种酶(PHY US573)在20 g/L NaCl和LiCl存在下分别可保持80%和95%的活性,说明PHY US573具有一定的耐盐能力。
3.2.6 芽孢杆菌通过固氮作用提高植物耐盐性氮素是植物细胞的重要组成部分,盐胁迫会干扰植物氮代谢,抑制植物对铵和硝酸盐的吸收和同化,降低植物组织中的有效氮含量,影响植物的生产力。过量使用无机肥将增加土壤盐度、破坏土壤结构、改变土壤微生物的组成,芽孢杆菌可通过固氮作用提高植株内的氮含量,抑制盐胁迫对植物氮代谢所造成的影响。例如,枯草芽孢杆菌L1[74]可促进拟南芥中硝酸还原酶的活性,增强拟南芥对硝酸盐的同化和利用,促进植株的生长。
3.2.7 芽孢杆菌的抗氧化作用有利于植物的耐盐性植株的呼吸作用、氧化磷酸化等过程都离不开氧气的参与,然而,当植物受到盐胁迫时氧会被转变成活性氧,活性氧具有很强的氧化能力,其在细胞内的积累会导致某些代谢功能障碍甚至造成植株死亡[75]。芽孢杆菌可产生半胱氨酸、谷胱甘肽(GSH)和抗坏血酸等非酶组分以清除过量的活性氧化物,也可以通过上调某些抗氧化物酶的活性应对土壤盐分过高对植株所造成的氧化胁迫[40]。盐胁迫条件下解淀粉芽孢杆菌SN13的过氧化氢酶活性上调约1.6倍,活性氧含量显著降低,将其作用于水稻,其促进植株生长的能力比使用抗氧化剂的效果显著[76]。接种解淀粉芽孢杆菌SQR9可显著提高拟南芥和玉米的耐盐性能力,对菌株SQR9分泌的分子进行分选,发现亚精胺可诱导植物产生耐盐性。亚精胺会使谷氨酰胺合成酶和谷胱甘肽还原酶基因表达增加,从而导致谷胱甘肽水平增加,谷胱甘肽水平对清除活性氧至关重要。此外,菌株SQR9衍生的亚精胺还会上调植物nhx1和nhx7的表达,nhx1和nhx7将钠离子隔离到液泡中,并将钠离子排出细胞,从而降低离子毒性[77]。
4 小结与展望盐胁迫会对植株生长造成威胁,严重影响作物的质量及产量,利用植物根际促生细菌的耐盐特性可抵御高盐环境对植株所造成的影响。芽孢杆菌是非常重要的一类植物根际促生细菌,随着现代分子生物技术的发展,人们对芽孢杆菌耐盐性的研究由个体转向分子层面,从基因角度深入研究其耐盐机制及某些信号转导途径并取得了一些实质性的进展,这对于转基因耐盐作物的研究起到了推动作用。本文介绍了芽孢杆菌的主要耐盐机制,并从7个方面阐述了芽孢杆菌对植物的盐胁迫应答机制。不过,芽孢杆菌提高植物对盐的耐受能力的作用机制不是单一的,通常是多种途径共同作用的结果,如芽孢杆菌B19[78]同时具有溶解无机磷酸盐、产生长素、产铁载体以及吸附土壤中重金属镉的作用;苏云金芽孢杆菌E31[79]具有溶磷解钾,合成生长素和铁载体的作用,不仅具有良好的耐盐特性,其对温度和pH也具有较强耐受性。
芽孢杆菌的研究已不断深入,但有许多方面仍需加大科研力度。例如,芽孢杆菌虽可通过产植物激素促进植物在盐胁迫条件下的生长,但各种植物激素之间存在的相互促进或抑制的现象对芽孢杆菌和植物的影响需进一步阐明;芽孢杆菌的耐盐促生相关研究虽有很多,但芽孢杆菌与根际土壤中其他微生物对盐渍土的协同作用却鲜有报道[40]。目前,有关耐盐芽孢杆菌的研究和开发还只停留在实验室条件下,并未投入实际产业化生产,主要原因有以下几个方面:筛选得到的菌株大多存在生物活力不高的问题;菌株耐盐性的作用机理还不明确;自然环境与实验室条件存在差异,微生物菌剂的用法用量等还需大量田间试验。
微生物在诱导植株抵抗外界不良环境的影响方面具有广阔的应用价值,为了推动芽孢杆菌在盐渍土壤中的应用,今后的研究重点应放在揭示其耐盐机制上,如深入研究其代谢调控过程、分子调控机制等。另外,可以利用基因工程、代谢工程和合成生物学的方法改造优势耐盐促生菌株,构建多功能高效PGPR,使菌株不仅具有良好耐盐性,还具有一定耐旱性、抵抗病虫害等的优良特性。未来我们可以把土壤与微生物、微生物与微生物、土壤与植物、植物与植物之间的相互作用关联起来,研究它们之间的信号传导、干扰机制等,建立一个动态关联生物系统,以加快生态农业的健康发展。
| [1] |
李光超. 黄河三角洲土壤盐渍化研究综述[J]. 安徽农学通报, 2020, 26(Z1): 113-115. Li GC. A summary on soil salinization of Yellow River Delta[J]. Anhui Agricilltarul Sciere Bulletin, 2020, 26(Z1): 113-115. |
| [2] |
翟彩娇, 邓先亮, 张蛟, 等. 盐分胁迫对稻米品质性状的影响[J]. 中国稻米, 2020, 26(2): 44-48. Zhai CJ, Deng XL, Zhang J, et al. Effects of salt stress on quality traits of japonica rice[J]. Chinese Rice, 2020, 26(2): 44-48. |
| [3] |
努尔沙吾列·哈斯木汉. 新疆土壤盐渍化成因及其防治对策[J]. 科学技术创新, 2020(9): 52-53. Nurshawulie KH. Causes of soil salinization in Xinjiang and its control measures[J]. Scientific and Technological Innovation, 2020(9): 52-53. |
| [4] |
赵娇, 谢慧君, 张建. 黄河三角洲盐碱土根际微环境的微生物多样性及理化性质分析[J]. 环境科学, 2020, 41(3): 1449-1455. Zhao J, Xie HJ, Zhang J. Microbial diversity and physicochemical properties of rhizosphere microenvironment in saline-alkali of the Yellow River Delta[J]. Environmental Science, 2020, 41(3): 1449-1455. |
| [5] |
Madhurankhi G, Suresh D. Plant growth-promoting rhizobacteria-alleviators of abiotic stresses in soil : a review[J]. Pedosphere, 2020, 30(1): 40-61. DOI:10.1016/S1002-0160(19)60839-8 |
| [6] |
Wu TY, Wu XQ, Xu XQ, et al. Salt tolerance mechanism and species identification of the plant rhizosphere bacterium JYZ-SD2[J]. Curr Microbiol, 2020, 77(3): 388-395. DOI:10.1007/s00284-019-01835-0 |
| [7] |
Patel RR, Patel DD, Thakor P, et al. Alleviation of salt stress in germination of vigna radiataL. by two halotolerant Bacilli sp. isolated from saline habitats of Gujarat[J]. Plant Growth Regulation, 2015, 76(1): 51-60. DOI:10.1007/s10725-014-0008-8 |
| [8] |
Paul S, Aggarwal C, Thakur JK, et al. Induction of osmoadaptive mechanisms and modulation of cellular physiology help Bacillus licheniformis strain SSA61 adapt to salt stress[J]. Curr Microbiol, 2015, 70(4): 610-617. DOI:10.1007/s00284-014-0761-y |
| [9] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. Dong XZ, Cai MY. Handbook of systematic identification of common bacteria[M]. Beijing: Science Press, 2001. |
| [10] |
Marta T, Inmaculada L, Borja T, et al. Growth promotion on horticultural crops and antifungal activity of Bacillus velezensis XT1[J]. Applied Soil Ecology, 2020, 150: 103453. DOI:10.1016/j.apsoil.2019.103453 |
| [11] |
翟世玉, 殷辉, 周建波, 等. 枯草芽孢杆菌与钾联用对黑腐皮菌的抑制作用[J]. 山西农业科学, 2019, 47(4): 660-664. Zhai SY, Yin H, Zhou JB, et al. Inhibitory effect of Bacillus subtilis combined with potassium against valsa mali[J]. Journal of Shanxi Agricultural Science, 2019, 47(4): 660-664. |
| [12] |
Azabou MC, Gharbi Y, Medhioub I, et al. The endophytic strain Bacillus velezensis OEE1 : an efficient biocontrol agent against verticillium wilt of olive and a potential plant growth promoting bacteria[J]. Biological Control, 2020, 142: 104168. DOI:10.1016/j.biocontrol.2019.104168 |
| [13] |
徐宁, 程海娇, 刘清岱, 等. 细菌Na+/H+逆向转运蛋白的研究进展[J]. 微生物学通报, 2015, 42(10): 2002-2011. Xu N, Cheng HJ, Liu QD, et al. Research progress of the Na+/H+ antiporters in bacteria[J]. Microbiology China, 2015, 42(10): 2002-2011. |
| [14] |
Ito M, Guffanti AA, Zemsky J, Ivey DM, et al. Role of the nhaC-encoded Na+/H+ antiporter of alkaliphilic Bacillus firmus OF4[J]. Bacteriol, 1997, 179(12): 3851-3857. DOI:10.1128/JB.179.12.3851-3857.1997 |
| [15] |
Yang LF, Zhang B, Wang L, et al. The short C-terminal hydrophilic domain of NhaH Na+/H+ antiporter from Halobacillus dabanensis with roles in resistance to salt and in pH sensing[J]. Chinese Science Bulletin, 2008, 53(21): 3311-3316. |
| [16] |
Fujisawa M, Kusumoto A, Wada Y, et al. NhaK, a novel monovalent cation/H+ antiporter of Bacillus subtilis[J]. Archives of Microbiology, 2005, 183(6): 411-420. DOI:10.1007/s00203-005-0011-6 |
| [17] |
Morino M, Suzuki T, Ito M, et al. Purification and functional reconstitution of a seven-subunit mrp-type na+/h+ antiporter[J]. Journal of Bacteriology, 2014, 196(1): 28-35. DOI:10.1128/JB.01029-13 |
| [18] |
Cheng B, Meng Y, Cui Y, et al. Alkaline response of a halotolerant alkaliphilic halomonas strain and functional diversity of its Na+ (K+)/H+ antiporters[J]. Journal of Biological Chemistry, 2016, 291(50): 26056-26065. DOI:10.1074/jbc.M116.751016 |
| [19] |
张薇, 魏海雷, 高洪文, 等. 中度嗜盐菌四氢嘧啶合成基因的克隆与功能分析[J]. 生物工程学报, 2008(3): 395-400. Zhang W, Wei HL, Gao HW, et al. Cloning and characterization of ectABC cluster from Bacillus alcalophilus DTY1[J]. ChineseJournal of Biotechnology, 2008(3): 395-400. |
| [20] |
鞠建松, 徐书景, 宋瑞甜, 等.一种合成四氢嘧啶的三基因共表达载体及应用: 中国, CN201710820910. 8[P]. 2017-09-13.Ju JS, Xu SJ, Song RT, et al. Synthesis and application of three-gene co-expression vector of tetrahydropyrimidine : China, CN201710820910. 8[P]. 2017-09-13. |
| [21] |
Brill J, Hoffmann T, Bleisteiner M, et al. Osmotically controlled synthesis of the compatible solute proline is critical for cellular defense of Bacillus subtilis against high osmolarity[J]. Journal of Bacteriology, 2011, 193(19): 5335-5346. DOI:10.1128/JB.05490-11 |
| [22] |
Hoffmann T, Bleisteiner M, Sappa PK, et al. Synthesis of the compatible solute proline by Bacillus subtilis : point mutations rendering the osmotically controlled proHJ promoter hyperactive[J]. Environmental Microbiology, 2017, 19(9): 3700-3720. DOI:10.1111/1462-2920.13870 |
| [23] |
Hecker M, Völker U. General stress response of Bacillus subtilis and other bacteria[J]. Advances in Microbial Physiology, 2001, 44(4): 35. DOI:10.1016/S0065-2911(01)44011-2 |
| [24] |
Krüger E, Völker U, Hecker M. Stress induction of clpC in Bacillus subtilis and its involvement in stress tolerance[J]. Journal of Bacteriology, 1994, 176(11): 3360-3367. DOI:10.1128/JB.176.11.3360-3367.1994 |
| [25] |
Hantke I, Schäfer H, Janczikowski A, et al. YocM a small heat shock protein can protect Bacillus subtilis cells during salt stress[J]. Molecular Microbiology, 2019, 111(2): 423-440. DOI:10.1111/mmi.14164 |
| [26] |
Hecker M, Völker U. Non-specific, general and multiple stress resistance of growth-restricted Bacillus subtilis cells by the expression of the sigmaB regulon[J]. Molecular Microbiology, 1998, 29(5): 1129-1136. DOI:10.1046/j.1365-2958.1998.00977.x |
| [27] |
Hahne H, Mäder U, Otto A, et al. A comprehensive proteomics and transcriptomics analysis of Bacillus subtilis salt stress adaptation[J]. Bacteriol, 2010, 192(3): 870-882. DOI:10.1128/JB.01106-09 |
| [28] |
Kunst F, Rapoport G. Salt stress is an environmental signal affecting degradative enzyme synthesis in Bacillus subtilis[J]. Bacteriol, 1995, 177(9): 2403-2407. DOI:10.1128/JB.177.9.2403-2407.1995 |
| [29] |
Kaiumov AR, Balaban NP, Mardanova AM, et al. Biosynthesis of the subtilisin-like serine proteinase of Bacillus intermedius under salt stress conditions[J]. Mikrobiologiia, 2006, 75(5): 642. |
| [30] |
Dartois V, Débarbouillé M, Kunst F, et al. Characterization of a novel member of the DegS-DegU regulon affected by salt stress in Bacillus subtilis[J]. Bacteriol, 1998, 180(7): 1855-1861. DOI:10.1128/JB.180.7.1855-1861.1998 |
| [31] |
Kharitonova MA, Kipenskaya LV, Ilinskaya ON. Activation of biosynthesis of guanyl-specific ribonuclease secreted by Bacillus circulans under salt stress[J]. Molecular Biology, 2016, 50(6): 874-879. DOI:10.1134/S0026893316050083 |
| [32] |
Yin L, Xue Y, Ma Y. Global microarray analysis of alkaliphilic halotolerant bacterium Bacillus sp. N16-5 salt stress adaptation[J]. PLoS One, 2015, 10(6): e0128649. DOI:10.1371/journal.pone.0128649 |
| [33] |
Lee JM, Kim YR, Kim JK, et al. Characterization of salt-tolerant beta-glucosidase with increased thermostability under high salinity conditions from Bacillus sp SJ-10 isolated from jeotgal, a traditional Korean fermented seafood[J]. Bioprocess & Biosystems Engineering, 2015, 38(7): 1335-1346. |
| [34] |
Zhang W, Xu H, Wu Y, et al. A new cold-adapted, alkali-stable and highly salt-tolerant esterase from Bacillus licheniformis[J]. International Journal of Biological Macromolecules, 2018, 111: 1183-1193. DOI:10.1016/j.ijbiomac.2018.01.152 |
| [35] |
Wang TT, Ding P, Chen P, et al. Complete genome sequence of endophyte Bacillus flexus KLBMP 4941 reveals its plant growth promotion mechanism and genetic basis for salt tolerance[J]. Journal of Biotechnology, 2017, 260: 38-41. DOI:10.1016/j.jbiotec.2017.09.001 |
| [36] |
金河坡.分离于酱油渣蜡样芽胞杆菌的耐盐机制研究[D].广州: 华南理工大学, 2016. Jin HP. Isolation and salt tolerance mechanism of Bacillus cereus from soy bean sauce residue[D]. Guangzhou : South China University of Science and Engineering, 2016. |
| [37] |
江晓慧, 高阳, 王广帅, 等. 基于FvCB模型分析盐分胁迫对棉花叶片光合作用的影响[J]. 应用生态学报, 2020, 31(5): 1653-1659. Jiang XH, Gao Y, Wang GS, et al. Examining effects of salt stress on leaf photosynthesis of cotton based on the FvCB model[J]. Chinese Journal of Applied Ecology, 2020, 31(5): 1653-1659. |
| [38] |
李有芳, 王石平, 丁金金, 等. 盐胁迫对小麦根系氧化损伤及细胞程序性死亡的影响[J]. 麦类作物学报, 2019, 39(11): 1326-1332. Li YF, Wang YS, Ding JJ, et al. Effect of salt stress on oxidative damage and programmed cell death in wheat roots[J]. Journal of Triticeae Crops, 2019, 39(11): 1326-1332. |
| [39] |
徐曼, 王茜, 王奕骁, 等. 不同盐胁迫对长穗偃麦草种子萌发及幼苗生长的影响[J]. 中国草地学报, 2020, 42(1): 15-20. Xu M, Wang Q, Wang YX, et al. Effects of different salt stress on seed germination and seedling growth of elytrigia elongate[J]. Chinese Journal of Grassland, 2020, 42(1): 15-20. |
| [40] |
纪超, 王晓辉, 刘训理. 盐胁迫环境下植物促生菌的作用机制研究进展[J]. 生物技术通报, 2020, 36(4): 131-143. Ji C, Wang XH, Liu XL. Research progress on the action mechanism of plant growth-promoting bacteria under salt stress[J]. Biotechnology Bulletin, 2020, 36(4): 131-143. |
| [41] |
Woo O, Kim H, Kim JS, et al. Bacillus subtilis strain GOT9 confers enhanced tolerance to drought and salt stresses in arabidopsis thaliana and brassica campestris[J]. Plant Physiol Biochem, 2020, 148: 359-367. DOI:10.1016/j.plaphy.2020.01.032 |
| [42] |
Yasmin H, Naeem S, Bakhtawar M, et al. Halotolerant rhizobacteria pseudomonas pseudoalcaligenes and Bacillus subtilis mediate systemic tolerance in hydroponically grown soybean(Glycine max L[J]. PLoS One, 2020, 15(4): e0231348. DOI:10.1371/journal.pone.0231348 |
| [43] |
徐瑛, 郭晓农, 蔡德育. 解淀粉芽孢杆菌GB03对藜麦生长影响的初探[J]. 大麦与谷类科学, 2019, 36(5): 10-14. Xu Y, Guo XN, Cai DY. Preliminary study on the effects of Bacillus amyloliquefaciens GB03 on the growth of Chenopodium quinoa Willd[J]. Barley and Cereal Sciences, 2019, 36(5): 10-14. |
| [44] |
Lorena RC, Erika B. Microbial volatile organic compounds produced by Bacillus amyloliquefaciens GB03 ameliorate the effects of salt stress in mentha piperita principally through acetoin emission[J]. Journal of Plant Growth Regulation, 2019. |
| [45] |
刘环.促进玉米耐盐碱细菌的分离筛选及其作用研究[D].银川: 北方民族大学, 2019. Liu H. Isolation and characterization of bacteria mitigating saline-alkine stress on zea mays[D]. Yinchuan : North Minzu University, 2019. |
| [46] |
Chauhan PS, Lata C, Tiwari S, et al. Transcriptional alterations reveal Bacillus amyloliquefaciens-rice cooperation under salt stress[J]. Scientific Reports, 2019, 9(1): 11912. DOI:10.1038/s41598-019-48309-8 |
| [47] |
Chen L, Liu Y, Wu G, et al. Induced maize salt tolerance by rhizosphere inoculation of Bacillus amyloliquefaciens SQR9[J]. Physiologia Plantarum, 2016, 158(1): 34-44. DOI:10.1111/ppl.12441 |
| [48] |
袁海, 何鹏飞, 吴毅歆, 等. 盐胁迫下益生菌对玉米的促生效应研究[J]. 玉米科学, 2019, 27(1): 69-74. Yuan H, He PF, Wu YX, et al. Effects of the beneficial bacteria promoting maize growth under salt stress[J]. Journal of Maize Sciences, 2019, 27(1): 69-74. |
| [49] |
钱兰华, 钱玮, 沈雪林, 等. 耐盐促生菌的筛选 鉴定及其对黄瓜的促生作用[J]. 江苏农业科学, 2019, 47(18): 160-163. Qian LH, Qian W, Shen XL, et al. Screening and identification of salt-tolerant bacteria and its promoting effect on cucumber[J]. Jiangsu Agricultural Sciences, 2019, 47(18): 160-163. DOI:10.15889/j.issn.1002-1302.2019.18.034 |
| [50] |
Xiong YW, Li XW, Wang TT, et al. Root exudates-driven rhizosphere recruitment of the plant growth-promoting rhizobacterium Bacillus flexus KLBMP 4941 and its growth-promoting effect on the coastal halophyte Limonium sinense under salt stress[J]. Ecotoxi Environ Safety, 2020, 194: 110374. DOI:10.1016/j.ecoenv.2020.110374 |
| [51] |
Zhang Z, Yin L, Li X, et al. Analyses of the complete genome sequence of the strain Bacillus pumilus ZB201701 isolated from rhizosphere soil of maize under drought and salt stress[J]. Microbes Environ, 2019, 34(3): 310-315. DOI:10.1264/jsme2.ME18096 |
| [52] |
Singh RP, Jha PN. A halotolerant bacterium Bacillus licheniformis HSW-16 augments induced systemic tolerance to salt stress in wheat plant(Triticum aestivum)[J]. Frontiers in Plant Science, 2016, 7(1252): 1890. DOI:10.3389/fpls.2016.01890 |
| [53] |
Misra S, Chauhan PS. ACC deaminase-producing rhizosphere competent Bacillus sp. mitigate salt stress and promote zea mays growth by modulating ethylene metabolism[J]. 3 Biotech, 2020, 10(3): 119. DOI:10.1007/s13205-020-2104-y |
| [54] |
Wang W, Wu Z, He Y, et al. Plant growth promotion and alleviation of salinity stress in capsicum annuum L. by Bacillus isolated from saline soil in Xinjiang[J]. Ecotoxicology & Environmental Safety, , 2018, 164: 520-529. |
| [55] |
El-Esawi MA, Alaraidh IA, Alsahli AA, et al. Bacillus firmus (SW5)augments salt tolerance in soybean(Glycine max L.)by modulating root system architecture, antioxidant defense systems and stress-responsive genes expression[J]. Plant Physiology & Biochemistry, 2018, 132: 375-384. DOI:10.1016/j.plaphy.2018.09.026 |
| [56] |
Rafiq K, Sohail Akram M, Shahid M, et al. Enhancement of salt tolerance in maize(Zea mays L.)using locally isolated Bacillus sp. SR-2-1/1[J]. Biologia, 2020, 75: 1425-1436. DOI:10.2478/s11756-020-00435-9 |
| [57] |
Baek D, Rokibuzzaman M, Khan A, et al. Plant-growth promoting Bacillus oryzicola YC7007 modulates stress-response gene expression and provides protection from salt stress[J]. Frontiers in Plant Science, 2020, 10: 1646. DOI:10.3389/fpls.2019.01646 |
| [58] |
Orozco-Mosqueda MDC, Glick BR, Santoyo G. ACC deaminase in plant growth-promoting bacteria(PGPB): an efficient mechanism to counter salt stress in crops[J]. Microb Res, 2020, 235: 126439. DOI:10.1016/j.micres.2020.126439 |
| [59] |
刘珂.转蜡样芽孢杆菌acdS基因改善烟草耐盐性研究[D].郑州: 郑州大学, 2017. Liu K. The research of cloning the acdS gene of Bacillus cereus into tobacco to improve its salt tolerance[D]. Zhengzhou : Zhengzhou University, 2017. |
| [60] |
姚强, 董晓霞, 宫志远, 等. 滨海盐碱地产ACC脱氨酶细菌的筛选及根际促生研究[J]. 山东农业科学, 2020, 52(2): 54-58. Yao Q, Dong XX, Gong ZY, et al. Screening and rhizosphere promotion of bacteria producing ACC deaminase in coastal saline-alkali land[J]. Shandong Agricultural Sciences, 2020, 52(2): 54-58. |
| [61] |
Am na, Ud Din B, Sarfraz S, et al. Mechanistic elucidation of germination potential and growth of wheat inoculated with exopolysaccharide and ACC- deaminase producing Bacillus strains under induced salinity stress[J]. Ecotoxi Environ Safety, 2019, 183: 109466. DOI:10.1016/j.ecoenv.2019.109466 |
| [62] |
Bokhari A, Essack M, Lafi FF, et al. Bioprospecting desert plant Bacillus endophytic strains for their potential to enhance plant stress tolerance[J]. Scientific Reports, 2019, 9(1): 18154. DOI:10.1038/s41598-019-54685-y |
| [63] |
Bokhari A, Essack M, Lafi FF, et al. Mitigation of salt stress in wheat seedlings by halotolerant bacteria isolated from saline habitats[J]. Springerplus, 2013, 2(1): 6. DOI:10.1186/2193-1801-2-6 |
| [64] |
Khan N, Bano A, Ali S, et al. Crosstalk amongst phytohormones from planta and PGPR under biotic and abiotic stresses[J]. Plant Growth Regulation, 2020, 90: 189-203. DOI:10.1007/s10725-020-00571-x |
| [65] |
李海洋, 李爱学, 王成, 等. 盐胁迫对苗期向日葵内源激素含量的影响[J]. 干旱地区农业研究, 2018, 36(6): 92-97. Li HY, Li AX, Wang C, et al. Effects of salt stress on endogenous hormone contents in sunflower seedlings[J]. Agricultural Research in Arid Areas, 2018, 36(6): 92-97. |
| [66] |
涂文文. NaCl处理对酸枣幼苗内源激素含量的影响及转录组测序分析[D].石河子: 石河子大学, 2019. Tu WW. Effect of NaCl treatment on the content of endogenous hormones in jujube seedings and the analysis of transcription group sequencing[D]. Shihezi : Shihezi University, 2019. |
| [67] |
魏士平, 刘贝贝.产生生长素的类短短芽孢杆菌及其应用: 中国, CN201910507692. 1[P]. 2019-11-01.Wei SP, Liu BB. Application of a Bacillus brevis strain producingauxin : China, CN201910507692. 1[P]. 2019-11-01. |
| [68] |
汪钱龙, 张德智, 王菊芬, 等. 不同植物促生细菌对玉米生长的影响及其生长素分泌能力研究[J]. 云南农业大学学报:自然科学, 2015, 30(4): 494-498. Wang QL, Zhang DZ, Wang JF, et al. Effects of plant growth-promoting bacterial on the growth of maize and the IAA secrete ability detection[J]. Journal of Yunnan Agricultural University : Natural Science, 2015, 30(4): 494-498. |
| [69] |
Khan AM, Asaf S, Khan AL, et al. Halotolerant rhizobacterial strains mitigate the adverse effects of NaCl stress in soybean seedlings[J]. Biomed Research International, 2019, 2019: 9530963. DOI:10.1155/2019/9530963 |
| [70] |
王磊, 冯二梅, 宿红艳. 烟台海域一株中度嗜盐芽孢杆菌YTM-5的鉴定及其耐盐机制研究[J]. 新乡学院学报:自然科学版, 2010, 27(3): 50-55. Wang L, Feng EM, Su HY. Identification of a moderately halophilic Bacillus Strain YTM-5 in Yantai sea area and the preliminary study of its salt-tolerant mechanism[J]. Journal of Xinxiang University : Natural Science Edition, 2010, 27(3): 50-55. |
| [71] |
Xu Y, Zhang D, Dai L, et al. Influence of salt stress on growth of spermosphere bacterial communities in different peanut(Arachis hypogaea L.)cultivar[J]. International Journal of Molecular Sciences, 2020, 21(6): 2131. DOI:10.3390/ijms21062131 |
| [72] |
郭英, 刘栋, 赵蕾. 生防枯草芽孢杆菌胞外植酸酶对小麦耐盐性的影响[J]. 应用与环境生物学报, 2009, 15(1): 39-43. Guo Y, Liu D, Zhao L. Effect of extracellular phytase produced by Bacillus subtilis T2 on salt tolerance of wheat seedlings[J]. Chinese Journal of Applied & Environmental Biology, 2009, 15(1): 39-43. |
| [73] |
Boukhris I, Farhat-Khemakhem A, Blibech M, et al. Characteriza-tion of an extremely salt-tolerant and thermostable phytase from Bacillus amyloliquefaciens US573[J]. International Journal of Biological Macromolecules, 2015, 80: 581-587. DOI:10.1016/j.ijbiomac.2015.07.014 |
| [74] |
Lee S, Trịnh CS, Lee WJ, et al. Bacillus subtilis strain L1 promotes nitrate reductase activity in arabidopsis and elicits enhanced growth performance in arabidopsis, lettuce, and wheat[J]. Journal of Plant Research, 2020, 133(2): 231-244. DOI:10.1007/s10265-019-01160-4 |
| [75] |
Liang W, Ma X, Wan P, et al. Plant salt-tolerance mechanism : a review[J]. Biochemical and Biophysical Research Communications, 2018, 495(1): 286-291. DOI:10.1016/j.bbrc.2017.11.043 |
| [76] |
Nautiyal CS, Srivastava S, Chauhan PS, et al. Plant growth-promoting bacteria Bacillus amyloliquefaciens NBRISN13 modulates gene expression profile of leaf and rhizosphere community in rice during salt stress[J]. Plant Physiol Biochem, 2013, 66: 1-9. DOI:10.1016/j.plaphy.2013.01.020 |
| [77] |
Chen L, Liu Y, Wu G, et al. Beneficial rhizobacterium Bacillus amyloliquefaciens SQR9 induces plant salt tolerance through spermidine production[J]. Molecular Plant Microbe Interactions, 2017, 30(5): 423-432. DOI:10.1094/MPMI-02-17-0027-R |
| [78] |
蒲强.多功能芽孢杆菌筛选及其促生长和吸附镉效果与机理研究[D].广州: 华南农业大学, 2017. Pu Q. Study on screening of multifunctional Bacillus and its effectand mechanism on plant growth and biosorption of cadmium[D].Guangzhou : South China Agricultural University, 2017. |
| [79] |
谢庆东, 何琳燕, 王琪, 等. 一株高效溶解钾长石芽孢杆菌的分离鉴定与生物学特性研究[J]. 土壤, 2017, 49(2): 302-307. Xie QD, He LY, Wang Q, et al. Isolation and identification of a feldspar-dissolving Bacillus strain and its biologicalcharacteristics[J]. Soil, 2017, 49(2): 302-307. |