2. 中国科学院大学,北京 100049;
3. 中国中医科学院中药资源中心,北京 100700;
4. 北京市农林科学院植物营养与资源研究所,北京 100097
2. University of Chinese Academy of Sciences, Beijing 100049;
3. National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700;
4. Institute of Plant Nutrition and Resources, Beijing Academy of Agriculture and Forest Sciences, Beijing 100097
在漫长的进化历程中,植物为抵御外界非生物及生物胁迫,调节自身生长以更好的适应环境变化,产生了大量结构及功能多样的次生代谢产物,其中萜类化合物是最重要的一类[1-2]。萜类化合物是一类以异戊二烯(C5)为基本构成单元并通过化学键的连接形成的链状或环状结构的次生代谢产物。根据异戊二烯数量,可将萜类化合物分为单萜(C10)、倍半萜(C15)、二萜(C20)、三萜(C30)、四萜(C40)、多萜(C > 40)及精油类(挥发性物质组成的混合物,主要为单萜、倍半萜及二萜类化合物)[3-5]。萜类化合物广泛存在于各类植物中,种类超过40 000种[6],其在植物生长及适应环境变化过程中发挥着重要作用,如倍半萜类化合物脱落酸(ABA)及二萜类化合物赤霉素(GA)是调节植物生长及应对逆境胁迫的重要激素[4];一些单萜类化合物(如芳樟醇、橙花叔醇)及倍半萜类化合物(如法呢烯、石竹烯)具有挥发性,其对植食性昆虫及病原微生物具有毒害性,还可作为信号分子吸引昆虫天敌,在保护植物免受昆虫及病原微生物侵袭过程中发挥着重要作用[5, 7-8];同时,植物根系在遭受病原微生物或食真菌性动物侵袭时也能分泌一些小分子萜类化合物(如梓醇)至共生真菌菌丝或土壤中,作为一种防御物质或信号分子保护共生真菌或邻近植物[9-10]。另外,一些萜类化合物还具有生物活性,是药用植物的主要活性成分,如甘草(Glycyrrhiza uralensis)中的三萜类化合物甘草酸、黄花蒿(Artemisia annua)中的倍半萜类化合物青蒿素等,因在临床上具有抗氧化、抗病毒、抗抑郁等药理作用,具有很高的药用价值[11-12]。植物组织中萜类化合物的生物合成途径可分为3阶段,包括共同底物异戊烯基二磷酸酯(IPP)及其异构体二甲基烯丙基二磷酸酯(DMAPP)生成阶段;直接前体法尼基二磷酸(FPP),牻牛儿基二磷酸(GPP)等生成阶段;各萜类化合物生成及修饰(氧化还原、酰化、糖基化等)阶段[13]。其中,共同底物IPP/DMAPP由质体中进行的2-甲基-D-赤藻糖醇-4-磷酸途径(MEP途径)和细胞质中进行的甲羟戊酸途径(MVA途径)提供,IPP/DMAPP及直接前体物质FPP,GPP等是所有萜类化合物生物合成所必须的[3]。因此,通过调节中间代谢底物的产生与积累可影响终产物-各类萜类化合物的合成与积累。
丛枝菌根(Arbuscular mycorrhizal,AM)真菌是一类能够与大多数陆地植物形成共生体系的土壤真菌。AM真菌帮助宿主植物获取水分及矿质养分,特别是磷元素(P)以促进植物生长;作为回报,宿主植物为AM真菌提供丰富的糖类及脂肪类化合物以帮助AM真菌完成生活史[14-15]。研究表明,在特定情形下,植物所需90%以上营养元素能够由菌根真菌提供,同时植物也会将高达30%的光合作用同化的碳(C)分配至菌根真菌[16-17]。AM真菌与植物共生不仅改善植物营养及水分状况,越来越多的研究也表明AM真菌能影响植物次生代谢及其产物的积累,显著提高多种药用植物中活性成分含量[18-20],这为解决目前药用植物人工栽培中普遍面临的活性成分含量及产量较低这一难题提供了可行途径。AM真菌促进宿主植物生长为次生代谢合成提供底物,同时光合C向AM真菌的分配改变了植物C的“源-库”关系,推动了C在植物体内的重新分配,也可能影响植物次生代谢的合成与积累[18, 20]。已有研究表明,AM真菌与植物共生能够显著影响植物萜类化合物含量和组成[8, 18]。另一方面,萜类化合物,尤其是分子量较小,通常具有挥发性的单萜类及倍半萜类化合物,在AM真菌与宿主植物的共生建成和功能发挥中具有重要作用[8-10]。基于此,本文综述了目前国内外有关AM真菌与植物萜类化合物合成与积累相关研究进展,包括AM真菌对植物萜类化合物合成与积累的影响及其作用机制,以及AM真菌调控植物萜类化合物代谢的影响因素,同时分析了当前AM真菌与植物萜类化合物研究方面的不足,并展望了未来研究方向和应用前景。
1 AM真菌与植物萜类化合物研究现状为了从总体上了解国内外有关AM真菌与植物萜类化合物代谢的研究现状,我们收集了2000-2019年的相关研究文献。通过ISI Web of Knowledge (http://login.webofknowledge.com/)、Google Scholar (http://scholar.google.com.cn/)及中国知网(http://epub.cnki.net/kns/default.htm)等文献检索平台,以关键词“arbuscular mycorrhiza*”和“secondary metaboli*、terpenoid*”或“丛枝菌根真菌”和“次生代谢、萜”进行检索,文献类型为“article”或“期刊论文”,文献纳入标准为:(1)采用AM真菌接种,且有不接种对照处理;(2)有特定萜类化合物的浓度或含量数据;(3)具有明确的统计分析结果或具有明确的处理重复数以及试验标准差或标准误。通过筛选共获得有效文献89篇,以任意一篇文献中的试验类型、宿主植物种类、AM真菌种类、试验处理种类、萜类化合物种类及萜类化合物积累部位等观测值为独立样本[21-22],提取相关数据并进行整理、分析。
数据分析表明,大部分研究论文发表在2015年-2019年这5年间(图 1-A),占研究文献总量的66%(n=89),表明AM真菌与植物萜类化合物关系的研究方兴未艾。试验类型方面(图 1-B),大田试验仅占样本总数的20%(n=90),盆栽试验占80%(其中温室类占62%,人工气候室类占9%,户外盆栽类占9%),这表明当前AM真菌与植物萜类化合物的研究仍集中于盆栽模拟研究,大田试验还较为缺乏,原因之一可能是由于大田条件相对复杂的环境条件和管理措施限制了AM真菌的应用[23]。Berruti等[24]综述了当前AM真菌接种对植物生长影响,也发现目前AM真菌的研究仍多为盆栽模拟试验。
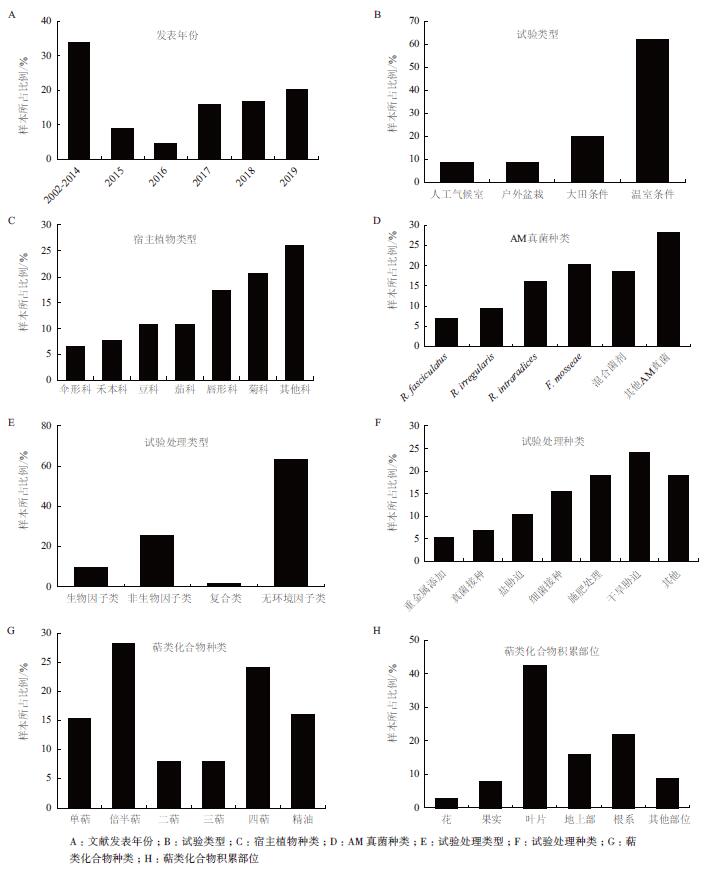
|
| 图 1 AM真菌与植物萜类化合物研究文献分析 |
宿主植物种类方面(图 1-C),用于AM真菌研究的植物种类多集中于菊科(Asteraceae,21%)、唇形科(Lamiaceae,17%)、茄科(Solanaceae,11%)及豆科(Leguminosae,11%),禾本科(Poaceae,8%)及伞形科(Apiaceae,7%)(n=92)等科植物也有少量研究,表明目前AM真菌与植物萜类化合物代谢的研究已在较为广泛的植物种类中展开。用于接种的AM真菌种类主要包括摩西斗管囊霉(Funneliformis mosseae)及根内根孢囊霉(Rhizophagus intraradices),分别占样本总数的21%和16%,多种AM真菌的混合接种占19%(n=156)(图 1-D),这可能是由于F. mosseae和R. intraradices在不同生态系统中广泛分布,是大多数农田土壤中的优势种,能够与大多数植物建立良好共生关系[25-26]。
从试验处理类型来看(图 1-E),无环境因子作用的试验处理样本占样本总数的64%,有环境因子作用的样本占36%(其中生物因子类占9%,非生物因子类占26%,生物及非生物复合因子类占1%)(n=137),揭示出环境因子这一因素在AM真菌与植物萜类化合物研究中的重要地位。这一方面是因为AM真菌与植物共生不仅能促进植物营养吸收和植物生长,同时也能帮助植物抵抗各种环境胁迫,如干旱、昆虫侵袭等[8, 24];另一方面则是适度的环境胁迫有利于植物次生代谢产物的合成与积累[27-29],如我们前期试验发现适度的干旱胁迫能够显著促进甘草根系中三萜类化合物甘草酸的生物合成与积累[30]。试验处理种类中(图 1-F),干旱胁迫是研究最多的非生物胁迫处理,占有环境因子作用样本总数的24%;非生物因子类中的施肥处理和盐胁迫,生物因子类中的细菌接种则分别占有环境因子作用样本总数的19%、10%和16%;真菌接种和重金属添加则只分别占有环境因子作用样本总数的7%和5%(n=58)。
从萜类化合物种类来看(图 1-G),具有挥发性的单萜、倍半萜以及四萜类化合物研究最多,占样本总数的67%;二萜和三萜类研究较少,分别仅占样本总数的8%和8%;精油类占样本总数的16% (n=124),表明目前关于AM真菌影响植物萜类化合物代谢的研究还存在不平衡性,尤其是二萜及三萜类化合物研究较少。萜类化合物积累部位研究多集中于植物地上部,尤其是叶片(43%),其次是根系(22%)(n=101),花、果实等其他植物器官也有少量研究(图 1-H),这与植物萜类化合物的合成和积累具有组织器官特异性有关,当前的研究多集中于植物地上部产生的简单萜类[8]。
2 AM真菌对植物萜类化合物合成与积累的影响AM真菌对植物萜类化合物合成与积累影响最终表现为萜类化合物的含量变化。一般来讲,AM真菌对植物萜类化合物含量的影响包括促进、抑制和无显著作用等不同情形[18, 31],且与萜类化合物种类相关。接种AM真菌主要促进二萜类(占样本总数的80.5%,n=82)、三萜类(90.3%,n=31)及精油类化合物(51.1%,n=88)含量积累;对单萜、倍半萜及四萜类化合物则主要为促进或无显著影响,其中显著促进作用所占样本比例分别为34.6% (n=526)、37.6%(n=338)和37.3%(n=177),无显著影响所占比例分别为46.2%、56.8%和45.2%。接种AM真菌显著抑制萜类化合物含量积累所占的比例则较少,接种抑制单萜、倍半萜、四萜及精油类化合物所占样本比例分别为19.2%(n=526)、5.62%(n=338)、17.51%(n=177)和4.55%(n=88)。我们的试验发现R. irregularis接种显著提高了甘草根系中三萜类甘草酸含量[30]。Zubek等[32]发现明根孢囊霉(R. clarum)接种显著提高了山菅草(Inula ensifolia)根系中单萜类百里香酚含量,但R. intraradices接种却降低了百里香酚含量,而Amir等[33]发现无论接种R. intraradices、F. mosseae或多种菌剂混合接种均不能改变天竺葵(Pelargonium graveolens)地上部四萜类类胡萝卜素含量,表明AM真菌-植物组合的特异性能够影响萜类化合物的含量积累。
某一萜类化合物含量的改变可能会导致其他萜类化合物含量发生变化,从而改变萜类化合物的组成。AM真菌接种不仅影响单一萜类化合物含量,也会影响萜类化合物的组成。Asensio等[34]发现番茄(Solanum lycopersicum)接种AM真菌后其地上部积累更多的ABA及类胡萝卜素等植物生长调节物质,而减少了非必需萜类包括一些单萜类和倍半萜类化合物的积累,从而改变了萜类化合物的组成。Adolfsson等[35]利用转录组和代谢组技术分析比较蒺藜苜蓿(Medicago truncatula)接种R. irregularis后植物叶片转录表达及次生代谢物含量变化发现,AM真菌接种不仅显著调节了各个萜类化合物合成途径相关基因表达,同时也对各个萜类化合物含量产生显著影响,揭示了AM真菌从基因表达层面影响植物萜类化合物合成与积累的机制。另外,罗勒(Ocimum basilicum)接种Gigaspora rosea后增加了叶片α-萜品醇和丁子香酚的积累,却减少了芳樟醇的积累,从而改变了罗勒叶片精油组成[36]。
3 AM真菌影响植物萜类化合物合成与积累的机制植物次生代谢产物的含量不仅与代谢产物的生物合成相关,也与代谢产物在植物体内的转运和在不同器官内的积累相关,本文从萜类化合物的合成、转运及积累3方面阐述AM真菌的作用机制。
3.1 AM真菌调节植物萜类化合物的合成生物体内各类代谢产物的合成是一系列酶促反应的结果,影响酶促反应进行的因素均会影响萜类化合物的合成,其中最重要的因素是酶促反应中底物浓度和相关酶活性[37]。植物体内萜类化合物的合成途径目前已得到较好阐释,主要通过质体中进行的MEP途径和细胞质中进行的MVA途径,代谢底物经多步酶促反应合成结构及功能多样的萜类化合物[13, 18]。诸多研究已表明接种AM真菌可以调节萜类化合物合成途径中底物浓度及关键酶基因表达[12, 30, 38]。AM真菌不仅调节植物对矿质养分如N、P吸收,调控光合C固定,影响植物C:N:P比,从而影响代谢底物的积累,还可通过调控转录因子等调节代谢途径关键基因表达。下文将从营养机制和非营养机制两方面就AM真菌调节植物萜类化合物的合成机理展开讨论。
3.1.1 AM真菌调节萜类化合物合成的营养机制AM真菌接种可提高植物组织矿质养分含量,尤其是P含量[14],而P是构成萜类化合物合成途径初始底物乙酰辅酶A和3-磷酸甘油醛的重要元素,同时也是MEP途径和MVA途径中共同底物IPP/DMAPP的构成元素[18-19],因此AM真菌接种可通过改善植物P营养状况进而调节萜类化合物的合成。试验中可通过对不接种对照处理添加P以使不接种处理和接种处理具有相似的组织P含量以及生物量来区分P介导的营养机制和非营养机制[39-40]。我们前期试验表明AM真菌接种促进甘草中甘草酸的积累主要是由AM真菌改善P营养所致[41]。Kapoor等[42]也发现当不接种处理和接种处理具有相似P含量时,茴香(Foeniculum vulgare)地上部有相似的精油含量。实际上,AM真菌促进植物根系对P的吸收被认为是AM真菌促进萜类化合物合成的首要因素[20]。
AM真菌促进植物对P的吸收也会影响植物对N的吸收,改变植物组织C:N:P化学计量比[43-44]。如Hodge和Fitter[45]通过15N同位素标记试验证明AM真菌根外菌丝能够吸收土壤中的N并转移至宿主植物。施加P肥可促进植物根系P吸收,降低巨桉(Eucalyptus grandis)根系N:P比和紫花苜蓿(Medicago satial)叶片C:N比[46-47]。根据C-营养元素平衡假说,C与营养元素间的比例调控植物次生代谢物的合成。当C:N比较高时,植物倾向于合成以C为基础的次生代谢物,如萜类化合物;当C:N比较低时,植物则倾向于合成以N为基础的次生代谢物,如生物碱类化合物[48-49]。这一假说一定程度上解释了次生代谢产物的合成与营养元素间的关系,也得到了一些研究的佐证[50]。我们试验同样发现接种AM真菌改变了甘草根系N、P平衡,降低了根系N:P比但提高了C:N比,同时促进了根系甘草酸的含量积累[30]。
接种AM真菌可以通过促进植物矿质养分吸收或其他非营养机制调控光合作用,进而调节C的固定及分配[40, 51],而植物组织内光合C在初生代谢物和各类次生代谢物间的分配是决定萜类化合物合成的重要因素。植物通过光合作用固定的C一部分用于植物生长,形成生物量(包括结构性C、非结构性C及次生代谢C),一部分通过植物根系转运至菌根共生体,供AM真菌利用;还有一部分C以呼吸作用或根系分泌物的形式散失[17, 52]。宿主植物与AM真菌形成共生体系以后,AM真菌为宿主植物提供P,而植物则将光合C分配至AM真菌,推动了植物将更多的光合C分配至根系,从而改变了C向其他次生代谢途径如萜类化合物代谢的分配[40, 53]。AM真菌不仅可以调控光合C向根系分配,还可以通过调控结构性C与非结构性C比例而调控次生代谢C分配。Black等[54]利用14C同位素示踪技术发现AM真菌接种增加了黄瓜(Cucumis sativus)叶片中水溶性C,但降低了叶片中淀粉含量。P胁迫条件下非菌根植物根系将更多的C分配至非结构性C及呼吸过程,而菌根植物则将C更多的用于合成各类次生代谢物[55-56]。我们研究发现,AM真菌接种后甘草根系C分配相对减少,但根系次生代谢物甘草酸含量却显著增加,表明AM真菌调节了植物C分配,使根系将更多的C用于合成甘草酸[30]。
3.1.2 AM真菌调节萜类化合物合成的非营养机制尽管诸多研究表明AM真菌促进营养元素吸收,尤其是P的吸收是调控植物萜类化合物合成的重要机制[20],但Schweiger等[40]研究表明AM真菌接种导致的宽叶车前草(Plantago major)叶片代谢变化只是部分归因于AM真菌接种提高了叶片P含量,这也得到了其他研究的佐证。很多研究表明,AM真菌侵染植物根系后可以改变萜类化合物合成途径关键酶活性及其基因表达水平,从而影响萜类化合物的合成[57-58]。1-脱氧-5-磷酸-D-木酮糖合成酶(DXS及1-脱氧-5-磷酸-D-木酮糖还原异构酶(DXR)是MEP途径的两个关键酶,其活性直接影响下游各类萜类化合物的合成。Walter等[38]从苜蓿中克隆得到两个编码DXS的基因MtDXS1和MtDXS2,并发现AM真菌接种能特异性诱导MtDXS2的高表达,同时伴随着类胡萝卜素(四萜类)的积累。AM真菌接种可同时上调黄花蒿(Artemisia annua)及甜叶菊(Stevia rebaundiana)叶片中DXS和DXR基因表达,促进青蒿素(倍半萜)及甜菊苷(二萜)的积累[12, 59]。3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMGR)是萜类化合物合成另一途径-MVA途径的第一个关键限速酶,其活性也能直接影响下游产物的合成[60]。目前,关于AM真菌通过影响HMGR基因表达而调控萜类化合物代谢仅见零星报道,Gerlach等[61]发现AM真菌接种上调玉米(Zea mays)根系HMGR基因表达,同时伴随着α,β-香树脂醇(三萜)的积累。然而,我们的试验发现尽管AM真菌接种显著提高了甘草根系中甘草酸含量,但并不能改变根系中HMGR基因表达水平[30, 41]。Mandal等[12]也发现AM真菌接种虽然促进了黄花蒿(Artemisia annua)叶片中青蒿素的积累,但对HMGR基因表达无显著影响。AM真菌接种条件下植株HMGR基因表达与萜类化合物合成响应的不一致可能是因为:(1)萜类化合物的合成既可以通过质体中的MEP途径进行,也可以通过细胞质中的MVA途径进行。如Opitz等[62]利用13C和2H同位素标记发现棉花地上部固醇类物质20%来自MEP途径,80%来自MVA途径;同时发现单萜、植醇(二萜)及类胡萝卜素主要通过MEP途径形成,倍半萜、萜醛类和三萜类主要通过MVA途径形成。(2)萜类化合物合成的共同底物IPP/DMAPP既可以来自MEP途径,也可以来自MVA途径,两条途径间存在“物质交换”。研究表明,萜类前体物质IPP可以在细胞质和质体之间穿梭,从而将在亚细胞水平上隔离的MVA途径和MEP途径联系起来[63]。Mendoza-Poudereux等[64]利用13C-葡萄糖饲喂宽叶薰衣草(Lavandula latifolia),发现薰衣草叶片中来自MVA途径合成的IPP/DMAPP可由液泡运输至质体中,以作为MEP途径中萜类化合物合成的底物,表明MVA途径和MEP途径并非相互独立。(3)AM真菌可调控萜类下游合成途径中萜类合酶(Terpene synthases,TPS)活性,进而弥补因上游酶活性降低而导致的底物不足。TPS位于类异戊二烯途径的分支点上,是调控下游萜类化合物合成的关键酶,同时由于其结构上的变化导致酶活性变化也是导致萜类化合物结构和种类多样的主要诱因[13]。我们的试验表明AM真菌接种可显著上调甘草酸合成途径中SQS1、β-AS、CYP88D6及CYP72A154表达,且这些基因的表达与甘草酸的积累具有显著的正相关性[30]。Mandal等[12]也发现AM真菌接种上调青蒿素合成途径关键基因ADS、CYP71AV、DBR2及ALDH1表达而促进青蒿素的合成。
总之,尽管AM真菌接种可通过调控营养元素吸收、调节C分配及改变元素化学计量比等营养机制,以及调控萜类化合物合成途径关键酶基因表达等非营养机制影响萜类化合物的合成,但这两种机制并非是相互独立的。营养元素含量,尤其是N、P含量,也能够影响植物次生代谢物合成途径关键基因表达[51, 65-66]。例如,有研究发现植株P含量可影响拟南芥(Arabidopsis thaliana)硫脂合成途径关键基因SOD1的表达及黄酮类合成途径关键基因表达,进而影响硫脂及黄酮类物质的积累[65, 67],但目前关于AM真菌通过调控植物营养元素吸收而影响萜类化合物合成途径基因表达,进而影响萜类化合物的合成的直接证据尚未见报道。
3.2 AM真菌调节植物萜类化合物的转运植物组织内次生代谢产物在亚细胞结构及不同组织部位的转运会影响次生代谢物的合成、积累与再分配[68],如三萜皂苷类化合物主要在细胞液泡中积累[69],但相关的生物合成酶却存在于质体或细胞质中,因此化合物的合成与积累存在着一个从细胞质/质体到液泡的转运系统[70-71]。次生代谢物质的转运系统一般包括基于膜性小泡的转运和基于膜转运蛋白的转运,其中ABC(ATP-binding cassette,ABC)转运蛋白是参于萜类化合物转运的重要蛋白[71]。不同植物中参与萜类化合物转运的ABC转运蛋白已相继被发现,如皱叶烟草(Nicotiana plumbaginifolia)中ABC转运蛋白参与了二萜类化合物香紫苏内酯和香紫苏醇的转运[72-73]。Kretzschmar等[74]首次从矮牵牛(Petunia hybrida)中克隆到参与倍半萜类化合物独脚金内酯转运的ABC转运蛋白PDR1,且该蛋白能够显著被AM真菌共生所诱导。目前,越来越多的次生代谢产物转运蛋白被鉴定出来,包括萜类和黄酮类转运蛋白[71, 75-76],但AM真菌如何调节这些转运蛋白活性进而影响代谢物的分配、积累还缺乏研究。同时,AM真菌不仅参于调节萜类化合物在细胞水平上的转运,也参与调节萜类化合物的长距离运输。AM真菌与植物共生早期阶段,AM真菌孢子可以通过分泌信号因子(Myc factor),调节宿主植物独脚金内酯转运蛋白PDR1活性而诱导植物根系大量转运、分泌独脚金内酯至根际土壤,促进AM真菌孢子萌发及菌丝分枝[77]。又如,Duhamel等[9]首次发现当宿主植物根系遭受食真菌线虫侵袭时,AM真菌能够诱导宿主植物特异性产生抗性物质梓醇(环烯醚萜),并将梓醇转运至根外菌丝中保护AM真菌菌丝免受线虫采食,但对于AM真菌如何调节梓醇在植物细胞及菌丝中的转运目前还未见报道。另外,当植物遭受干旱胁迫时,从根部产生的ABA能长距离转运至地上部叶片,调节叶片气孔开闭及水分散失,从而增强植物对干旱胁迫的抵抗性[78]。研究表明,接种AM真菌能够上调番茄(Solanum lycopersicum)根部ABA合成基因SlNCED的表达,但是并未引起根中ABA含量增加,表明AM真菌可能通过调控了ABA从根系向叶片的长距离运输,进而提高植物抗旱性[79]。
3.3 AM真菌调节植物萜类化合物的积累植物体内同化物,如萜类化合物在特定组织和器官中的积累不仅与化合物的合成、转运相关,同时也受到积累部位——“库”强度影响。“库”强度包括“库”的容量(指“库”的总质量)和“库”的活力(指单位时间单位干重吸收同化物的速率),改变库容量或库活力都会影响同化物的运输模式和含量积累[3]。AM真菌调节“库”强度而影响萜类化合物的积累可从植物腺毛响应得以证明。腺毛是植物表皮细胞向外生长形成的特殊结构,存在于30%左右的维管束植物中,其能产生并积累一些次生代谢产物,如唇形科和菊科植物叶片腺毛主要合成和积累萜类化合物,包括单萜、倍半萜及二萜类[80]。腺毛的形成和发育直接影响次生代谢物的合成和积累[81]。研究表明,AM真菌接种可以提高黄花蒿(Artemisia annua)叶片腺毛密度,改变腺毛结构,增加腺毛“库”容量进而提高黄花蒿中青蒿素的积累[12, 82]。Hazzoumi等[83]则发现接种AM真菌可以显著改变丁香罗勒(Ocimum gratissimum)腺毛结构,增加腺毛胞外腔的直径,增加精油的存储容量。另外,其他一些特殊分化的结构也可储存萜类化合物,如分泌囊,分泌细胞等,AM真菌如何调节这些特殊结构的发育来影响萜类化合物的积累是未来值得研究的方向。另外,研究表明植物次生代谢产物主要贮存在细胞液泡或细胞壁中[3],如甘草根系中三萜类甘草酸主要分布在根的次生韧皮部薄壁细胞和维管射线细胞中,且主要积累在这些细胞的细胞壁[84],激光共聚焦扫描发现燕麦(Avena strigosa)根系燕麦皂苷主要积累于根表皮细胞的液泡中[70]。转录组及代谢组分析发现接种AM真菌可显著上调编码细胞壁组成物质如木质素、纤维素及半纤维素等合成基因表达,提高根系木质素、纤维素等含量,从而导致细胞壁加厚[85-87]。“库”活力主要指调节同化物的长距离转运的能力,包括同化物在筛管筛分子的卸出、细胞壁的代谢和从质外体回收同化物及其利用的能力,如低温处理库组织会抑制库代谢,导致同化物输入库的速率下降和代谢物积累降低[3]。然而,目前关于AM真菌如何调节萜类化合物积累部位——“库”活力而影响萜类化合物的积累还缺少研究。
4 AM真菌调节植物萜类化合物合成与积累的影响因素我们根据已发表文献资料数据分析了试验条件(大田试验/室内试验)、接种方式(单接种/混合接种)及环境因子(无环境因子/有环境因子)对AM真菌接种调节植物萜类化合物合成与积累的影响。考虑到AM真菌对根系的侵染情况既是评价AM真菌与植物共生关系的指标,也影响到AM菌根效应的发挥[40, 88],因此我们分析了不同条件下菌根侵染率的变化。同时,由于诸多萜类化合物不仅具有重要的生理生态功能,同时也是药用植物的活性成分,其含量和产量均是人们关注的重点,故我们也分析了总萜类含量变化以及影响萜类化合物产量的植物生物量和组织P含量。采用SPSSAU(v 20.0)-在线SPSS数据分析软件(https://spssau. com/front/spssau/index.html)进行两独立样本率z检验分析,并计算数据95%渐进置信区间[24]
分析结果表明,试验条件显著影响单萜类及四萜类化合物含量,同时相比盆栽条件,大田条件下接种AM真菌植物更倾向于合成与积累单萜类化合物,而更少积累四萜类化合物。试验条件对植物倍半萜、精油类含量无显著影响(图 2-A)。这可能是由于大田条件下植物遭受更多的环境因素影响,如昆虫及微生物侵袭,而具有挥发性的单萜类化合物起到重要的防御作用[8]。与多种AM真菌菌剂的混合接种比较,单一AM真菌接种更能提高单萜类化合物含量(图 2-C),这可能是由于混合接种时不同种类的AM真菌间存在潜在的竞争作用,尤其是在大田条件下,这一定程度上抑制了AM真菌对根系侵染,进而影响菌根共生体建成及功能发挥[23]。倍半萜类、四萜类及精油类则不受AM真菌接种方式影响(图 2-C)。环境因子作用下AM真菌接种更能提高植物单萜类、倍半萜类化合物含量,但无环境因子作用下AM真菌接种植物更倾向于积累四萜类化合物(图 2-E),表明环境因子对萜类化合物合成与积累影响与萜类化合物种类密切相关。这可能是由于各类环境因子的参与促进了AM真菌与植物根系的相互作用,一定的环境因子胁迫是提高植物次生代谢物含量的必要条件[27-28];另外,环境因子参与的试验类型中,生物因子类(包括真菌和细菌接种)约占有环境因子作用样本总数的23%(图 1-F),而具有挥发性的单萜及倍半萜类化合物在防御微生物侵袭及对邻近植物的警示过程中发挥重要作用[8-10]。总体上环境因子作用下接种AM真菌对二、三萜类化合物及精油含量无显著影响(图 2-E)。
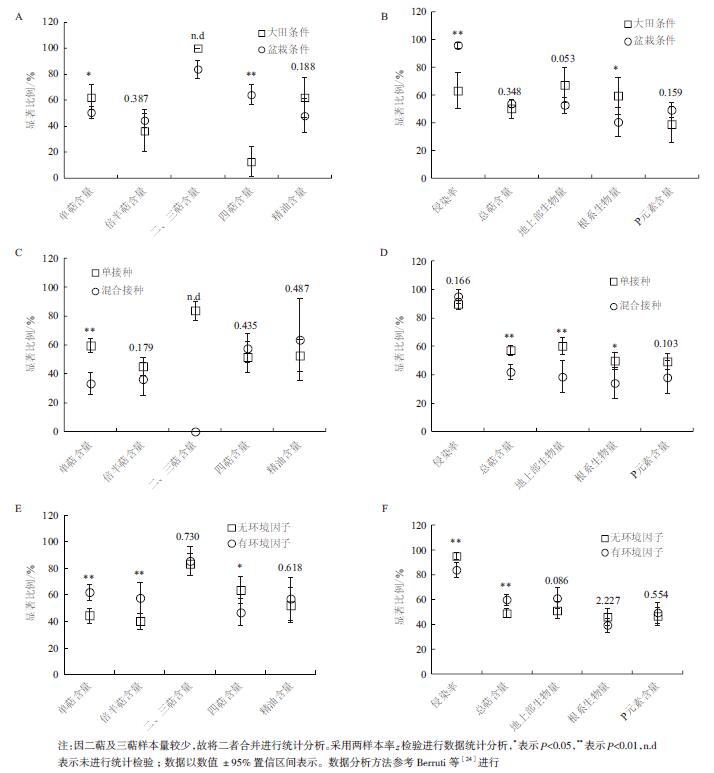
|
| 图 2 试验条件(A,B)、接种方式(C,D)及环境因子(E,F)对AM真菌调节植物萜类化合物含量、菌根侵染、植物生长和组织P吸收的影响 |
AM真菌通过根外菌丝侵染植物根系,进而与植物建立共生关系,并影响植物生长及次生代谢。统计分析结果表明,试验条件显著影响AM真菌对植物根系的侵染,相比大田条件,盆栽条件下AM真菌更易与植物根系建立良好共生关系(图 2-B)。这与一般研究的结论相一致,因为大田条件下AM真菌与植物共生受多种环境因素影响,尤其是土有效P含量,土著AM真菌丰度及多样性,而盆栽条件下培养基质通常选用低P基质,且普遍会经过灭菌处理,降低了土著AM真菌的丰度及多样性,有利于外源AM真菌对根系的侵染[23-24]。与侵染率结果相反,大田条件下AM真菌接种更能促进植物生长,提高植物根系及地上部生物量,进而可能提高萜类化合物产量(图 2-B)。Berruti等[24]收集了2001年-2015年共15年间AM真菌接种对植物生长影响的文献资料,通过分析后也发现大田条件下AM真菌接种较室内盆栽条件更能促进植物生长,并认为可能是由于盆栽试验条件(包括盆钵的大小及有限的营养元素)限制了植物根系生长及营养元素吸收,并最终抑制了植物生长。同时盆栽条件下植物对AM真菌依赖度更高,植物可通过AM真菌获取所需的大部分矿质营养元素,因而降低了光合C向生物量,尤其是根系生物量的分配[24, 89]。
单一AM真菌接种相比混合接种不仅能提高总萜类化合物含量,也更易提高植物地上部及根系生物量(图 2-D),进而提高萜类化合物产量。这一现象得到了其他研究者的佐证,Berruti等[24]同样发现单接种相比混合接种对植物地上部生物量的促进作用更加显著。秦明森等[22]通过Meta分析也发现混合接种对车轴草属植物总生物量的提高程度显著低于单接种。这一方面可能是由于目前大部分研究为盆栽试验(图 1-B),所用栽培基质通常会经过灭菌等处理,降低了土著微生物的丰度及多样性,植物生长环境较大田环境更为简单,因此单一AM真菌即可较好的侵染植物根系,并与植物根系建立共生关系并发挥作用,同时避免了混合菌种间的竞争作用[23-24];另外,单接种所选用的AM真菌种类多为R. intraradices,F. mosseae和R. irregularis(图 1-D),这三类AM真菌对宿主植物不具有专一性,具有良好的环境适应性和促进植物生长的能力[25, 90]。尽管这样,Wagg等[91]认为混合菌剂中功能差异较大的AM真菌组合,较功能单一的单接种更易发挥菌根提高植物生产力的作用,尤其是对于大田条件这种环境条件复杂多变的应用环境,表明实际应用中需要综合考虑各AM真菌的特性、宿主植物特性及环境条件,尤其是土壤环境条件,以确定最优AM真菌组合。
与无环境因子作用相比较,有环境因子作用总体上显著降低了AM真菌对植物根系的侵染(图 2-F)。环境因子类型中,干旱胁迫是AM真菌研究中最为常见的环境因子作用类型(图 1-F)。干旱胁迫可通过影响AM真菌孢子萌发,丛枝的形成及根外菌丝在土壤中的生长等直接影响AM真菌对根系的侵染,还可以通过抑制宿主植物生长进而降低植物光合C向AM真菌的分配而间接影响AM真菌-植物共生体的建成及功能发挥。与菌根侵染率相反,有环境因子作用下植物更易提高总萜类化合物含量,且明显增大了地上部生物量的接种效应(P=0.086),但对根系生物量和组织P含量无显著影响(图 2-F),表明环境因子作用下接种AM真菌更有利于植物地上部生物量的增长,同时AM真菌接种对促进植物P吸收的效应具有稳定性,即使在环境胁迫条件下,AM真菌也能稳定促进植物对P的吸收。这一结果也得到了其他研究的证实[22]。
5 问题及展望综上所述,AM真菌可以影响萜类化合物的合成、转运及积累,且这种调节作用受多种外部因素影响。近年来,AM真菌对植物萜类化合物影响的研究逐渐增多,但更系统深入的研究仍有待加强。为了更加深入地认识AM真菌对植物萜类化合物代谢的影响及其作用机制,推进菌根技术在农业生产中的应用,今后应加强以下几个方面的研究。
5.1 AM真菌接种对植物萜类化合物组成的影响植物次生代谢物的组成及比例对调节植物生长、抵御环境胁迫及特定的药效作用具有重要意义。目前,AM真菌对植物萜类化合物影响研究还多集中于特定的单一萜类化合物,其中单萜及倍半萜等挥发性化合物的组成研究也仅有少量涉及[18],这在很大程度上是由于萜类化合物成分复杂、结构多样,影响了其分离、提取及测定。基于色谱、质谱技术的发展及代谢物数据库的不断完善,组学技术,特别是非靶标代谢组学等高通量组学的发展为研究AM真菌影响药用植物药效成分,以及主要农作物中与抗性、品质相关的萜类化合物组成及比例奠定了方法基础[35, 92]
5.2 AM真菌影响植物萜类化合物合成、转运和积累的分子机制AM真菌通过调节萜类化合物合成途径关键基因表达(转录水平)而影响萜类化合物合成已有较多研究[18-20],但转录后水平(包括磷酸化、甲基化及糖基化等转录后修饰作用)及翻译水平上的相关研究还较为缺乏。如Xue等[93]发现粳稻(oryza sativa)中2,3-环氧鲨烯合酶(三萜类合成途径关键酶)末端氨基酸残基决定下游萜类化合物的类型及其构象,真菌诱导子则可抑制烟草(Nicotiana tabacum)细胞角鲨烯合酶(SQS)活性,但SQSmRNA水平并没有发生明显变化,表明SQS基因的表达受到转录后水平的调控[94]。另外,深入理解AM真菌如何影响次生代谢物在植物体内及菌丝内的转运在生态学及植物保护学等方面具有重要意义,如AM真菌如何影响植物黄酮类化合物及独脚金内酯(SLs)的转运及分泌关系到AM真菌和植物共生关系的建立[77],AM真菌如何通过菌丝网络(Common mycorrhizal networks,CMNs)转运信号物质和次生代谢物至邻近植株,从而保护植株免受昆虫及病原菌侵袭,在植物保护及生态恢复等方面也有重要意义[9-10, 95]。植物次生代谢物转运很大程度上依赖于相关转运蛋白,但目前AM真菌如何调节转运蛋白活性进而影响萜类化合物转运的研究还处于起步阶段。随着转录组学、代谢组学技术的发展,已有众多参与次生代谢物转运的蛋白被鉴定、克隆并进行功能验证,也有少数萜类化合物转运蛋白被报道[72-73],AM真菌参于调节萜类化合物的转运也已有研究[74]。总之,相信随着相关研究的不断深入,AM真菌参于调节萜类化合物合成、转运与积累的分子机制也会得到进一步阐释。
5.3 AM真菌调节药用植物萜类化合物合成与积累的应用研究众多萜类化合物是传统药用植物的主要活性成分,而目前药用植物栽培普遍面临因栽培周期较短、管理不善等原因造成有效成分含量达不到国家标准的问题。尽管已有较多研究报道AM真菌接种可以有效提高药用植物活性成分含量,但这些研究多还集中于盆栽模拟试验阶段,且涉及的萜类种类较少[18-19]。AM真菌作为一种生物肥料在农业中的应用及影响菌根效应发挥的影响因素也已有较多研究[23-24],这为AM真菌在药用植物栽培中的应用奠定了基础。对于药用植物栽培中AM真菌的应用,未来研究还需要关注以下两个方面:一是由于中药材一般具有“道地性”,针对特定药用植物,应注重筛选其生长环境中土著优势AM真菌菌株,并结合土壤、气候等环境条件,综合分析药材“道地性”成因,并开展药材异地接种栽培试验,以期为扩大药材栽培区域提供理论与实践指导;二是针对大田环境的复杂多变性及植物次生代谢产物积累的规律性,同时考虑到不同AM真菌菌株对植物生长影响的差异性及对不同土壤环境的适应性[84],应进一步探索针对特定药用植物的高效AM真菌菌剂组合,同时在实际应用中应当配合适度的环境胁迫,如减少水分灌溉、调整化肥施用量等,从而最大程度上发挥AM真菌的积极作用,提高药用植物药材品质。
| [1] |
Wink M. Evolution of secondary metabolites from an ecological and molecular phylogenetic perspective[J]. Phytochemistry, 2003, 64(1): 3-19. |
| [2] |
董娟娥, 张康健, 梁宗锁. 植物次生代谢与调控[M]. 杨凌: 西北农林科技大学出版社, 2009. Dong JE, Zhang KJ, Liang ZS. Plant secondary metabolism and its regulation[M]. Yangling: Northwest A & F University Press, 2009. |
| [3] |
潘瑞炽. 植物生理学[M]. 第7版.北京: 高等教育出版社, 2012. Pan RZ. Plant physiology[M]. 7rd Edition. Beijing: Higher Education Press, 2012. |
| [4] |
Pusztahelyi T, Holb IJ, Pócsi I. Secondary metabolites in fungus-plant interactions[J]. Frontiers in Plant Science, 2015, 6: 573. |
| [5] |
Bakkali F, Averbeck S, Averbeck D, et al. Biological effects of essential oils-a review[J]. Food and Chemical Toxicology, 2008, 46(2): 446-475. DOI:10.1016/j.fct.2007.09.106 |
| [6] |
Bohlmann J, Keeling CI. Terpenoid biomaterials[J]. The Plant Journal, 2008, 54(4): 656-669. DOI:10.1111/j.1365-313X.2008.03449.x |
| [7] |
Kappers IF, Aharoni A, van Herpen TWJM, et al. Genetic engineering of terpenoid metabolism attracts, bodyguards to Arabidopsis[J]. Science, 2005, 309: 2070-2072. DOI:10.1126/science.1116232 |
| [8] |
Sharma E, Anand G, Kapoor R. Terpenoids in plant and arbuscular mycorrhiza-reinforced defence against herbivorous insects[J]. Annals of Botany, 2017, 119(5): 791-801. |
| [9] |
Duhamel M, Pel R, Ooms A, et al. Do fungivores trigger the transfer of protective metabolites from host plants to arbuscular mycorrhizal hyphae?[J]. Ecology, 2013, 94(9): 2019-2029. DOI:10.1890/12-1943.1 |
| [10] |
Babikova Z, Gilbert L, Bruce TJA, et al. Underground signals carried through common mycelial networks warn nei ghbouring plants of aphid attack[J]. Ecol Lett, 2013, 16(7): 835-843. DOI:10.1111/ele.12115 |
| [11] |
Hayashi H, Sudo H. Economic importance of licorice[J]. Plant Biotechnology, 2009, 26(1): 101-104. |
| [12] |
Mandal S, Upadhyay S, Wajid S, et al. Arbuscular mycorrhiza increase artemisinin accumulation in Artemisia annua by higher expression of key biosynthesis genes via enhanced jasmonic acid levels[J]. Mycorrhiza, 2015, 25(5): 345-357. DOI:10.1007/s00572-014-0614-3 |
| [13] |
王凌健, 方欣, 杨长青, 等. 植物萜类次生代谢及其调控[J]. 中国科学:生命科学, 2013, 43(12): 1030-1046. Wang LJ, Fang X, Yang CQ, et al. Biosynthesis and regulation of secondary terpenoid metabolism in plants[J]. Science in China (Series C), 2013, 43(12): 1030-1046. |
| [14] |
Smith SE, Read DJ. Mycorrhizal symbiosis[M]. Pittsburgh: Academic Press, 2008.
|
| [15] |
Jiang Y, Wang W, Xie Q, et al. Plants transfer lipids to sustain colonization by mutualistic mycorrhizal and parasitic fungi[J]. Science, 2017, 356(6343): 1172-1175. DOI:10.1126/science.aam9970 |
| [16] |
Drigo B, Pijl AS, Duyts H, et al. Shifting carbon flow from roots into associated microbial communities in response to elevated atmospheric CO2[J]. Proc Natl Acad Sci, 2010, 107(24): 10938-10942. DOI:10.1073/pnas.0912421107 |
| [17] |
van der Heijden MGA, Martin FM, Selosse MA, et al. Mycorrhizal ecology and evolution : the past, the present, and the future[J]. New Phytol, 2015, 205(4): 1406-1423. DOI:10.1111/nph.13288 |
| [18] |
Welling MT, Liu L, Rose TJ, et al. Arbuscular mycorrhizal fungi : effects on plant terpenoid accumulation[J]. Plant Biology, 2016, 18(4): 552-562. |
| [19] |
Zeng Y, Guo L, Chen B, et al. Arbuscular mycorrhizal symbiosis and active ingredients of medicinal plants : current research status and prospectives[J]. Mycorrhiza, 2013, 23(4): 253-265. DOI:10.1007/s00572-013-0484-0 |
| [20] |
Kapoor R, Anand G, Gupta P, et al. Insight into the mechanisms of enhanced production of valuable terpenoids by arbuscular mycorrhiza[J]. Phytochem Rev, 2017, 16(4): 677-692. |
| [21] |
Treseder, Kathleen K. The extent of mycorrhizal colonization of roots and its influence on plant growth and phosphorus content[J]. Plant Soil, 2013, 371(1-2): 1-13. DOI:10.1007/s11104-013-1681-5 |
| [22] |
秦明森, 关佳威, 刘永俊, 等. 丛枝菌根真菌对车轴草属植物生长影响的Meta分析[J]. 草业科学, 2015, 32(10): 1576-1585. Qin MS, Guan JW, Liu YJ, et al. A Meta-analysis of arbuscular mycorrhizal fungi effects on Trifolium plants growth[J]. Pratacultural Science, 2015, 32(10): 1576-1585. DOI:10.11829/j.issn.1001-0629.2015-0014 |
| [23] |
Verbruggen E, van der Heijden MGA, Rillig MC, et al. Mycorrhizal fungal establishment in agricultural soils : factors determining inoculation success[J]. New Phytol, 2013, 197(4): 1104-1109. DOI:10.1111/j.1469-8137.2012.04348.x |
| [24] |
Berruti A, Lumini E, Balestrini R, et al. Arbuscular mycorrhizal fungi as natural biofertilizers : let's benefit from past successes[J]. Front Microbiol, 2016, 6: 1559. DOI:10.3389/fmicb.2015.01559 |
| [25] |
Öpik M, Vanatoa A, Vanatoa E, 等. The online database MaarjAM reveals global and ecosystemic distribution patterns in arbuscular mycorrhizal fungi(Glomeromycota)[J]. New Phytol, 2010, 188(1): 223-241. DOI:10.1111/j.1469-8137.2010.03334.x |
| [26] |
Oehl F, Laczko E, Bogenrieder A, et al. Soil type and land use intensity determine the composition of arbuscular mycorrhizal fungal communities[J]. Soil Biology and Biochemistry, 2010, 42(5): 724-738. DOI:10.1016/j.soilbio.2010.01.006 |
| [27] |
黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成[J]. 中国中药杂志, 2007, 32(4): 277-280. Huang LQ, Guo LP. Secondary metabolites accumulating and geoherbs formation under enviromental stress[J]. China Journal of Chinese Materia Medica, 2007, 32(4): 277-280. |
| [28] |
Selmar D, Kleinwächter M. Influencing the product quality by deliberately applying drought stress during the cultivation of medicinal plants[J]. Ind Crops Prod, 2013, 42: 558-566. DOI:10.1016/j.indcrop.2012.06.020 |
| [29] |
Thakur M, Bhattacharya S, Khosla PK, et al. Improving production of plant secondary metabolites through biotic and abiotic elicitation[J]. Journal of Applied Research on Medicinal and Aromatic Plants, 2019, 12: 1-12. DOI:10.1016/j.jarmap.2018.11.004 |
| [30] |
Xie W, Hao Z, Zhou X, et al. Arbuscular mycorrhiza facilitates the accumulation of glycyrrhizin and liquiritin in Glycyrrhiza uralensis under drought stress[J]. Mycorrhiza, 2018, 28(3): 285-300. DOI:10.1007/s00572-018-0827-y |
| [31] |
张华, 孙纪全, 包玉英. 丛枝菌根真菌影响植物次生代谢产物的研究进展[J]. 农业生物技术学报, 2015, 23(8): 1093-1103. Zhang H, Sun JQ, Bao YY. Advances in studies on plant secondary metabolites influenced by arbuscular mycorrhizal fungi[J]. Journal of Agricultural Biotechnology, 2015, 23(8): 1093-1103. |
| [32] |
Zubek S, Stojakowska A, Anielska T, et al. Arbuscular mycorrhizal fungi alter thymol derivative contents of Inula ensifolia L[J]. Mycorrhiza, 2010, 20(7): 497-504. DOI:10.1007/s00572-010-0306-6 |
| [33] |
Amiri R, Nikbakht A, Rahimmalek M, et al. Variation in the essential oil composition, antioxidant capacity, and physiological characteristics of Pelargonium graveolens Linoculated with two species of mycorrhizal fungi under water deficit conditions[J]. Journal of Plant Growth Regulation, 2017, 36(2): 502-515. DOI:10.1007/s00344-016-9659-1 |
| [34] |
Asensio D, Rapparini F, Peñuelas J nonessential isoprenoids especially under drought stress conditions or after jasmonic acid application. AM fungi root colonization increases the production of essential isoprenoids vs[J]. Phytochem, 2012, 77: 149-161. DOI:10.1016/j.phytochem.2011.12.012 |
| [35] |
Adolfsson L, Nziengui H, Abreu IN, et al. Enhanced secondary-and hormone metabolism in leaves of arbuscular mycorrhizal Medicago truncatula[J]. Plant Physiology, 2017, 4597-4602. |
| [36] |
Copetta A, Lingua G, Berta G. Effects of three AM fungi on growth, distribution of glandular hairs, and essential oil production in Ocimum basilicum L. var. Genovese[J]. Mycorrhiza, 2006, 16(7): 485-494. DOI:10.1007/s00572-006-0065-6 |
| [37] |
Shrivastava G, Ownley BH, Augé RM, et al. Colonization by arbuscular mycorrhizal and endophytic fungi enhanced terpene production in tomato plants and their defense against a herbivorous insect[J]. Symbiosis, 2015, 65(2): 65-74. DOI:10.1007/s13199-015-0319-1 |
| [38] |
Walter MH, Floβ DS, Hans J, et al. Apocarotenoid biosynthesis in arbuscular mycorrhizal roots : contributions from methylerythritol phosphate pathway isogenes and tools for its manipulation[J]. Phytochemistry, 2007, 68(1): 130-138. DOI:10.1016/j.phytochem.2006.09.032 |
| [39] |
Baas R, Lambers H. Effects of vesicular-arbuscular mycorrhizal infection and phosphate on Plantago major sspp leiosperma in relation to the internal phosphate concentration[J]. Physiologia Plantarum, 1988, 74: 701-707. DOI:10.1111/j.1399-3054.1988.tb02040.x |
| [40] |
Schweiger R, Baier MC, Müller C. Arbuscular mycorrhiza-induced shifts in foliar metabolism and photosynthesis mirror the developmental stage of the symbiosis and are only partly driven by improved phosphate uptake[J]. Molecular Plant-Microbe Interactions, 2014, 27(12): 1403-1412. DOI:10.1094/MPMI-05-14-0126-R |
| [41] |
Xie W, Hao Z, Yu M, et al. Improved phosphorus nutrition by arbuscular mycorrhizal symbiosis as a key factor facilitating glycyrrhizin and liquiritin accumulation in Glycyrrhiza uralensis[J]. Plant Soil, 2018, 1. |
| [42] |
Kapoor R, Giri B, Mukerji KG. Improved growth and essential oil yield and quality in Foeniculum vulgare mill on mycorrhizal inoculation supplemented with P-fertilizer[J]. Bioresource Technology, 2004, 93(3): 307-311. DOI:10.1016/j.biortech.2003.10.028 |
| [43] |
Saia S, Benítez E, García-Garrido JM, et al. The effect of arbuscular mycorrhizal fungi on total plant nitrogen uptake and nitrogen recovery from soil organic material[J]. The Journal of Agricultural Science, 2014, 152(3): 370-378. DOI:10.1017/S002185961300004X |
| [44] |
Zhao R, Guo W, Bi N, et al. Arbuscular mycorrhizal fungi affect the growth, nutrient uptake and water status of maize(Zea mays L.) grown in two types of coal mine spoils under drought stress[J]. Applied Soil Ecology, 2015, 88: 41-49. DOI:10.1016/j.apsoil.2014.11.016 |
| [45] |
Hodge A, Fitter AH. Substantial nitrogen acquisition by arbuscular mycorrhizal fungi from organic material has implications for N cycling[J]. Proc Natl Acad Sci, 2010, 107(31): 13754-13759. DOI:10.1073/pnas.1005874107 |
| [46] |
Graciano C, Goya JF, Frangi JL, et al. Fertilization with phosphorus increases soil nitrogen absorption in young plants of Eucalyptus grandis[J]. For Ecol Manage, 2006, 236(2-3): 202-210. DOI:10.1016/j.foreco.2006.09.005 |
| [47] |
刘文兰, 师尚礼, 田福平, 等. 紫花苜蓿生物量空间层次分布与叶片C, N, P化学计量特征对P添加的响应[J]. 草地学报, 2017, 25(2): 322-329. Liu WL, Shi SL, Tian FP, et al. Spatial distribution of alfalfa biomass and response of leaf C, N, P ecological stoichiometry to P addition[J]. Acta Agrestia Sinica, 2017, 25(2): 322-329. |
| [48] |
Gershenzon J. Metabolic costs of terpenoid accumulation in higher plants[J]. J Chem Ecol, 1994, 20(6): 1281-1328. DOI:10.1007/BF02059810 |
| [49] |
Hamilton JG, Zangerl AR, DeLucia EH, et al. The carbon-nutrient balance hypothesis : its rise and fall[J]. Ecology Letters, 2001, 4(1): 86-95. |
| [50] |
Fritz C, Palacios-Rojas N, Feil R, et al. Regulation of secondary metabolism by the carbon-nitrogen status in tobacco : nitrate inhibits large sectors of phenylpropanoid metabolism[J]. The Plant Journal, 2006, 46(4): 533-548. DOI:10.1111/j.1365-313X.2006.02715.x |
| [51] |
Gavito, M E, Jakobsen I, Mikkelsen TN, et al. Direct evidence for modulation of photosynthesis by an arbuscular mycorrhiza-induced carbon sink strength[J]. New Phytol, 2019, 223(2): 896-907. DOI:10.1111/nph.15806 |
| [52] |
Huang J, Hammerbacher A, Forkelová L, et al. Release of resource constraints allows greater carbon allocation to secondary metabolites and storage in winter wheat[J]. Plant Cell and Environment, 2017, 40(5): 672-685. DOI:10.1111/pce.12885 |
| [53] |
Schweiger R, Müller C. Leaf metabolome in arbuscular mycorrhizal symbiosis[J]. Curr Opin Plant Biol, 2015, 26: 120-126. DOI:10.1016/j.pbi.2015.06.009 |
| [54] |
Black KG, Mitchell DT, Osborne BA. Effect of mycorrhizal-enhanced leaf phosphate status on carbon partitioning, translocation and photosynthesis in cucumber[J]. Plant Cell and Environment, 2000, 23(8): 797-809. DOI:10.1046/j.1365-3040.2000.00598.x |
| [55] |
Nielsen KL, Eshel A, Lynch JP. The effect of phosphorus availability on the carbon economy of contrasting common bean (Phaseolus vulgaris L.) genotypes[J]. J Exp Bot, 2001, 52(355): 329-339. DOI:10.1246/cl.2004.788 |
| [56] |
Shinde S, Naik D, Cumming JR. Carbon allocation and partitioning in Populus tremuloides are modulated by ectomycorrhizal fungi under phosphorus limitation[J]. Tree Physiol, 2017, 38(1): 52-65. |
| [57] |
Kapoor R, Chaudhary V, Bhatnagar AK. Effects of arbuscular mycorrhiza and phosphorus application on artemisinin concentration in Artemisia annua L [J]. Mycorrhiza, 2007, 17(7): 581-587. DOI:10.1007/s00572-007-0135-4 |
| [58] |
Khaosaad T, Vierheilig H, Nell M, et al. Arbuscular mycorrhiza alter the concentration of essential oils in oregano(Origanum sp., Lamiaceae)[J]. Mycorrhiza, 2006, 16(6): 443-446. DOI:10.1007/s00572-006-0062-9 |
| [59] |
Mandal S, Upadhyay S, Singh VP, et al. Enhanced production of steviol glycosides in mycorrhizal plants : a concerted effect of arbuscular mycorrhizal symbiosis on transcription of biosynthetic genes[J]. Plant Physiol Biochem, 2015, 89: 100-106. DOI:10.1016/j.plaphy.2015.02.010 |
| [60] |
Chappell J, Wolf F, Proulx J, et al. Is the reaction catalyzed by 3-hydroxy-3-methylglutaryl coenzyme A reductase a rate-limiting step for isoprenoid biosynthesis in plants?[J]. Plant Physiology, 1995, 109(4): 1337-1343. DOI:10.1104/pp.109.4.1337 |
| [61] |
Gerlach N, Schmitz J, Polatajko A, et al. An integrated functional approach to dissect systemic responses in maize to arbuscular mycorrhizal symbiosis[J]. Plant Cell and Environment, 2015, 38(8): 1591-1612. DOI:10.1111/pce.12508 |
| [62] |
Opitz S, Nes WD, Gershenzon J. Both methylerythritol phosphate and mevalonate pathways contribute to biosynthesis of each of the major isoprenoid classes in young cotton seedlings[J]. Phytochemistry, 2014, 98: 110-119. DOI:10.1016/j.phytochem.2013.11.010 |
| [63] |
Laule O, Fürholz A, Chang HS, et al. Crosstalk between cytosolic and plastidial pathways of isoprenoid biosynthesis in Arabidopsis thaliana[J]. Proc Natl Acad Sci, 2003, 100(11): 6866-6871. DOI:10.1073/pnas.1031755100 |
| [64] |
Mendoza-Poudereux I, Kutzner E, Huber C, et al. Metabolic cross-alk between pathways of terpenoid backbone biosynthesis in spike lavender[J]. Plant Physiol Biochem, 2015, 95: 113-120. DOI:10.1016/j.plaphy.2015.07.029 |
| [65] |
Lillo C, Lea US, Ruoff P. Nutrient depletion as a key factor for manipulating gene expression and product formation in different branches of the flavonoid pathway[J]. Plant Cell and Environment, 2008, 31: 587-601. DOI:10.1111/j.1365-3040.2007.01748.x |
| [66] |
Lazzara S, Militello M, Carrubba A, et al. Arbuscular mycorrhizal fungi altered the hypericin, pseudohypericin, and hyperforin content in flowers of Hypericum perforatum grown under contrasting P availability in a highly organic substrate[J]. Mycorrhiza, 2017, 27(4): 345-354. DOI:10.1007/s00572-016-0756-6 |
| [67] |
Essigmann B, Güler S, Narang RA, et al. Phosphate availability affects the thylakoid lipid composition and the expression of SQD1, a gene required for sulfolipid biosynthesis in Arabidopsis thaliana[J]. Proc Natl Acad Sci, 1998, 95(4): 1950-1955. DOI:10.1073/pnas.95.4.1950 |
| [68] |
Jørgensen ME, Nour-Eldin HH, Halkier BA. Transport of defense compounds from source to sink : lessons learned from glucosinolates[J]. Trends Plant Sci, 2015, 20(8): 508-514. DOI:10.1016/j.tplants.2015.04.006 |
| [69] |
Mylona P, Owatworakit A, Papadopoulou K, et al. Sad3 and Sad4 are required for saponin biosynthesis and root development in oat[J]. Plant Cell, 2008, 20(1): 201-212. DOI:10.1105/tpc.107.056531 |
| [70] |
Kurosawa Y, Takahara H, Shiraiwa M. UDP-glucuronic acid : soyasapogenol glucuronosyltransferase involved in saponin biosynthesis in germinating soybean seeds[J]. Planta, 2002, 215(4): 620-629. DOI:10.1007/s00425-002-0781-x |
| [71] |
Zhao J, Dixon R A. The' ins 'and' outs 'of flavonoid transport[J]. Trends Plant Sci, 2010, 15(2): 72-80. DOI:10.1016/j.tplants.2009.11.006 |
| [72] |
Jasiński M, Stukkens Y, Degand H, et al. A plant plasma membrane ATP binding cassette-type transporter is involved in antifungal terpenoid secretion[J]. Plant Cell, 2001, 13(5): 1095-1107. DOI:10.2307/3871366 |
| [73] |
Crouzet J, Roland J, Peeters E, et al. NtPDR1, a plasma membrane ABC transporter from Nicotiana tabacum, is involved in diterpene transport[J]. Plant Mol Biol, 2013, 82(1-2): 181-192. DOI:10.1007/s11103-013-0053-0 |
| [74] |
Kretzschmar T, Kohlen W, Sasse J, et al. A petunia ABC protein controls strigolactone-dependent symbiotic signalling and branching[J]. Nature, 2012, 483(7389): 341-344. DOI:10.1038/nature10873 |
| [75] |
Boursiac Y, Léran S, Corratgé-Faillie C, et al. ABA transport and transporters[J]. Trends Plant Sci, 2013, 18(6): 325-333. DOI:10.1016/j.tplants.2013.01.007 |
| [76] |
张婧, 陈梦词, 马清, 等. 植物ABCG转运蛋白研究进展[J]. 草业学报, 2015, 24(7): 180-188. Zhang J, Chen MC, Ma Q, et al. Review of advances in the study of plant ABCG transporters[J]. Acta Prataculturae Sinica, 2015, 24(7): 180-188. |
| [77] |
Nadal M, Paszkowski U. Polyphony in the rhizosphere : presymbiotic communication in arbuscular mycorrhizal symbiosis[J]. Curr Opin Plant Biol, 2013, 16(4): 473-479. DOI:10.1016/j.pbi.2013.06.005 |
| [78] |
Holbrook NM, Shashidhar VR, James RA, et al. Stomatal control in tomato with ABA-deficient roots : response of grafted plants to soil drying[J]. J Exp Bot, 2002, 53(373): 1503-1514. |
| [79] |
Aroca R, del Mar Alguacil M, Vernieri P, et al. Plant responses to drought stress and exogenous ABA application are modulated differently by mycorrhization in tomato and an ABA-deficient mutant(sitiens)[J]. Microbial Ecology, 2008, 56(4): 704. DOI:10.1007/s00248-008-9390-y |
| [80] |
Zager JJ, Lange BM. Assessing flux distribution associated with metabolic specialization of glandular trichomes[J]. Trends Plant Sci, 2018, 23(7): 638-647. DOI:10.1016/j.tplants.2018.04.003 |
| [81] |
Shi P, Fu X, Shen Q, et al. The roles of AaMIXTA1 in regulating the initiation of glandular trichomes and cuticle biosynthesis in Artemisia annua[J]. New Phytol, 2018, 217(1): 261-276. DOI:10.1111/nph.14789 |
| [82] |
Mandal S, Evelin H, Giri B, et al. Arbuscular mycorrhiza enhances the production of stevioside and rebaudioside-A in Stevia rebaudiana via nutritional and non-nutritional mechanisms[J]. Applied Soil Ecology, 2013, 72: 187-194. DOI:10.1016/j.apsoil.2013.07.003 |
| [83] |
Hazzoumi Z, Moustakime Y, Joutei KA. Effect of arbuscular mycorrhizal fungi and water stress on ultrastructural change of glandular hairs and essential oil compositions in Ocimum gratissimum[J]. Chemical and Biological Technologies in Agriculture, 2017, 4(1): 20. DOI:10.1186/s40538-017-0102-z |
| [84] |
李宏富, 彭励, 刘滨, 等. 甘草根中甘草酸的免疫组织化学定位研究[J]. 西北植物学报, 2012, 32(7): 1361-1364. Li HF, Peng L, Liu B, et al. Immunohistochemical localization of glycyrrhizic acid in the radix of Glycyrrhiza uralensis Fisch[J]. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(7): 1361-1364. |
| [85] |
Marquez N, Giachero ML, Gallou A. Transcriptional changes in mycorrhizal and nonmycorrhizal soybean plants upon infection with the fungal pathogen Macrophomina phaseolina[J]. Molecular. |
| [86] |
Scheller HV, Ulvskov P. Hemicelluloses[J]. Annual Review of Plant Biology, 2010, 61: 263-289. DOI:10.1146/annurev-arplant-042809-112315 |
| [87] |
Chen X, Kang Y, San SP, et al. Arbuscular mycorrhizal fungi increase the proportion of cellulose and hemicellulose in the root stele of vetiver grass[J]. Plant Soil, 2018, 425(1-2): 309-319. DOI:10.1007/s11104-018-3583-z |
| [88] |
Tomczak VV, Müller C. Influence of arbuscular mycorrhizal stage and plant age on the performance of a generalist aphid[J]. Journal of Insect Physiology, 2017, 98: 258-266. DOI:10.1016/j.jinsphys.2017.01.016 |
| [89] |
Smith SE, Jakobsen I, et al. Roles of arbuscular mycorrhizas in plant phosphorus nutrition : interactions between pathways of phosphorus uptake in arbuscular mycorrhizal roots have important implications for understanding and manipulating plant phosphorus acquisition[J]. Plant Physiology, 2011, 156(3): 1050-1057. DOI:10.1104/pp.111.174581 |
| [90] |
Rosendahl S, Peter M, Joseph BM. Lack of global population genetic differentiation in the arbuscular mycorrhizal fungus Glomus mosseae suggests a recent range expansion which may have coincided with the spread of agriculture[J]. Molecular Ecology, 2009, 18(20): 4316-4329. DOI:10.1111/j.1365-294X.2009.04359.x |
| [91] |
Wagg C, Barendregt C, Jansa J, et al. Complementarity in both plant and mycorrhizal fungal communities are not necessarily increased by diversity in the other[J]. J Ecol, 2015, 103(5): 1233-1244. DOI:10.1111/1365-2745.12452 |
| [92] |
Rivero J, Gamir J, Aroca R, et al. Metabolic transition in mycorrhizal tomato roots[J]. Front Microbiol, 2015, 6: 598. |
| [93] |
Xue Z, Tan Z, Huang A, et al. Identification of key amino acid residues determining product specificity of 2, 3-oxidosqualene cyclase in Oryza species[J]. New Phytol, 2018, 218(3): 1076-1088. DOI:10.1111/nph.15080 |
| [94] |
Devarenne TP, Shin DH, Back K, et al. Molecular characterization of tobacco squalene synthase and regulation in response to fungal elicitor[J]. Arch Biochem Biophysics, 1998, 349: 205-215. DOI:10.1006/abbi.1997.0463 |
| [95] |
Song Y, Wang M, Zeng R, et al. Priming and filtering of anti-herbivore defenses among Nicotiana attenuata plants connected by mycorrhizal networks[J]. Plant Cell and Environment, 2019, 42(11): 2945-2961. DOI:10.1111/pce.13626 |




