作物微生物组包括叶、茎、根不同部位的所有”[1]微生物基因资源,是作物的“第二套基因组,不仅蕴含着改变作物生长发育的重要遗传资源,更是作物和环境作用的纽带,是物质循环生态链不可分割的一环,在提升作物产能、维护生态平衡中发挥着不可替代的作用[2]随着微生物组研究技术包括现代测序技术及分析平台的快速发展,关于作物微生物组的研究也逐渐深人,并受到越来越多的重视。例如,国际公布的未来农业发展中最具潜力的五个领域中,农业微生物组研究是其中之一.[3]; 在2017年启动的“中国科学院微生物组计划”中,农作物微生物组也是重要研究内容之一[4]。
根际是作物-微生物相互作用最为活跃的区域,土壤微生物与作物地下部分发生能量和物质交换:作物将光合作用固定的碳以根系分泌物和植物残体的形式释放到根际土壤,为微生物提供养分和基质[5]; 微生物则通过直接或间接的方式,如促进根系养分吸收6]、提高作物环境适应性[7]、调控作物免疫反应[8]等,影响作物的营养代谢和抗逆性能,并最终决定作物的生长发育。目前,科学家围绕多种作物的根际微生物群落结构和功能变化特征展开了一系列研究,包括玉米[9]、水稻[10]、小麦[11]、大豆[12]和向日葵[13]等。
近年来,利用微生物技术促进作物营养代谢、提高作物抗逆性能等越来越被重视,特别是针对作物抗病能力,在减施/不施农药前提下,微生物技术因其灵活性、有效性、以及降低食品安全隐患而被接受[14]。但传统微生物技术常常局限在单株菌的分离、培养和利用,而可培养微生物数量有限,不足总量的3%-5%[15],极大限制了抗逆菌株的应用。跨越传统的思路和技术局限,当前针对作物微生物组的研究提供了从微生物组层面寻找解决这一问题的可能:对根际微生物组进行改良、重组和构建。虽然根际微生物组的功能研究已经取得了一定进展,并在此基础上探索了微生物组的人工模拟和重建[16],但是,根际微生物组重组构建相关技术体系的打造仍处在初期探索阶段,存在巨大提升空间。
当前在技术上想完全复制任何一种作物的微生物组都似乎不大可能。在现有条件下,努力突破以往单株或单类菌的局限性,尽可能实现微生物组综合体系的运用则是比较实际的策略。以往的生产实践中,有些已经蕴含着作物微生物组改良和重组的思路。但是,由于具体目标的侧重点不同,并没有突出和强化“微生物组”的改变。那么,当前有哪些可能的策略有助于实现作物根际微生物组改良和重组的目标?在前人探索基础上、并结合我们自己的经验和思考,以提高作物抗病能力为例,我们归纳了3种可能实现根际微生物组改良、重组和构建的技术构想(图 1),希望能够为科研工作者提供一定的启发和借鉴。能否真正实现应用推广,还需要在不断实践的基础上,进一步提升和完善相关细节。
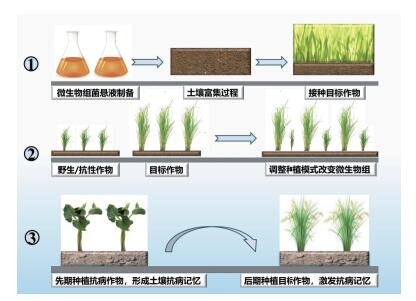
|
| ①土壤菌悬液接种法:利用土壤微生物组菌悬液作为接种源,实际操作中需要经过土壤培育和富集的过程,并适度结合筛选分离的高效生防菌联合施用;②作物间作/套种法:利用作物对微生物组的选择、以及植物间微生物组的交流和互换来实现改良和重组的目标,比如,可以利用野生/抗病作物所具有的对有益微生物组的募集作用来服务于栽培作物的微生物组改良目的;③土壤记忆法:前期种植的作物所具有的微生物组特征,会延续至后期种植的作物,前期种植作物的选择可以选择抗病作物为主 图 1 作物根际微生物组改良和重组的三种技术体系的初步构想 |
借鉴传统微生物分离、培养和回接的模式,用根际微生物组菌群代替单株菌对目标作物进行接种。针对根际微生物组,可以采用土壤菌悬液,能够在较大程度上保留微生物组的类群,包括类群间的比例关系。Yan等[17]系统研究了不同稀释浓度的土壤菌悬液接种后的植物根际微生物群落结构和功能的变化,结果表明,利用土壤菌悬液接种可以有效获得原始土壤微生物组绝大多数组成类群,包括变形菌(Proteobacteria)、放线菌(Actinobacteria)、拟杆菌(Bacteroidetes)、酸杆菌(Acidobacteria)、疣微菌(Verrucomicrobia)、浮霉菌(Planctomycetes)和厚壁菌(Firmicutes),占微生物类群总量的90%以上;此外,特定的稀有类群在高倍稀释的土壤菌悬液中依然能够保留。Panke-Buisse等[18]研究发现,使用特定表型拟南芥(开花时间不同)的根际土壤悬液接种其他拟南芥植株能够改变目标植株的开花时间,证实了土壤菌悬液接种能够通过作物根际微生物组进而改变宿主性状。当前,已有研究表明,使用健康土壤菌悬液接种特定植株,可以增强植株抗病免疫能力[19]。在传统农业管理方法中,“客土法”已蕴含了微生物组改良的思路,如李集勤等[20]将红砂土作为“客土”掺混沙泥田耕层土壤,显著降低了烟草青枯病的发病率,其主要原因之一是红砂土中含有大量放线菌,能够改善烟草根际微生物群落结构,增强植株对青枯病原菌的拮抗能力。由于该方法引入了非原位土壤,对“客土”的土壤质量要求较高,而土壤菌悬液接种法能够一定程度上降低土壤因素带来的影响,有利于突出微生物组重组改良的功效。
土壤菌悬液接种法的关键在于菌悬液的制备过程,van de Voorde等[21]对土壤菌悬液的制备方法进行了研究,比较了经1 mm筛和20 μm筛过滤的菌悬液接种后植物的生物量,发现后者对植物的促生长效果更显著。这一结论表明,菌悬液制备方式能够显著影响接种效果。此外,土壤菌悬液接种后通常也会需要一个富集、培育的过程,才可以达到预期的微生物数量。Chang等[19]的研究表明,使用黑土菌悬液接种灭菌后的土壤,需要经过48 d的温室培育过程,才可以促进微生物组在目标土壤中获得足够量的积累,使其具备黑土微生物类群结构。无论是菌悬液的制备还是富集过程,虽然跨越了单株菌的分离培养,依然会导致微生物类群的丢失,但相对来说可以在较大程度上实现微生物组的模拟构建。在这一过程中,可以融合传统方法得到的抗病菌株以提高改良效果。由于微生物间的相互作用关系在调控根际微生物群落结构和功能方面起到重要作用[22],影响着微生物组的生态服务功能,因此,在微生物组的应用中,微生物之间的相互作用关系也是需要考虑的重要因素。在具体实践中,我们可以首先筛选能够分离培养的抗病微生物,再结合土壤菌悬液的使用,尤其关注抗病菌株与土壤菌悬液的配比和组合,以寻求最优改良效果。
2 作物间作/套种法如果说土壤菌悬液接种法中人为选择还发挥着主导作用,作物间作/套种法则更多发挥作物本身对微生物组的选择作用,通过作物-作物之间的交流实现微生物组的重组,进而达到改良效果。丛枝菌根真菌和作物的互作研究已经证实,真菌的菌丝桥不仅可以实现不同植物间的营养传递,而且能够实现抗病信号的传递,提升作物整体免疫力[23]。
作物间作/套种法的关键在于通过调整不同作物的联合种植模式,将抗逆作物微生物组有效输入到目标作物根际,进而实现根际微生物群落的重组和改良,起到提升作物抗逆性能的效果。目前,已有研究报道了间作对作物根际微生物群落结构及作物抗病能力的影响。Jin等[24]发现与单作黄瓜相比,小麦间作的黄瓜根际微生物组中厌氧绳菌(Anaerolineae)、δ-变形菌(Deltaproteobacteria)、浮霉菌(Planctomycetacia)等丰度较高,而α-变形菌(Alphaproteobacteria)和蓝细菌(Cyanobateria)等丰度较低。此外,小麦与黄瓜的间作提高了有益菌(如假单胞菌属Pseudomonas spp.和原囊菌属Archangium spp.等)在黄瓜根际的定殖比例,改良了黄瓜根际微生物组的群落结构,进而提高了黄瓜对枯萎病的抗病能力[24]。
研究表明,由于生存环境严苛,野生作物的根际微生物组中往往蕴含着丰富的抗病微生物资源,在作物抗病中具有重要的应用潜力,可以利用其实现栽培作物抗病[25]。因此,针对作物微生物组的改良目的,微生物组输出源可以是抗病品种及野生作物[26-27]。可以将野生作物和栽培作物(包括已有抗病品种)合理搭配组合,通过彼此之间的交流,将野生作物富集的微生物组输入到栽培作物,进而提升栽培作物的抗病能力。这里的关键在于如何促进微生物组在不同植物间的有效传递,而这一关键点正是目前仍在探索的地方,在技术上暂时没有实现大的突破。此外,还需要考虑现实生产中如何避免混种或者套种带来的外源作物与目标作物竞争生长所必需的营养、光照、水分等情况[28];且为了促进输出源微生物组的有效抗病性,是否以及如何实现对输出源微生物组进行先期抗逆诱导等;这些细节是完善该项技术体系打造的重要内容,需要在理论探索基础上不断地实践摸索。
3 土壤记忆法决定微生物组类群结构和功能的两个主要因素是土壤和作物,上面的方法探讨了作物的选择作用潜在的应用可能。此外,我们还可以考虑借助土壤的某些特性,如“土壤记忆”在改良作物根际微生物组中的作用。
土壤记忆法阐述的是,土壤赋予给植物的微生物组类群常常倾向于沿袭上一代在该土壤中生长的植物所具有的微生物组,也就是所谓的“记忆”。Wei等[29]研究了健康植物和患病植物根际土壤对下一代植物的影响发现,健康植物根际土壤能够显著降低下一代植物的发病率,为“土壤记忆”提供了最直接的证据。此外,Raaijmakers和Mazzola[30]在2016年提出了“土壤免疫”的概念,指出土壤对植物病原菌也具有识别和记忆的功能,一些“抑病土壤”能够在病原菌再次侵染植物时表现出对病原菌的抑制作用,帮助植物抵抗病原菌。而“土壤免疫”的形成与上一代植物被病原菌感染后特异性招募的拮抗微生物菌群以及进而构建的抗病根际微生物组密切相关,且微生物间互作关系也在其中发挥关键作用[8, 31]。
由于病原菌同样可以通过“土壤记忆”传递[32],因此在实际应用中,为了避免发病,上一代种植的植物最好是抗病品种、或者是爆发该病害概率较小的其它作物类型,既能一定程度避免土壤中病原菌的传递,又能够将抗病品种根际富集的微生物组进行有效的利用[33-34]。对黑土农田微生物的研究,证实了“一方水土养一方微生物”的生态学特征,也意味着土壤是决定作物微生物群落结构和功能的重要因素[35]。若将土壤记忆法应用到作物根际微生物组的改良、重组和构建中,关键在于寻找合适的轮换作物,以及需要以健康土壤作为培育最初优良微生物组的基础,最终的效果是土壤和作物联合作用的综合体现。
4 展望除了以上提到的土壤和作物两个主要因素之外,农业水资源[36]、大气资源[37]等也都可能影响着作物微生物组的类群和功能。此外,农田管理措施如秸秆还田[38]、减肥增效[39]、调整种植结构[40]等,也会在不同程度上改变作物根际微生物组,只是改变方向及可控性还需要详细探索。
综上,本文在前人实践经验的基础上,特别是以“客土法”、“作物间作法”和“作物轮作法”等生产实践操作为依据,初步归纳和探讨了3种根际微生物组改良和重组的技术构想,将传统技术中涉及微生物组的内容更为具体和清晰化,目的在于引导科研工作者积极思考,并针对现有技术的不足开展相关工作,共同推进根际微生物组改良重组技术体系的打造和完善。未来进一步探索根际微生物组改良和重组的技术体系,可以考虑在宏基因组基础上的功能解析、高通量测序基础上的核心类群鉴定、并结合传统分离培养中高效菌株的培育和改良等综合手段,把作物学、土壤学以及生态学等的相关知识有效融合,打造高效根际微生物组改良技术体系,提升作物生产力。
| [1] |
Berendsen RL, Pieterse CM, Bakker PA. The rhizosphere microbiome and plant health[J]. Trends Plant Sci, 2012, 17: 478-486. DOI:10.1016/j.tplants.2012.04.001 |
| [2] |
Muller DB, Vogel C, Bai Y, et al. The plant microbiota:systems-level insights and perspectives[J]. Annual Review of Genetics, 2016, 50: 211-234. DOI:10.1146/annurev-genet-120215-034952 |
| [3] |
Khosla R. Science breakthroughs 2030:transforming food and agriculture research[J]. CSA News, 2018, 63: 14-15. DOI:10.2134/csa2018.63.0910 |
| [4] |
刘双江. 微生物组:新机遇, 新天地[J]. 微生物学报, 2017, 57(6): 791. Liu SJ. Microbiome:New opportunities, new worlds[J]. Acta Microbiologica Sinica, 2017, 57(6): 791. DOI:10.1016/j.ajog.2015.05.032 |
| [5] |
Sasse J, Martinoia E, Northen T. Feed your friends:do plant exudates shape the root microbiome?[J]. Trends Plant Sci, 2018, 23: 25-41. DOI:10.1016/j.tplants.2017.09.003 |
| [6] |
Mbodj D, Effa-Effa B, Kane A, et al. Arbuscular mycorrhizal symbiosis in rice:establishment, environmental control and impact on plant growth and resistance to abiotic stresses[J]. Rhizosphere, 2018, 8: 12-26. DOI:10.1016/j.rhisph.2018.08.003 |
| [7] |
Zhang R, Vivanco JM, Shen Q. The unseen rhizosphere root-soil-microbe interactions for crop production[J]. Current Opinion in Microbiology, 2017, 37: 8-14. DOI:10.1016/j.mib.2017.03.008 |
| [8] |
Berendsen RL, Vismans G, Yu K, et al. Disease-induced assemblage of a plant-beneficial bacterial consortium[J]. ISME J, 2018, 12: 1496-1507. DOI:10.1038/s41396-018-0093-1 |
| [9] |
Szoboszlay M, Lambers J, Chappell J, et al. Comparison of root system architecture and rhizosphere microbial communities of Balsas teosinte and domesticated corn cultivars[J]. Soil Biology and Biochemistry, 2015, 80: 34-44. |
| [10] |
Shenton M, Iwamoto C, Kurata N, et al. Effect of wild and cultivated rice genotypes on rhizosphere bacterial community composition[J]. Rice(N Y), 2016, 9: 42. DOI:10.1186/s12284-016-0111-8 |
| [11] |
Chen S, Waghmode TR, Sun R, et al. Root-associated microbiomes of wheat under the combined effect of plant development and nitrogen fertilization[J]. Microbiome, 2019, 7: 136. DOI:10.1186/s40168-019-0750-2 |
| [12] |
Mendes LW, Raaijmakers JM, de Hollander M, et al. Influence of resistance breeding in common bean on rhizosphere microbiome composition and function[J]. ISME Journal, 2018, 12: 212-224. DOI:10.1038/ismej.2017.158 |
| [13] |
Leff JW, Lynch RC, Kane NC, et al. Plant domestication and the assembly of bacterial and fungal communities associated with strains of the common sunflower, Helianthus annuus[J]. New Phytol, 2017, 214: 412-423. DOI:10.1111/nph.14323 |
| [14] |
乔雪娟. 微生物在植物病虫害防治上的应用[J]. 林业科技情报, 2019, 51(4): 17-18. Qiao XJ. Application of microorganisms in the control of plant diseases and insect pests[J]. Forestry Science and Technology Information, 2019, 51(4): 17-18. |
| [15] |
邢磊, 赵圣国, 郑楠, 等. 未培养微生物分离培养技术研究进展[J]. 微生物学通报, 2017, 44(12): 3053-3066. Xing L, Zhao SG, Zhen N, et al. Advance in isolation and culture techniques of uncultured microbes:a review[J]. Microbiology, 2017, 44(12): 3053-3066. |
| [16] |
Liu Y, Qin Y, Bai Y. Reductionist synthetic community approaches in root microbiome research[J]. Current Opinion in Microbiology, 2019, 49: 97-102. DOI:10.1016/j.mib.2019.10.010 |
| [17] |
Yan Y, Kuramae EE, Klinkhamer PG, et al. Revisiting the dilution procedure used to manipulate microbial biodiversity in terrestrial systems[J]. Applied and Environmental Microbiology, 2015, 81(4246): 4252. |
| [18] |
Panke-Buisse K, Poole AC, Goodrich JK, et al. Selection on soil microbiomes reveals reproducible impacts on plant function[J]. ISME Journal, 2015, 9: 980-989. DOI:10.1038/ismej.2014.196 |
| [19] |
Chang C, Chen W, Luo S, et al. Rhizosphere microbiota assemblage associated with wild and cultivated soybeans grown in three types of soil suspensions[J]. Archives of Agronomy and Soil Science, 2018, 65: 74-87. |
| [20] |
李集勤, 陈俊标, 袁清华, 等. 客土改良对植烟土壤营养及烟草青枯病的影响[J]. 中国烟草科学, 2017, 38(1): 48-52. Li JQ, Chen JB, Yuan QH, et al. Effects of alien earth soil-improving on soil nutrient status and tobaccobacterial wilt[J]. Chinese Tobacco Science, 2017, 38(1): 48-52. |
| [21] |
van de Voorde TFJ, van der Putten WH, Bezemer TM. Soil inoculation method determines the strength of plant-soil interactions[J]. Soil Biology and Biochemistry, 2012, 55: 1-6. DOI:10.1016/j.soilbio.2012.05.020 |
| [22] |
Hassani MA, Duran P, Hacquard S. Microbial interactions within the plant holobiont[J]. Microbiome, 2018, 6: 58. DOI:10.1186/s40168-018-0445-0 |
| [23] |
BartoEK, Weidenhamer JD, Cipollini D, et al. Fungal superhighways:do common mycorrhizal networks enhance below ground communication?[J]. Trends Plant Sci, 2012, 17: 633-637. DOI:10.1016/j.tplants.2012.06.007 |
| [24] |
Jin X, Shi Y, Wu F, et al. Intercropping of wheat changed cucumber rhizosphere bacterial community composition and inhibited cucumber Fusarium wilt disease[J]. Scientia Agricola, 2020, 77. DOI:10.1590/1678-992x-2019-0005 |
| [25] |
Perez-Jaramillo JE, Mendes R, Raaijmakers JM. Impact of plant domestication on rhizosphere microbiome assembly and functions[J]. Plant Mol Biol, 2016, 90: 635-644. DOI:10.1007/s11103-015-0337-7 |
| [26] |
Mendes LW, Mendes R, Raaijmakers JM, et al. Breeding for soil-borne pathogen resistance impacts active rhizosphere microbiome of common bean[J]. ISME Journal, 2018, 12: 3038-3042. DOI:10.1038/s41396-018-0234-6 |
| [27] |
Tian L, Shi S, Nasir F, et al. Comparative analysis of the root transcriptomes of cultivated and wild rice varieties in response to Magnaporthe oryzae infection revealed both common and species-specific pathogen responses[J]. Rice(N Y), 2018, 11: 26. DOI:10.1186/s12284-018-0211-8 |
| [28] |
Brooker RW, BennettAE, Cong WF, et al. Improving intercropping:a synthesis of research in agronomy, plant physiology and ecology[J]. New Phytol, 2015, 206: 107-117. DOI:10.1111/nph.13132 |
| [29] |
Wei Z, Gu Y, Friman VP, et al. Initial soil microbiome composition and functioning predetermine future plant health[J]. Science Advances, 2019, 5:eaaw0759. DOI:10.1126/sciadv.aaw0759 |
| [30] |
Raaijmakers JM, Mazzola M. Soil immune responses[J]. Science, 2016, 352: 1392-1393. DOI:10.1126/science.aaf3252 |
| [31] |
Yuan J, Zhao J, Wen T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Microbiome, 2018, 6: 156. DOI:10.1186/s40168-018-0537-x |
| [32] |
黄新琦, 蔡祖聪. 土壤微生物与作物土传病害控制[J]. 中国科学院院刊, 2017, 32: 593-600. Huang XQ, Cao ZC. Soil microbes and control of soil-borne diseases[J]. Bulletin of the Chinese Academy of Sciences, 2017, 32: 593-600. |
| [33] |
Lapsansky ER, Milroy AM, Andales MJ, et al. Soil memory as a potential mechanism for encouraging sustainable plant health and productivity[J]. Current Opinion in Biotechnology, 2016, 38: 137-142. DOI:10.1016/j.copbio.2016.01.014 |
| [34] |
Bettenfeld P, Fontaine F, Trouvelot S, et al. Woody plant declines. What's wrong with the microbiome?[J]. Trends Plant Sci, 2020, 25: 381-394. DOI:10.1016/j.tplants.2019.12.024 |
| [35] |
Liu J, Sui Y, Yu Z, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113-122. DOI:10.1016/j.soilbio.2013.12.014 |
| [36] |
Meisner A, De Deyn GB, de Boer W, et al. Soil biotic legacy effects of extreme weather events influence plant invasiveness[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110: 9835-9838. DOI:10.1073/pnas.1300922110 |
| [37] |
Zhang T, Chen HYH, Ruan H. Global negative effects of nitrogen deposition on soil microbes[J]. ISME Journal, 2018, 12: 1817-1825. DOI:10.1038/s41396-018-0096-y |
| [38] |
徐莹莹, 王俊河, 刘玉涛, 等. 耕作与秸秆还田方式对连作玉米田根际微生物及酶活性的影响[J]. 黑龙江农业科学, 2018, 7: 1-3. Xu YY, Wang JH, Liu YT, et al. Effects of tillage and straw returning on microorganism and enzyme activity in continuous cropping corn field[J]. Heilongjiang Agricultural Sciences, 2018, 7: 1-3. |
| [39] |
Fu L, Penton CR, Ruan Y, et al. Inducing the rhizosphere microbiome by biofertilizer application to suppress banana Fusarium wilt disease[J]. Soil Biology and Biochemistry, 2017, 104: 39-48. DOI:10.1016/j.soilbio.2016.10.008 |
| [40] |
Hamel C, Gan Y, Sokolski S, et al. High frequency cropping of pulses modifies soil nitrogen level and the rhizosphere bacterial microbiome in 4-year rotation systems of the semiarid prairie[J]. Applied Soil Ecology, 2018, 126: 47-56. DOI:10.1016/j.apsoil.2018.01.003 |




