生长抑素又名生长激素释放抑制因子,是抑制动物生长的一类激素。1968年在绵羊下丘脑中发现[1],随后被分离、提取并命名为生长抑素(Somatostatin,SS)[2]。一般认为,SS是一组在分子结构上密切相关和生物效应上相似的物质,并且所有哺乳动物SS的氨基酸序列都相同,没有种属差异,其中SS-14是SS的主要生物活性结构[3-4],它是分子量为1.639 kD的14肽。天然SS-14成环状,在3位和14位半胱氨酸之间形成二硫键。除SS-14以外,还有SS-28和SS-25等其它形式。
SS广泛分布在动物机体的神经系统、外周神经系统、大脑皮层和消化道等。SS通过其受体(Somatostatin receptor,SSR)发挥作用实现对脑垂体功能的调节以及抑制胃的蠕动、胃酸分泌、肠道对糖类氨基酸以及电解质的吸收。实验表明SS免疫可以中和体内SS,进而促进动物生长和提高生产性能。用SS抗体免疫幼虹鳟鱼五周后,较对照组体重有所增加[5]。利用SS免疫猪[6]、羔羊和小牛,对其生长有一定的促进作用[7-10]。SS的免疫方式可以分为被动免疫和主动免疫[7-10],其中被动免疫为给动物注射SS抗血清,即注射抗体,动物直接对SS产生免疫力,但该法的缺点在于抗血清对动物作用时间短,需要不断加强免疫及改善在动物生产性能上的应用。另外一种免疫方式是主动免疫,通过导入抗原物质来激发动物主动对外来SS抗原产生抗体,作用时间比较长,更具应用价值。
植物源性的饲料包含大量的木聚糖。木聚糖是一种杂聚多糖[11],其主链是由吡喃木糖通过β-1,4糖苷键连接而形成的,在主链的吡喃木糖环的2号和3号位有不同的取代基。这些取代基包括4-O-甲基-D-葡萄糖醛酸残基、α-L-阿拉伯糖残基、O-乙酰基等,其中α-L-阿拉伯糖残基上又可与阿魏酸和香豆酸等酯化[12-13]。木聚糖是半纤维素的主要成分,它对维持细胞纤维的凝聚力和细胞壁的完整性起着非常重要的作用,半纤维素是植物细胞壁的主要组成成分,也是自然界中除纤维素之外第二丰富的再生资源[14]。木聚糖酶能够有效地降解木聚糖主链的β-1,4糖苷键,从而起到破坏植物细胞壁、促进营养物质释放的重要作用。目前木聚糖酶研究最多的为GH10和GH11家族,GH10家族主要来源于细菌、真菌和植物,催化结构域为α螺旋和β折叠片层构成的八桶状结构,有的木聚糖酶最适温度达到100℃,而GH11家族则耐碱和耐热性相对较差[15]。
在饲料里添加木聚糖酶可以有效地降低动物消化道中食糜的黏度、提高干物质的消化率和营养吸收,从而提高饲料的利用率。国内外大量的研究表明,在饲料里添加木聚糖酶能够显著提高动物的生产性能。汪敬等[16]在饲粮中添加富含木聚糖酶的酶制剂,使23-38 kg的生长肥育猪日增重和饲料转化率分别提高8.4%和4.3%。可见,在单胃动物家畜的日粮中添加木聚糖酶能有效消除抗营养因子的负作用并提高饲料利用率和动物的生产性能。
SS-14是只有14个氨基酸的小肽,在体内稳定性较差,Spencer等[17]曾使用α-球蛋白和BSA作为载体蛋白进行了SS的偶联成功制备了抗原,但制备成本高的问题却没有得到解决。Ding等[18]为了改善SS的代谢动力学,将人血清白蛋白(HSA)和两拷贝SS-14融合表达,但HSA有585个氨基酸,相较于SS的14个氨基酸较多,SS氨基酸所占融合蛋白氨基酸比例2.3%,而且HSA只能单纯的作为蛋白质来源,不能发挥其它作用;而木聚糖酶在饲料中广泛添加,且具有很好的促生长作用。因此,本研究尝试使用木聚糖酶和SS-14融合来制备SS的融合蛋白,具体为将嗜热细菌Caldicellulosiruptor bescii来源的木聚糖酶CbXyn10C与SS进行融合表达,以期获得具有SS抗原性与免疫原性的重组蛋白,且融合蛋白又保留木聚糖酶的活性,为提高饲料利用率和提高动物生长和生产性能提供新思路。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和实验动物毕赤酵母(Pichia pastoris)GS115、表达质粒pPIC9和细菌C. bescii来源的木聚糖酶基因CbXyn10C由本实验室保存;大肠杆菌Escherichia coli Trans1-Tl和质粒pEASY-T3购自北京全式金生物技术有限公司。20-25 g重、6周龄BALB/c雄性小鼠由北京维通利华实验动物技术有限公司提供。
1.1.2 主要培养基LB培养基:蛋白胨1%,酵母提取物0.5%,NaCl 1%,固体培养基另添加2%琼脂粉;YPD培养基:酵母提取物1%,蛋白胨2%,葡萄糖2%;BMGY种子培养基:蛋白胨2%,酵母提取物1%,甘油1%,生物素4 mg/L,YNB 13.4 g/L;BMMY诱导培养基:蛋白胨2%,酵母提取物1%,生物素4 mg/L,YNB 13.4 g/L,甲醇0.5%;MD固体培养基:葡萄糖20 g/L,琼脂糖20 g/L,YNB 13.4 g/L,生物素4 mg/L。
1.1.3 试剂和仪器榉木木聚糖(Beechwood xylan)购自Sigma公司;生物素购自国药集团化学试剂有限公司;质粒小提试剂盒购自北京天根生化科技有限公司;DNA胶回收试剂盒购自OMEGA公司;Taq酶和限制性内切酶(EcoRI和NotI)购自Fermentas公司;限制性内切酶BglII购自TaKaRa公司;T4 DNA连接酶购自New England Biolab公司;蛋白Marker购自北京GeneStar生物公司,PVDF膜(0.45 μm)购自Amersham Biosciences公司;生长抑素SS-14和针对SS-14的兔IgG多克隆抗体一抗(效价1:64 000),由南京金斯瑞生物科技有限公司制备;二抗为羊抗兔IgG-HRP或羊抗鼠IgG-HRP,分别购自Sigma和北京陆桥技术股份有限公司;弗氏完全佐剂和不完全佐剂均为Sigma公司产品;DAB购自上海生工生物工程有限公司;引物由上海捷瑞生物工程有限公司合成;测序由北京擎科生物技术有限公司完成。其他试剂均为国产分析纯。主要仪器如下:PCR扩增仪(美国Bio-Rad公司,型号T100),电转仪(美国Bio-Rad公司,型号411 BR0167),凝胶成像系统(美国Bio-Rad公司,型号1708195),高速冷冻离心机(日本HIMAC公司,型号CR2IGIII),酶标仪(美国Thermo公司,型号HIMFDG),水浴锅(上海森信公司,型号DLL-8D),恒温培养箱(北京利康公司,型号SPX-250),涡旋混合器(北京同正公司,型号HQ-60-Ⅱ)。
1.2 方法 1.2.1 表达载体pPIC9-CbXyn10C-SS的构建本实验室此前在大肠杆菌和毕赤酵母中均实现了CbXyn10C的重组表达[19]。以在毕赤酵母中进行工程表达的质粒pPIC9-CbXyn10C为模板,利用特异性引物CbXyn10C-F分别和CbXyn10C-R1、CbXyn10C-R2、CbXyn10C-R3进行3轮PCR扩增以获得CbXyn10C-SS基因,具体方法如表 1所示。PCR扩增程序为:95℃,5 min;95℃,30 s,60℃,30 s,72℃,75 s,30个循环;72℃,10 min。1%琼脂糖凝胶电泳并切胶回收目的条带。CbXyn10C-SS基因与酵母表达载体pPIC9,分别用EcoRI和NotI进行双酶切,电泳、切胶回收目的片段,用T4连接酶连接、转化大肠杆菌Trans1-T1并筛选得到重组质粒pPIC9-CbXyn10C-SS。
将pPIC9-CbXyn10C、pPIC9-CbXyn10C-SS分别用SacI单酶切以线性化质粒,电击转化GS115感受态细胞并涂布于MD平板,30℃培养3 d。挑取单克隆于BMGY培养基中培养2 d,更换至BMMY诱导培养基继续培养2 d。12 000×g离心,收集培养液上清筛选产酶克隆。将高酶活转化子在200 mL液体培养基中培养、诱导,同法收集培养液上清即为粗酶液,将其用10 kD的超滤膜包浓缩。浓缩后的酶液再对磷酸-柠檬酸缓冲液(100 mmol/L,pH7.5)超滤以脱盐。将获得的重组蛋白进行SDS-PAGE电泳验证蛋白的大小及纯度。
1.2.3 CbXyn10C-SS融合蛋白中生长抑素抗原性分析将1.6 µg的CbXyn10C和CbXyn10C-SS蛋白分别进行SDS-PAGE电泳,将蛋白电转移到PVDF膜上(转印条件:25 Ⅴ,1.5A,7 min),5%脱脂牛奶4℃过夜封闭。将PVDF膜与抗SS的一抗(500×稀释)在37℃孵育2 h,PBST(10 mmol/L磷酸盐缓冲液,pH7.4,0.05% Tween-20)中洗膜3次,每次10 min。再将膜与HRP标记的羊抗兔IgG在37℃孵育2 h,洗涤3次。最后将膜在含有DAB溶液中孵育,当见到显色条带时立即用蒸馏水冲洗膜以终止反应。
1.2.4 CbXyn10C-SS融合蛋白中生长抑素免疫原性分析取6只6周龄BALB/c雄性小鼠,将小鼠分为2组,每组3只,第1组免疫CbXyn10C-SS蛋白,剩余小鼠做对照组,编为第2组。免疫程序如下,首免:将CbXyn10C-SS用20 mmol/L PBS稀释至2 mg/mL,取300 μL蛋白溶液与300 μL弗氏完全佐剂混合,利用微量乳化器乳化制成浓度为1 μg/μL的疫苗,200 μL/只,颈部、背部皮下多点注射。二免:14 d后进行二免,取2 mg/mL的CbXyn10C-SS 150 μL与150 μL弗氏不完全佐剂混合,利用微量乳化器乳化制成浓度为1 μg/μL的疫苗,100 μL/只,皮下多点注射。三免:14 d后进行三免,方法同二免。三免7 d后断尾采血,3 000×g离心5 min以收集血清,ELISA法检测抗体效价,如效价符合要求则三免后8 d眼眶采血收集每只小鼠血清,-20℃保存备用。使用斑点免疫(Dot-blot)方法对小鼠血清中针对SS-14的抗体进行检测,方法如下:将倍比稀释的SS-14(1 μg、0.5 μg、0.25 μg和0.125 μg)分别点样至PVDF膜上,室温晾干,将膜在5%脱脂牛奶中于37℃封闭1 h。将封闭好的膜与2 000×稀释的一抗在37℃下孵育2 h。使用PBST洗涤膜3次,每次10 min;再将膜与2 000×稀释的HRP标记的兔抗鼠IgG孵育2 h,PBST洗涤3次,每次10 min;将膜浸泡于DAB溶液中直到出现斑点,用蒸馏水冲洗膜以终止反应。
1.2.5 CbXyn10C和CbXyn10C-SS融合蛋白木聚糖酶比活的测定将5 mg/mL的榉木木聚糖分别与CbXyn10C-SS蛋白(0.1 µmol/L)在和CbXyn10C-SS融合蛋白(0.1 µmol/L)在0.1 mol/L磷酸-柠檬酸缓冲溶液中混合孵育,90℃和95℃反应10 min,加人1.5 mL二硝基水杨酸(DNS)[20],沸水浴煮5 min,冷却后测定OD540,根据木糖对DNS的标准曲线计算酶活。酶活单位定义为:1个木聚糖酶活性单位(U)为以0.5%可溶性榉木木聚糖为底物,在最适pH和最适温度条件下每分钟水解木聚糖生成1 μmol木糖所需的酶量。
1.2.6 CbXyn10C与CbXyn10C-SS酶学性质分析最适pH:将5 mg/mL的榉木木聚糖和适当稀释的酶液在不同缓冲液pH条件(100 mmol/L,Gly-HCl缓冲液:pH 2.0-3.0;柠檬酸-磷酸氢二钠缓冲液:pH 3.0-7.5;Tris-HCl缓冲液:pH 8.0;Gly-NaOH缓冲液:pH 9.0-10.0)下于80℃反应10 min。最适温度:在最适pH(6.0)条件下将CbXyn10C、CbXyn10C-SS在不同温度(40℃、50℃、60℃、70℃、75℃、80℃、85℃、90℃、95℃和100℃)下分别反应10 min,测定酶活。pH稳定性:将酶液稀释至合适浓度在不同pH的缓冲液下37℃处理1 h后,在最适温度和最适pH下测定剩余酶活。温度稳定性:将酶液分别在80℃和90℃下孵育,定时取出样品并在最适条件下测定残余酶活。金属离子和化学试剂对酶活的影响:在酶促反应体系中加入终浓度为5 mmol/L的不同金属离子(Li+、Na+、K+、Pb+、Mg2+、Mn2+、Fe3+、Cr3+、Cu2+、Co2+、Zn2+、Ni+和Ca2+),在该酶的最适条件下测定酶活。动力学常数:以底物浓度为0.125-5 mg/mL、最适温度和最适pH下分别测量CbXyn10C与CbXyn10C-SS的酶活,利用双倒数作图法计算得到KM、Vmax和kcat的值。
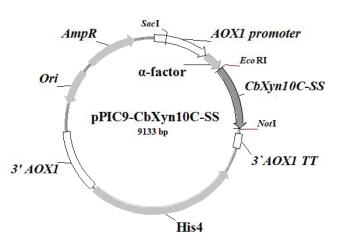
2 结果 2.1 融合基因CbXyn10C-SS的克隆及表达载体的构建以本室所存质粒pPIC9-CbXyn10C为模板进行3轮PCR扩增,成功获得CbXyn10C-SS融合基因。序列分析表明(图 1),CbXyn10C基因全长为1 020 bp,编码339个氨基酸,理论分子量为39.23 kD,等电点为6.21。在CbXyn10C和SS-14之间设计了GGGGS的柔性连接肽(linker)序列。CbXyn10C-SS融合基因全长为1 077 bp,编码358个氨基酸(图 1),SS氨基酸所占融合蛋白氨基酸比例4.0%;理论分子量大小为41.28 kD,等电点为6.73。对本研究中构建得到的重组质粒载体pPIC9-CbXyn10C-SS基因测序表明,CbXyn10C-SS融合基因以正确的阅读框与酵母表达载体pPIC9的α因子信号肽序列的3′端融合,重组质粒的构建正确(图 2)。

|
| 斜体为GGGGS柔性连接肽序列;SS-14序列以黑体、下划线表示 图 1 CbXyn10C-SS的基因和所编码融合蛋白的氨基酸序列 |
|
| 图 2 重组表达质粒pPIC9-CbXyn10C-SS示意图 |
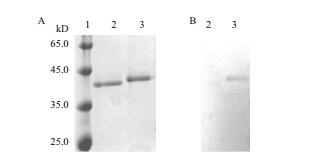
将构建的表达质粒pPIC9-CbXyn10C和pPIC9-CbXyn10C-SS用SacI线性化并切胶回收,分别转化至毕赤酵母GS115感受态细胞,使用甲醇进行重组蛋白的诱导表达。在摇瓶中进行高酶活转化子的培养,BMMY中培养48 h后离心得粗酶液浓度75 mg/L,粗酶液经过浓缩、脱盐等处理后,通过SDS-PAGE电泳验证重组蛋白的分子量大小和纯度(图 3-A)。可见,CbXyn10C和CbXyn10C-SS在毕赤酵母中得到了成功的重组表达。CbXyn10C的表观分子量为40 kD,而CbXyn10C-SS的表观分子量为42 kD。这与计算的结果基本一致。由于分子中含有SS-14分子,因此CbXyn10C-SS比CbXyn10C大~2 kD。
|
| 1:蛋白分子量标准;2:CbXyn10C;3:CbXyn10C-SS;A:SDS-PAGE;B:Western blot分析 图 3 CbXyn10C-SS的重组表达和抗原性分析 |
在将CbXyn10C-SS进行成功的重组表达后,首先需要验证重组蛋白是否具有抗原性。因此,将CbXyn10C和CbXyn10C-SS首先通过SDS-PAGE电泳,再将其转印到PVDF膜上,使用针对SS的抗体作为一抗、HRP标记的羊抗兔IgG为二抗进行免疫印迹操作。如图 3-B,在CbXyn10C-SS的目标位置处出现了单一条带,而对照CbXyn10所在位置则没有出现显色条带,这证明CbXyn10C-SS蛋白上的生长抑素仍然保留了良好的抗原性,可用于下一步实验。
2.4 CbXyn10C-SS的免疫原性将CbXyn10C-SS应用于畜禽的口服免疫,其首要条件是该融合蛋白需要具备一定的免疫原性。因此,将融合蛋白CbXyn10C-SS首先采用皮下和腹腔注射对小鼠进行了免疫,在三免后的第7天,使用ELISA法检测到小鼠的血清中产生了针对融合蛋白CbXyn10C-SS的抗体,ELISA效价 > 1:5 000,这表明木聚糖酶生长抑素的融合蛋白CbXyn10C-SS能够刺激机体发生免疫反应。随后使用斑点免疫法对融合蛋白刺激小鼠所产生的抗体中是否含有针对生长抑素的特异抗体进行了研究。将倍比稀释的SS-14点于PVDF膜上,依次采用适当稀释的免疫小鼠血清和HRP标记的羊抗鼠IgG作为一抗和二抗进行反应;以未免疫小鼠的血清作为阴性血清对照。由图 4可以看出:对于1.0-0.125 μg点膜的样品,使用CbXyn10C-SS免疫小鼠的血清中存在抗体可特异的与SS发生结合,而相同条件下,在阴性血清对照则未能检测到显色反应(效果最佳),这说明CbXyn10C-SS蛋白对小鼠的皮下多点注射和腹腔免疫能使小鼠产生特异针对SS的抗体。

|
| A:阴性血清;B:CbXyn10C-SS免疫小鼠血清 图 4 CbXyn10C-SS免疫小鼠血清针对生长抑素的斑点免疫实验 |
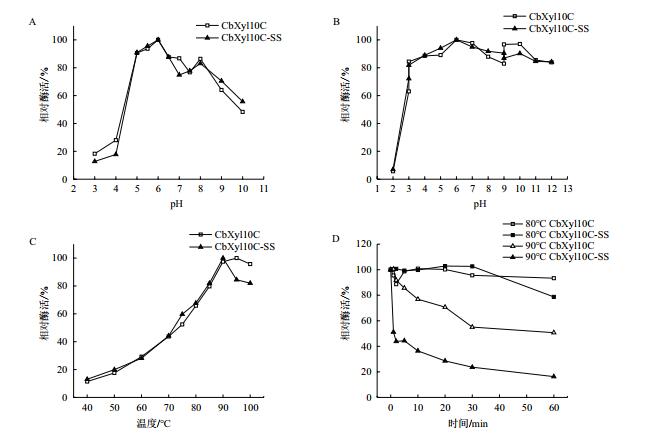
本课题组前期研究发现木聚糖酶CbXyn10C具有较好的热稳定性和pH稳定性;为了评估融合表达SS后重组酶性质,首先测定了CbXyn10C-SS的生化性质。CbXyn10C-SS的最适作用pH为6.0(图 5-A-B),在pH 5.0-8.0时均具有较高酶活;它还具有较好的pH稳定性(图 5-A-B),在pH 3.0-12.0均能保持72.2%以上的剩余酶活。可见,CbXyn10C-SS和未融合SS的CbXyn10C具非常相似的最适pH值和pH稳定性,说明C端融合SS没有对其最适pH值和pH稳定性发生显著影响。对最适温度的研究表明,CbXyn10C-SS较CbXyn10C的最适温度为95℃下降了5℃(图 5-C)。CbXyn10C在90℃稳定性相对较好(图 5-D),处理60 min仍能保持50%左右的酶活,而CbXyn10C-SS的热稳定相对略差,处理60 min仅保持16%左右的相对酶活。但在80℃(制粒所用温度)孵育30 min两个酶的残余酶活均没有显著下降,只在较长时间(60 min)孵育后,CbXyn10C-SS的酶活下降至~80%,而CbXyn10C的酶活仍然无显著下降。实验说明C端融合的SS短肽序列对于蛋白维持高温下的结构稳定性存在一定的负面影响,但仍然能维持饲料制粒需求(80℃,5 min)。CbXyn10C与CbXyn10C-SS的比活分别为437.2 U/mg和349.7 U/mg。利用双倒数法作图计算,得到CbXyn10C的KM、Vmax和kcat值则分别为0.90 mg/mL、1 000 μmol/min·mg和653.8 s-1,而CbXyn10C-SS的KM、Vmax和kcat值分别0.58 mg/mL、526 μmol/min·mg和362.1 s-1。
|
| A:最适pH;B:pH稳定性;C:最适温度;D:热稳定性 图 5 Cb与CbXyn10C-SS的生化性质表征 |
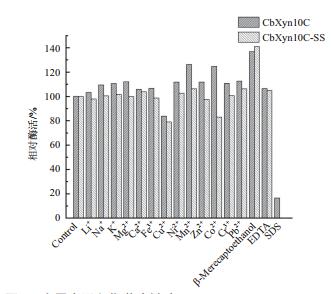
和未融合表达SS的木聚糖酶相比,金属离子和化学试剂的存在对于木聚糖酶CbXyn10C-SS活性的影响和CbXyn10C差别不大,但可见对绝大多数的金属离子和化学试剂,CbXyn10C-SS的剩余酶活比例均略低于CbXyn10C,说明C端融合了SS对于CbX-yn10C的整体结构有所影响,金属离子和化学试剂对木聚糖酶的酶活有轻微的负面作用。β-巯基乙醇对两个酶均具有显著、相似程度的促进作用(图 6)。
|
| 图 6 金属离子和化学试剂对CbXyn10C、CbXyn10C-SS的活性影响比较 |
SS的免疫方式主要包括被动免疫和主动免疫,主动免疫是通过导入抗原物质来激发动物主动对外源SS抗原产生抗体,作用时间比较长,因此相对具有更普遍的应用价值。SS主动免疫的方式主要包括注射、口服等形式[6, 8, 21],均可使机体产生抗体。注射免疫虽然有使用剂量小的优点,但可能会引起动物的应激反应,影响动物的正常生长,而口服免疫则可与饲料或水混合进行免疫,不存在这个问题,但口服免疫的缺点使用剂量大是其制约性瓶颈,即需要大量SS蛋白。目前,人工合成SS成本过高,不利于生产中广泛利用,贡长慧等[22]在大肠杆菌中将SS与LTB融合表达出现包涵体,需破碎与纯化增加成本,虽然Ding等[18]将人血清白蛋白(HSA)和两拷贝SS-14融合表达,经高细胞密度发酵72 h,可达150 mg/L,但融合蛋白中SS所占比例低,且HSA在饲料中作为外源蛋白添加不经济。
木聚糖酶是一种在饲料中已经得到广泛应用的酶蛋白制剂。研究表明,其通过降低动物消化道中食糜的黏度、提高干物质的消化率和营养吸收,从而提高饲料的利用率。木聚糖酶和HSA均为蛋白,都可作为蛋白载体。此前,已有使用木聚糖酶作为载体融合表达其它基因例如抗菌肽基因的研究,但目前未见融合表达SS的报道。因此我们采用了耐热性较好的热泉细菌C. bescii来源的木聚糖酶CbXyn10C作为蛋白载体,将它的基因和SS-14融合构建质粒载体并转化毕赤酵母进行高效表达。与未融合SS的木聚糖酶CbXyn10C相比,融合蛋白CbXyn10C-SS的最适作用pH均为6.0,pH稳定性几乎没有下降,在酸性条件下(pH 3.0-6.0)能保持72%以上的剩余酶活,碱性条件下(pH 7.0-12.0)也能保持84%以上的剩余酶活。虽然融合了SS之后,木聚糖酶的最适作用温度由95℃下降到90℃;热稳定性方面,从90℃热处理60 min剩余50%左右的相对酶活下降到剩余16%左右的相对酶活,但80℃处理30 min,两个酶的残余酶活均无显著下降,说明即使在C端融合了SS-14使得酶的热稳定性略有下降,但仍足以满足饲料制粒的要求[23-24]。
虽然摇瓶发酵中CbXyn10C-SS的表达量不高仅为75 mg/L,但本实验室已经通过发酵罐高密度发酵予以解决,得到大量表达的重组融合蛋白。用于木聚糖酶-SS融合蛋白对于小鼠动物模型实验以及在家畜、家禽饲喂实验,以探索CbXyn10C-SS使用剂量对动物生长性能的影响。我们也注意到,当木聚糖酶的C端融合了SS短肽之后,木聚糖酶的酶活和热稳定性略有下降,这可能是C端融合的SS短肽通过和木聚糖酶的核心结构部分氨基酸残基的互作,从而对其完整性和稳定性有一定的负面影响,这可以在随后的实验中通过融合蛋白三维晶体结构的解析和定点突变等加以改进。
融合表达的CbXyn10C-SS既表现出SS的抗原性和免疫原性,又具有木聚糖酶的活性和良好的热稳定性。木聚糖酶可以与SS融合表达而很好的保持了木聚糖酶的活性,同时SS的抗原性和免疫原性又没有损失,那么其它饲料用酶[25],如植酸酶[26]、葡聚糖酶[26]、甘露聚糖酶[27]、淀粉酶[28]、纤维素酶[29]、果胶酶[30]等,是不是也可以与SS融合表达,既保持酶和饲料中底物的反应特性,又具有SS的免疫原性;同样,其它功能性的多肽是不是也可以这样使用,这些都有待于进一步的实验探索。
4 结论本研究在探索饲用酶和功能肽的融合表达上进行了有益的尝试,成功地将耐热木聚糖酶CbXyn10C和SS-14进行了融合表达,融合蛋白CbXyn10C-SS具有抗原性且能刺激小鼠产生特异抗体,具有免疫原性;融合蛋白的理化、酶学性质和CbXyn10C非常相似,因此理论上同时具有木聚糖酶和生长抑素抗原的功能,在养殖业中具有潜在的应用价值。
| [1] |
Chen M, He M, Peng K, et al. Expression of somatostatin and cDNA cloning in the thymus of the African ostrich[J]. Acta Histochemica, 2014, 116(1): 191-196. |
| [2] |
Gonkowski S, Rytel L. Somatostatin as an active substance in the mammalian enteric nervous system[J]. International Journal of Molecular Sciences, 2019, 20(18): 4461. |
| [3] |
Tostivint H, Lihrmann I, Vaudry H. New insight into the molecular evolution of the somatostatin family[J]. Molecular and Cellular Endocrinology, 2008, 286(1-2): 5-17. |
| [4] |
Patel YC. Somatostatin and its receptor family[J]. Frontiers in Neuroendocrinology, 1999, 20(3): 157-198. |
| [5] |
Lakeh AAB, et al. Growth enhancement of rainbow trout(Oncorhy-nchus mykiss)by passive immunization against somatostatin-14[J]. Aquaculture International, 2016, 24(1): 11-21. |
| [6] |
黄志鹏, 等.生长抑素基因疫苗pVAX1-TRX-SS的构建及对猪生长的影响[J].中国兽医学报, 2018, 38(12): 2360-2365. Huang ZP, Chen T, Sun JJ, et al. Construction of somatostatin gene vaccine pVAX1-TRX-SS and its effect on pig growth[J]. Chinese Journal of Veterinary Science, 2018, 38(12): 2360-2365. |
| [7] |
Hill RA, Flint DJ, Pell JM. Antibodies as molecular mimics of biomolecules:roles in understanding physiological functions and mechanisms[J]. Adv Physiol Edu, 2008, 32(4): 261-273. |
| [8] |
Xue C, et al. Effect of genetic adjuvants on immune respondance, growth and hormone levels in somatostatin DNA vaccination-induced Hu lambs[J]. Vaccine, 2010, 28(6): 1541-1546. |
| [9] |
Morisset J. Somatostatin[J]. Pancreapedia:The Exocrine Pancreas Knowledge Base, 2015. DOI:10.3998/panc.2015.43 |
| [10] |
Sillence MN. Technologies for the control of fat and lean deposition in livestock[J]. The Veter J, 2004, 167(3): 242-257. |
| [11] |
Xin D, Chen X, Wen P, et al. Insight into the role of α-arabinofuranosidase in biomass hydrolysis:cellulose digestibility and inhibition by xylooligomers[J]. Biotechnology for Biofuels, 2019, 12(1): 64. |
| [12] |
Rennie EA, Scheller HV. Xylan biosynthesis[J]. Current Opinion in Biotechnology, 2014, 26: 100-107. |
| [13] |
Alokika, Singh B. Production, characteristics, and biotechnological applications of microbial xylanases[J]. Applied Microbiology and Biotechnology, 2019, 103(21): 8763-8784. |
| [14] |
Lee SH, Lim V, Lee CK. Newly isolate highly potential xylanase producer strain from various environmental sources[J]. Biocatalysis and Agricultural Biotechnology, 2018, 16: 669-676. |
| [15] |
Verma D, Kumar R, Satyanarayana T. Diversity in xylan-degrading prokaryotes and xylanolytic enzymes and their bioprospects[M]//Satyanarayana T, Das SK, Johri BN. Microbial diversity in ecosystem sustainability andbiotechnological applications, Singapore: Springer Singapore. 2019: 325-373.
|
| [16] |
汪儆.木聚糖酶制剂对生长肥育猪次粉日粮饲养效果的影响[J].中国饲料, 1997, 3 : 17-19. Wang J, Juokslahti T. Effect of xylanase preparation on feeding effect of wheat middlings meal diets for growing and finishing pigs[J]. China Feed, 1997, 3 : 17-19. |
| [17] |
Spencer GSG, Garssen GJ, et al. A novel approach to growth promotion using auto-immunisation against somatostatin Ⅱ[J]. Livestock Production Science, 1983, 10(5): 469-477. |
| [18] |
Ding Y, et al. The effect of albumin fusion patterns on the produc-tion and bioactivity of the somatostatin-14 fusion protein in Pichia pastoris[J]. Appl Biochem Biotechnol, 2013, 7: 1637-1648. |
| [19] |
Xue X, Wang R, Tu T, et al. The N-terminal GH10 domain of a multimodular protein from Caldicellulosiruptor bescii is a versatile xylanase/β-glucanase that can degrade crystalline cellulose[J]. App Environ Microbiol, 2015, 81(11): 3823-3833. |
| [20] |
Chu Y, Hao Z, Wang K, et al. The GH10 and GH48 dual-functional catalytic domains from a multimodular glycoside hydrolase synergize in hydrolyzing both cellulose and xylan[J]. Biotechnology for Biofuels, 2019, 12: 279-279. |
| [21] |
Liang A, Riaz H, Dong F, et al. Evaluation of efficacy, biodistribution and safety of antibiotic-free plasmid encoding somatostatin genes delivered by attenuated Salmonella enterica serovar Choleraesuis[J]. Vaccine, 2014, 32(12): 1368-1374. |
| [22] |
贡长慧, 等.重组嵌合生长抑素工程菌的构建、表达与免疫[J].海南大学学报: 自然科学版, 2018, 36(2): 110-116. Gong CH, Feng S, Shen WJ, et al. Construction, characterization and immunogenicity of a recombinant chimeric somatostatin engineering bacteria strain[J]. Natural Science Journal of Hainan University, 2018, 36(2): 110-116. |
| [23] |
Gehring CK, Lilly KGS, Shires LK, et al. Increasing mixer-added fat reduces the electrical energy required for pelleting and improves exogenous enzyme efficacy for broilers[J]. Journal of Applied Poultry Research, 2011, 20(1): 75-89. |
| [24] |
Goodarzi Boroojeni F, Svihus B, et al. The effects of hydrothermal processing on feed hygiene, nutrient availability, intestinal microbiota and morphology in poultry-A review[J]. Animal Feed Science and Technology, 2016, 220: 187-215. |
| [25] |
Singh P, Yadav SK. Feed enzymes: source and applications[M]//Kuddus M. enzymes in food technology: improvements and innovations. Singapore: Springer Singapore. 2018: 347-358.
|
| [26] |
De Lima MR, Perazzo Costa FG, Vieira DVG, et al. Xylanase, glucanase, and phytase in the diet of light laying hens[J]. The Journal of Applied Poultry Research, 2019, 28(4): 1150-1155. |
| [27] |
Tewoldebrhan TA, et al. Exogenous β-mannanase improves feed conversion efficiency and reduces somatic cell count in dairy cattle[J]. J Dairy Sci, 2017, 100(1): 244-252. |
| [28] |
Gernaey B, Sorbara JOB, et al. Environmental assessment of amyl-ase used as digestibility improvement factor for intensive chicken production in Brazil[J]. Sustainability, 2018, 10(8): 2735. |
| [29] |
Ye M, et al. The optimization of fermentation conditions for producing cellulase of Bacillus amyloliquefaciens and its applica-tion to goose feed[J]. R Soc Open Sci, 2017, 4(10): 171012. |
| [30] |
Additives EPanel O, Feed PoSuiA, Bampidis V, et al. Safety and efficacy of FRA® Octazyme C Dry(endo-1, 4-β-xylanase, mannan-endo-1, 4-β-mannosidase, α-amylase, endo-1, 3(4)-β-glucanase, pectinase, endo-1, 4-β-glucanase, protease, α-galactosidase)as a feed additive for weaned piglets and chickens for fattening[J]. EFSA Journal, 2019, 17(6): e05730. |





