羊肚菌(Morchella),隶属子囊菌门(Ascomy-cota)、盘菌纲(Pezizomycetes)、盘菌目(Pezizales)、羊肚菌科(Morchellaceae),是一种名贵食药用真菌[1],其营养丰富,具有多种抗病毒、抗肿瘤等作用的生理活性物质,在食品、保健品、医药、化妆品等领域有着广阔的应用前景[2]。
实际上,羊肚菌也是典型的土生真菌[3],其生长过程与土壤有着密切联系。申时才等[4]发现人工种植羊肚菌不需要施用任何肥料,同时还能减少土壤中氮、磷、钾流失,有利于土壤的有机含量,还发现经过3-4年后,种植过羊肚菌的土壤其养分含量比没有种植过羊肚菌的土壤高5-7倍。羊肚菌主要在冬季栽培,在栽培周期内,植物根系和土壤动物几乎处于休眠状态,土壤内细菌、真菌及放线菌数量较少,此时羊肚菌便成为土壤中的优势菌株,可能成为影响土壤养分构成和土壤酶活性变化的主要因素[5-6]。土壤酶活性是土壤质量的指标之一,能够直接敏感的响应土壤环境的变化[7]。土壤酶活性的表现,在一定程度上反映了土壤所处的状态,是土壤生态系统变化的预警和敏感指标,是土壤综合肥力特征的有效反映[8-9]。其中蔗糖酶和淀粉酶广泛存在于土壤中,是测定土壤酶活性的关键酶。土壤蔗糖酶可将蔗糖催化水解成容易被植物和土壤微生物吸收利用的葡萄糖和果糖,提高土壤有机质的转化;土壤淀粉酶可分解土壤中不溶解的淀粉组分,生成可溶单糖,增加土壤中易溶性营养物质[10]。
由于羊肚菌子实体产量有限,很多学者就将研究对象转为羊肚菌菌丝体及其发酵产物。季向阳等[11]对羊肚菌发酵培养条件进行了优化,确定了其液体发酵的最佳条件。王莹等[12]对比分析菌丝体与子实体的化学成分,表明两者在营养成分上差异不大,并对羊肚菌菌丝体进行了培养基配方和条件的研究,得到了最优配比。羊肚菌菌丝体营养物质较为丰富,同样具有很高的开发利用价值[13]。因此,本实验探究了羊肚菌菌丝体的加入对土壤蔗糖与淀粉酶活性的影响,以评判羊肚菌改良土壤的可行性,为开发利用羊肚菌菌肥提供参考依据。
1 材料与方法 1.1 材料 1.1.1 样品采集尖顶羊肚菌(Morchella conica),采集于青海互助北山林场,分离获得纯菌种,保藏于青海师范大学微生物实验室。
土样采挖于青海师范大学校园内,取无植被生长离地表 10 cm处土样,碾碎过40目筛,密封置于4℃冰箱保藏待用。
1.1.2 培养基固体活化培养基[14]:200 g马铃薯,15 g琼脂粉,20 g葡萄糖,1.5 g硫酸镁(MgSO4),3 g磷酸二氢钾(KH2PO4),1 L蒸馏水。
液体培养基[14]:100 g马铃薯,30 g蔗糖,1 g蛋白胨,5 g酵母膏,0.5 g硫酸镁(MgSO4),0.5 g磷酸二氢钾(KH2PO4),1 L蒸馏水。
1.1.3 主要试剂与仪器试剂:甲苯、葡萄糖、麦芽糖、2%淀粉、8%蔗糖溶液、3,5-二硝基水杨酸、pH 5.5磷酸缓冲液、pH 5.6乙酸-磷酸缓冲液。
仪器:SW-CJ-2FD型双人单面净化工作台(郑州南北仪器设备有限公司)、HZQ-F160A型高低温恒温振荡培养箱(上海精密仪器仪表有限公司)、LS-35HD型立式压力蒸汽灭菌器(济南来宝医疗器械有限公司)、UV-1100型紫外可见分光光度计(上海元析仪器有限公司)。
1.2 方法 1.2.1 羊肚菌菌丝体培养 1.2.1.1 菌种活化将保存的菌种转接至斜面固体活化培养基上,26℃培养5 d。
1.2.1.2 液体培养将2 mm3的菌块接入液体培养基中静置24 h,后置于26℃、180 r/min条件下摇床培养6 d,抽滤分离,收集菌丝体。
1.2.2 单因素试验以100 g土样为基准,探究菌土质量比1:5、1:10、1:15、1:20和1:25(g/g),处理温度25、26、27、28和29℃,处理时间3、5、7、9和11 d,对土壤蔗糖酶和淀粉酶活性的影响,每个处理3次重复。
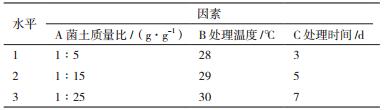
1.2.3 正交试验按照单因子试验结果,选择菌土质量比、温度、时间为考察因素设计三因素三水平L9(33)正交试验(表 1和表 2)。
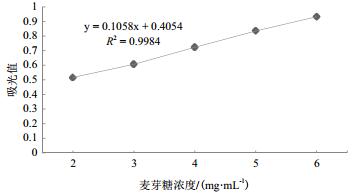
配成葡萄糖与麦芽糖标准溶液(1 mg/mL)[15]。在10 mL试管中各进行5个处理,分别加入葡萄糖标准溶液1、2、3、4和5 mL(或麦芽糖标准溶液2、3、4、5和6 mL),DNS试剂3 mL,沸水浴5 min,冷却后定容[16]。用紫外分光光度计在508 nm波长下测各管吸光度。绘制吸光值-葡萄糖(或麦芽糖)浓度曲线(图 1和图 2)。

|
| 图 1 葡萄糖标准曲线 |
|
| 图 2 麦芽糖标准曲线 |
以培养24 h,1 g风干土样中所含葡萄糖(或麦芽糖)毫克数表示。
蔗糖酶活性(H1)计算公式为:H1=(a1-b1-c1)×4
淀粉酶活性(H2)计算公式为:H2=(a2-b2-c2)×5
其中,a为试验组所得葡萄糖(或麦芽糖)毫克数;b为无机质对照组得到的葡萄糖(或麦芽糖)毫克数;c为无土壤对照组得到的葡萄糖(或麦芽糖)毫克数。
1.2.5 统计分析对试验数据结果进行直观分析,各项测定指标用Excel 2010与Spass软件计算绘图。
2 结果 2.1 蔗糖酶活性结果 2.1.1 处理条件的单因素试验结果 2.1.1.1 菌土质量比对蔗糖酶活性影响以100 g土样为基准,菌土质量比分别为1:5、1:10、1:15、1:20和1:25(g/g),在25℃处理3 d后,得到菌土质量比对蔗糖酶活性影响结果(图 3)。由图 3可知,当菌丝体添加量为10 g即菌土质量比为1:10时,蔗糖酶活性值最大(H1=8.785 mg/g)。

|
| 图 3 菌土质量比对蔗糖酶活性影响 |
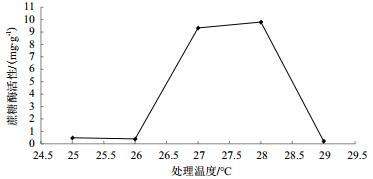
以100 g土样为基准,处理温度分别为25、26、27、28和29℃,在菌土质量比为1:25条件下处理3 d后,得到处理温度对蔗糖酶活性影响结果(图 4)。由图 4可知,在处理温度为28℃时蔗糖酶活性值最大(H1=9.803 mg/g)。
|
| 图 4 处理温度对蔗糖酶活性影响 |
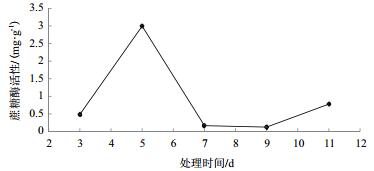
以100 g土样为基准,处理时间分别为3、5、7、9和11 d,在菌土质量比为1:25,25℃下得到处理时间对蔗糖酶活性影响结果(图 5)。由图 5可知,在处理时间为5 d时蔗糖酶活性值最大(H1=2.999 mg/g)。
|
| 图 5 处理时间对蔗糖酶活性影响 |
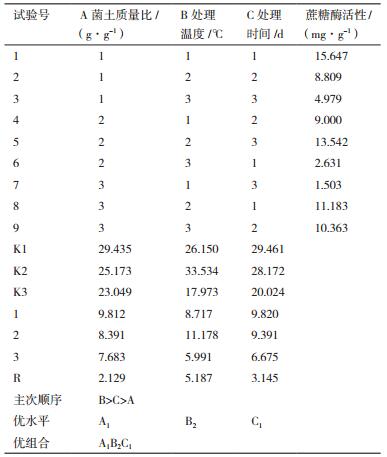
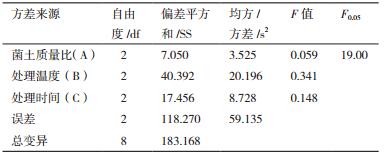
由表 3直观分析可知,各因素对试验结果影响的主次顺序是处理温度>处理时间>菌土质量比;优化得到的菌土处理对土壤蔗糖酶活性影响方案为A1B2C1,即菌土质量比为1:5、处理温度28℃、处理时间3 d。该处理组合不在正交表试验组中,需对该组合进行验证试验,重复3组,均值16.529 mg/g,高于正交试验值。并对表 3试验结果进行方差分析,结果见表 4。
经方差分析结果表明,菌土质量比、处理温度、处理时间对结果的影响均不显著。根据验证试验确定A1B2C1该组合为最优组合。
2.2 淀粉酶活性结果 2.2.1 处理条件的单因素试验结果 2.2.1.1 菌土质量比对淀粉酶活性影响以100 g土样为基准,菌丝体添加量分别为1:5、1:10、1:15、1:20和1:25(g/g),在25℃处理3 d后,得到菌丝体添加量对淀粉酶活性影响结果(图 6)。当菌丝体添加量为20 g菌土质量比为1:5时淀粉酶活性值最大(H2=7.849 mg/g)。

|
| 图 6 菌丝体添加量对淀粉酶活性影响 |
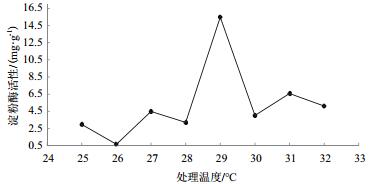
以100 g土样为基准,处理温度分别为25、26、27、28、29、30、31和32℃,在菌丝体添加量为1:25条件下处理3 d后,得到处理温度对淀粉酶活性影响结果(图 7)。可知土壤淀粉酶对温度的变化较为敏感,则处理温度为29℃时淀粉酶活性值最大(H2=15.470 mg/g)。
|
| 图 7 处理温度对淀粉酶活性影响 |
以100 g土样为基准,处理时间分别为3、5、7、9和11 d,在菌丝体添加量为1:25,25℃下得到处理时间对淀粉酶活性影响结果(图 8)。表明处理时间为5 d时淀粉酶活性值最大(H2=6.193 mg/g)。
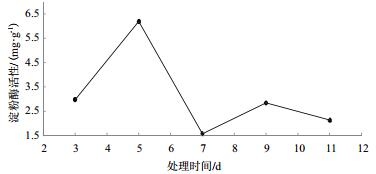
|
| 图 8 处理时间对淀粉酶活性影响 |
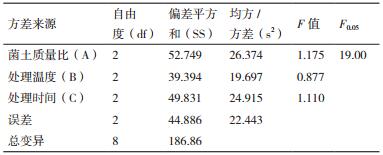
由表 5直观分析得,各因素对试验结果影响的主次顺序是处理时间>菌丝体添加量>处理温度;优化得到的菌土处理对淀粉酶活性各因素水平的组合是A1B1C3,即菌土质量比为1:5、处理温度28℃、处理时间7 d。该处理组合不在正交表试验组中,对该组合进行验证试验,重复3组,均值20.052 mg/g,高于正交试验值。对表 5试验结果进行方差分析,结果见表 6。
经方差分析结果表明,菌土质量比、处理温度、处理时间对结果的影响均不显著。根据验证试验确定A1B1C3该组合为最优组合。
3 讨论土壤酶种类繁多,不同土壤酶种类对各影响因素的响应不同[17]。本研究考察了菌土质量比、处理温度和处理时间对土壤淀粉酶与蔗糖酶活性的影响,并得到了菌土影响土壤酶活性的最佳条件。试验中随着菌土质量比、处理温度和时间的逐渐增大,土壤蔗糖酶与淀粉酶呈现出先升高后下降的趋势。其中,随着处理温度的逐渐升高,土壤蔗糖酶与淀粉酶活性较其它两种因素对酶活性影响,变化幅度较大。原因可能是因为土壤酶活性对温度较为敏感。已有研究发现,温度是影响土壤酶活性的重要环境因子,对土壤酶活性有直接作用,一般情况下,土壤酶活性在一定温度范围内随着温度的升高而升高,到达最适温度后土壤酶活性下降[18],可能是由于增温可以通过影响酶动力学性质来影响土壤酶活性,还会通过影响土壤微生物生物量和群落结构组成等间接地影响土壤酶活性[19]。另外,在菌土影响酶活性的最佳条件中,土壤淀粉酶与蔗糖酶活性的最佳温度均为28℃,但李天星[20]的研究表明羊肚菌菌丝体在3-25℃均能生长,最适温度18-22℃。两者结果存在差异,可能是因为试验过程中仪器显示温度与菌土实际温度有误差,或者受到菌土质量比与时间因素的影响,还有待进一步研究分析。
试验中随处理时间的延长,两种酶活性均表现为先升高后降低之后酶活性变化趋于稳定。赵苗等[6]发现土壤蔗糖酶呈现先升高后降低的趋势,但土壤淀粉酶活性则表现先降低再升高后降低的变化趋势与本试验结果不同,可能是由于随着时间的延长,羊肚菌菌丝体生物量急剧升高,羊肚菌开始将淀粉作为主要碳源之一,后酶活达到峰值,且开始降低。因此,土壤淀粉酶活性的变化趋势还需试验的长期监控。试验关于菌土质量比对土壤酶活性的影响,所能参阅的相关资料较少,需继续进行试验探究。
在短期内羊肚菌菌丝体的生长对土壤中蔗糖酶和淀粉酶活性均有提高。本试验结果表明菌土质量比、处理温度、处理时间对土壤蔗糖酶和淀粉酶活性的影响均不显著,究其原因可能是本试验存在一定误差且误差自由度小,使得检验的灵敏度较低,从而掩盖了考察因素的显著性,需要在试验过程中减小操纵误差以及重复正交试验次数的方法来改善试验误差。由于本试验是在室内条件下进行的,与野外试验相比,虽有一定的可控性,但精确度存在差异,后续将增加野外实验来进行深入研究。
此外,试验期间还有菌渣产生,目前已经有利用食用菌渣改良土壤的研究[21-23],滕青等[24]将平菇菌渣加入到土壤的实验中发现,施用菌渣可提高农田土壤养分、有机质含量、土壤酶活性和微生物数量,减少养分流失,改善农田土壤生态环境。然而,有关羊肚菌菌渣的研究报道少之又少,其菌渣是否也对改良土壤具有一定影响,是否能够提高羊肚菌产量,需要深入的探索。
4 结论本实验采用3,5-二硝基水杨酸比色法,得到各因素对土壤蔗糖酶活性影响的主次顺序是处理温度>处理时间>菌土质量比,菌土影响蔗糖酶活性最佳条件为温度28℃,时间3 d,菌丝体添加量为1:5,蔗糖酶活性为16.529 mg/g,与对照组相比土壤蔗糖酶活性增加为对照组的12倍。各因素对土壤淀粉酶活性影响的主次顺序是处理时间>菌丝体添加量>处理温度,菌土影响淀粉酶活性的最佳条件为时间7 d,菌丝体添加量1:5,温度28℃,淀粉酶活性为20.052 mg/g,与对照组相比土壤蔗糖酶活性增加为对照组的18倍。
| [1] |
杜习慧, 赵琪, 杨祝良. 羊肚菌的多样性、演化历史及栽培研究进展[J]. 菌物学报, 2014, 33(2): 183-197. Du XH, Zhao Q, Yang ZL. The diversity, evolution history and cultivation research progress of morel[J]. Acta Mycology, 2014, 33(2): 183-197. |
| [2] |
李娟, 王臻, 姚良同, 等. 羊肚菌多糖研究进展[J]. 微生物学杂志, 2005(4): 89-91. Li J, Wang Z, Yao LT, et al. Research progress of morel polysaccharides[J]. Journal of Microbiology, 2005(4): 89-91. |
| [3] |
赵苗.羊肚菌生长过程中土壤酶变化规律研究[C].中国菌物学会、迪庆藏族自治州人民政府. 2018第三届全国羊肚菌大会资料汇编, 2018: 113-120. Zhao M. Study on the changes of soil enzymes during the growth of morel[C]. Chinese Society of Mycology, People's Government of Diqing Tibetan Autonomous Prefecture. 2018 third National Morel Conference. Chinese Society of Mycology, 2018: 113-120. |
| [4] |
申时才, 朱映安, 钱洁, 等. 香格里拉县五境乡传统人工种植羊肚菌对经济生态的影响[J]. 西南农业学报, 2011, 24(5): 2004-2009. Shen SC, Zhu YA, Qian J, et al. The impact of traditional artificial cultivation of morels on economic ecology in Wujing township, Shangri-La county[J]. Journal of Southwest Agriculture, 2011, 24(5): 2004-2009. |
| [5] |
张猛.土壤管理方式对李园土壤影响研究[D].成都: 四川农业大学, 2004. Zhang M. Study on the influence of soil management methods on the soil of Liyuan garden[D]. Chengdu: Sichuan Agricultural University, 2004. |
| [6] |
赵苗, 张能, 谢敬宜, 等. 羊肚菌生长过程中土壤酶变化规律研究[J]. 中国食用菌, 2017, 36(2): 41-46. Zhao M, Zhang N, Xie JY, et al. Study on the change law of soil enzymes during the growth of morchella[J]. Chinese Edible Fungus, 2017, 36(2): 41-46. |
| [7] |
刘纪爱, 束爱萍, 刘光荣, 等. 施肥影响土壤性状和微生物组的研究进展[J]. 生物技术通报, 2019, 35(9): 21-28. Liu JA, Shu AP, Liu GR, et al. Research progress in the effects of fertilization on soil properties and microbiome[J]. Biotechnology Bulletin, 2019, 35(9): 21-28. |
| [8] |
万忠梅, 宋长春. 土壤酶活性对生态环境的响应研究进展[J]. 土壤通报, 2009, 40(4): 951-956. Wan ZM, Song CC. Research progress on the response of soil enzyme activity to ecological environment[J]. Soil Bulletin, 2009, 40(4): 951-956. |
| [9] |
邵文山, 李国旗. 土壤酶功能及测定方法研究进展[J]. 北方园艺, 2016(9): 188-193. Shao WS, Li GQ. Soil enzyme function and determination method research progress[J]. Northern Horticulture, 2016(9): 188-193. |
| [10] |
周玮, 周运超, 李进. 花江石漠化喀斯特土壤有机碳及其部分转化酶演变[J]. 农业现代化研究, 2007(1): 110-113. Zhou W, Zhou YC, Li J. The evolution of organic carbon and some invertases in Huajiang rocky desertification karst soil[J]. Research of Agricultural Modernization, 2007(1): 110-113. |
| [11] |
季向阳, 罗孝坤. 羊肚菌液体培养条件的优化[J]. 中国食用菌, 2016, 35(2): 21-23, 27. Ji XY, Luo XK. Optimization of liquid culture conditions of morel mushroom[J]. Chinese Edible Fungus, 2016, 35(2): 21-23, 27. |
| [12] |
王莹, 孙永海, 王笑丹, 等. 粗柄羊肚菌菌丝体液体培养条件的优化[J]. 食用菌, 2007(6): 6-8. Wang Y, Sun YH, Wang XD, et al. Optimization of liquid culture conditions for the mycelium of morchella crassicarpa[J]. Edible Fungus, 2007(6): 6-8. |
| [13] |
敬华英. 羊肚菌种属鉴定及活性成分保健功效研究进展[J]. 安徽农业科学, 2018, 46(14): 34-36, 140. Jing HY. Research progress on the identification of morel and the health benefits of its active ingredients[J]. Anhui Agricultural Sciences, 2018, 46(14): 34-36, 140. |
| [14] |
郭晓蕾.羊肚菌发酵液及其胞外多糖的分析与研究[D].长春: 吉林大学, 2016. Guo XL. Analysis and research of morel fermentation broth and its extracellular polysaccharide[D]. Changchun: Jilin University, 2016. |
| [15] |
俞明义, 龚建锋. DNS法对金耳注射液多糖含量的测定[J]. 浙江中医杂志, 2006(4): 235. Yu MY, Gong JF. Determination of Polysaccharides in Jiner Injection by DNS method[J]. ZheJiang Journal of Traditional Chinese Medicine, 2006(4): 235. |
| [16] |
赵凯, 许鹏举, 谷广烨. 3, 5-二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008(8): 534-536. Zhao K, Xu PG, Gu GY. Study on 3, 5-Dinitrosalicylic acid colorimetric determination of reducing sugar content[J]. Food Science, 2008(8): 534-536. |
| [17] |
韩玮, 孙晨曦, 苏敬. 模拟增温和酸雨对水稻土酶活性及温度敏感性的影响[J]. 生态与农村环境学报, 2017, 33(12): 1117-1124. Han W, Sun CX, Su J. Effects of simulated warming and acid rain on enzyme activities and temperature sensitivity of paddy soil[J]. Journal of Ecology and Rural Environment, 2017, 33(12): 1117-1124. |
| [18] |
Yang QP, Xu M, Liu HS, et al. Impact factors and uncertainties of the temperature sensitivity of soil respiration[J]. Acta Ecologica Sinica, 2011, 31(8): 2301-2311. |
| [19] |
李娜, 王根绪, 高永恒, 等. 模拟增温对长江源区高寒草甸土壤养分状况和生物学特性的影响研究[J]. 土壤学报, 2010, 47(6): 1214-1224. Li N, Wang GX, Gao YH, et al. Effects of simulated temperature increase on soil nutrient status and biological characteristics of alpine meadows in the source area of the Yangtze River[J]. Acta Pedologica Sinica, 2010, 47(6): 1214-1224. |
| [20] |
李天星. 羊肚菌大田无基料栽培技术[J]. 农村经济与科技, 2019, 30(13): 82-83. Li TX. Cultivation techniques of morels without foundation in the field[J]. Rural Economy and Technology, 2019, 30(13): 82-83. |
| [21] |
王艮梅, 黄松杉, 郑光耀, 等. 菌渣作为土壤调理剂资源化利用的研究进展[J]. 土壤通报, 2016, 47(5): 1273-1280. Wang GM, Huang SS, Zheng GY, et al. Research progress on the utilization of bacterial residues as soil conditioners[J]. Soil Bulletin, 2016, 47(5): 1273-1280. |
| [22] |
王莹, 马宏伟. 食用菌废渣改良土壤理化性质的研究[J]. 吉林农业, 2013(1): 59-60. Wang Y, Ma HW. Study on the improvement of soil physical and chemical properties by edible fungus residue[J]. Jilin Agriculture, 2013(1): 59-60. |
| [23] |
唐凯悦, 尹蕾, 张跃新, 等. 木耳栽培废弃料改良土壤应用研究[J]. 牡丹江师范学院学报:自然科学版, 2016(1): 68-69. Tang KY, Yin L, Zhang YX, et al. Study on the application of fungus cultivation waste materials to improve soil[J]. Journal of Mudanjiang Teachers College:Natural Science Edition, 2016(1): 68-69. |
| [24] |
滕青, 曾梦凤, 林慧凡, 等. 菌渣还田对生菜生长、土壤养分及酶活性的影响研究[J]. 中国农学通报, 2020, 36(6): 30-36. Teng Q, Zeng MF, Lin HF, et al. Effects of returning bacterial residues to the field on lettuce growth, soil nutrients and enzyme activities[J]. Chinese Agricultural Science Bulletin, 2020, 36(6): 30-36. |