2. 山东盐碱地植物-微生物联合修复工程技术研究中心,泰安 271018;
3. 宁夏中青农业科技有限公司,宁夏 750000
2. Shandong Engineering Research Center of Plant-Microbe Restoration for Saline-alkali Land, Tai'an 271018;
3. Ningxia Zhongqing Agricultural Technology Co. Ltd, Yinchuan 750000
桃(Amygdalus persica L.)起源于我国西北高原地区,是我国最古老的栽培树种之一[1]。近年来,桃类产业发展迅速,桃树种植面积逐年上升,许多老果园亟待更新,但受用地及产业发展的限制,很多果园都需要在原地重建。桃树自身的自毒作用加上农药化肥的长期滥用,土壤理化性质恶化、营养失衡、病原物增多,加剧了桃树栽培过程中病虫害的发生[2-3]。
桃树根腐病,别称烂根病(Peach root rot),是桃树连作障碍中重要的土传病害。该病害一般由土壤习居菌镰刀菌侵染所致[4-5],常发生在地势低洼,土壤黏重,排水不良的地块。此病害最先危害桃树根部,先是须根变褐枯死,而后是侧根和主根,随着病害的加重,病斑不断变大甚至可深达木质部,最后整段根都枯死[6]。目前,多用化学手段来防控桃树根腐病,并没有一种真正意义上有效且环境友好的防治措施。可用于防治各种作物病害的芽胞杆菌菌剂就成为了化学农药和化肥的极佳替代品。
芽胞杆菌(Bacillus spp.)广泛存在于自然界中,具有对不良环境极强的抗逆性,是一种可以形成芽孢的革兰氏阳性杆状细菌[7-9]。作为生物防治中的明星菌种,芽胞杆菌可以显著影响植物根际土壤中关键酶的活性以及微生物的多样性。本研究从桃树根腐病发病桃园健康植株根际分离筛选,获得对多株土传病原菌具有较好拮抗效果的生防芽胞杆菌,经形态学、生理生化和分子生物学系统性鉴定,对其抗病和促生效果进行实验室和盆栽试验评价,为可防治桃树根腐病等多种土传病害的生物肥料与生物农药的开发应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试病原菌株和土壤样品供试土样:2018年12月采集江苏泗洪县桃树根腐病发病果园中健康植株根际土壤,装入到无菌样品袋中、密封、编号,于实验室中4℃保存。
抗菌谱供试病原菌:AMCC100027串珠镰刀菌(Fusarium moniliforme)、AMCC100029腐皮镰刀菌(F. solani)、AMCC100025层出镰刀菌(F. proliferatum)、AMCC100030丝核菌(Rhizoctonia solani)、AMCC400016普通疮痂链霉菌(Streptomyces scabieis)、AMCC400044酸疮痂链霉菌(S. acidiscabies)、AMCC辛1-3肿痂链霉菌(S. Turgidis)、链霉菌AMCC400023均由山东农业大学AMCC资源与环境微生物研究室保藏。
1.1.2 供试材料盆栽试验番茄品种为3716。
1.1.3 培养基LB培养基:酵母膏5.0 g,NaCl 10.0 g,蛋白胨10.0 g,琼脂20.0 g,水1 L,pH 7.0-7.5。
高氏I号培养基:可溶性淀粉20.0 g,KNO3 1.0 g,NaCl 0.5 g,K2HPO4 0.5 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.5 g,琼脂20.0 g,水1 L,pH 7.2-7.4。
脱脂奶粉培养基:脱脂奶粉5.0 g,琼脂18.0 g,水1 L,pH 7.0。
纤维素培养基:C6H7O2(OH)2CH2COONa 1.0 g,蛋白胨1.0 g,酵母膏0.5 g,MgSO4·7H2O 0.02 g,NaCl 1.0 g,KH2PO4 0.1 g,琼脂20.0 g,蒸馏水1 L,pH自然。
几丁质培养基:几丁质5.0 g,蛋白胨2.0 g,KH2PO4 0.5 g,MgSO4·7H2O 0.3 g,琼脂20.0 g,水1 L,pH 7.2。
果胶培养基:果胶5.0 g,蛋白胨2.0 g,KH2PO4 0.5 g,MgSO4·7H2O 0.3 g,琼脂20.0 g,水1 L,pH 7.2。
1.2 方法 1.2.1 生防菌的筛选 1.2.1.1 生防菌分离将10 g采集的土壤样品加入90 mL无菌水中(含Φ3.5 mm玻璃珠),充分振荡后,80℃水浴0.5 h,静置15 min。将上清液梯度稀释(10-3-10-5)后,于LB培养基上涂布,37℃培养24 h,挑取不同的菌落分离纯化,2-3次后,将获得的菌株编号后保藏。
1.2.1.2 生防菌初筛将病原腐皮镰刀菌活化到长满平板,用无菌的打孔器(Φ10 mm)打成均匀的圆形菌块,转接到PDA平板中间,28℃培养2 d后用接种环挑取纯化好的细菌接种到距病原真菌菌饼边缘2 cm处,28℃继续培养4-5 d。待病原真菌菌体长满平板,观察有无抑菌带出现。
1.2.1.3 生防菌复筛采用双层平板牛津杯法[10]进行试验。将待试菌株发酵培养得种子发酵液。将各菌株种子液接种到0.1 L的LB液体培养基中,发酵培养24 h后,4℃离心20 min,经0.22 µm无菌滤膜过滤得无菌发酵上清液。将100 µL(105 CFU/mL)腐皮镰刀菌的发酵液均匀涂布,用镊子将牛津杯放置在平板两侧,吸取100 µL滤菌发酵上清液至牛津杯中。空白为仅涂布等量病原发酵液。待病原长满平板,测量抑菌圈直径以及抑菌率(抑菌圈直径/病原菌生长直径)。
1.2.1.4 生防菌株抗菌谱的测定将供试菌株活化后培养备用。将100 µL浓度为105 CFU/mL的各供试病原菌(共8种)的发酵液涂布,刮取少量的待测细菌菌苔均匀点接于距离培养基中心2.5 cm处,对照组是将等量105 CFU/mL的各病原菌发酵液均匀涂布。待对照组各病原菌长满整个平板时,测量抑菌圈直径以及病原菌生长半径r,对照组半径为平板半径r0,利用公式(r0-r)/r0计算抑菌率。
结合初筛、复筛及抑菌谱结果,从待测细菌中选取抑菌效果突出的一株进行后续研究。
1.2.2 生防菌T-6系统鉴定 1.2.2.1 形态学鉴定参照《常见细菌系统鉴定手册》[11]中形态学指标观察菌落性状,进行革兰氏染色观察。
1.2.2.2 生理生化鉴定参照《常见细菌系统鉴定手册》进行葡萄糖、淀粉水解试验等反应测定。
1.2.2.3 Biolog系统分析TSA培养基33℃培养生防菌16-24 h,用无菌棉棒蘸取IF-B接种液后,将接种液搅拌均匀。调整浊度仪浊度到90%-98%T,将菌悬液倒入加样水槽中,用移液枪依次接种到鉴定板上,每孔100 μL。反应24-36 h后,放入读数仪中,设置参数后读取菌株的代谢指纹信息。
1.2.2.4 分子鉴定(1)16S rDNA序列扩增:用康为试剂生物科技有限公司DNA提取试剂盒提取生防菌的基因组DNA后进行16SrDNA序列PCR扩增[12]。引物为通用引物27F-5' -AGAGTTTGATCCTGGCTCAG-3' 和1492R-5' -GGTTACCTTGTTACGACTT-3' 。PCR产物测序工作委托上海铂尚生物技术有限公司完成,将所得到的序列在NCBI上进行序列比对分析,最后用Mega7.0构建系统发育树。
(2)特异性PCR:经16S鉴定发现该菌株与枯草芽胞杆菌遗传关系较近,遂采用枯草菌群特异性PCR技术对该菌株进一步鉴定。各引物信息为:解淀粉芽胞杆菌(L100-AAATCTGCCCGTATCGTCG,R836-GCGTCACGGCGRATCTCAA);枯草芽胞杆菌(BSL72-CGTAGAGCCACTTGAGCG,BSR328-CTGCCGTTACAGTTCCTT)。PCR扩增反应条件为94℃ 3 min;94℃ 0.5 min;61.7℃ 0.5 min;72℃ 0.4 min;延伸72℃ 10 min循环29次(NYT2066-2011)。
1.2.3 生防菌T-6抗病促生检测与验证 1.2.3.1 生防菌拮抗因子检测(1)蛋白酶检测:将菌株T-6接种到脱脂奶粉培养基平板上,37℃培养2 d,看有无透明圈产生。(2)果胶酶检测:将菌株T-6接种到果胶培养基平板上,37℃培养2 d,观察是否有透明圈。(3)几丁质酶检测:将生防菌株T-6接种到几丁质培养基平板上,37℃培养2 d,观察有无透明圈出现。(4)纤维素酶检测:用纤维素培养基平板培养生防菌株2 d,0.5%刚果红染液染色,静置1 h后倒出染液。用5%的NaCl溶液洗脱1 h后倒出,看有无透明圈出现。
1.2.3.2 生防菌促生指标检测(1)溶磷、解磷指标的测定:将菌株接种到有机磷和无机磷平板中,28℃培养2-5 d,观察是否有透明圈。(2)解钾指标的测定:生防菌三区划线到硅酸盐培养基中,37℃培养72 h,观察是否有光滑透明油滴状菌落。
1.2.3.3 番茄幼苗抗病促生盆栽试验(1)试验设计:试验设置为CK、病原菌、生防菌、病原菌+生防菌4个处理。取3-4片真叶健康、长势均一的番茄幼苗,定植4-5 d后,2、4处理组灌病原菌发酵液(105 CFU/mL)100 mL,其余加等量PDA液体。7 d后,后两个处理组每株灌100 mL生防菌发酵液(107 CFU/mL),其余加等量LB液体。病原与生防菌隔7 d灌一次,各灌3次,管理45 d测量农艺性状。
(2)测定方法:将植株105℃处理30 min,90℃烘干称重。叶绿素含量用CT(mg/L)=Ca+Cb =20.2A645+8.02A663来计算,Ca、Cb分别为叶绿素a、b的浓度。用根系扫描仪来观察根系情况。
病害调查采用番茄根腐病分级标准。0级:无病;1级:茎上出现水渍状的病斑;2级:茎上病斑扩展,但不超过株高1/4,不萎蔫;3级:病部超过整株1/4,延伸至根部不超过株高3/4,茎基部轻微萎蔫;4级:病部蔓延至全株,包括根和叶柄,茎基部严重溢缩,叶片枯萎,死亡。病情指数=∑(各级病株数×相应级别)/(调查总株数×最大级数)×100。防治效果(%)=(空白对照病情指数-处理病情指数)/空白对照病情指数×100。
1.2.4 运用Excel 2010和SPSS19.0等软件进行数据统计和分析。 2 结果 2.1 桃树根腐病生防菌的分离筛选 2.1.1 桃树根腐病生防菌初筛初筛共获得6株对靶标腐皮镰刀病原菌有拮抗作用的生防芽孢菌,编号为T-1-T-6,如图 1所示。

|
| 图 1 生防菌株T-1-T-6拮抗腐皮镰刀菌初筛结果 |
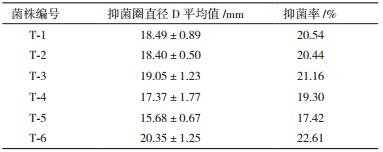
以LB液体培养基为对照,在复筛中T-3、T-6菌株的发酵上清液对桃树根腐病病原腐皮镰刀菌有较好的抑菌效果,抑菌率如表 1所示分别可达21.16%与22.61%。
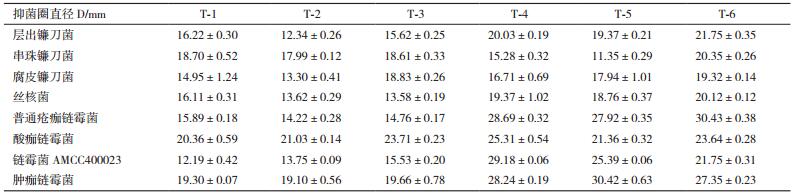
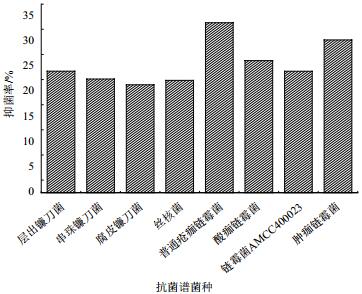
复筛中所用6株生防菌株对串珠镰刀菌、层出镰刀菌、丝核菌等病原菌的抑制作用。如表 2所示,T-4、T-5、T-6菌株的综合拮抗效果较好。图 2中T-6菌株对4种病原真菌的抑菌效果均可达20%以上,对普通疮痂链霉菌的抑制效果可高达33.81%,体现了较为广谱的抗性,因此,选定T-6菌株进行后续实验。图 3为T-6菌株拮抗部分真菌与链霉菌的结果。
|
| 图 2 菌株T-6抗菌谱抑菌结果 |

|
| 图 3 T-6菌株拮抗串珠镰刀菌(A)及T-6菌株拮抗普通疮痂链霉菌(B)部分结果 |
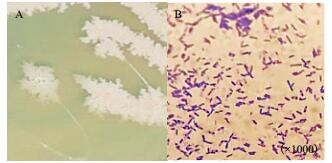
从图 4中可以看出T-6菌株的菌落呈白色,边缘不规则,中间呈嵴状突起,湿润无光泽。革兰氏染色试验表明该生防菌株为革兰氏阳性菌株。
|
| A:T-6菌株菌落形态;B:T-6菌株的显微形态 图 4 生防菌T-6的形态特征 |
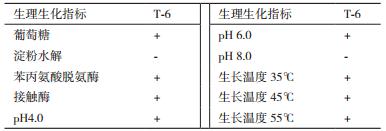
通过生理生化指标测定分析,菌株T-6可以利用葡萄糖作为碳源,苯丙氨酸脱氨酶、接触酶指标均为阳性,符合芽胞杆菌属的生理特性。鉴定结果如表 3所示。
通过Biolog系统鉴定分析,将所得鉴定板结果(表 4)与标准板布局图比对,可以初步确定生防菌株T-6为芽胞杆菌,与解淀粉芽胞杆菌的特性类似。
将测序结果进行Blast同源性比对后,利用Mega7.0构建系统发育树。如图 5所示,菌株T-6与B. amyloliquefaciens和B. methylotrophicus的系统发育关系最近,自展值可达97%。

|
| 图 5 菌株T-6的16S rDNA序列系统发育树 |
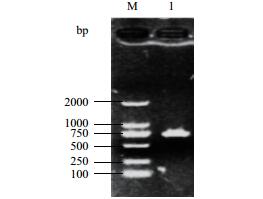
通过特异性PCR,发现菌株T-6可以用B. amyloliquefaciens的特异性引物扩增出条带(图 6)。结合前面的鉴定结果,可以确定该菌株是B. amyloliquefaciens。
|
| M:Marker;1:解淀粉芽孢杆菌特异性扩增引物 图 6 菌株T-6特异性PCR结果 |
检测结果如图 7所示,T-6菌株的菌落在果胶和纤维素培养基上不产生透明圈,在脱脂奶粉、几丁质培养基上可产生明显的透明圈,说明该菌株具有产蛋白酶和几丁质酶的能力。

|
| 图 7 生防菌T-6产蛋白酶(A)、几丁质酶(B)能力测定结果 |
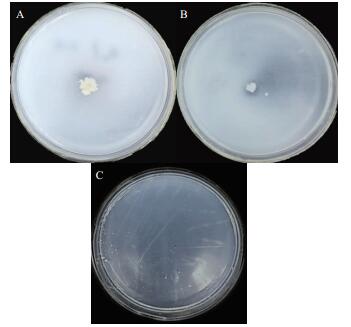
T-6菌株溶磷、解磷、解钾试验结果如图 8所示。图 8-A、图 8-B图中,菌落周围均有较小的透明圈,图 8-C图中培养基上可长出产荚膜的光滑透明油滴状菌落,说明该菌株具有一定的溶磷、解磷和解钾的功能。
|
| 图 8 T-6菌株溶磷(A)、解磷(B)、解钾(C)能力测定结果 |
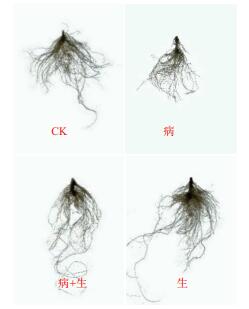
从菌株T-6番茄盆栽结果中植株(图 9)与根(图 10)的长势上来看,腐皮镰刀根腐病菌很大程度上影响了植株的生长,导致病原菌处理过的番茄幼苗长势在对照和3个处理组中最弱;而生防菌处理组的番茄幼苗长势最好;其次是生防菌+病原菌处理组,可见生防菌T-6对病原菌与番茄生长均有一定的影响。经统计(表 5),将生防菌T-6单处理组与CK进行比较时,发现两组幼苗在干重、根总长与叶绿素3个方面呈极显著差异,分别提高31.81%、50.79%、35.11%,其余3个性状呈显著差异(P < 0.05),表明了该生防菌株明显的促生性能。与病原处理组相比,病原菌+生防菌混合处理组的鲜重、干重、株高、茎粗等6个指标均明显提高,且差异极为显著(P < 0.01),其中鲜重、干重增长69.43%、77.57%,说明T-6菌株在盆栽试验中突出的抗病效果。

|
| 图 9 菌株T-6番茄盆栽试验 |
|
| 图 10 番茄幼苗扫根结果 |
在病原菌+生防菌的混合处理组中,番茄苗的干重较比CK提高了23.37%,具有极显著的差异,其余鲜重、株高、茎粗等5个参数均表现出显著的差异。这两个处理组的比较结果,充分证明生防菌T-6菌株在盆栽试验中明显的拮抗病原菌与促进作物生长的能力。
第3次接种病原菌5 d后,病原菌对照组的植株矮小,茎基部萎蔫,出现根腐病的症状,病情指数可达85.25,病原菌+生防菌T-6处理组的病情指数和防效分别为37.09和56.49%(表 6)。说明了T-6菌株具有一定防治根腐病的潜力。
根腐病主要致病菌为半知菌亚门的镰刀菌,这类病原菌宿主广泛,可引起桃树、番茄等多种作物的根腐病害。传统防治过程中,农药化肥长期的滥用迫使土壤中的有益微生物数量骤减,减弱了土壤自身的修复能力[13]。作为一种无毒、无害且生态友好型的方法,生物防治越来越受到人们的欢迎。目前报道的根腐病生防菌,多为枯草芽胞杆菌等常见菌种[14],对解淀粉芽胞杆菌研究较少。2015年,Sunar等[15]发现B. altitudinis对黄瓜根腐病防效可达66.6%。此外,马铃薯疮痂病作为农业生产中又一种土传病害,已经成为马铃薯产业重要的挑战。其病原菌主要有S. scabies[16],S. turgidiscabies[17-18],S. galilaeus[19]等。本研究室的Li等[20]2019年发现生防菌B. altitudinis AMCC101304对马铃薯疮痂病有良好的防治效果。本研究分离获得一株对桃树根腐病、马铃薯疮痂病等土传病害病原菌抑制效果明显的生防菌株T-6,经系统鉴定后确定该菌株为解淀粉芽胞杆菌(B. amyloliquefaciens)。
生防菌在根际土壤中广泛存在,可主动调节作物根际土壤中的微生物组分与土壤生态功能[21-22],促进养分的吸收[23-24],增强抗病性,提高品质[25-26]。2017年,本研究室的Chen等[21]报道生防菌Brevibacillus laterosporu AMCC100017有利于土壤中有益功能菌的增殖,可增加土壤群落中微生物多样性。在多数情况下,芽胞杆菌的抑菌活性与其合成抗生素或其他化合物抑制或直接杀死病原生物的能力有关[27-28]。Bacillus可通过核糖体或非核糖体两种途径来合成抗生素、细菌素及抗菌肽等多种抗菌物质[29]。迄今为止,已揭示的芽胞杆菌生防机制有竞争、拮抗与诱导寄主抗性等内容[30]。本研究在检测生防菌株T-6抑菌物质酶活时发现,该菌株具有产蛋白酶与几丁质酶的活性,推测其抑菌特性与这两种酶解能力紧密相关。通过盆栽试验测定T-6菌株对番茄根腐病的防治效果发现,灌入生防菌T-6发酵液后的混合处理组对比单病原对照组病情指数明显降低,防效可达54.69%。
芽胞杆菌还可通过分泌植物激素[31]或通过磷增溶、铁还原等方式为植物提供营养来直接促进作物生长[32]。Chowdhury等[33]研究发现,解淀粉芽胞杆菌FZB42防治茄根枯萎病时,可显著提高生菜的生物量。本研究经对T-6菌株进行促生指标测定,发现该菌株具有解磷、溶磷及解钾的能力。在后期番茄盆栽试验中,该菌株在CK与生防菌处理组、病原菌与病原菌+生防菌处理组以及CK与病原菌+生防菌处理组这3组比较结果中,有部分指标可达差异极显著水平,表现出了该生防菌株显著的促生和抗病效果。分析其原因可能是该菌株通过分泌酶类物质抑制病原菌的增殖与通过解磷和解钾的方式为植株提供营养,从而极大地促进了番茄幼苗的生长。结合盆栽中其显著的防治效果,说明T-6菌株确实具有一定的促生与生防潜力。
芽胞杆菌菌剂的生产,从菌株的筛选鉴定、功能验证到后期的大田应用,需要经历相对复杂漫长的过程[34],这期间芽胞杆菌要受许多内在因素与外界环境的影响,因此,本试验获得的生防芽胞杆菌菌株还需要后期进一步的大田验证与系统优化。
4 结论本研究筛选出的T-6生防芽胞杆菌菌株,经形态学、Biolog生理生化和分子生物学系统鉴定,确定为B. amyloliquefaciens。该生防菌株具有一定的促生及广谱的抗菌活性,在防治桃树根腐病等土传病害方面具有较大的潜力。
| [1] |
汪祖华, 庄恩. 中国果树志(桃卷)[M]. 北京: 中国林业出版社, 2001. Wang ZH, Zhuang E. Chinese fruit tree(Peach Roll))[M]. Beijing: China Forestry Publishing House, 2001. |
| [2] |
刘嘉彬, 张泽勇, 刘振京. 桃树重茬病及其防治技术[J]. 河北林业科技, 2006, 2: 67. Liu JB, Zhang ZY, Liu ZJ. Peach tree stubble disease and its control techniques[J]. Hebei Forestry Science and Technology, 2006, 2: 67. |
| [3] |
张立恒, 杨凤英, 马海峰, 等. 果树连作障碍研究进展[J]. 落叶果树, 2019, 3: 28-31. Zhang LH, Yang FY, Ma HF, et al. Research progress on continuous cropping obstacles of fruit trees[J]. Deciduous Fruit Trees, 2019, 3: 28-31. |
| [4] |
Waterer D. Management of common scab of potato using planting and harvest dates[J]. Can J Plant Sci, 2002, 82(1): 185-189. DOI:10.4141/P01-030 |
| [5] |
Nyczepir AP, Pusey PL. Association of Criconemella xenoplax and Fusarium spp. with root necrosis and growth of peach[J]. Journal of Nematology, 1986, 18(2): 217-220. |
| [6] |
郭延虎, 张志强, 朱咏霞. 苹果圆斑根腐病的综合防治[J]. 北方果树, 2009, 5: 36-37. Guo YH, Zhang ZQ, Zhu YX. Integrated control of apple round spot root rot[J]. Northern Fruit Tree, 2009, 5: 36-37. |
| [7] |
Chitlaru T, Altboum ZR, Euveny S, et al. Progress and novel Strategies in vaccine development and treatment of anthrax[J]. Immunological Reviews, 2011, 239: 221-236. DOI:10.1111/j.1600-065X.2010.00969.x |
| [8] |
Connor N, Sikorski J, Rooney AP, et al. Ecology of speciation in the genus Bacillus[J]. Applied and Environmental Microbiology, 2010, 76: 1349-1358. DOI:10.1128/AEM.01988-09 |
| [9] |
Pignatelli M, Moya A, Tamames J. A database for describing the environmental distribution of prokaryotic[J]. Environmental Microbiology Reports, 2009, 1: 191-197. DOI:10.1111/j.1758-2229.2009.00030.x |
| [10] |
Bettini C, Wang X, Jajodia S. Testing complex temporal relationships involving multiple granularities and its application to data mining[C]. Symposium on Principles of Database Systems, 1996: 68-78.
|
| [11] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. Dong XZ, Cai MY. Common bacterial system identification manual[M]. Beijing: Science Press, 2001. |
| [12] |
Marchesi JR, et al. Design and evaluation of useful Bacterium-Specific PCR primers that amplify genes coding for bacterial 16S rRNA[J]. Appl Environ Microbiol, 1998, 2: 795-799. |
| [13] |
张海亮, 王智博. 西北某地区农村农药化肥污染问题的调查研究[J]. 中国集体经济, 2016, 33: 16-17. Zhang HL, Wang ZB. Investigation on the pollution of pesticides and fertilizers in rural areas in northwest China[J]. China Collective Economy, 2016, 33: 16-17. |
| [14] |
王凡.湖北保康县核桃根腐病病原分离鉴定及药剂防控技术研究[D].荆州: 长江大学, 2015. Wang F. Study on the isolation and identification of the pathogen of walnut root rot in Baokang county, Hubei province and the technology of pharmaceutical prevention and control[D]. Jingzhou: Yangtze University, 2015. |
| [15] |
Sunar K, Dey P, Chakraborty U, et al. Biocontrol efficacy and plant growth promoting activity of Bacillus altitudinis isolated from Darjeeling hills India[J]. J Basic Microbiol, 2015, 55: 91-104. DOI:10.1002/jobm.201300227 |
| [16] |
Lambert DH, Manzer FE. Relationship of calcium to potato scab[J]. Phytopathology, 1991, 81: 632-636. DOI:10.1094/Phyto-81-632 |
| [17] |
Miyajima K, Tanaka F, Takeuchi T, et al. Streptomyces turgidiscabies sp. nov.[J]. International Journal of Systematic Bacteriology, 1998, 48(2): 495-502. DOI:10.1099/00207713-48-2-495 |
| [18] |
Kreuze JF, Suomalainen S, Paulin L, et al. Phylogenetic analysis of 16S rRNA genes and PCR analysis of the nec1 gene from Streptomyces spp. causing common scab, pitted scab, and netted scab in Finland[J]. Phytopathology, 1999, 89(6): 462-469. DOI:10.1094/PHYTO.1999.89.6.462 |
| [19] |
Guo FL, Zhang HY, Yu X. First report of Streptomyces galilaeus associated with common scab in China[J]. Plant Disease, 2014, 98(5): 683. |
| [20] |
Li BY, Wang B, Pan P, et al. Bacillus altitudinis strain AMCC 101304:a novel potential biocontrol agent for potato common scab[J]. Biocontrol Sci Technol, 2019, 29: 1009-1022. DOI:10.1080/09583157.2019.1641791 |
| [21] |
Chen SF, Zhang MS, Wang JY, et al. Biocontrol effects of Brevibacillus laterosporus AMCC100017 on potato common scab and its impact on rhizosphere bacterial communities[J]. Biological Control, 2017, 106: 89-98. DOI:10.1016/j.biocontrol.2017.01.005 |
| [22] |
Erlacher A, Cardinale M, Grosch R, et al. The impact of the pathogen Rhizoctonia solani and its beneficial counter part Bacillus amyloliquefaciens on the indigenous lettuce microbiome[J]. Front Microbiol, 2014, 5: 175. |
| [23] |
Jha PN, Kumar A. Endophytic colonization of Typha australis by a plant growth-promoting bacterium Klebsiella oxytoca strain GR-3[J]. Journal of Applied Microbiology, 2007, 103: 1311-1320. DOI:10.1111/j.1365-2672.2007.03383.x |
| [24] |
Ji X, Lu G, Gai Y, et al. Colonization of Morus alba L. by the plant-growth-promoting and antagonistic bacterium Burkholderia cepacia strain Lu10-1[J]. BMC Microbiology, 2010, 10: 243. DOI:10.1186/1471-2180-10-243 |
| [25] |
Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases:principles, mechanisms of action, and future prospects[J]. Applied and Environmental Microbiology, 2005, 71: 4951-4959. DOI:10.1128/AEM.71.9.4951-4959.2005 |
| [26] |
Ding CY, Shen QR, Zhang RF, et al. Evaluation of rhizosphere bacteria and derived bio-organic fertilizers as potential biocontrol agents against bacterial wilt(Ralstonia solanacearum)of potato[J]. Plant Soil, 2013, 366: 453-466. DOI:10.1007/s11104-012-1425-y |
| [27] |
Turner JT, Backman PA. Factors relating to peanut yield increases after seed treatment with Bacillus subtilis[J]. Plant Disease, 1991, 75(4): 347-353. DOI:10.1094/PD-75-0347 |
| [28] |
Glick BR. The Enhancement of plant growth by free-living bacteria[J]. Can J Microbiol, 1995, 41: 109-117. DOI:10.1139/m95-015 |
| [29] |
Chen XH, Koumoutsi A, Scholz R, et al. Genome analysis of Bacillus amyloliquefaciens FZB42 reveals its potential for biocontrol of plant pathogens[J]. Biotechnol, 2009, 140: 27-37. |
| [30] |
洪鹏, 安国栋, 胡美英. 解淀粉芽胞杆菌防治果蔬采后病害研究进展[J]. 中国农学通报, 2013, 29(12): 168-173. Hong P, An GD, Hu MY. Research progress of Bacillus amylolique-faciens preventing and treating postharvest diseases of fruits and vegetables[J]. Chinese Agricultural Science Bulletin, 2013, 29(12): 168-173. |
| [31] |
Ahmad F, Ahmad I, Khan MS. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microb Res, 2008, 163: 173-181. DOI:10.1016/j.micres.2006.04.001 |
| [32] |
Orozco-Mosqueda MC, Velázquez-Becerra C, Macías-Rodríguez LI, et al. Arthrobacter agilis UMCV2 induces iron acquisition in Medicago truncatula(strategy I plant)in vitro via dimethylhexadecylamine emission[J]. Plant Soil, 2012, 362: 51-66. |
| [33] |
Chowdhury SP, Dietel K, Randler M, et al. Effects of Bacillus amyloliquefaciens FZB42 on Lettuce growth and health under pathogen pressure and its impact on the rhizosphere bacterial community[J]. PLoS One, 2013, 8: 1-10. |
| [34] |
Asaka O, Shoda M. Biocontrol of Rhizoconia solani damping-off tomato with Bacillus subtilis RB14[J]. Applied and Environmental Microbiology, 1996, 62(11): 4081-4085. DOI:10.1128/AEM.62.11.4081-4085.1996 |